化学反应速率 化学反应速率理论
- 格式:ppt
- 大小:1.91 MB
- 文档页数:65





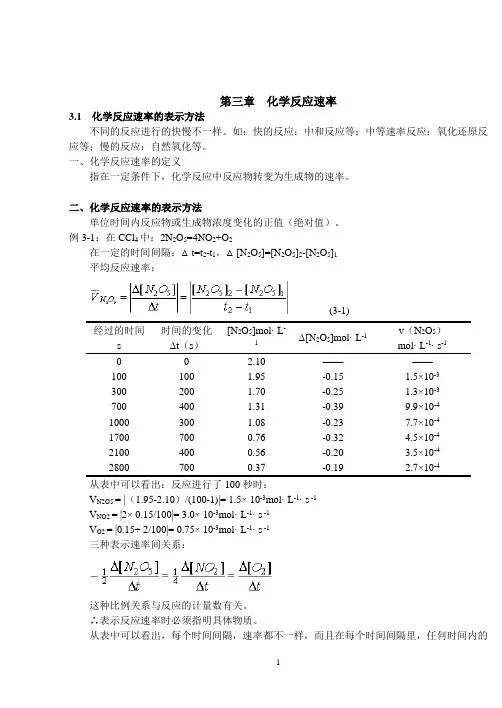
第三章化学反应速率3.1化学反应速率的表示方法不同的反应进行的快慢不一样。
如:快的反应:中和反应等;中等速率反应:氧化还原反应等;慢的反应:自然氧化等。
一、化学反应速率的定义指在一定条件下,化学反应中反应物转变为生成物的速率。
二、化学反应速率的表示方法单位时间内反应物或生成物浓度变化的正值(绝对值)。
例3-1:在CCl4中:2N2O5=4NO2+O2在一定的时间间隔:△t=t2-t1,△[N2O5]=[N2O5]2-[N2O5]1平均反应速率:(3-1)经过的时间s 时间的变化Δt(s)[N2O5]mol· L-1Δ[N2O5]mol· L-1v(N2O5)mol· L-1· s-10 0 2.10 ————100 100 1.95 -0.15 1.5×10-3300 200 1.70 -0.25 1.3×10-3700 400 1.31 -0.39 9.9×10-41000 300 1.08 -0.23 7.7×10-41700 700 0.76 -0.32 4.5×10-42100 400 0.56 -0.20 3.5×10-42800 700 0.37 -0.19 2.7×10-4从表中可以看出:反应进行了100秒时:V N2O5 = |(1.95-2.10)/(100-1)|= 1.5× 10-3mol· L-1· s -1V NO2 = |2× 0.15/100|= 3.0× 10-3mol· L-1· s -1V O2 = |0.15÷ 2/100|= 0.75× 10-3mol· L-1· s -1三种表示速率间关系:这种比例关系与反应的计量数有关。
∴表示反应速率时必须指明具体物质。




影响化学反应速率的因素一、化学反应速率理论1、有效碰撞反应物分子间能发生反应的碰撞。
发生条件:①发生碰撞的分子具有较高的能量;②分子在一定方向上发生碰撞2、活化分子化学反应中,能量较高、有可能发生有效碰撞的分子。
3、活化能活化分子的平均能量与所有分子的平均能量之差。
例1:下列说法正确的是①活化分子间的碰撞一定能发生化学反应;②普通分子间的碰撞有时也能发生化学反应;③活化分子比普通分子具有较高的能量;④化学反应的实质是原子的重新组合;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程;⑥化学反应的实质是活化分子有合适取向时的有效碰撞。
例2:1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。
能引发化学反应的碰撞称之为有效碰撞。
⑴图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是(填“A”“B”或“C”);⑵20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出了化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程红经过一个高能量的过渡态。
图Ⅱ示NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:⑶过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。
请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
⑷进一步研究表明,化学反应的能量变化( H)与反应物和生成物的键能有关。
键能可以简单地理解为断开1mol化学键时所需吸收的能量。
下表是部分化学键的键能数据:已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中x=二、影响化学反应速率的因素1、内因(主要因素):⑴化学键的强弱与反应速率的关系:例如:在相同条件下,F2与H2在黑暗处就能发生爆炸(反应速率非常大);Cl2与H2在光照条件下会发生爆炸(反应速率大);Br2与H2在加热条件下会发生爆炸(反应速率较大);I2与H2在较高温度时才能发生反应,同时生成HI又分解(反应速率较小)。
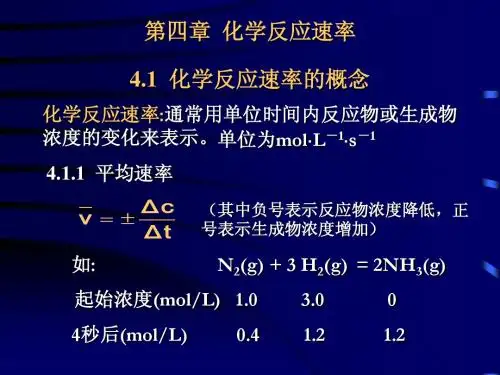
化学动力学中的反应速率理论在化学反应过程中,反应速率是指单位时间内反应物消失量或产物生成量与反应物浓度之积的比值。
而反应速率理论则提供了一种描述化学反应动力学的数学模型,可用于预测反应速率、反应机理和反应路径等方面的研究。
一、反应速率理论基础反应速率理论是基于化学反应物分子间碰撞的概率推导而来的。
根据亚当斯(Adams)和懦得罗夫(Guggenheim)提出的分子碰撞模型,反应物分子必须经过一定能量的阈值,才能碰撞并发生化学反应。
因此,反应速率与反应物分子碰撞的频率和碰撞能量有关。
二、反应速率常数与活化能根据反应速率理论,反应速率常数k和反应物分子碰撞的概率成正比例。
反应速率常数k的大小决定了反应速率的快慢,其大小受到反应物浓度、温度等因素的影响。
此外,反应速率理论还提出了活化能的概念。
活化能是指化学反应必须克服的能量阈值,只有高于此能量阈值,反应物分子才能进行碰撞并发生化学反应。
反应速率常数k和活化能之间有一个Arrhenius公式,可以用来描述反应速率常数的温度依赖性。
三、反应速率与反应机理的研究反应速率理论不仅可以用于预测反应速率和活化能,还可以用于研究反应机理和反应路径。
通过反应速率和温度对k和活化能的测量,可以推导出反应物子的反应路径和反应物状态的变化情况。
这对于研究复杂反应、优化催化剂以及发展新的化学反应渠道具有重要意义。
四、反应速率理论的应用反应速率理论在工业上有着广泛的应用。
例如,研究反应过程中的速率和活化能可以制定更好的催化剂。
同时,反应速率理论还有助于工业生产中的反应条件的优化,从而提高了生产效率和工艺质量。
在环境保护方面,反应速率理论也有着重要的作用,可以通过反应速率理论研究和模拟污染物的分解和去除过程。
总之,反应速率理论是描述化学反应动力学的重要理论模型,有着广泛的应用价值。
通过对反应速率、反应机理、活化能等因素的研究,可以为化学工业的发展、环境治理以及科学研究提供帮助。