九年级化学饱和和不饱和溶液
- 格式:ppt
- 大小:179.50 KB
- 文档页数:9

第二课时:饱和溶液与不饱和溶液一、教材分析饱和溶液与不饱和溶液是在学习了溶液之后进一步研究溶质在溶剂中溶解的情况。
学好饱和溶液才能真正理解溶解度的概念,饱和溶液教学的成功与否直接关系着溶解度的理解,同时也为下面学习有关溶质质量分数的计算及混合物的分离提供了基础。
二、学情分析学生已学了溶液的形成、溶液的定义,虽然对于一般物质溶解后形成溶液的现象比较熟悉,但是从定量的角度去认识物质的溶解性以及溶液的种种状态却很少思考。
所以本节课通过一些生活中的现象引入,学生比较感兴趣,由于饱和溶液的概念比较抽象,学生在学习时容易忽略概念定义的三个条件,所以我精心设计了几个连贯且逐渐深入的实验,通过不断的探究加深对概念的理解,同时也激发学生的学习热情。
三、教学目标知识与技能:1、理解饱和溶液和不饱和溶液的概念;了解二者的转化2、了解溶液的饱和与不饱和跟溶液的“浓”、“稀”的关系与区别过程与方法:通过实验,培养学生观察实验、分析问题和解决问题的能力。
情感态度与价值观:利用实验和数据结合,培养学生区分不同概念的比较能力和分析思维能力。
四、重难点重点:1、饱和溶液和不饱和溶液的涵义。
2、饱和(不饱和)溶液与浓(稀)溶液的关系。
3、饱和溶液与不饱和溶液间的转化。
难点:对饱和溶液和不饱和溶液的理解。
五、教学流程创设情景,提出问题————一杯水里能否无限地溶解食盐?↓实验探究一、二————饱和溶液和不饱和溶液↓实验探究三——————饱和溶液和不饱和溶液的相互转化↓知识拓展——————浓稀溶液及与饱和溶液不饱和溶液的关系↓总结巩固——饱和溶液、不饱和溶液的概念及相互转化溶液饱和与否跟溶液浓稀之间的关系↓课堂检测——————检测反馈六、教学过程教学反思:本节饱和、不饱和概念通过实验与日常生活经验相结合后学生理解接受起来比较容易,两者之间的转化关系用实验也能很好的接受,但它们与浓、稀溶液之间的关系部分用实验解释时间有点太长,最好用微视频解决。


饱和溶液与不饱和溶液大家好!今天我说课的课题是饱和溶液和不饱和溶液,面我从课标和教材分析、教学目标、学情分析、教法学法分析教学过程及设计等六个方面进行说课。
一、课标和教材分析关于此课题课程标准的要求是:了解饱和溶液的含义,能举例说明结晶现象教材体系中,本课题是人教版化学九年级下册第九单元课题二第一课时的内容,它是在学生学习了溶液之后进一步研究溶质在溶剂中溶解的情才能真正理解溶解度的概念,饱和溶液教学的成功与否直接关系着学生对溶解度的理解,同时也为下面学习有关溶质质量分数的计算及混合物的分离提供了基础。
二、教学目标知识与技能:1、理解饱和溶液和不饱和溶液的含义。
2、掌握饱和溶液和不饱和溶液的概念。
3、知道饱和溶液与不饱和溶液之间的转化方法4、了解溶液饱和与否与溶液浓稀之间的关系过程与方法:1、学习观察、分析实验现象,并能归纳出相应的概念。
2学习通过实验探究饱和溶液、不饱和溶液转化的条件。
情感态度与价值观:通过“实验探究”,让学生亲身体验科学探究,形成科学严谨的探究意识。
在上述教学目标中,掌握掌握饱和溶液和不饱和溶液的概念与饱和溶液和不饱和溶液的相互转化是本节课的教学重点。
三、学情分析就学情来说,学生已经学习了溶液的形成、溶液的定义,虽然对于一般物质溶解后形成溶液的现象比较熟悉,但是从定量的角度去认识物质的溶解性以及溶液的种种状态却很少思考。
所以本节课通过学生比较感兴趣的一些现象引入,由于饱和溶液的概念比较抽象,学生在学习时容易忽略概念定义的两个条件,所以我精心设计了几个连贯且逐渐深入的实验,通过不断的探究加深对概念的理解,同时也激发学生的学习热情。
四、教法学法分析本节课拟采用“质疑——探究——归纳——总结”的教学方法。
通过联系生活创设情境,通过实验探究,总结出出饱和溶液和不饱和溶液的定义。
具体的教学过程如下:五、教学过程本节课饱和溶液与不饱和溶液的概念比较抽象,学生对物质的溶解现象有一定的生活经验,但对多个关联因素不易把握且常只根据直观现象而做出判断,这样有可能产生一些模糊的甚至是错误的认识。


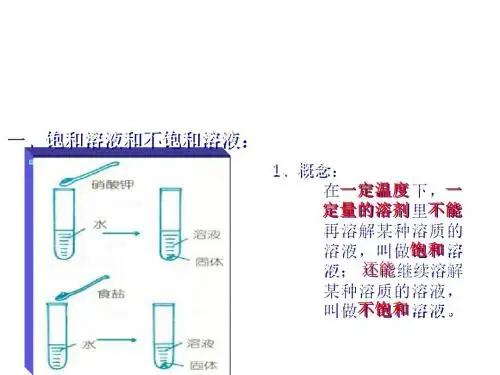
饱和溶液和不饱和溶液的概念①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液判断一种溶液是否是饱和溶液要注意:①在一定温度下。
②在一定量的溶剂里。
因为温度改变或溶剂量改变都会把饱和溶液变成不饱和溶液,也就是说饱和溶液与不饱和溶液在一定条件下可以互相转化,③被溶解的物质,即溶质能否继续溶解,若能继续溶解则为不饱和溶液,若不能继续溶解则为饱和溶液。
④某一种物质的饱和溶液是对该物质而言,但对其他物质则不是饱和溶液。
如20℃时,NaCl的饱和溶液不能再溶解NaCl了,但还能继续溶解KNO3,即此溶液对于NaCl来说是饱和溶液,但对KNO3来说则是不饱和溶液。
饱和溶液与不饱和溶液的相互转化方法:(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大饱和溶液不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少饱和石灰水不饱和石灰水概念的理解:(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。
因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。
如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:①饱和溶液不饱和溶液(或不饱和溶液饱和溶液。
不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小判断溶液是否饱和的方法:①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。





1. 饱和溶液与不饱和溶液● 定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液;还能继续溶解的溶液,叫做不饱和溶液。
● 判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的质量不变,那么溶液是饱和溶液。
● 由于水可以和酒精以任意比例互溶,所以水和酒精不可以形成饱和溶液。
● 不饱和溶液与饱和溶液的转化① 氢氧化钙和气体的溶解度随着温度升高而降低。
所以若把氢氧化钙和气体的不饱和溶液变成饱和溶液,在改变温度时要升高温度。
② 最可靠的方法是蒸发溶剂、加溶质、加溶剂。
③ 若想把氢氧化钙的饱和溶液变成不饱和溶液,可以通入适量的二氧化碳并过滤。
④ 若想把氢氧化钙的不饱和溶液变成饱和溶液,也可以加入CaO 并冷却。
⑤ 氢氧化钙不是晶体,从氢氧化钙溶液也不会析出晶体,所以只能称作“澄清的石灰水变浑浊”。
● 浓、稀溶液与饱和、不饱和溶液之间的关系:① 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
② 在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓。
不饱和溶液降温、恒温蒸发溶剂、加溶质饱和溶液1.欲使任意一种物质的不饱和溶液变为饱和溶液,一定可行的方法是()A.降低温度B.升高温度C.倒出一些溶液D.再加入该溶质2.某溶液将达到饱和,要使其转变成饱和溶液,最可靠的方法是()A.加热蒸发B.增加溶质C.降低温度D.升高温度3.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是()①蒸发溶剂,②增加溶质,③降低温度,④加热升温A.只有①②B.只有②③C.①②③D.①②④4.小乐同学欲使一不饱和硝酸钾溶液变成饱和溶液但不改变其浓度,正确的方法是()A.加热蒸发溶剂后再降至原温度B.加入一定量的硝酸钾C.降温后使其析出部分晶体D.降温至溶液刚好达到饱和5.现有一瓶某温度下接近饱和的硝酸钾溶液,欲将其转化为饱和溶液,下列措施不正确的是()A.降低温度B.蒸发一定量水,在恢复到原温度C.温度不变时增加溶质D.升高温度6.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,如图所示,欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是()A.氧化钙B.氯化钠C.硝酸铵D.氢氧化钠7.下列叙述正确的是()A.加溶剂可以使饱和溶液变成不饱和溶液B.某物质的饱和溶液就是不能再溶解该物质的溶液C.饱和溶液比不饱和溶液含溶质更多D.一种物质的饱和溶液中,不能再溶解其他溶质8.现有一杯60℃的不饱和硝酸钾溶液,欲使其达到饱和,下列方法一定不可行的是()A.加一定量的水B.恒温蒸发部分水C.降低温度D.加一定量的硝酸钾固体9.要使50℃时不饱和的硝酸钾溶液变成饱和溶液,下列措施中错误的是()A.升高温度B.降低温度C.补充硝酸钾D.蒸发水分10.将20℃时氢氧化钙饱和溶液转变为不饱和溶液可采用()A.升高温度B.加入溶剂C.加入溶质D.倒掉一半溶液11.要使一杯氢氧化钙的不饱和溶液变为饱和溶液,不能采用的方法是()A.升高温度B.加入溶质C.降低温度D.蒸发水12.要将一瓶接近饱和的石灰水变成饱和溶液,下列的方法不可行的是()A.加入CaO B.加入Ca(OH)2C.升高温度D.降低温度13.将接近饱和的石灰水变成饱和溶液,不可行的方法是()A.加入CaO B.加入Ca(OH)2C.升高温度D.加入CaCO314.氢氧化钙的溶解度随着温度的升高而降低。