镁铝及其化合物知识点
- 格式:docx
- 大小:269.21 KB
- 文档页数:9
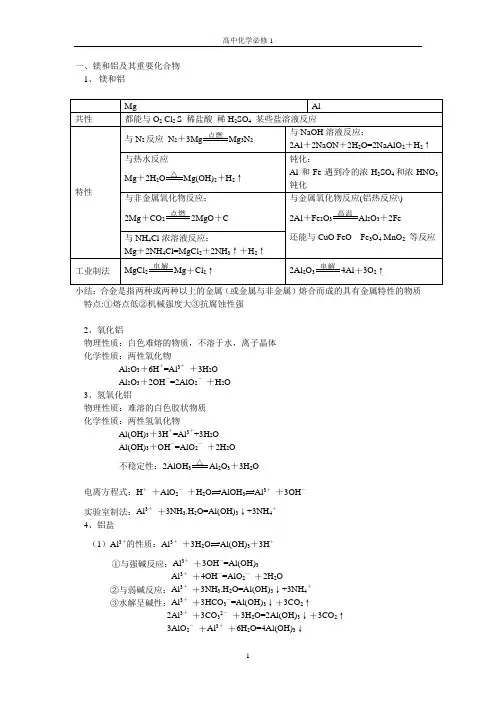
一、镁和铝及其重要化合物1、镁和铝特点:①熔点低②机械强度大③抗腐蚀性强2、氧化铝物理性质:白色难熔的物质,不溶于水,离子晶体化学性质:两性氧化物Al2O3+6H+=Al3++3H2OAl2O3+2OH-=2AlO2-+H2O3、氢氧化铝物理性质:难溶的白色胶状物质化学性质:两性氢氧化物Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O△不稳定性:2AlOH3Al2O3+3H2O电离方程式:H++AlO2-+H2O33++3OH-实验室制法:Al3++3NH3.H2O=Al(OH)3↓+3NH4+4、铝盐(1)Al3+的性质:Al3++3H2O Al(OH)3+3H+①与强碱反应:Al3++3OH-=Al(OH)3Al3++4OH-=AlO2-+2H2O②与弱碱反应:Al3++3NH3.H2O=Al(OH)3↓+3NH4+③水解呈碱性:Al3++3HCO3-=Al(OH)3↓+3CO2↑2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑3AlO2-+Al3++6H2O=4Al(OH)3↓总结:AlCl 3溶液滴加到NaOH 溶液中开始无沉淀后有沉淀NaOH 溶液滴加到AlCl 3溶液中先出现沉淀后沉淀溶解 (2)AlO 2-的性质AlO 2- +2H 2O=Al(OH)3↓+OH - ① 与强酸反应: AlO 2- +H +(少量) +H 2O=Al(OH)3↓ AlO 2-+4H + (过量)=Al 3+ +H 2O②与弱酸反应:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-③与水解呈酸性的物质反应:3AlO 2- +Al 3+ +6H 2O=4Al(OH)3↓3AlO 2- +Fe 3+ + 6H 2O=3Al(OH)3↓+Fe(OH)3↓总结:将HCl 滴加到NaAlO 2中先出现沉淀后溶解 将NaAlO 2滴加到HCl 中开始无沉淀后有沉淀 (3)明矾2KAl(SO 4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO 4+K 2SO 4 KAl(SO 4)2+2Ba(OH)2=2BaSO 4↓+KAlO 2+H 2O小结:Al 3+AlOH 3AlO 2AlOH 3Al 3+ 未知溶液白色沉淀白色沉淀溶解,从而未知溶液中含Al 3+未知溶液白色沉淀白色沉淀溶解,从而未知溶液含AlO 2-二、铁及其重要化合物1、铁:第四周期第Ⅷ族 26号元素 各层电子数为2 8 14 2 常见价态+2和+3(1)与弱氧化剂反应 Fe Fe 2+ S +Fe I 2+Fe 2(2)与强氧化剂反应Fe Fe 3+ 3Cl 2+2Fe=2FeCl 3 3Br 2+2Fe 3稀硝酸:Fe +4HNO 3=Fe(NO 3)3+2NO ↑+2H 2O 3Fe +8HNO 3=3Fe(ON 3)3+2NO 2↑+4H 2O特殊:3Fe +2O 23O 4 3Fe +4H 2O 3O 4+4H 2↑2、 氧化物 FeO :黑色固体不溶于水,在空气中加热会生成Fe 3O 4Fe 2O 3:红棕色固体不溶于水,俗称铁红、铁锈,可做红色染料 Fe 3O 4:黑色固体不溶于水,俗称磁性氧化铁3、 氢氧化物Fe(OH)2 白色沉淀迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3Fe(OH)3:红褐色沉淀 具有不稳定性,受热易分解2FeOH 3Fe 2O 3+3H 2O4、Fe 2+ Fe 3+的盐 (1)Fe 2+的性质 ①颜色:浅绿色△高温点燃△△△过量HClHCl 过量NaOH H +H +OH - OH -②易水解:Fe2++2H2O2+2H+如何保存FeSO4溶液:加几滴稀硫酸或加铁粉③强还原性:与O2Cl2Br2HNO3浓H2SO4KMnO4酸性溶液反应Fe2+检验:①加碱法(NaOH或氨水)②先加KSCN溶液,无现象再加氨水会出现血红色(2)Fe3+的性质①颜色:棕黄色②易水解:Fe3++3H2O3+3H+Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(与CO32-AlO2-也双水解) ③强氧化性:氧化S2-I-SO2SO32-Cu Fe2Fe3++2S2-=2Fe2++2S↓2Fe3++2I-=2Fe2++I2 (Fe3+能使湿润的淀粉KI试纸变蓝)2Fe3++Cu=2Fe2++Cu2+④络合性:KSCN溶液--血红色Fe3++3SCN-=Fe(SCN)3↓⑤制Fe(OH)3胶体:FeCl3+3H2O=Fe(OH)3胶体+3HCl⑥与苯酚显紫色⑧Fe3+检验:溶液加碱法加苯酚法。






镁和铝其化合物性质知识点归纳一Mg的化学性质1与非金属反应(1)与。
2反应。
常温下与空气中的02反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2Mg+0? 一2Mg0。
4AI+ 30 2』2AI 2O 3(2)与卤素单质、硫等反应。
__ Mg+ C 2 门"MgCI 2AI+ 3CI 2 ' '2AICI 32AI+ 3S——AI2S3 (用于工业制备) Mg+ MgS[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:I占烬I总堆頁烬I2Mg+O2 … 2Mg0 3Mg+N 2 … Mg 3N2 2Mg+C0 2 2Mg0+C②燃烧时都放出大量的热,发出耀眼的白光。
禾U用镁的这种性质来制造照明弹。
③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2. 与H20反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H 2^^= Mg(0H) 2+H2T 2A1+6H 2^^= 2A1(0H) 3+3H2T3. 与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2S04,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(1)镁与二氧化碳反应:2Mg+C0 2 * 2Mg0+C[特别提醒]: “ CQ不能助燃”的说法是不全面的,C0 2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2AI+ Fe 2O3 11 2Fe+ AI2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe203、Fe0、Fe304、Cr 2。
3、V205、Mn0 2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。

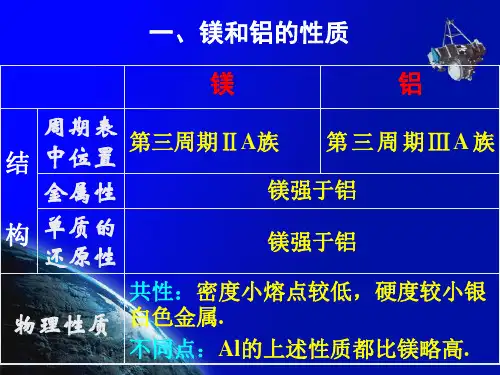
课时11 镁、铝及其重要化合物知识点一 镁、铝的性质及应用【考必备·清单】 1.镁、铝的结构和存在名称 镁 铝 周期表中位置 第三周期ⅡA 族第三周期ⅡA 族原子结构示意图自然界存在形态 化合态化合态2.镁、铝的物理性质都是银白色、有金属光泽的固体,密度较小,硬度较低,均具有良好的延展性、导电性和导热性等。
3.铝的化学性质写出图中有关反应的化学方程式:②2Al +3Cl 2=====点燃2AlCl 3④2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al +Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应)[名师点拨]①常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
②能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
5.与铝对比记忆镁的化学性质铝镁与非金属反应能被Cl2、O2、N2氧化2Mg+O2=====点燃2MgO(与O2反应)3Mg+N2=====点燃Mg3N2(与N2反应)与水反应反应很困难能与沸水反应:Mg+2H2O=====△Mg(OH)2+H2↑与碱反应能溶于强碱溶液不反应与某些氧化物反应能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应能在CO2中燃烧:2Mg+CO2=====点燃2MgO+C[名师点拨]①Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
②镁也可在氮气中燃烧,生成氮化镁(Mg3N2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气。
6.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应[名师点拨]①由MgCl2·6H2O到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。
②因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。


高中化学镁铝铁知识归纳知识网络一、镁及其化合物相关化学方程式2Mg+O2=2MgO3Mg+N2Mg3N2Mg+Cl2MgCl2Mg+2H+=Mg2++H2↑Mg+2H2O MgOH2+H2↑2Mg+CO22MgO+CMgO+H2O=MgOH2MgO+2HCl=MgCl2+H2OMgCl2熔融Mg+Cl2↑Mg2++CO32-=MgCO3↓MgCO3+2H+=Mg2++CO2↑+H2OMgCO3+CO2+H2O=MgHCO32MgCO3+H2O MgOH2+CO2↑MgOH2+2H+=Mg2++H2OMgOH2MgO+H2OMg3N2+6H2O=3MgOH2↓+2NH3↑二、铝及其化合物相关化学方程式4Al+3O2=2Al2O33S+2Al Al2S32Al+3Cl22AlCl32Al+6HCl=2AlCl3+3H2↑2Al+6H2O 2AlOH3+3H2↑2Al+Fe2O3Al2O3+2Fe2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+2H2O2Al2O3熔融4Al+3O2↑Al3++3H2O=AlOH3+3H+Al3++3NH3·H2O=AlOH3↓+3NH4+ Al3++3OH-=AlOH3↓Al3++4OH-=AlO2-+2H2OAl2S3+6H2O=2AlOH3↓+3H2S↑AlOH3+3H+=Al3++3H2OAlOH3+OH-=AlO2-+2H2OAlO2-+CO2+2H2O=AlOH3↓+HCO3-AlO2-+H++H2O=AlOH3↓AlO2-+4H+=Al3++2H2O3AlO2-+Al3++6H2O=4AlOH3↓三、铁及其化合物相关化学方程式3Fe+2O2纯Fe3O4Fe+S FeS2Fe+3Cl22FeCl3Fe+2H+=Fe2++H2↑3Fe+4H2O Fe3O4+4H2↑Fe+Cu2+=Cu+Fe2+FeO+2HCl=FeCl2+H2OFeOH2+2HCl=FeCl2+2H2O4FeOH2+O2+2H2O=4FeOH32FeCl2+Cl2=2FeCl3FeS+2H+=Fe2++H2S↑2Fe3++Fe=3Fe2+4FeS2+11O22Fe2O3+8SO2 Fe2O3+6H+=2Fe3++3H2OFe2O3+3CO 2Fe+3CO2Fe3++3H2O FeOH3+3H+Fe3++SCN-=FeSCN2+FeOH3+3H+=Fe3++3H2O2FeOH3Fe2O3+3H2O各部分知识回顾一、镁1.原子结构示意图:2.单质1在周期表中位置:第三周期ⅡA族碱土金属2物理性质:银白色,质软,轻金属,硬度较小,熔沸点较低;3化学性质①与非金属反应发出耀眼白光,常温形成致密氧化膜②与非金属氧化物反应③与非氧化学性质酸反应④与氧化学性质酸如硝酸、浓硫酸反应,不放出H2⑤与水反应能使酚酞变红⑥与盐溶液反应,能置换出后面的金属4冶炼:5用途:制轻合金、飞机、汽车部件、烟火、照明弹等; 3.化合物1MgO①物理性质:白色粉末,密度小,熔点高,硬度大,难溶于水;②化学性质:碱性氧化物, 缓慢③制法:MgCO3MgO+CO2↑④用途:耐火材料2MgOH2:难溶性中强碱:3MgCl2:无色、味苦、易溶、易潮解的白色晶体,具有可溶性盐的通性; 4KCl·MgCl2·6H2O光卤石:从中可提取MgCl2·6H2O二、铝1.原子结构示意图:2.在周期表中位置:第三周期ⅢA族3.单质1物理性质:银白色,质软,轻金属;2化学性质①与金属反应常温下被O2氧化,形成致密氧化膜,在O2中或高温下点燃生成Al2O3 4Al+3O22Al2O3与Cl2、S等非金属反应 2Al+3Cl22AlCl3 2Al+3S Al2S3②与Fe3O4、WO3、MnO2等金属氧化物发生铝热反应8Al+3Fe3O44Al2O3+9Fe③与非氧化性酸发生置换反应2Al+6H+=2Al3++3H2↑注:常温下在浓硫酸、浓硝酸中钝化;④与沸水发生置换反应2Al+6H2O 2AlOH3+3H2↑⑤与强碱液液反应:⑥与盐溶液反应,置换后面的金属3冶炼:熔融电解4用途:制轻合金、飞机、汽车、轮船部件,导线,炊具、还原剂,铝热剂; 4.化合物1Al2O3①物理性质:白色难溶固体,熔点高,硬度大;②化学性质:两性氧化物Al2O3+6H+=2Al3++3H2OAl2O3+2OH-=2AlO2-+H2O③制法:④用途:制铝、耐火材料;刚玉可做仪器、手表轴承、磨料等;2AlOH3:两性氢氧化物,不溶于水的白色胶状物AlOH3+3H+=Al3++3H2OAlOH3+OH-=AlO2-+2H2O3AlCl3:具有可溶性盐的通性,能水解而呈酸性,只存在于酸性溶液中; 4NaAlO2:易水解而显碱性,只存在于强碱性溶液中AlO2-+ H++ H2O=AlOH3↓5KAlSO42·12H2O明矾:属复盐,易水解生成胶状AlOH3,可做净水剂;三、铁1.原子结构示意图:能失去最外层2个电子及第三层1个电子2.在周期表中位置:第四周期第Ⅷ族,属过渡元素3.存在①游离态:少量存在于陨石中;②化合态:赤铁矿、磁铁矿、褐铁矿、黄铁矿、菱铁矿;4.单质1物理性质:银白色,ρ=·cm-3,熔点1535℃;纯铁抗蚀能力较强,能被磁铁吸引和磁化;2化学性质:典型金属,有金属通性;①与非金属反应与O2:常温干燥空气中不易与O2反应,但在潮湿空气中易形成原电池等形式被腐蚀;铁粉能在纯氧中燃烧:与卤素:I2+Fe FeI2与硫:②与酸反应非氧化学性质酸:与浓硝酸、浓硫酸:常温下钝化,加热时反应③与盐:④与水:↑3冶炼:5.化合物1氧化物:FeO、Fe2O3、Fe3O42氢氧化物:FeOH2、FeOH33盐:①亚铁盐:FeSO4·7H2O绿矾②铁盐:FeCl3、Fe2SO43③络盐:FeSCN n3-n n=1~6四、合金1概念:由两种或两种以上的金属或金属跟非金属熔合而成的具有金属特性的物质;2特点:合金性质不是各成分金属性质的总和;硬度一般比各成分金属大;多数合金的熔点一般比各成分金属低;化学性质与成分金属不同;3常见合金:镁铝合金、硬铝、合金钢、锰钢、黄铜、青铜、钛合金……。
考点15 镁、铝及其重要化合物一、镁和铝的性质金属项目镁(Mg)铝(Al)原子结构原子最外层2个电子原子最外层3个电子原子半径1.60×10−10 m 1.43×10−10 m化合价+2+3单质性物理性质镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝相比较,铝的硬度比镁的稍大,熔点和沸点都是铝比镁的高活泼性较活泼较活泼抗腐蚀性在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有高腐蚀性能与O22Mg+O22MgO4Al+3O22Al2O3主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等铝热反应2Al+Fe2O32Fe+Al2O34Al+3MnO23Mn+2Al2O3在实验室按如图所示装置进行铝热反应,实验现象是当外露部分镁条刚刚燃烧完毕时,纸漏斗内混合物立即剧烈反应,发出耀眼的光芒,产生大量的烟。
纸漏斗被烧破,有红热状的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体(落下的是铁珠)。
铝热反应是指工业上用铝粉来还原一些金属氧化物,得到Fe、V、Cr、Mn等难溶金属的一类反应。
铝热反应的实质是铝在高温条件下将活动性比铝弱的金属从其氧化物中置换出来.二、氧化铝和氢氧化铝两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物.名称氧化铝氢氧化铝化学式Al2O3Al(OH)3类别两性氧化物两性氢氧化物物理性质高熔点,高沸点,高硬度,不溶于水的白色固体不溶于水的白色胶状固体,具有吸附性化学性质①与强酸反应:Al2O3+6H+2Al3++3H2O②与强碱反应:Al2O3+2OH—22AlO-+H2O①两性:Al(OH)3+3H+Al3++3H2OAl(OH)3+OH—2AlO-+2H2O②热稳定性:2Al(OH)3Al2O3+3H2O用途炼铝原料、制作耐火材料可用作吸附剂、媒染剂和净水剂;治疗胃酸;可作为制造瓷釉、耐火材料、防水织物的原料三、“铝三角"及其应用1.具体反应Al(OH)3+OH−2AlO-+2H2OAl(OH)3+3H+Al3++3H2OAl3++3OH−Al(OH)3↓AlO-+H++H2O Al(OH)3↓2AlO-+4H+Al3++2H2O2Al3++4OH−2AlO-+2H2OAl3++32AlO-+6H2O4Al(OH)3↓2.应用(1)判断离子共存问题Al3+与OH−及2HCO-以AlO-与H+、3AlO-、23CO-、S2−等弱酸根阴离子或2及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
镁、铝及其重要化合物一、镁及其化合物镁合金强度高,机械性能好,制造汽车,飞机,火箭的重要材料,冶金时,镁常用作还原剂和脱氧剂. 常温下氧化生成氧化物保护层,具有抗腐蚀的性质.镁与O2,N2,CO2等气体燃烧.2Mg+O22MgO CO2+2Mg2MgO+C 3Mg+N2Mg3N2镁与SiO2:2Mg+SiO2=2MgO+Si镁与冷水反应很慢,在加热时反应加快.Mg+2H2O=Mg(OH)2+H2↑镁与非氧化性酸.Mg+2HCl=MgCl2+H2↑镁与水解显酸性的盐溶液的反应. Mg+2NH4Cl =MgCl2+2NH3↑+H2↑镁盐与氨水,产生Mg(OH)2沉淀.Mg(OH)2又能溶解在NH4Cl溶液中.前者由Mg(OH)2的特殊溶解性决定.在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大.故产生Mg(OH)2的条件:浓的Mg2+ 盐溶液与浓氨水反应.后者是由Mg(OH)2的电离性质和+4NH的水解性质决定.通常认为Mg(OH)2完全电离,能溶解在饱和NH4Cl溶液中,MgCl2+2NH3·H2O Mg(OH)2+2NH4Cl海水提镁:㈠海水加碱,得氢氧化镁沉淀,沉淀分离出来再加盐酸,变成氯化镁;后过滤,干燥,电解得镁.Mg2++2OH-==Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2Mg+Cl2↑㈡从海水提取出食盐、KCl、Br2以后留下的母液浓缩,得到卤块,主要成分是MgCl2·6H2O,然后脱水, MgCl2·6H2O MgCl2+6H2O,最后电解熔融的氯化镁得到镁.氧化镁(白色粉末,高熔点,碱性氧化物,)与水缓慢作用,与酸反应.MgO+2HCl=MgCl2+H2O MgO+H2O Mg(OH)2氢氧化镁(白色粉末,难溶于水)与H+作用,与NH4Cl溶液作用,对热不稳定.Mg(OH)2+2HCl=MgCl2+2H2O Mg(OH)2MgO+H2O↑二、铝及其化合物铝(银白色金属,导电性仅次于银、铜和金。
镁铝及其化合物知识点 SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-
镁、铝及其化合物知识点整理
Ⅰ.课标要求
1.通过海水制镁的事例了解镁及化合物的性质.
2.通过合金材料了解铝及化合物的性质.
3.能列举合金材料的重要应用.
Ⅱ.考纲要求
1.掌握镁铝及化合物的性质.
2.了解镁铝及化合物在生活.生活中的应用.Ⅲ.教材精讲
一. Mg、Al的化学性质
1.与非金属反应
(1)与O
2反应:常温下与空气中的O
2
反应生成一层致密的氧化物
薄膜,所以镁、铝都有抗腐蚀的性能。
镁能在空气中燃烧:
2Mg+O
22MgO ,铝在纯氧中燃烧:4Al+ 3O
2
2Al
2
O
3
(2)与卤素单质、硫等反应:Mg+ Cl 2
MgCl 2
2Al+ 3Cl 2
2AlCl 3
2Al+ 3S
Al 2S 3 (用于工业制
备) Mg+ S
MgS
③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2.与H 2O 反应
Mg 、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气
Mg+2H 2O (沸水) Mg(OH)2+H 2↑ 2A1+6H 2O
2A1(OH)3+3H 2
↑
[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生: 2Mg+O 2
2MgO 3Mg+N 2
Mg 3N 2 2Mg+CO 2
2MgO+C
②燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
3.与酸反应置换出H
2
Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H
2
,其中铝
在冷浓 H
2SO
4
,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷
的浓硫酸或浓硝酸。
4.与某些氧化物反应
(1)镁与二氧化碳反应:2Mg+CO
2
2MgO+C
[特别提醒]:“CO
2不能助燃”的说法是不全面的,CO
2
对绝大多
数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe
2O
3
2Fe+ Al
2
O
3
铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金
属氧化物可以是:Fe
2O
3
、FeO、Fe
3
O
4
、Cr
2
O
3
、V
2
O
5
、MnO
2
等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
③要使用没有氧化的铝粉,氧化铁粉末要烘干。
④KClO 3作为引燃剂,也可以用Na 2O 2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
5.与碱反应
镁不与碱反应,铝与碱液反应:2Al+2NaOH+6H 2O
2NaAlO 2+4H 2O+3H 2↑
简写:2Al+2NaOH+2H 2O 2NaAlO 2+3H 2↑
二.氢氧化铝
1.物理性质:A l (O H )3是几乎不溶于水的白色胶状固体,具有吸附性。
2.化学性质
①与酸反应:Al(OH)3 +3HCl =AlCl 3+3H 2O 离子反应方程式:Al(OH)3+3H +=Al 3++3H 2O ②与碱反应:Al(OH)3+NaOH =NaAlO 2+2H 2O 离子反应方程式:Al(OH)3+OH =NaAlO 2+2H 2O
3.Al(OH)
3
的制取
①铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不
用强碱与可溶性铝盐溶液反应是因为氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液
②偏铝酸盐与酸反应:一般用向偏铝酸盐溶液中通入CO
2
的方法
制取Al(OH)
3。
当CO
2不足或适量时:2AlO
2
+CO
2
+3H
2
O=2Al(OH)
3
↓+CO
3
2
当CO
2过量时:AlO
2
+CO
2
+2H
2
O=Al(OH)
3
↓+HCO
3
4.Al(OH)
3的用途:由于A l(O H)
3
具有吸附性,既能凝聚水中悬
浮物,又能吸附色素,因此A l(O H)
3
可作净水剂和色素吸附剂。
[特别提醒]:(1)制取Al(OH)
3
也可用铝盐与强碱作用,但应严
格控制加入碱的量,因为强碱过量会使制得的Al(OH)
3
转化为偏铝酸盐。
(2)一般不用强酸,因为强酸的量控制不当会使制得的Al(OH)
3溶解。
三.镁铝及其化合物的转化关系图 1.镁及其化合物的知
识主线
上图的1~13中的
有关化学方程式如下:
1、
2、
3、
4、
5、 MgO+H
2O ==== Mg(OH)
2
6、7、8、9、
10、 MgCO
3+H
2
O===Mg(OH)
2
+CO
2
↑
11、 Mg
3N
2
+6H
2
O=3Mg(OH)
2
+2NH
3
↑
12、
13、
2.铝及其化合物的知识主线(重点)(创新设计P37 “铝三角”相关图像)
上图1~12的有关化学方程式如下:
1、
2、
3、
4、
5、
6、
7、
8、9、
10、
11、
12、 2KAl(SO
4)
2
+ 6NH
3
·H2O = 2Al(OH)
3
↓ + K
2
SO
4
+3(NH
4
)
2
SO
4。