国家局飞行检查情况汇总
- 格式:xls
- 大小:34.00 KB
- 文档页数:6


2023
序号被检查
单位
品种省份检查发现问题备注
1 湖南海普
明科技有
限公司
软性亲
水接触
镜
湖南
检查发现一般不符合项12项。
一、机构和人员方面
1.进入十万级洁净车间的人员更衣流程未明确是否需要戴手套,实际对
进入车间的检查组人员要求不一致,从女更进入人员要求戴手套,从男更进
入人员未要求。
二、设备方面
2.提纯车间旋转蒸发器清洗记录中未记录设备编号;PP杯包装机的硅胶
管未规定更换周期,未建立更换记录;萃取车间的萃取柜舱门不严密,工作
时有蒸汽漏出。
3.旋转蒸发器的真空表未计量检定,检验室使用的滴定管没有检定标
识。
提纯车间的电子计重秤的操作规程中未规定使用前校验。
三、文件管理方面
不符合
项目整
改已完
成。

飞行检查总结报告1. 背景介绍飞行检查是航空公司运营过程中重要的环节之一,旨在确保飞机的飞行安全和正常运营。
本次总结报告将对最近一次飞行检查的情况进行详细分析和总结。
2. 检查目标与范围本次飞行检查的目标是评估飞机的机械状态、飞行员的技术水平以及航空公司的运营流程。
范围包括飞机设备的完好性、飞行员的技术能力和飞行操作流程的合规性等多个方面。
3. 检查过程本次飞行检查采用了多种方式,包括机械设备的检查、飞行员的模拟飞行以及实际飞行任务。
在检查过程中,我们详细记录了各项指标的数据和观察情况,并对可能存在的问题进行了记录和分析。
4. 结果分析在本次飞行检查中,我们对飞机设备的完好性进行了全面的检查,包括机体、机翼、发动机等各个方面的检查。
通过数据的分析,我们发现了部分机体结构存在磨损情况,需要及时修复和更换。
同时,我们还对飞行员的技术能力和操作流程进行了评估,发现部分飞行员存在操作不规范和技术瑕疵的问题,需要进一步培训和指导。
5. 问题解决方案针对本次飞行检查中发现的问题,我们制定了以下解决方案:a) 机体结构的问题将尽快报告给维修团队,紧急修复并更换受损的部件,确保飞机的安全运行。
b) 针对飞行员存在的技术问题,我们将制定针对性的培训计划,提升其技术能力,确保其操作符合规范和安全要求。
c) 对于操作流程方面的问题,我们将与相关部门进行沟通,并进行规范化的流程调整。
6. 结束语通过本次飞行检查,我们发现了一些问题,并制定了解决方案,以确保飞机的安全运行和航空公司的运营质量。
我们将持续关注并改进飞行检查的流程和标准,以提高飞行安全和运营水平。
谢谢。

国家局审核查验中心飞检汇总2015年1月22日至28日,食品药品监管总局组织检查组分别对河南禹州、安徽亳州、河北安国、湖南廉桥、四川荷花池等5个中药材专业市场进行飞行检查。
检查发现上述中药材专业市场普遍存在不同程度的以次充好、染色增重、掺杂使假、违法加工、非法经营等问题。
具体如下:河南禹州中药材专业市场:非法加工销售中药饮片问题十分突出,市场内商铺门前随处可见当地药农采用浸、泡、煎、煮、炒、炙、煅、煨等炮制方法加工饮片,品种如砂炙鳖甲、麸炒僵蚕、杜仲皮炒炭等;市场内有商户当街进行栀子染色;商户经营的红参用糖浸泡,高甜度,参味弱;柴胡等以同属不同种伪品冒充正品、以柴胡茎等非药用部位替代药用部位出售。
同时还存在无视卫生条件随意晾晒中药材等问题。
安徽亳州中药材专业市场:红参用糖浸泡,高甜度、参味淡,有的表面已经有糖霜析出;沉香表面喷油,劣质的沉香或者檀香则直接标注为“非药用”品,以逃避管理者查处;银杏、百合过度硫磺熏蒸,口尝明显发酸;东革阿里等进口木材是非药用材料,但被宣传具有药用疗效。
其中,2091摊位一个程姓商户涉嫌暗中售假蒲黄、海金沙;中国(亳州)康美中药城矿石专营随姓商户涉嫌非法销售冰片、青黛、阿胶、龟甲胶、鹿角胶等按批准文号管理的中药,属非法经营。
河北安国中药材专业市场:红参为便于浸糖增重已被去皮,外观呈红色或黑红色,口尝较甜,参味较弱,其有效成分流失严重;沉香浸油以次充好、血竭掺伪及染色;百合,白及,天麻等过度硫磺熏蒸,口尝发酸;以翼蓼冒充何首乌、土大黄冒充大黄、大叶骨碎补冒充骨碎补、黄精冒充白及等;龙胆草和吴茱萸以非药用部位冒充药用部位;销售霉变甘草片、牛鞭片中药饮片等质量问题;还存在采用“菜刀”加“案板”等家庭式加工方式非法加工西洋参片、黑枸杞、牛蒡根、辣木籽等中药饮片销售;违法销售斑蝥、红娘虫等毒性中药材和穿山甲片等国家保护的野生动植物药材;无视卫生条件随意晾晒黄芪、枳实、牛鞭等中药材等。

医疗器械飞行检查情况通告(2023年第4号)
尊敬的各位厂家和经销商:
经过本着质量第一、安全至上的原则,我局对全国各地医疗器械企业进行了飞
行检查。
现将2023年第4号医疗器械飞行检查情况通告如下:
检查情况
共检查出各类医疗器械300余种,其中有148种医疗器械存在各种问题,包括:未按照国家标准生产制造的医疗器械、生产质量不符合国家标准的医疗器械、骗取注册和备案的医疗器械等。
危害性
这些存在问题的医疗器械的使用,会对人们的健康产生不利影响,甚至危及人
体生命安全。
处理措施
为了保障人们的生命健康,我局决定,对存在问题的医疗器械,按照国家相关
规定进行处理。
对于涉及到不合格医疗器械的厂家和经销商,我局将依法进行查处,追究其法律责任。
后续措施
为了保障医疗器械的质量和安全,我局将进一步加大对医疗器械的飞行检查力度,严厉打击垄断和不正当竞争行为,促进医疗器械市场健康发展。
建议
各医疗器械生产企业和经销商对自己的产品生产管理要严格把关,保证质量安全。
同时,须认识到质量安全是企业生命的关键,不具备质量安全条件的企业将难以在市场上立足。
谢谢大家的合作!
国家医疗器械监管局
2023年11月20日。

航空航天行业飞行安全检查工作总结航空航天行业作为现代科技的前沿领域,飞行安全始终是重中之重。
飞行安全检查工作则是保障飞行安全的关键环节之一,其目的在于及时发现并消除潜在的安全隐患,确保每一次飞行都能够安全、顺利地进行。
在过去的一段时间里,我们的飞行安全检查工作经历了种种挑战,也取得了一定的成绩。
以下是对这段时间工作的详细总结。
一、工作背景与目标随着航空航天技术的不断发展,飞行任务的日益复杂和多样化,对飞行安全的要求也越来越高。
我们的飞行安全检查工作旨在依据国家和行业的相关标准、规范,以及企业内部的安全管理制度,对飞行活动的各个环节进行全面、细致的检查,以预防事故的发生,保障人员生命财产安全,维护国家航空航天事业的声誉和发展。
二、工作内容与方法1、飞行器检查对各类飞行器进行定期和不定期的检查,包括机体结构、动力系统、飞行控制系统、导航系统等关键部位。
检查工作采用了先进的检测设备和技术,如无损检测、传感器监测等,同时结合人工目视检查,确保不放过任何一个可能影响飞行安全的细节。
2、飞行人员资质审查严格审查飞行人员的资质和培训情况,包括飞行执照、健康状况、飞行经历、应急处置能力等。
定期组织飞行人员进行培训和考核,确保其具备足够的知识和技能应对各种飞行状况。
3、飞行环境评估对飞行任务的环境因素进行评估,包括气象条件、空域状况、机场设施等。
与气象部门保持密切联系,及时获取准确的气象信息,为飞行决策提供依据。
4、安全管理制度执行情况检查检查企业内部的安全管理制度是否得到有效执行,如飞行前的准备工作流程、飞行中的操作规范、飞行后的维护保养要求等。
对违反制度的行为进行严肃处理,同时加强对制度的宣传和培训,提高员工的安全意识和遵守制度的自觉性。
三、工作成果与成效1、安全隐患排查与整改通过一系列的检查工作,共发现了____处安全隐患,其中包括____个重大隐患和____个一般隐患。
对于发现的隐患,我们及时制定了整改措施,并跟踪整改情况,确保隐患得到彻底消除。

第十一部分不良事件监测、分析和改进1企业仅针对检测过程中产生的合格和不合格进行了统计,形成质量统计月报表,未按数据分析控制程序(3L/QP 020)中的规定,运用统计技术对与产品质量、不良事件、顾客反馈和质量管理体系运行相关的数据进行分析。
2企业未按照公司制定的《不良事件控制程序》要求对2018年全年度的医疗器械不良事件监测情况进行数据分析。
3企业建立了数据分析程序,但未按照程序要求开展数据分析。
4企业售后服务记录表中,顾客朱某于2017年10月15日购买的产品(型号GK-5A)存在无法开机的质量问题,企业未分析问题原因,也未采取有效预防措施。
5企业2018年质量目标规定过程检验一次送检合格率≥95.6%,顾客投诉率≤5%,但未对这两个质量目标完成情况进行统计汇总。
62018年质量审核文档的质量审核依据有ISO9001、ISO13485、医疗器械生产质量管理规范现场检查指导原则、及美国QSR820、加拿大CMDR、欧盟MDD等,但质量审核报告只记录了依据ISO9001、ISO13485、医疗器械生产质量管理规范现场检查指导原则开展审核的内容。
7企业于2017年5月1日、2018年3月1日两次修订《白模具验收标准操作规程》中底模盖模尺寸,但至今未对2014年购进、存于库房的白模具按验收操作规程进行尺寸检测。
8企业建立有《数据分析控制程序》(文件编号:ZMN/OP-18,版本 5.1,生效日期:2018.7.27),提供了近两年的客户投诉反馈单记录和不良事件记录的详细列表,均有对应的处置资料,企业自称在每年的管理评审中会开展分析,但企业未严格按照《数据分析控制程序》的要求对不良事件和客户投诉进行归纳统计分析和评价。
* 9有不良事件报告程序,但未明确具体人员,相关人员对不良事件报告的具体要求、时限说不清楚。
10针对国抽不合格批号产品,企业发布了产品召回通告,但未能召回产品,看到进货单位的产品已用完说明。

飞行检查总结报告一、引言在飞行事业中,安全始终是最重要的关键。
为了确保飞行操作的安全性和有效性,飞行检查在航空业务中起着重要的作用。
本报告旨在总结最近一次飞行检查的结果,并提出改进建议,以进一步提高飞行安全水平。
二、检查概述本次飞行检查由航空公司专业监察团队组织,检查范围涵盖了航班准备、飞机装载和卸货、飞行操作、通信联络、紧急处置和导航系统等方面。
检查过程中,我们对飞行员队伍的技能水平、作业程序的遵循度以及飞行安全意识进行了综合评估。
三、检查结果1. 飞行员技能水平在本次飞行检查中,飞行员队伍展示了高水平的技能和专业素养。
他们对飞行操作程序的掌握程度良好,能够熟练运用机上设备进行操作,并通过高效的协作完成任务。
飞行员们在应对各种紧急情况时表现出色,展现出出色的应变能力和决策水平。
2. 作业程序遵循度航空公司在飞行作业程序的落实方面表现出色。
各个环节都严格按照标准操作流程进行,保证了飞行的安全和准确性。
此外,飞行员在飞行前的准备工作和航班报告的书写以及飞行后的相关记录和报告填写等方面也做得非常到位。
3. 飞行安全意识飞行员和机务人员在本次飞行检查中展现了高度的飞行安全意识。
他们对飞行规章制度和安全程序有着清晰的理解和遵守,严格遵循安全操作规范。
在面对潜在风险和突发紧急情况时,他们能够快速反应和采取适当的措施,确保乘客和机组人员的安全。
四、改进建议尽管本次飞行检查取得了良好的成绩,但仍有一些可以改进的地方,以进一步提高飞行操作的安全性和效率。
1. 强化培训计划:进一步加强飞行员和机务人员的培训,提高他们的技能水平和专业素养。
持续的培训可以使他们不断适应新技术和操作流程,增强应对复杂情况的能力。
2. 审查操作程序:定期审查和更新操作程序,确保其与最新的安全标准和法规一致。
优化流程可以减少操作风险和错误,并提高整体运行效率。
3. 强化沟通协作:鼓励飞行员和机务人员之间的密切合作和信息共享,加强团队协作精神。

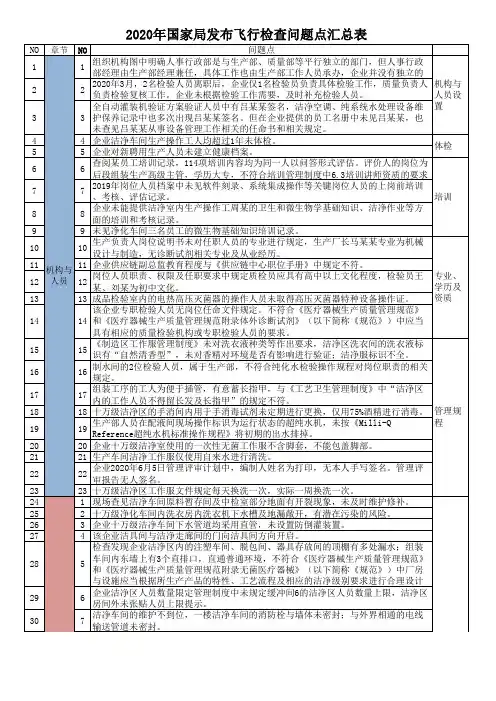
国家局飞检不合格项汇总,第一部分机构和人员1企业管理组织机构图中管理者代表负责质管部和注册管理部两个部门,与质量手册(3L/QM-01)中管理者代表的职责和权限不一致。
2个别接触产品的生产工人无健康档案。
* 3管理者代表不能履行建立、实施和保持质量体系运行和改进的能力。
不能回答现场有关管理规范、洁净常识等提问。
4 现场提问质量负责人等有关人员,对医疗器械质量管理规范知识和技能不熟悉。
无开展《规范》培训的记录。
* 5企业负责人高某不熟悉企业生产运行及质量管理。
* 6质量管理手册中管理者代表为吕某,现已离职,现场检查期间管理者代表未更新。
7健康档案中缺少研发部负责人王某某和管代刘某等影响产品质量的人员的相关材料。
8《质量手册》未规定生产部门中不同岗位的职责权限,如未规定生产部经理、车间主任、操作工各自的职责权限;《岗位说明书》中缺少供销部经理、车间主任的岗位说明。
92019年7月2日,企业对全体职工进行了《医疗器械生产质量管理规范》的培训,培训效果的考核规定为考试,实际考核为现场提问。
10缺少职业技能培训记录。
11人员花名册显示有30人,但考勤表有47名员工。
122018年12月21日,管理者代表主持进行年度管理评审,无证据证明企业负责人组织实施管理评审活动。
13称量间,操作人员现场使用FA1104电子分析天平,但未按照该仪器的标准操作规范(SB-SOP-019)调零。
14检验相关人员的专业能力与其岗位不适应。
批号为2019060314的二氯化汞饱和水溶液配制复核人李某的专业为日语,企业未能提供其与所配制产品相适应的专业技能培训记录或相关资格证明,也未能提供250ml量筒的自校人员(苏某某)相应的专业技能培训记录或相关资格证明。
15质量部理化室试剂架的稀硫酸溶液(批号20190816),配制人为黄某某(专业为生物技术),复核人为罗某某(专业为动物医学),且企业未能提供其与所配制产品相适应的专业技能培训记录或相关资格证明。

医疗器械飞行检查情况通告(2023年第2号)
近期,国家药品监督管理局对全国范围内的医疗器械生产企业展开了为期两周的飞行检查,共检查了200家企业,涉及医疗器械包括医用手术器械、医用诊断试剂和医用电子产品等种类。
经过检查,发现了一些不符合标准的企业和产品,现将检查情况通告如下:
飞行检查概述
监督检查内容
飞行检查主要涉及医疗器械生产过程、品质管理体系、原材料质量、人员资质及管理情况、设备的设施和维护情况等方面,旨在全面了解企业的质量管理体系和生产过程,并发现和纠正存在的问题。
检查结果
经过检查,共检出存在问题的企业24家,其中在生产过程中存在严重问题的企业5家。
同时还发现了一批不符合标准的医疗器械,共计2000件。
检查结果通告
处罚结果
检查发现的存在问题的企业将受到罚款和停产整顿等处罚,具体处罚方式由当地药品监管部门根据法律法规进行决定,在此不再赘述。
安全警示
国家药品监督管理局再次提醒广大企业,在生产过程中要严格遵守相关的质量管理体系和标准,确保产品能够符合标准要求,以保障广大公众的健康和安全。
处理措施
为了保障消费者的利益,要求对于已经存在问题的医疗器械,相关企业应该采取一定的处理措施,具体处理方式包括召回、停产整顿、销毁等,以确保安全。
另外,要求对于未发现问题但是涉及被检出问题的企业和产品也要严格把控,确保产品质量符合标准要求,以维护广大消费者的健康权益。
总结
本次医疗器械飞行检查意在加大对生产企业和产品质量的监管,以保障广大公众的安全和利益。
同时,也提醒各企业感受此次飞行检查的压力,加强生产质量管理,确保生产过程及产品质量符合标准和规范要求。
西安国家飞行检查检查点总结检查企业:陕西玉龙医药XXX;陕西恒生医药XXX;西安华协医药有限责任公司;一、检查时间:两天二、检查安排:第一天:客户资质、首营资料、进销存记录、账货相符等。
第二天:冷链专项。
三、检查概述:1、检查组组成:国家局10人,省、市、区分局陪同8-12人。
2、检查形式:进库立刻分散,各人查各人的内容,最后做汇总简报。
3、检查手段:手机APP对货物进行扫码。
让企业根据规程进行现场演练操作。
4、取证办法:记录问题,手机拍照取证,手机拍照取证时要拍证据上的企业名称或同时拍企业人员照片。
四、检查重点:第一天就不详细说了,就是10个人拿各种资料,然后进会议室后关门核对所有资料。
第二天冷链专项。
1、检查流程:A、进库后让企业提供冷链相关操作规程、验证报告和企业花名册,根据报告,让验证相关人员(如养护员)进行现场操作,核对操作规程与现场操作是否一致,同时检查操作规程是否符合GSP要求。
过程中其他人不得提醒和提供帮助。
B、要求打印一段时间(要求半年,货量大也可减少)进销存系统内所有冷链单据,同时在监控系统中调出这段时间的温湿度记录,一条一条对。
C、报告检查:a.查询年度验证计划(必查项);b.根据年度验证计划核对本次验证时间及验证项目;c.查参与人员签字;d.要培训记录及培训内容(要纸质的!);e.对参加过培训的人员提问,不许其他人帮忙,主要问题如下:1)规范要求的布点原则是什么?2)你们企业布点原则是什么?3)验证项目你们这次都做了哪些?4)项目怎么做的你大概给我描述一下。
5)根据岗位不同根据操作规程提出一些问题,主要是跟冷链相关的,比如开门多长时间,冷链运输最长时间是多少,路上车坏了怎么办等。
f.核对报告所使用的校准证书,一张一张核对。
g.根据报告的结论核对企业操作规程。
2、检查重点及与我们相关:A中检查重点是操作规程,与我们相关的就是验证后我们给客户的报告结论,建议根据各地实际情况,将报告整理后给客户一套验证结论。
飞行检直不合格项汇总(1)生产间隙期洁净区的地漏未水封;(2)除菌过滤药液的滤心在使用后未做滤心完整试验;(3)企业未建立防止筛网断裂的措施(该筛网用于待分装的注射用阿魏酸钠过筛);(5)粉针剂车间操作人员2006年未进行皮肤病检查(5601);(6)验证过程中的数据收集不全,分析内容不完整;列管式纯蒸汽发生器的验证未收集每小时蒸汽发生量、不同时间段蒸汽的质量(6001);(7)批生产记录内容不全,如:胶塞清洗的最后一次注射用水清洗的可见异物检查记录未归入批生产记录;(8)精制工序中过筛后的阿魏酸钠(注射用)废粉、母液未制定处理程序;(9)胶塞灭菌柜、脉动真空灭菌柜、热风循还烘箱的自动打印设备不能实施自动打印,使用过程中采取手工记录;(10)一万级洁净区地面自流坪破损处未及时修复;(1101)(11)部分设备维修保养记录内容不全;(3701)(12)个别洁净生产操作间的废弃物未及时处理;(5001)(13)水系统再验证过程中的部分数据收集不全;(6001)(14)个别批生产记录数据收集不完整。
(6801)(15)洁净区使用的拖帕和抹布未存放在规定地点(1103);(16)小容量注射剂空调净化系统初效过滤器未按规定及时清洗(1504);(17)洁净区工作鞋无清洗记录(5203);(18)从事灯检的人员未进行色盲检查(5601);(19)胶塞漂洗间无生产状态标识(7009);(20)质量管理部门未严格履行对检验用仪器、试剂管理办法的职责(7503);(21)从事药品生产的人员经相应的专业技术培训不够(0601);(22)固体原辅料库房中存有液体原料药维生素E和三氯叔丁醇(4302);(23)个别设备清洁状态标示未规定有效期,仅有已清洁的标示,个别设备未挂清洁状态标示(4902);(24)不同洁净级别工作服(一万级与十万级)均为蓝色,仅有微小的花纹差别,不易区分(5201);(25)十万级洁净区内,洁净服上的自编号与清洗、消毒、灭菌记录中登记的号码不符,无发放记录;(5204)(26)部分文件制订的内容不完整。
飞行检查情况汇报根据飞行安全管理规定,我司于2022年10月10日进行了飞行检查,现将情况汇报如下:一、飞行器检查情况。
本次飞行检查主要针对飞行器的机械设备和电子设备进行了全面检查。
经过检查,飞行器的发动机、起落架、襟翼等机械设备运行正常,无异常声响和异味。
电子设备包括导航系统、通信系统和飞行控制系统等也运行良好,无故障报警和失灵情况。
二、飞行员身体状况检查情况。
飞行员身体状况是飞行安全的重要保障。
本次飞行检查对飞行员进行了身体状况检查,包括身体健康、精神状态和工作疲劳情况等。
经检查,飞行员身体状况良好,精神状态饱满,不存在工作疲劳情况,符合飞行安全要求。
三、气象条件检查情况。
气象条件是影响飞行安全的重要因素。
本次飞行检查对目的地和途中气象条件进行了详细检查。
根据气象部门提供的数据,目的地和途中的天气情况良好,不存在大风、雷暴和降水等恶劣天气,符合飞行要求。
四、飞行计划检查情况。
飞行计划是飞行安全的重要保障之一。
本次飞行检查对飞行计划进行了详细检查,包括航线选择、高度规划、燃油消耗等内容。
经检查,飞行计划合理,航线选择合适,高度规划科学,燃油充足,符合飞行安全要求。
五、飞行员操作技能检查情况。
飞行员的操作技能是保障飞行安全的重要因素之一。
本次飞行检查对飞行员的操作技能进行了检查。
经检查,飞行员操作技能熟练,能够熟练应对各种飞行情况,符合飞行安全要求。
综上所述,本次飞行检查情况良好,各项指标均符合飞行安全要求,飞行器、飞行员、气象条件、飞行计划和操作技能等方面均不存在安全隐患。
我们将继续加强飞行安全管理,确保飞行安全,为乘客提供安全、舒适的飞行服务。
32条国家局飞行检查确认与验证缺陷汇总及分析1、产品工艺验证不符合要求现场检查发现企业生产的盐酸小檗碱7种批量,但仅对其中3种批量进行验证。
点评:确认与验证附录第十九条规定,…工艺验证应当包括首次验证、影响产品质量的重大变更后的验证、必要的再验证以及在产品生命周期中的持续工艺确认,以确保工艺始终处于验证状态。
所以,任何使用新批量进行商业化生产前均应进行工艺验证,盐酸小檗碱片增大生产批量或减小生产批量对制粒后、混合后颗粒的均一性产生影响,应进行工艺验证。
2003版药品生产验证指南中提到批量大小变化小于等于10%,属于较小变动,一般不需再验证!2、产品验证不符合要求(1)痛风舒片混合粉实际生产批量与工艺验证批量不一致。
点评:GMP第一百四十九条规定,应当根据验证的结果确认工艺规程和操作规程。
确认与验证附录第二十二条规定,工艺验证批的批量应当与预定的商业批的批量一致。
怎么个死法,任选一条!(2)氨咖黄敏胶囊总混质量均一性验证未确认取样位置和取样量。
点评:确认与验证附录第二十五条规定,工艺验证方案应当至少包括以下内容:…(十)取样方法及计划;应在工艺验证方案中明确氨咖黄敏胶囊总混质量均一性取样计划,包括取样位置、取样点数量、取样量、取样工具等,并根据取样点位置对样品进行编号,以便检验结果的追溯。
按照2015版中国药典0941含量均匀度检查法执行,取上中下各取3个样品+中心点,共10个样品。
(3)五维他口服液验证批未体现取样检测情况,缺失部分过程;未按要求检测配料的样品性状、相对密度和主药含量,报告中也无含量检测数据。
点评:GMP第一百四十八条规定,确认或验证应当按照预先确定和批准的方案实施,并有记录。
确认或验证工作完成后,应当写出报告,并经审核、批准。
确认或验证的结果和结论(包括评价和建议)应当有记录并存档。
(4)痛风舒片工艺规程的变更无相关研究数据或验证数据支持。
点评:GMP第一百四十二条规定,当影响产品质量的主要因素,如原辅料、与药品直接接触的包装材料、生产设备、生产环境(或厂房)、生产工艺、检验方法等发生变更时,应当进行确认或验证。
国家医疗器械飞行检查不合格项汇总一、背景介绍1. 我国是世界上最大的医疗器械市场之一,医疗器械的质量安全直接关系到民众的健康和生命安全。
为保障医疗器械的质量安全,国家对医疗器械进行了严格的监管,其中医疗器械飞行检查就是一种重要的监管方式。
2. 医疗器械飞行检查即国家食品药品监督管理总局组织的医疗器械监管人员对医疗器械生产、经营单位进行突击检查,以发现和排查医疗器械质量安全隐患,维护公共健康和安全。
二、飞行检查不合格项汇总1. 检查对象特点分析a. 医疗器械生产企业b. 医疗器械经营企业c. 监管部门2. 检查过程及不合格项a. 对医疗器械生产企业的检查不合格项汇总1) 生产环境不符合要求2) 生产设备不合格3) 质量管理体系存在缺陷4) 生产记录不完整5) 产品标识不符合标准b. 对医疗器械经营企业的检查不合格项汇总1) 进货渠道不明确2) 购进医疗器械未经许可3) 销售医疗器械未按规定进行备案4) 经营场所卫生条件不达标5) 无资质销售高风险医疗器械c. 对监管部门的检查不合格项汇总1) 监管措施不力2) 监管不到位3) 对不合格医疗器械处罚不力4) 监管信息公开不及时5) 监管人员素质不高三、飞行检查不合格项原因分析1. 企业自身原因a. 缺乏质量管理意识b. 无资质生产、经营c. 投机取巧,追求利润d. 忽视法律法规2. 监管部门原因a. 缺乏有效监管手段b. 监管资源不足c. 监管责任不落实d. 监管信息不对称四、飞行检查不合格项整改措施建议1. 加强企业自身管理a. 完善质量管理体系b. 强化员工培训c. 提高生产设备和环境管理水平2. 强化监管措施a. 完善监管法规b. 加大监管力度c. 提高监管部门素质和能力五、结语1. 医疗器械飞行检查不合格项的汇总对于整个医疗器械行业来说,是一种警示和教育,也为相关企业提供了改进的契机。
希望医疗器械生产企业、经营企业及监管部门引以为戒,积极改进,共同维护医疗器械的质量安全,保障广大患者的健康。