人教版初中化学《第六单元碳和碳的氧化物》知识点总结
- 格式:doc
- 大小:42.50 KB
- 文档页数:1
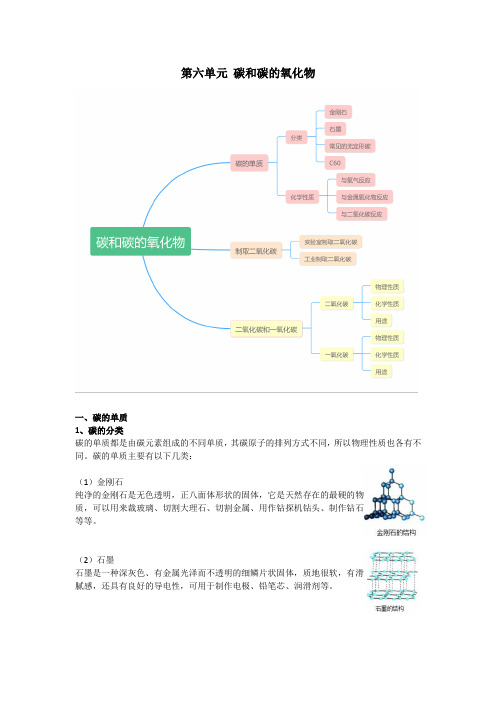
第六单元碳和碳的氧化物一、碳的单质1、碳的分类碳的单质都是由碳元素组成的不同单质,其碳原子的排列方式不同,所以物理性质也各有不同。
碳的单质主要有以下几类:(1)金刚石纯净的金刚石是无色透明,正八面体形状的固体,它是天然存在的最硬的物质,可以用来裁玻璃、切割大理石、切割金属、用作钻探机钻头、制作钻石等等。
(2)石墨石墨是一种深灰色、有金属光泽而不透明的细鳞片状固体,质地很软,有滑腻感,还具有良好的导电性,可用于制作电极、铅笔芯、润滑剂等。
(3)常见的无定形碳无定形碳是由石墨的微小晶体和少量杂质构成,没有固定形状,常见的有木炭、活性炭、焦炭、炭黑。
木炭:灰黑色的多孔性固体,可用于制作燃料、制作火药、冶炼金属等。
活性炭:灰黑色的多孔颗粒状固体,可用于净化气体和液体、制作防毒面具等。
焦炭:浅灰色的多孔性固体,可用于冶炼金属。
炭黑:极细的黑色粉末,可用于制作油墨、燃料、橡胶制品的填料等。
C(4)60C分子是由60个碳原子构成的,分子结构形似足球,这种足球结构的每个60C分子很稳定,有可能广泛应用于超导、催化、材料、医学及生物等领域。
602、单质碳的化学性质(1)在常温下,碳的化学性质不活泼。
(2)碳具有可燃性充分燃烧时:不充分燃烧时:(3)碳具有还原性木炭与氧化铜反应实验【实验原理】【实验装置】【实验现象】黑色固体逐渐变红,澄清石灰水变浑浊。
【注意事项】①酒精灯上网罩的作用:使火焰集中并提高温度。
②应该使用过量木炭:防止已经还原的铜被氧气重新氧化。
③实验结束后应先撤出导管,再熄灭酒精灯,防止石灰水倒流到试管中使试管炸裂。
在高温条件下,焦炭与氧化铁发生反应(4)在高温条件下,碳可以把二氧化碳转变成一氧化碳二、制取二氧化碳1、实验室制取二氧化碳【实验药品】大理石或石灰石、稀盐酸。
不能用稀硫酸代替稀盐酸:稀硫酸与大理石反应生成微溶于水的硫酸钙,阻碍反应继续进行。
不能用浓盐酸代替稀盐酸:浓盐酸易挥发,会造成生成的二氧化碳气体不纯。


第六单元 碳和碳的氧化物重点知识1、同一种元素可以组成不同的物质。
如:金刚石、石墨、C 60都是由碳元素组成的不同种单质;氧气(O 2)和臭氧(O 3)都是由氧元素组成的。
由同一种元素组成的物质不一定是纯净物。
2、碳的单质:⑴金刚石:是自然界中最硬的物质,可用于制钻石,刻划玻璃, 钻探机的钻头等;⑵.石墨:是最软的矿物之一,有优良的导电性,润滑性,可用于制铅笔芯,电极等。
⑶.活性炭:具有疏松多孔结构,具有吸附性,防毒面具里滤毒罐就是利用活性炭吸附毒气的,制糖工业中也利用活性炭来脱色以制白糖。
3、金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列方式不同。
4、碳单质的化学性质:单质碳的物理性质各异,而化学性质却完全相同。
⑴.常温下碳的化学性质不活泼,我国古代的书法和字画能够保存长时间的原因。
⑵.碳具有可燃性: 完全燃烧 C+O 2 点燃 CO 2不完全燃烧 (氧气不足)2C+O 点燃2CO⑶.碳具有还原性 C + 2CuO 高温 2Cu + CO 2 ↑ (置换反应)应用:冶金工业, 现象:黑色粉末逐渐变成光亮红色, 澄清石灰水变浑浊。
5、二氧化碳的制法:⑴实验室制取气体的思路:(原理、装置、检验)①.发生装置:由反应物状态和反应条件决定。
反应物是固体,需加热,制取气体时则用高锰酸钾制氧气的发生装置;反应物是固体和液体,不需要加热,制取气体是则用制二氧化碳的发生装置。
②.收集方法:气体的密度以及溶解性决定。
难溶于水用排水法收集 ; CO 只能用排水法密度比空气小用向下排空气法;密度比空气大用向上排空气法。
CO 2只能用向上排空气法⑵.CO 2的实验室制法①.原理:用石灰石和稀盐酸反应:CaCO 3 + 2HCl =CaCl 2 + H 2O + CO 2↑②发生装置:固+夜 不需加热③气体收集方法:向上排空气法④检验方法:将制得的气体通人澄清的石灰水,若变浑浊,则是二氧化碳气体; ⑤验满方法:用燃着的木条,放在集气瓶口,木条熄灭证明已集满二氧化碳。


2024九年级化学上册“第六单元碳和碳的氧化物”必背知识点一、碳的几种单质1. 金刚石物理性质:无色透明、正八面体形状,自然界中最硬的物质。
用途:用于制钻石、刻划玻璃、钻探机的钻头等。
2. 石墨物理性质:深灰色,有金属光泽,细鳞片状固体,最软的矿物之一,有优良的导电性和润滑性。
用途:制铅笔芯、干电池的电极、电车的电刷、做固体润滑剂等。
3. 无定形碳主要成分:焦炭、木炭、活性炭、炭黑等。
性质:具有强烈的吸附性 (因其疏松多孔的结构),主要用于食品、工业产品中除去色素、异味等,以及防毒面具中除去毒气等。
4. C60构成:由60个碳原子构成的分子,形似足球,结构稳定。
二、单质碳的化学性质1. 常温下的稳定性:古代用墨书画的字画能长久保存,证明了碳在常温下的稳定性。
2. 可燃性完全燃烧(氧气充足):C + O2 →CO2不完全燃烧(氧气不充足):2C + O2 →2CO3. 还原性C + 2CuO →2Cu + CO2↑(置换反应),应用于冶金工业,现象为黑色粉末逐渐变成光亮红色,石灰水变浑浊。
2Fe2O3 + 3C →4Fe + 3CO2↑,现象为红棕色粉末逐渐变成黑色,石灰水变浑浊。
三、二氧化碳的制法1. 实验室制法原理:CaCO3 + 2HCl →CaCl2 + H2O + CO2↑装置:与制氢气相同的发生装置 (固体与液体反应,不需要加热)。
收集方法:向上排空气法(密度比空气大)。
验证:将制得的气体通入澄清的石灰水,若石灰水变浑浊,则是二氧化碳。
验满:用点燃的木条放在集气瓶口,木条熄灭则证明已集满。
2. 工业制法煅烧石灰石:CaCO3 →CaO + CO2↑四、二氧化碳的性质1. 物理性质无色、无味的气体,密度比空气大,能溶于水,高压低温下可得固体——干冰。
2. 化学性质不能燃烧,也不支持燃烧,不能供给呼吸。
与水反应生成碳酸:CO2 + H2O →H2CO3(碳酸不稳定,易分解)。
能使澄清的石灰水变浑浊:CO2 + Ca(OH)2 →CaCO3↓+ H2O,用于检验二氧化碳。

人教版2023初中化学九年级化学上册第六单元碳和碳的氧化物知识点汇总单选题1、填涂答题卡需要用2B铅笔,铅笔芯中含有石墨。
下列属于石墨化学性质的是A.金属光泽B.质软C.导电性D.可燃性答案:D分析:通过化学变化才能体现出来的性质属于化学性质。
A、金属光泽不需要通过化学变化就能体现,属于物理性质,不符合题意;B、质软不需要通过化学变化就能体现,属于物理性质,不符合题意;C、导电性不需要通过化学变化就能体现,属于物理性质,不符合题意;D、可燃性需要通过化学变化就能体现,属于物理性质,符合题意。
故选D。
2、下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是()A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是COB.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气C.该实验可以观察到B处固体从黑色逐渐变成红色D.该模拟实验缺少尾气处理装置,会污染空气答案:CA、得氧的过程是氧化反应,失氧的过程是还原反应,B处玻璃管内发生的化学反应是氧化铁和一氧化碳反应生成铁和二氧化碳,是氧化还原反应,还原剂是CO,选项正确;B、CO与空气的混合气体,点燃或加热时可能发生爆炸。
在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气,防止加热事发生爆炸,选项正确;C、氧化铁是红色固体,铁粉是黑色固体,该实验可以观察到B处固体从红色逐渐变成黑色,选项错误;D、一氧化碳是大气污染物,该模拟实验缺少尾气处理装置,会污染空气,选项正确。
故选C。
3、下列有关CO2实验的图示正确的是()A.制取CO2B.收集CO2C.验证CO2已集满D.验证CO2能与水反应答案:DA、制取二氧化碳时,长颈漏斗要伸入液面以下防止生成的气体从长颈漏斗下端逸出,故A不正确;B、二氧化碳能溶于水,不能用排水法收集,如果用的话也要短进长出,故B不正确;C、验满时要把燃着的木条放在集气瓶中,而不是伸入集气瓶内,故C不正确;D、通过观察紫色石蕊试液变红色就可以验证二氧化碳能和水反应,故D正确。
人教版初中化学《第六单元碳和碳的氧化物》知识点总结人教版初中化学《第六单元碳和碳的氧化物》知识点总结人教版初中化学《第六单元碳和碳的氧化物》知识点总结碳单质及其化合物的反应方程式总结1、一氧化碳与氧气2CO+O2=CO2(点燃)2、一氧化碳与氧化铁3CO+Fe2O3=2Fe+3CO2↑3、二氧化碳与水CO2+H2O=H2CO34、二氧化碳与过氧化钠2Na2O2+2CO2=2Na2CO3+O2↑5、二氧化碳与少量的氢氧化钠CO2+NaOH=NaHCO36、二氧化碳与足量的石灰水Ca(OH)2+CO2=CaCO3↓+H2O7、二氧化碳与少量的石灰水Ca(OH)2+2CO2=Ca(HCO3)28、二氧化碳与饱和的碳酸钠溶液Na2CO3+H2O+CO2=2NaHCO39、二氧化碳与碳酸钙和水CO2+CaCO3+H2O=Ca(HCO3)210、二氧化碳与碳CO2+C=2CO(高温)扩展阅读:人教版初中化学知识点总结(练习)第1单元走进化学世界1、化学是研究物质的_______________________以及___________的基础科学。
2、我国劳动人民商代会制造_______,___________时会炼铁、炼钢。
3、绿色化学-----___________________________(化合反应符合绿色化学反应)①四特点P6(原料、条件、零排放、产品)②核心:________________________4、蜡烛燃烧实验(描述现象时不可出现产物名称)(1)火焰:焰心、内焰(最明亮)、外焰(温度最高)(2)比较各火焰层温度:用一火柴梗平放入火焰中。
现象:两端先碳化;结论:外焰温度最高(3)检验产物H2O:用干冷烧杯罩火焰上方,烧杯内有水雾CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊(4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。
说明石蜡蒸气燃烧。
5、吸入空气与呼出气体的比较结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多(吸入空气与呼出气体成分是相同的)6、学习化学的重要途径科学探究一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象;7、化学实验(化学是一门以实验为基础的科学)一、常用仪器及使用方法(一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶可以直接加热的仪器是--试管、蒸发皿、燃烧匙只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网受热均匀)可用于固体加热的仪器是--试管、蒸发皿可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶不可加热的仪器量筒、漏斗、集气瓶(二)测容器--量筒量取液体体积时,量筒必须放平稳。
课题一金刚石、石墨、C60一、碳的单质金刚石、石墨、C60等均是由碳元素组成的单质。
碳的单质还有碳纳米管、单层石墨片等。
★注:①同种元素可以组成不同的单质。
②不同的碳单质,碳原子的排列方式不同,所以它们的物理性质不同。
1.金刚石(化学式C )金刚石由碳原子构成⑴结构:正八面体形状的固体。
⑵物理性质:无色透明、不导电、导热性差、硬度大,是天然存在的最硬的物质。
⑶用途:裁玻璃、切割大理石、加工坚硬的金属、做钻头、装饰品。
2.石墨(化学式C )石墨由碳原子构成⑴结构:细鳞片状固体,碳原子呈平面层状排列。
⑵物理性质:深灰色、有金属光泽、不透明、质软、有滑腻感、熔点高、具有优良的导电性。
⑶用途:制铅笔芯、石墨电极、电刷、润滑剂、干电池、制造熔融金属的坩埚等。
3.C60(又称足球烯) C60由C60分子构成⑴结构:每个C60分子是由60个碳原子构成的,它形似足球,这种结构的碳分子很稳定。
⑵物理性质:几乎不导电、质软、导热性差。
⑶用途:有可能广泛用于超导、催化、材料、医学、及生物等领域。
4.物质结构、性质用途之间的关系5.木炭、焦炭、活性炭、炭黑等统称为无定型碳。
(主要成分碳单质,结构与石墨类似。
)①木炭:常用作固体燃料;结构疏松多孔,具有吸附能力,吸附一些食品和工业产品里的色素,也可以用来吸附有异味的物质。
②活性炭:结构疏松多孔,具有较强的吸附性。
吸附水中的色素气味,常用于防毒面具中吸附毒气,制糖工业中也利用活性炭脱色以制白糖。
③炭黑:常用来制造墨汁;染料;颜料;充填橡胶增强抗摩擦力、抗撕力、抗拉力。
④焦炭:工业上用作还原剂,冶炼金属的重要原料。
点燃点燃高温6.碳与炭的区别“碳”:碳元素,属于化学用语。
在书写元素名称和碳的单质及碳的化合物等用到。
“炭”:不是化学用语,无定形碳是人工制造的碳单质,都含有少量杂质为表示区别,常写:木炭,活性炭,焦炭,炭黑等。
二、单质碳的化学性质1.稳定性:在常温下,碳的化学性质不活泼。
碳和碳的氧化物知识总结1、碳在常温下化学性质不活泼,受日光照射或与空气、水分接触,都不容易起变化。
碳的单质中最硬的是金刚石,可做润滑剂和电极的是石墨,可用来吸附一些食品和工业产品里的色素是活性炭、木炭,做防毒面具的是活性炭,最软,可做成铅笔芯的是石墨,用于制墨、油墨、填充橡胶的是炭黑。
它们的物理性质有很大差异是由于碳原子的排列方式不同。
C60分子是一种由60个碳原子构成的分子。
2、检验CO2的试剂是澄清的石灰水,现象是澄清的石灰水变浑浊。
3、CO2用于灭火是由于CO2不能燃烧,不能支持燃烧,密度比空气大,CO2固体称作干冰,可用于致冷剂冷藏食品和人工降雨。
4、要除去CO中的CO2,可将气体通过澄清的石灰水或炽热的炭,要除去CO2中的CO,可将气体通过灼热的氧化铜。
有关化学方程式依次为CO2+Ca(OH)2=CaCO3↓+H2O、C+CO2 2COCO+CuO Cu+CO2。
5、实验室制取CO2的药品是碳酸钙、稀盐酸,不用碳酸钠、碳酸钾是因为反应太快不易收集,不用浓盐酸、硝酸是因为浓盐酸、硝酸易挥发,使制得的气体不纯,不用稀硫酸是因为硫酸与碳酸钙反应生成微溶性的硫酸钙,覆盖在碳酸钙表面,阻止了反应的继续进行。
6、分别写出碳跟氧化铜、锻烧石灰石制生石灰的化学方程式:C+2CuO 2Cu+CO2↑、CaCO3 CaO+CO2↑。
7、实验室制取CO2的发生装置与用H2O2和二氧化锰制氧气装置相同,发生器中长颈漏斗应伸入液体中,否则产生的气体会从长颈漏斗中逸出,导气管伸入液体中的后果是气体不能排出,伸入过长的后果是气体不易排出,装药品前应先检查装置的气密性。
化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑宜用向上排空气法收集验满的方法是将燃着的木条平放在瓶口,木条熄灭,就收集满了CO2。
8、还原剂是得氧的物质,氧化剂是失氧的物质。
还原反应是失氧的反应,氧化反应是得氧的反应。
在2Mg+CO2点燃2MgO+C中,其中镁被氧化,CO2是氧化剂,镁具有还原性。
1.“碳”和“炭”的区别:“碳”指碳元素,不是指某种物质;而“炭”指由碳元素组成的单质。
2. 金刚石是无色透明、正八面体的固体,是天然存在的最硬的物质,不能导电、也不导热、润滑性不好。
熔点高。
用途:裁玻璃、切割大理石、做钻探机的钻头等3. 石墨是深灰色、有金属光泽、不透明的细鳞片状固体,硬度软,能导电、导热、润滑性好,熔点高。
用途:做电极、铅笔芯、做电刷等无定形碳:木炭、活性炭、焦炭、炭黑。
其中(木炭)和(活性炭)具有疏松多孔的结构,所以都具有吸附性,但活性炭吸附性最强4. C60分子是一种由60个碳原子构成的分子,C60主要应用于材料科学,超导体领域5.金刚石、石墨、C60 物理性质不同的原因:碳原子的排列方式不同。
6. 金刚石、石墨、C60的物理性质不同,而他们的化学性质却相似,常温下化学性质稳定,具有可燃性、还原性7. 还原反应:含氧化合物里的氧被夺去的反应,叫做还原反应。
8. 三大还原剂:H2(无色气体)、C(黑色固体)、CO(无色气体)——共同性质:可燃性、还原性。
9. 二氧化碳:CO2向上排空气法收集化学性质:不能燃烧,也不支持燃烧。
无毒,不能供给呼吸。
能与水发生反应生成碳酸(H2CO3),碳酸不稳定易分解; 能使澄清石灰水(Ca(OH)2)变浑浊二氧化碳的用途:灭火(通过化学反应制得CO2来灭火)、干冰升华降雨、光合作用的气体肥料二氧化碳对环境的影响:造成温室效应造成温室效应的气体有:二氧化碳、臭氧(O3)、甲烷(CH4)、氟利昂等。
10. 一氧化碳:CO物理性质:无色、无味的气体,难溶于水,密度比空气略小。
只能用排水法收集化学性质:可燃性:发出蓝色火焰,放热,生成能使澄清石灰水变浑浊的气体,可用来做燃料毒性一氧化碳极易与血液中的血红蛋白结合,使氧气不能再与血红蛋白结合,造成生物体缺氧还原性:可在冶金工业中做还原剂11. 碳的可燃性:C+O2CO2(C和O2质量比小于3:8)2C+O22CO(C和O2质量比大于3:4)木炭还原氧化铜:C+2CuO2Cu+CO2↑焦炭还原氧化铁:2Fe2O3+3C4Fe+3CO2↑木炭还原二氧化碳:2C+ CO22CO二氧化碳与水反应:CO2+H2O=H2CO3碳酸不稳定易分解:H2CO3=H2O+CO2↑澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O实验室制取二氧化碳:CaCO3+2HCl = CaCl2+H20+CO2↑工业制取二氧化碳:CaCO3CaO + CO2↑一氧化碳燃烧:2CO+O22CO2一氧化碳还原氧化铜:CO+CuO Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO2①木炭还原氧化铜的实验实验原理:C+2CuO2Cu+CO2↑实验现象:黑色固体逐渐变红,澄清石灰水变浑浊实验结论:木炭能使氧化铜还原成铜,同时生成二氧化碳。