96工艺提高头孢拉定精氨酸的混合均匀度
- 格式:pdf
- 大小:209.57 KB
- 文档页数:4


100生物技术世界 BIOTECHWORLD20世纪70年代,头孢拉定进入到国内药品市场,是第一代头孢菌素类抗生素,可以制成注射剂以及口服药剂。
临床通常会遇到药品的质量稳定性问题,头孢拉定的质量稳定性与其结晶性存在很大的联系,结晶的形成过程对成品的质量具有非常大的影响,同时还会影响成品的药效作用。
产品的晶型越好、包含的杂志越少、色级性越高,则药效作用越好,因此,头孢拉定的结晶工艺是生产成品的关键环节。
但是,头孢拉定在结晶的过程中会受到温度、结晶添加剂等因素的影响,为了提高头孢拉定的产品质量,应该从温度以及结晶添加剂等方面进行优化,以此满足社会的实际需求。
1 头孢拉定的结晶工艺过程1.1 实验仪器与材料1.1.1 实验材料主要包括亚硫酸铵(化学纯);亚硫酸氢氨(化学纯);亚硫酸钠(化学纯);亚硫酸氢钾(化学纯);亚硫酸氢钠(化学纯);丙酮(化学纯);乙醚(化学纯);正丁醇(化学纯);甲醇(化学纯);正丙醇(化学纯);异丙醇(化学纯);1,2-丙二醇(化学纯);乙腈(化学纯);无水乙醇(分析纯);二甲胺(化学纯);乙二胺(化学纯);浓盐酸(化学纯);精氨酸(分析纯);头孢环己烯(进口样品)。
1.1.2实验仪器主要包括多功能电子蠕动泵;标准筛(20-300目);血细胞计数板;12000A 型生物显微镜;电子分析天平;智能超声控制器;Zk-82真空恒温干燥箱;磁力加热搅拌器;CS501超级恒温水浴。
1.2 实验方法1.2.1 溶解弄盐酸精确称量头孢环己烯样品5.00g,加入20.0mL水,在一定温度下进行恒温搅拌,缓慢的滴加浓盐酸,将样品溶液的PH值控制在1.7-1.8之间,此时样品溶液为透明澄清状。
1.2.2 制备晶种在制备的样品溶液中缓慢的滴加乙二胺:二甲胺=2:1混合液,将样品溶液的PH值调整至2.8-2.9,过滤后定容到50.0mL,取定容之后溶液2.5mL,用70W/cm 2、30KHz的超声波刺激起晶成核20s左右,溶液开始由澄清变为白浊,出现大量的细针状晶核。


头孢拉定胶囊工艺规程目录一、产品说明(名称、剂型、规格)二、工艺处方和依据三、生产工艺流程四、设备一览表及主要设备生产能力五、工艺卫生和环境卫生(包括对净化级别要求)六、操作过程和工艺条件及所执行的SOP名称。
七、原辅料、中间产品和成品的质量标准及贮存注意事项八、中间产品的检验方法及控制九、需要进行验证的关键工序及工艺质量控制点十、包装要求、标签、说明书(附样本与产品保管方法)十一、原辅材料的消耗定额,技术经济指标、物料平衡及各项指标的计算方法十二、技术安全及劳动保护十三、劳动组织与岗位定员十四、变更记录表一、产品说明1. 药品名称1.1.通用名:头孢拉定胶囊1.2.英文名: Cefradine Capsules1.3.汉语拼音:Toubao lading Jiaonang1.4.本品主要成分及其化学名称为:(6R,7R)-7[(R)-2-氨基-2-(1,4-环己烯基)乙酰氨基]-3-甲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸。
1.5.其结构式为:分子式:C16H19N3O4S分子量:394.402.性状:本品为胶囊剂;内装白色或类白色粉末。
3.规格:0.25g4.有效期;两年5.包装规格:铝塑包装12粒/板×2板/盒×300盒/箱,12粒/板×4板/盒×200盒/箱,6.批准文号:国药准字37022900二、工艺处方和依据:2.1.工艺处方:原辅料名称单位每千粒用量每万粒用量头孢拉定: kg 0.25 2.5 淀粉: kg 0.05 0.5浆用淀粉: g 5.0 50.0硬脂酸镁: g 0.75 7.5纯化水: kg 0.095 0.95 2.2依据:中华人民共和国药典2000版二部三、工艺流程工艺流程图:三十万级区一般区四、设备一览表及主要设备生产能力五、工艺卫生和环境卫生1.本品种生产配料至铝塑包装在30万级洁净区,外包装在一般生产区,具体情况见工艺流程图,严格执行口服固体制剂车间生产区清洁规程。

文章编号:1001-8689(2000)04-0263-03加晶种提高头孢拉定反应结晶产品质量的研究赵茜 杜磊 高大维* (华南农业大学食品科学系, 广州510642;*华南理工大学食品与生物工程学院, 广州510642) 摘要: 反应结晶是抗生素生产中常用的一种结晶方法,但目前国内反应结晶技术水平落后,普遍存在产品粒度分布过宽问题。
加晶种的控制结晶是一种改善结晶产品粒度分布的有效方法,已广泛用于蒸发结晶、冷却结晶、溶析结晶等结晶体系,而未见报道在反应结晶过程中应用。
本文对在头孢拉定反应结晶过程中投加晶种改善产品粒度分布进行了研究,比较了在相同的育晶条件下,超声波法制备的晶种、筛分后的成品作为晶种和自然起晶方式对最终产品粒度分布的影响,结果表明,加入超声波法制备的晶种得到的最终产品中间粒度最大,变异系数(CV 值)最小。
关键词: 头孢拉定; 反应结晶; 晶种; 粒度分布中图分类号: T Q 460.6 文献标识码:A收稿日期:1999-08-20本文参加1999年全国抗生素分离、纯化、合成及质量分析学术研讨交流会作者简介:赵茜:女,生于1971年,博士。
研究方向:食品与生化物质分离纯化。
头孢拉定是第一代半合成头孢菌素,主要对耐药性金葡球菌和肺炎克雷伯氏菌有较强的杀菌作用,对溶血性链球菌、肺炎球菌、大肠埃希氏菌、部分变形杆菌等均有抗菌作用。
临床上适用于耐药金葡球菌感染,如肾盂肾炎、支气管炎、肺炎等[1]。
生产上,头孢拉定的结晶采用反应结晶法[2],反应结晶也称沉淀结晶,即加入反应剂或调节pH 产生新物质,当其浓度超过它的溶解度时就有结晶析出。
反应结晶是制药工业中一种常用的结晶方法,而目前国内反应结晶技术水平较落后,生产操作大多是凭经验进行,反应结晶产品普遍存在结晶收率偏低、粒度分布宽、晶体流动性差以及比容过高,给分装带来困难等问题。
早年Griffith [3]提出了“加晶种的控制结晶”,即在分批操作的结晶过程中,为了控制晶体的生长,获得粒度较均匀的晶体产品,必须尽一切可能防止意外的晶核生成,小心地将溶液的过饱和度控制在介稳区内,不使出现初级成核现象,并向溶液中加入适当数量及适当粒度的晶种,让被结晶的物质只在晶体表面上生长,用温和的搅拌,使晶种较均匀地悬浮在整个溶液,并尽量避免二次成核现象。


目的:建立头孢拉定胶囊的生产工艺规程。
范围:头孢拉定胶囊的生产。
职责:生产管理部经理、质量管理部经理、车间主任、工艺员、班长、操作工、QA。
规程:1.品名、剂型与处方依据1.1通用名称:头孢拉定胶囊汉语拼音:Toubao lading Jiaonang英文名: Cefradine Capsules1.2剂型:胶囊剂1.3处方与处方依据项的说明1.3.1处方(共制成73.6万粒)头孢拉定 200kg羟丙甲纤维素 0.78kg75%乙醇 59.22kg*硬脂酸镁 2kg1.3.2 处方依据项说明:药品的生产批文:批准时间:质量标准编号:2.生产工艺流程:←↓→↓→↓←↓ ←→← →←→一般生产区 三十万级生产区3.生产工艺操作与工艺技术参数中关键的注意事项: 3.1操作过程与生产过程质量控制 3.1.1配料工序:● 按SOP-MN/G-001-00原辅料处理岗位标准操作规程要求对主药进行粉碎过60筛处理,硬脂酸镁过80目筛,放备料间备用。
● 按SOP-MN/G-003-00粘合剂配制岗位标准操作规程制备粘合剂1.3%羟丙甲纤维素液:取处方量羟丙甲纤维素,加入75%的乙醇到规定量,浸泡约12-16小时,过胶体磨,即得。
● 将处理好的主药、淀粉准确称量,按SOP-MN/G-004-00湿法制粒岗位标准操作规程,以每料35kg 分别置于湿法混合制粒机的搅拌锅中,按SOP- EQ/G-005-00 HLSG110型湿法混合颗粒机标准操作规程开动搅拌桨和切碎刀运作两分钟后加入适量粘合剂,将软材切割成均匀的湿颗粒(约七分钟)。
● 按SOP-MN/G-005-00干燥岗位标准操作规程,湿颗粒置于热风循环箱干燥,按SOP-EQ/G-006-00 FL-IIIA 热风循环干燥柜标准操作规程,开启蒸汽阀、风机,箱内温度控制在60-70℃之间,约为3.5小时。
干燥过程中每1.5小时翻粉一次,收粒时水份应控制在3-5%范围内。

1.产品名称、剂型通用名称:注射用头孢拉定英文名:Cefradine for Injection汉语拼音:Zhusheyong Toubaolading剂型:注射剂。
2.产品概述本品为头孢拉定的无菌粉末。
按平均装量计算,含头孢拉定 (C16H19N3O4S)应为标示量的95.0%~115.0%。
2.3.产品规格及有效期按(C16H19N3O4S)计算 0.5g有效期24个月。
2.4.适应症适用于敏感菌包致急性咽炎、扁桃休炎、中耳炎、支气管炎和肺炎等的呼吸道感染、泌尿道感染、泌尿生殖道感染及皮肤软组织感染。
2.5.用法与用量静脉滴注、静脉注射或肌内注射,成人,一次0.5-1.0g,每6小时一次,一日最高剂每6小时一次8.0g。
小儿(1周岁以上)按体重12.5~25mg/kg,每6小时一次3.工艺概述注射用头孢拉定的生产是采用无菌分装的工艺,经过洗瓶、分装、轧盖、目检、贴标、包装等工序得到最终的产品。
\5.生产工艺流程图及环境区域划分100000级10000级100级图1 生产工艺流程图5操作过程及工艺条件5.1. 西林瓶的处理5.1.1.操作过程5.1.1.1. 西林瓶的清洗按生产指令领取一定数量的西林瓶,通过西面货梯到粉针车间门口,经初步除尘、清洁后,用生产区专用推车拉至脱外包室,去除西林瓶外包装,由传递窗传入贮存间;西林瓶在贮存间通过理瓶挑出异形瓶、破损瓶、污染瓶后,送入洗瓶间,采用W600/8超声波洗瓶机洗涤西林瓶。
西林瓶经过滤后纯化水初洗,过滤后注射用水精洗;再用过滤压缩空气吹干,清洗后的西林瓶检查洁净度应不挂水珠、无可见异物,合格后,进行灭菌。
5.1.1.2西林瓶的干热灭菌、除热原清洗合格后的西林瓶经联动装置自动进入T600H1/C1隧道烘箱,进行干热灭菌,温度设定为320℃,时间为15分钟。
5.1.2. 工艺条件5.1.2.1西林瓶初洗用纯化水应符合中国药典2005版二部规定,终端须经过孔径为0.22微米的过滤器过滤;精洗用注射用水应符合中国药典2005版二部规定,终端须经过孔径为0.22微米的过滤器过滤。

后混合均匀,以30%的乙醇为润湿剂制成软材,过16目筛制成颗粒,在烘箱内鼓风干燥(<50℃,>5h )后加处方量润滑剂,16目铁丝筛整粒。
包芯片制备:称取处方量的外层颗粒,将其1/2量填于充模孔内,然后平放一内芯片于冲模中央,再把剩余颗粒全部放入冲模孔内,用12mm 冲压成包芯片。
21113 工艺要求 内芯片压力控制在115-210kg/cm 2,且表面光滑,无粘冲现象;包芯片压力控制在410-610kg/cm 2,且表面光滑,无毛边和斑点。
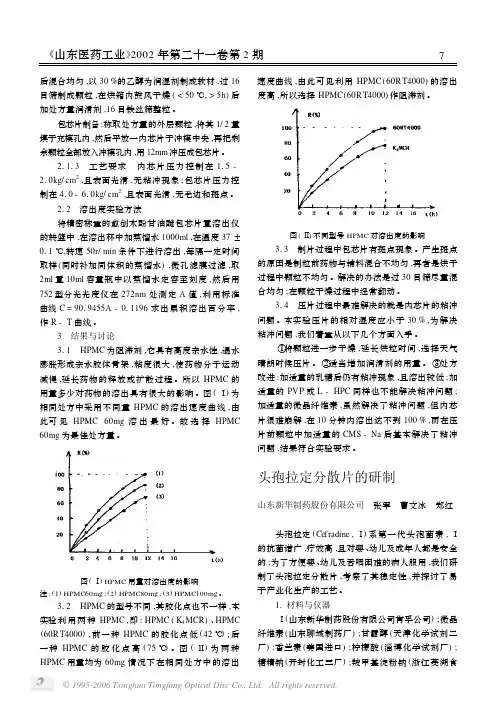
212 溶出度实验方法将精密称重的愈创木酚甘油醚包芯片置溶出仪的转篮中,在溶出杯中加蒸馏水1000ml ,在温度37±011℃,转速50r/min 条件下进行溶出,每隔一定时间取样(同时补加同体积的蒸馏水),微孔滤膜过滤,取2ml 置10ml 容量瓶中以蒸馏水定容至刻度,然后用752型分光光度仪在272nm 处测定A 值,利用标准曲线C =9019455A -011196求出累积溶出百分率,作R -T 曲线。
3 结果与讨论311 HPMC 为阻滞剂,它具有高度亲水性,遇水膨胀形成亲水胶体骨架,粘度很大,使药物分子运动减慢,延长药物的释放或扩散过程。
所以HPMC 的用量多少对药物的溶出具有很大的影响。
图(Ⅰ)为相同处方中采用不同量HPMC 的溶出速度曲线,由此可见HPMC 60mg 溶出最好。
故选择HPMC60mg 为最佳处方量。
图(Ⅰ)HPMC 用量对溶出度的影响注:(1)HPMC60mg ;(2)HPMC80mg ;(3)HPMC100mg 。
312 HPMC 的型号不同,其胶化点也不一样,本实验利用两种HPMC ,即:HPMC (K 4MCR )、HPMC (60RT4000),前一种HPMC 的胶化点低(42℃);后一种HPMC 的胶化点高(75℃)。
图(Ⅱ)为两种HPMC 用量均为60mg 情况下在相同处方中的溶出速度曲线,由此可见利用HPMC (60RT4000)的溶出度高,所以选择HPMC (60RT4000)作阻滞剂。

头孢类制剂生产工艺规程云华药业有限公司目录一、产品名称与剂型二、产品概述三、处方四、工艺流程图五、操作过程及工艺条件六、质量标准七、质量监控八、设备九、工艺卫生十、批量及批号的管理规程十一、物料消耗定额和物料平衡十二、技术安全及劳动保护十三、劳动组织岗位定员和生产周期十四、工艺沿革一、药品名称与剂型通用名:头孢拉定胶囊英文名:Cefradine Capsules汉语拼音:Toubaolading Jiaonang剂型:胶囊剂二、产品概述【成份】本品主要成分为头孢拉定,其化学名为(6R,7R)-7[(R)-2-氨基-2-(1,4-环己烯基)乙酰氨基]-3-甲基-8-氧代-5-硫杂-1-氮杂双环[4、2、0]辛-2-烯-2-羧酸。
其结构式为:分子式:C16H19N3O4S分子量:349.40【性状】本品为胶囊剂,内容物为白色至淡黄色粉末或颗粒。
【适应症】适用于敏感菌所致的急性咽炎、扁桃体炎、中耳炎、支气管炎和肺炎等呼吸道感染、泌尿生殖道感染及皮肤软组织感染。
本品为口服制剂,不宜用于严重感染。
【规格】0.25g(按C16H19N3O4S 计)【用法用量】口服。
成人一次1~2粒,每6小时1次,一日最高剂量为16粒。
小儿常用量:按体重一日25~50mg/kg。
【不良反应】本品不良反应较轻,发生率也较低,约6%。
恶心、呕吐、腹泻、上腹部不适等胃肠道反应较为常见。
药疹发生率约1%~3%,伪膜性肠炎、嗜酸粒细胞增多、直接Coombs试验阳性反应、周围血象白细胞及中性粒细胞减少等见于个别患者。
少数患者可出现暂时性血尿素氮升高,血清氨基转移酶、血清碱性磷酸酶一过性升高。
【禁忌】对头孢菌素过敏者及有青霉素过敏性休克或即刻反应史者禁用本品。
【注意事项】1.在应用本品前须详细询问患者对头孢菌素类、青霉素类及其他药物过敏史,有青霉素类药物过敏性休克史者不可应用本品,其他患者应用本品时必须注意头孢菌素类与青霉素类存在交叉过敏反应的机会约有5%~7%,需在严密观察下慎用。
欧洲药典中关于头孢拉定精氨酸的检测方法一、背景介绍头孢拉定精氨酸是一种抗生素原料药,广泛应用于临床治疗中。
在生产过程中,为了确保产品的质量和安全性,需要对头孢拉定精氨酸进行严格的检测。
欧洲药典作为国际上公认的药品质量标准之一,其对于药品原料和成品的检测方法及标准有着严格的规定,因此关于头孢拉定精氨酸的检测方法在欧洲药典中有着详细的规定。
二、检测方法欧洲药典中规定了头孢拉定精氨酸的检测方法,主要包括以下几个方面:1. 仪器及试剂在检测头孢拉定精氨酸的过程中,需要用到的仪器及试剂包括高效液相色谱仪(HPLC)、色谱柱、溶剂、标准品等。
2. 样品制备在进行头孢拉定精氨酸的检测前,需要对样品进行适当的制备处理,包括样品的溶解、稀释、过滤等步骤,以确保样品的纯度和稳定性。
3. 色谱条件欧洲药典中规定了头孢拉定精氨酸的检测色谱条件,包括色谱柱的类型、流动相的配比、流速、检测波长等参数,以确保检测的准确性和重复性。
4. 检测方法头孢拉定精氨酸的检测方法主要采用HPLC法,通过测定样品中头孢拉定精氨酸的含量来进行定量分析。
5. 数据处理在进行头孢拉定精氨酸的检测时,需要对实验数据进行准确的处理和分析,以确保结果的可靠性和准确性。
三、检测结果的评定在欧洲药典中,对于头孢拉定精氨酸的检测结果有着严格的评定标准,主要包括以下几个方面:1. 含量测定头孢拉定精氨酸的含量测定结果需要符合欧洲药典中规定的标准,以确保产品的质量和有效成分的含量符合要求。
2. 相关物质在头孢拉定精氨酸的检测过程中,还需要对相关物质进行分析,确保产品的纯度和杂质含量符合要求。
3. 检测重复性在头孢拉定精氨酸的检测中,需要对实验结果的重复性进行评定,确保结果的可靠性和准确性。
四、实际应用头孢拉定精氨酸作为一种常用的抗生素原料药,其质量和安全性对于临床治疗具有重要意义。
头孢拉定精氨酸的检测方法在欧洲药典中有着详细的规定,对于生产企业和监管部门具有重要的指导意义。
头孢拉定药品标准注射用头孢拉定Zhusheyong ToubaoladingCefradine for Injection本品为头孢拉定加适量助溶剂精氨酸制成的无菌粉末。
按无水、无精氨酸物计算,含头孢拉定(C , 6 H 1 9 N 30 4 S )不得少于9 0 . 0 % ;按平均装量计算,含头孢拉定(C1 S H 1 9 N 3 0 4 S )应为标示量的9 5 . 0% 115. 0 %【性状】本品为白色或类白色粉末。
【鉴别】在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】碱度取本品,加水制成每l m l 中含头孢拉定0. lg的溶液,依法测定(附录W H ) , p H 值应为8 . 0 9. 6溶液的澄清度与颜色取本品 5 瓶,按标示量分别加水制成每l m l 中含头孢拉定0 . lg的溶液,溶液应澄清无色;如显浑浊,与1号浊度标准液(附录K B)比较,均不得更浓;如显色,与黄色或黄绿色8号标准比色液(附录K A第一法)比较,均不得更深。
头孢氨苄取本品的内容物,混合均匀,精密称取适量,加流动相溶解并定量稀释制成每l m l 中含头孢拉定0 . 7mg的溶液,作为供试品溶液;另取头孢氨苄对照品约20mg,精密称定,置50ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取5 m l ,置50ml量瓶中,用水稀释至刻度,摇匀,作为对照品溶液。
照头抱拉定项下的方法测定,含头孢氨苄不得过头孢拉定和头孢氨苄总量的6 . 0 % 。
有关物质取本品的内容物,混合均匀,精密称取适量,加流动相溶解并定量稀释制成每l m l 中含头孢拉定l m g 的溶液,作为供试品溶液。
照头抱拉定项下的方法测定,检测波长为2 5 4 n m。
供试品溶液色谱图中如有杂质峰,除头孢氨苄夕卜,7-氨基去乙酰氧基头孢烷酸按外标法以峰面积计算,不得过1 . 0 % ; 其他单个杂质峰面积不得大于对照溶液主峰面积的5倍(2. 5%),其他各杂质峰面积的和不得大于对照溶液主峰面积的6 倍( 3 . 0 % ) 。
国外医药抗生素分册2019年1月第40卷第1期.65.头鞄拉定合成工艺的优化李文杰,曹桂僖(河南康达制药有限公司,周口466200)摘要:7-ADCA与四甲基脈反应形成肌盐,再与苯酹氨酸邓钠盐的混合酸酹缩合,经水解得到头抱拉定,收率〉94%。
此工艺优化了反应条件,找到了可行的检测方法来监控反应终点,省去了炭脱色步骤,釆用抽除二氯甲烷的方法稳定晶型,还可 以从母液中回收复盐并套用,易于工业化生产。
关键词:7-ADCA;混合酸肝法;合成;头抱拉定;复盐中图分类号:R914文献标识码:A文章编号:1001-8751(2019)01-0065-04Optimization of Cefradine Synthesis ProcessLi Wen-jie,Cao Gui-xi(Henan Kang Da Pharmaceutical Co.,Ltd.,Zhoukou466200)Abstract:The cefradine is synthesized by hydrolysis from the condensation products of guanidine salt,which is the combination of7-Aminodesacetoxycephalosporanic acid with an overall yield of more than94%.It is easy to realize industrial mass production by optimizing reaction conditions and finding a feasible detection method to monitor the ending point of the reactions.It is also feasible to take several other measures to realize industrial mass production,including eliminating carbon decoloring process,adopting the method of pumping methylene chloride to stablize crystal structure and recycling double salts to reuse.Keyword:7-ADCA;mixed anhydride method;synthesis;cefradine;double salt头砲拉定(Cefradine)如图1,化学名为(6R,7R)-7[(R)-2-氨基-2-(1,4-环己烯基)乙酰氨基]-3冲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-竣酸。
第31卷第3期2004年北京化工大学学报JOURNAL OF BEI J IN G UN IV ERSIT Y OF CHEMICAL TECHNOLO GYVol.31,No.32004头孢拉定微粉化的研究杨 雁 钟 杰 沈志刚 刘晓林 陈建峰3(北京化工大学教育部超重力工程研究中心,北京 100029)摘 要:采用反应结晶法进行了头孢拉定微粉化实验。
考察了头孢拉定的浓度、溶液与溶剂的比例、搅拌转速等因素对微粉化过程的影响。
通过实验得到适宜的微粉化条件是:溶液中头孢拉定的质量浓度为0120~0125g/mL ,溶液与溶剂比为1∶3,电机转速一般定为600~800r/min ,超声功率范围200~320W ,对微粉化后粉体进行了扫描电镜和XRD 分析。
结果表明制得的头孢拉定微粉粒度分布在2~5μm ,而且晶型没有改变。
溶解时间测试实验显示出头孢拉定微粉比工业产品优越。
关键词:头孢拉定;微粉化;精氨酸中图分类号:TQ46511收稿日期:2003210208基金项目:国家“863”计划(2001AA218061)第一作者:女,1974年生,硕士生3通讯联系人E 2mail :chenjf @ 根据Noyes 2Whitney 方程,药物的溶出速度与药物表面积成正比关系,一般药物颗粒微粉化能增大药物溶解速率和提高生物利用度[1]。
常用的药物微粉化技术有超临界技术[2]、高压均质法[3]和反应结晶法[4]等技术。
头孢拉定是被广泛应用的头孢菌素类药物。
注射用的头孢拉定常加入精氨酸或碳酸钠作为助溶剂,但这些助溶剂的使用会带来一些生理上的负面影响。
因而考虑通过微粉化的途径改善头孢拉定的溶解性能进而减少助溶剂的使用。
本实验采用反应结晶法制备头孢拉定微粉。
实验选择丙酮作为溶剂,用氨水调节等电点。
1 材料和方法111 实验试剂与仪器头孢拉定原料药,纯度99%,华北制药厂;精氨酸,华北制药厂;丙酮,分析纯,北京化工产;氨水,分析纯,北京世纪红星化工责任有限公司;盐酸,分析纯,北京化工产。