奥希替尼合成路线图解
- 格式:pdf
- 大小:1.27 MB
- 文档页数:2

奥希替尼结构式-回复什么是奥希替尼?奥希替尼(Osimertinib),商品名为Tagrisso,是一种被广泛用于治疗非小细胞肺癌的药物。
它是一种表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,主要用于EGFR突变阳性的晚期或转移性非小细胞肺癌(NSCLC)的治疗。
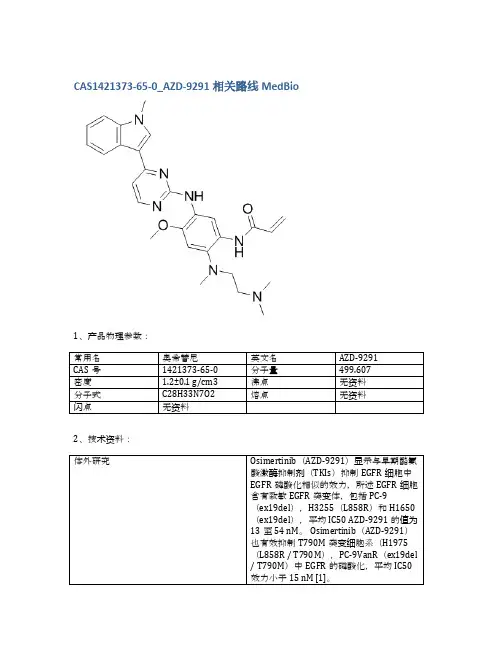
奥希替尼药物结构式如下:[奥希替尼药物结构式]奥希替尼药物结构式简单而直观。
它主要由三个核心部分构成:中央的三环芳香烃结构、左侧的蓝色四氟酰氨基苯基基团和右侧的芳香胺基团。
这些结构部分相互作用,并发挥药物的治疗作用。
为什么需要使用奥希替尼?EGFR是一种在细胞表面的受体蛋白,它在人体中的正常功能是调控细胞生长和分裂。
然而,在某些肿瘤中,EGFR可能突变,导致肿瘤细胞异常增长和扩散。
EGFR突变的肿瘤通常对奥希替尼非常敏感。
这是因为奥希替尼通过阻断EGFR的酪氨酸激酶活性,抑制肿瘤细胞的生长和分裂,从而达到治疗的效果。
奥希替尼的治疗效果如何?临床研究显示,奥希替尼对EGFR突变阳性非小细胞肺癌患者具有显著的治疗作用。
许多临床试验都证实了奥希替尼的疗效。
其中一项重要的研究是灵巧研究(AURA3),该研究证实了奥希替尼相对于标准化疗的优势。
灵巧研究纳入了281名晚期或转移性EGFR T790M突变阳性非小细胞肺癌患者,结果显示,奥希替尼治疗组的总生存时间明显延长,同时毒副作用的发生率也较低。
这些研究结果使得奥希替尼成为EGFR突变阳性非小细胞肺癌患者的重要治疗选择。
如何使用奥希替尼?奥希替尼是一种口服药物,每日一次,建议在饭后服用。
剂量根据患者的具体情况和医生的建议来确定。
通常,起始剂量为80毫克,持续使用直到疾病进展或无法耐受。
值得注意的是,奥希替尼可能与其他药物相互作用,因此在使用奥希替尼之前应告知医生正在使用的其他药物。
奥希替尼的副作用如何?奥希替尼的安全性和耐受性已得到广泛证实。
然而,与任何药物一样,奥希替尼也可能引起一些副作用。
最常见的副作用包括腹泻、皮疹、肺部炎症等。

奥希替尼奥希替尼,又名泰瑞沙,英文名为:Osimertinib Mesylate Tablets ,适用于既往经表皮生长因子受体(EGFR)①酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。
一、成分本品活性成份为甲磺酸奥希替尼[1]化学名称:N-{2-{[2-(二甲氨基)乙基](甲基)氨基}-4-甲氧基-5-{[4-(l-甲基-lH-吲哚-3-基)嘧啶-2-基]氨基}苯基)丙-2烯酰胺甲磺酸盐化学结构式:分子式: C28H33N7O2· CH4O3S分子量: 595.71二、适应症本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。
三、用法用量在使用本品治疗局部晚期或转移性NSCLC前,首先需要明确EGFR T790M突变的状态。
应采用经过充分验证的检测方法确定存在EGFR T790M突变方可使用本品治疗。
剂量本品的推荐剂量为每日80mg,直至疾病进展或出现无法耐受的毒性。
如果漏服本品1次,则应补服本品,除非下次服药时间在12小时以内。
本品应在每日相同的时间服用,进餐或空腹时服用均可。
剂量调整根据患者个体的安全性和耐受性,可暂停用药或减量。
如果需要减量,则剂量应减至40mg,每日1次。
注意:出现不良事件(AE)和毒性后的减量原则。
特殊人群无需因为患者的年龄、体重、性别、种族和吸烟状态对剂量进行调整。
肝功能损害轻度肝功能损害(总胆红素<正常值上限(ULN)且谷草转氨酶(AST)达1至1.5xULN;或总胆红素达1至1.5xULN,AST不限)患者无需进行剂量调整,但此类患者仍应慎用本品。
中重度肝功能损害患者使用本品的安全性和有效性尚不明确。
药物Osimertinib(奥希替尼)合成检索总结报告
一、Osimertinib(奥希替尼)简介
Osimertinib(奥希替尼)用于治疗转移性表皮生长因子受体(EGFR)T790M突变阳性以及其他EGFR.阻断剂治疗后疾病恶化的非小细胞肺癌(NSCLC)患者。
Osimertinib(奥希替尼)不良反应有:腹泻,皮疹,皮肤干燥和指甲毒性。
Osimertinib(奥希替尼)分子结构式如下:
英文名称:Osimertinib
中文名称:奥希替尼
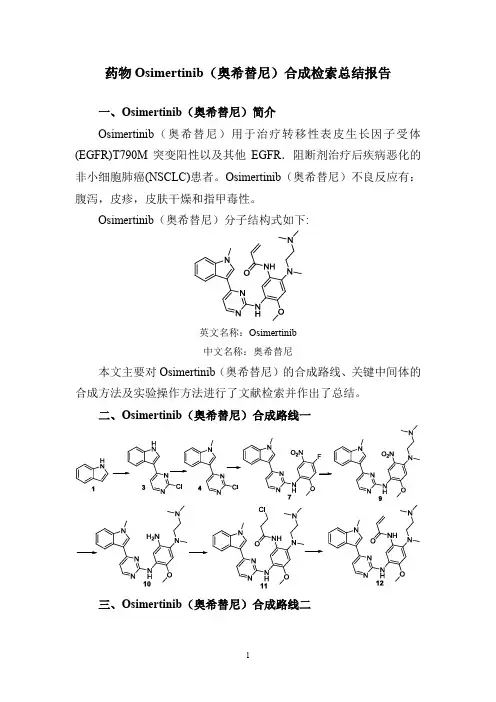
本文主要对Osimertinib(奥希替尼)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、Osimertinib(奥希替尼)合成路线一
三、Osimertinib(奥希替尼)合成路线二
四、Osimertinib(奥希替尼)合成路线一检索总结报告(一) Osimertinib(奥希替尼)中间体3的合成(路线一)
(二) Osimertinib(奥希替尼)中间体4的合成方法一(路线一)
(三) Osimertinib(奥希替尼)中间体4的合成方法二(路线一)。
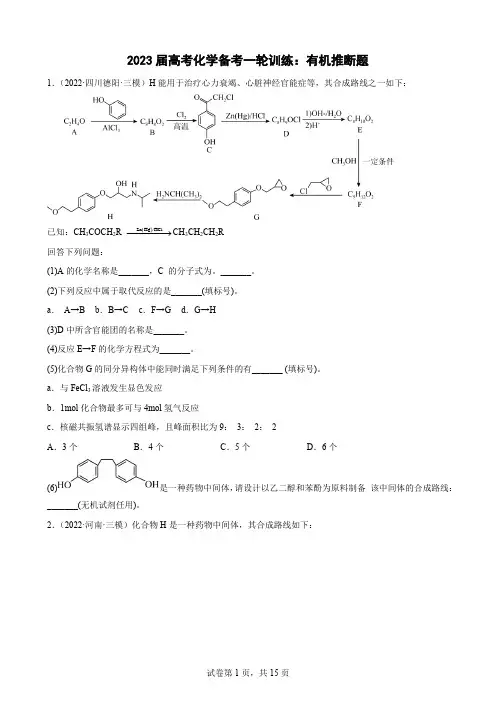
2023届高考化学备考一轮训练:有机推断题1.(2022·四川德阳·三模)H 能用于治疗心力衰竭、心脏神经官能症等,其合成路线之一如下:已知:CH 3COCH 2R ()Zn Hg /HCl −−−−→CH 3CH 2CH 2R回答下列问题:(1)A 的化学名称是_______,C 的分子式为。
_______。
(2)下列反应中属于取代反应的是_______(填标号)。
a . A→B b .B→C c .F→G d .G→H (3)D 中所含官能团的名称是_______。
(4)反应E→F 的化学方程式为_______。
(5)化合物G 的同分异构体中能同时满足下列条件的有_______ (填标号)。
a .与FeCl 3溶液发生显色发应b .1mol 化合物最多可与4mol 氢气反应c .核磁共振氢谱显示四组峰,且峰面积比为9: 3: 2: 2 A .3个B .4个C .5个D .6个(6)是一种药物中间体,请设计以乙二醇和苯酚为原料制备 该中间体的合成路线:_______(无机试剂任用)。
2.(2022·河南·三模)化合物H 是一种药物中间体,其合成路线如下:回答下列问题:(1)用系统命名法命名A为_______。
(2)F具有的官能团名称为_______。
(3)A→B的化学方程式为_______。
(4)E→G的反应类型为_______ 。
(5)D的结构简式为_______,其核磁共振氢谱中有_______组峰。
(6)化合物W是B的同分异构体,且W中含有-NH2和苯环,同时满足以上条件的W(除B外)共有_______种(不考虑立体异构);其中含有手性碳(手性碳指连有四个不同原子或原子团的碳原子)的化合物的结构简式为_______。
3.(2022·陕西汉中·二模)有机物F是重要的医药合成中间体,其一种合成路线如下:已知:FeHCl回答下列问题:(1)物质A的名称为_______;B的结构简式_______。

第32卷第2期化㊀学㊀研㊀究Vol.32㊀No.22021年3月CHEMICAL㊀RESEARCHMar.2021奥希替尼的合成工艺改进高梦康,张华霖,王玉睢,乔振蕊,严㊀琳∗(河南大学药学院,河南开封475004)收稿日期:2020⁃11⁃03基金项目:国家自然科学基金(U1704185);河南省科技厅项目(202102310147)作者简介:高梦康(1995-),男,硕士研究生,研究方向为药物化学㊂∗通讯联系人,E⁃mail:yanlin@henu.edu.cn摘㊀要:以2⁃甲氧基⁃4⁃氟苯胺(2)为原料,用硝酸铵代替硝酸钾进行硝化反应得2⁃氟⁃4⁃甲氧基⁃5⁃硝基苯胺(3),进而与丙烯酰氯进行酰胺化反应得N⁃(2⁃氟⁃4⁃甲氧基⁃5⁃硝基)苯基⁃2⁃丙烯酰胺(4)㊂4与N,N,N⁃三甲基乙二胺进行亲核取代反应时,加入阻聚剂对羟基苯甲醚,成功地降低了副反应Michael加成反应的发生,得到N⁃[2⁃[[2⁃(二甲基氨基)乙基]甲基氨基]⁃4⁃甲氧基⁃5⁃硝基]苯基⁃2⁃丙烯酰胺(5)㊂用锌粉㊁无水氯化钙代替Pd/C催化对5的还原反应,产物不经纯化直接与3⁃(2⁃氯嘧啶⁃4⁃基)⁃1⁃甲基吲哚进行偶联得目标产品奥希替尼,总收率43.2%(以2计),纯度为99.85%㊂改进后的工艺路线步骤少㊁反应条件温和㊁操作和后处理简便,为奥希替尼的制备提供了一种新的方法㊂关键词:奥希替尼;酪氨酸激酶抑制剂;工艺改进中图分类号:O627文献标志码:A文章编号:1008-1011(2021)02-0118-04ImprovedsynthesisofosimertinibGAOMengkang ZHANGHualin WANGYusui QIAOZhenrui YANLin∗PharmaceuticalCollegeofHenanUniversity Kaifeng475004 Henan ChinaAbstract Animprovedsynthesisofosimertinib(1)wasreported.The2⁃fluoro⁃4⁃methoxy⁃5⁃nitroaniline(3)wasobtainedbynitrationof2⁃methoxy⁃4⁃fluoroaniline(2)withammoniumnitrateinsteadofpotassiumnitrate.ThenN⁃(2⁃fluoro⁃4⁃methoxy⁃5⁃nitro)phenyl⁃2⁃acrylamide(4)wasobtainedbyamidationwithacryloylchloride.Inthenucleophilicsubstitutionreactionofcompound4withN,N,Nᶄ⁃trimethylethylenediamine,4⁃methoxyphenolwasaddedtoreducethesidereactionofMichaeladdition,andN⁃[2⁃[[2⁃(dimethylamino)ethyl]methylamino]⁃4⁃methoxy⁃5⁃nitro]phenyl⁃2⁃acrylamide(5)wasobtainedasmajorproduct.Thereductionofcompound5wascatalyzedbyzincpowderandanhydrouscalciumchlorideinsteadofPd/C,andtheproductwasdirectlycoupledwith3⁃(2⁃chloropyrimidine⁃4⁃yl)⁃1⁃methylindolewithoutpurificationtogivethetargetproductosimertinibwithanoverallyieldof43.2%(basedon2)andpurityof99.85%.Theimprovedprocesshastheadvantagesoffewsteps,mildreactionconditions,simpleoperationandpost⁃treatment,whichprovidesanewmethodforthepreparationofosimertinib.Keywords:osimertinib;tyrosinekinaseinhibitor;processimprovement㊀㊀奥希替尼(Osimertinib,1),化学名为N⁃(2⁃{2⁃二甲氨基乙基⁃甲氨基}⁃4⁃甲氧基⁃5⁃{[4⁃(1⁃甲基⁃1H⁃吲哚⁃3⁃基)嘧啶⁃2⁃基]氨基}苯基)⁃2⁃丙烯酰胺,CAS登记号为:1421373⁃65⁃0,是由英国阿斯利康公司研制,治疗非小细胞肺癌(NSCLC)的第三代酪氨酸激酶抑制剂,能不可逆地与表皮生长因子受体(EGFR)结合[1-2]㊂2015年11月,奥希替尼获得FDA加速审批,并获得 突破性疗法 称号,用于T790M阳性NSCLC初治患者的治疗[3-4]㊂文献报道的奥希替尼的合成路线主要有以下3第2期高梦康等:奥希替尼的合成工艺改进119㊀条:路线1以4⁃氟⁃2⁃甲氧基苯胺,2,4⁃二氯嘧啶和1⁃甲基吲哚为原料,经过7步反应,得到奥希替尼(图1)[5]㊂此路线反应步骤较长,并且通过铁铵还原法还原苯环上的硝基,反应条件苛刻,反应后处理困难,且收率低(85%),不适合大规模的工业生产㊂图1㊀合成路线1Fig.1㊀Synthesisroute1㊀㊀路线2以4⁃氟⁃2⁃甲氧基⁃1⁃硝基苯为原料,经过6步反应,得到奥希替尼(图2)[6]㊂此路线通过氢气和Pd/C还原硝基,危险系数高,操作复杂,反应后处理困难,且成本较高,不利于大规模生产㊂图2㊀合成路线2Fig.2㊀Synthesisroute2㊀㊀路线3以2⁃氟⁃4⁃甲氧基苯胺为原料,经过7步反应,得到奥希替尼(图3)[5]㊂此路线反应步骤较长,胍基化反应中采用不易储存的单氰胺,同时直接成环产率低,不适合大规模的工业生产㊂通过调整上述路线的反应顺序,并优化实验条件,设计了如下合成路线4(图4)㊂以2⁃氟⁃4⁃甲氧基苯胺(2)为起始原料,用硝酸铵代替硝酸钾[5,7]进行硝化反应得2⁃氟⁃4⁃甲氧基⁃5⁃硝基苯胺(3)㊂化合物3与丙烯酰氯在室温下反应2h得N⁃(2⁃氟⁃4⁃甲氧基⁃5⁃硝基)苯基⁃2⁃丙烯酰胺(4)㊂化合物4与N,N,Nᶄ⁃三甲基乙二胺进行亲核取代反应时,加入阻聚剂4⁃甲氧基苯酚降低副反应Michael加成的发生,同时用价廉易得的碳酸钾代替N,N⁃二异丙基乙胺(DIPEA)[5-6]作缚酸剂,制得N⁃[2⁃[[2⁃(二甲基氨基)乙基]甲基氨基]⁃4⁃甲氧基⁃5⁃硝基]苯基⁃2⁃丙烯酰胺(5)㊂用价廉易得的锌粉㊁无水氯化钙代替Pd/C和氢气[5-6]催化还原反应,产物不经纯化直接与3⁃(2⁃氯嘧啶⁃4⁃基)⁃1⁃甲基吲哚偶联得奥希替尼㊂优化后的路线步骤少,反应条件温和,后处理简便,为奥希替尼的制备提供了一种新的方法㊂120㊀化㊀学㊀研㊀究2021年图3㊀合成路线3Fig.3㊀Synthesisroute3图4㊀合成路线4Fig.4㊀Synthesisroute41㊀仪器与试剂BrukerAVANCEⅢ全数字化超导核磁共振谱仪(德国Bruker公司),OptiMeltMPA100全自动熔点仪(美国斯坦福大学研究所),LC⁃10AT型高效液相色谱仪(日本岛津公司),2⁃氟⁃4⁃甲氧基苯胺(上海皓鸿生物医药科技有限公司,纯度>95%),丙烯酰氯(郑州阿尔法化工有限公司,纯度>98%),N,N,N⁃三甲基乙二胺(武汉峰耀同辉化学制品有限公司,纯度>95%),3⁃(2⁃氯嘧啶⁃4⁃基)⁃1⁃甲基吲哚(上海钰康生物科技有限公司,纯度>95%),其余所用试剂均为市售分析纯㊂2㊀化合物的合成2.1㊀2⁃氟⁃4⁃甲氧基⁃5⁃硝基苯胺(3)的合成在冰浴条件下,将0ħ的浓硫酸(6mL)加至2,2.00g,14.2mmol)中,分三批缓慢加入硝酸铵(1.13g,14.2mmol)㊂加毕,保温反应20min㊂将反应液倒入冰水中,边搅拌边滴加氨水,调节pH至8,有大量黄色固体析出㊂抽滤,滤饼用水(20mLˑ3)洗涤,40ħ真空干燥得亮黄色固体3(2.57g,92%),纯度为96.14%,[HPLC面积归一化法:色谱柱COSMOSIL5C18-PAQ(250mmˑ4.6mm,5μm);流动相3mmol/L磷酸水溶液⁃乙腈;检测波长210nm,流速1.0mL/min]㊂m.p.98.7 102.7ħ㊂1HNMR(300MHz,CDCl3)δ:7.44(d,J=9.1Hz,1H),6.80(d,J=12.1Hz,1H),3.89(s,3H),3.68(s,2H)㊂2.2㊀N⁃(2⁃氟⁃4⁃甲氧基⁃5⁃硝基)苯基⁃2⁃丙烯酰胺(4)的合成将3(2.42g,13.0mmol)㊁三乙胺(1.98g,15.1mmol)溶于3mL乙腈中,冰浴冷却,1.5h内滴加丙烯酰氯(郑州阿尔法化工有限公司,纯度>98%,1.27mL,15.6mmol)的乙腈(5mL)溶液,滴毕,室温反应2h㊂减压蒸除溶剂,用饱和碳酸氢钠溶液(40mL)洗涤产物,将pH调至8,用二氯甲烷第2期高梦康等:奥希替尼的合成工艺改进121㊀(10mLˑ2)萃取,合并有机相,减压浓缩得乳黄色固体4(2.79g,89%),纯度94.74%,[HPLC面积归一化法,条件同上]㊂m.p.168.1-172.6ħ㊂1HNMR(300MHz,CDCl3)δ:9.02(d,J=8.1Hz,1H),6.88(d,J=12.2Hz,1H),6.49(d,J=16.8Hz,1H),6.26(dd,J=16.8,10.2Hz,1H),5.88(s,1H),5.30(s,1H),3.94(s,3H)㊂2.3㊀N⁃[2⁃[[2⁃(二甲基氨基)乙基]甲基氨基]⁃4⁃甲氧基⁃5⁃硝基]苯基⁃2⁃丙烯酰胺(5)的合成将4(2.50g,10.4mmol)㊁碳酸钾(2.15g,15.6mmol)㊁N,N,N⁃三甲基乙二胺(1.17g,11.4mmol)㊁4⁃甲氧基苯酚(0.065g,0.5mmol)依次加入6mLDMF中,常温反应2h㊂将反应液倒入300mL水中,用乙酸乙酯(30mLˑ3)萃取,滤液减压浓缩,残余物用硅胶柱色谱分离(二氯甲烷㊁甲醇体积比,80ʒ1),得暗黄色固体5(2.26g,67%),纯度94.95%,[HPLC面积归一化法,条件同上]㊂m.p.110.3-114.5ħ㊂1HNMR(300MHz,CDCl3)δ:10.20(s,1H),9.13(s,1H),6.75(s,1H),6.40(dd,J=17.0,1.8Hz,1H),6.26(dd,J=17.0,10.1Hz,1H),5.69(dd,J=10.0,1.8Hz,1H),3.88(s,3H),2.96-2.79(m,2H),2.76(s,3H),2.53-2.35(m,2H),2.33(d,J=8.3Hz,6H)㊂2.4㊀奥希替尼(1)的合成按乙醇与水体积比3ʒ1配制溶剂10mL,将5(2.00g,6.1mmol)㊁无水氯化钙(0.41g,3.7mmol)㊁锌粉(3.99g,61mmol)依次加入溶剂,滴加6N盐酸50μL,滴毕,加热回流0.5h㊂加入20mL水后抽滤除去锌粉,用乙酸乙酯(5mLˑ3)萃取,减压浓缩后得1.62g棕色固体6㊂不做进一步处理,直接用于下一步反应㊂将6(1.62g,5.4mmol)㊁3⁃(2⁃氯嘧啶⁃4⁃基)⁃1⁃甲基吲哚1.45g,5.9mmol)㊁对甲苯磺酸(1.12g,6.5mmol)依次加入8mL正丁醇溶液中,85ħ回流5h,TLC检测反应完毕后,用氨水淬灭反应,加水(50mL)有黄色固体析出,搅拌4h,抽滤,滤饼用乙腈(10mLˑ2)洗涤,50ħ真空干燥6h,得淡黄色固体1(2.37g,78%),纯度99.85%,[HPLC面积归一化法,条件同上]㊂m.p.103.8-107.1ħ(文献[8]:104-107ħ)㊂1HNMR(300MHz,CDCl3)δ:10.08(s,1H),9.85(s,1H),9.09(s,1H),8.38(d,J=5.1Hz,1H),8.08-8.05(m,1H),7.73(s,1H),7.41-7.39(m,1H),7.31-7.18(m,2H),7.20(d,J=5.1Hz,1H),6.78(s,1H),6.48-6.44(m,2H),5.74-5.69(m,1H),4.00(s,3H),3.89(s,3H),2.93(dd,J=1.5,5.1Hz,2H),2.71(s,3H),2.32(s,8H)㊂3㊀结论改进后的合成路线不仅反应步骤缩短至5步,而且试剂价廉易得,成本大幅度降低㊂此外反应条件温和,反应时间短,各步骤反应时间均低于5h,且后处理简便,为奥希替尼的制备提供了一种新的方法㊂参考文献:[1]SONGZ,GEY,WANGC,etal.Challengesandperspectivesonthedevelopmentofsmall⁃moleculeEGFRinhibitorsagainstT790M⁃mediatedresistanceinnon⁃small⁃celllungcancer[J].JournalofMedicinalChemistry,2016,59(14):6580-6594.[2]PADFIELDE,ELLISHP,KURIANKM.CurrenttherapeuticadvancestargetingEGFRandEGFRvIIIinglioblastoma[J].FrontiersinOncology,2015,5(5):1-4.[3]ZHAOJ,GUERREROA,KELNARK,etal.SynergybetweennextgenerationEGFRtyrosinekinaseinhibitorsandmiR⁃34aintheinhibitionofnon⁃smallcelllungcancer[J].LungCancer,2017,108:96-102.[4]LEEY,WANGY,JAMESM,etal.InhibitionofIGF1Rsignalingabrogatesresistancetoafatinib(BIBW2992)inEGFRT790Mmutantlungcancercells[J].MolecularCarcinogenesis,2016,55(5):991-1001.[5]HUGHESDL.Patentreviewofmanufacturingroutestooncologydrugs:carfilzomib,osimertinib,andvenetoclax[J].OrganicProcessResearch&Development,2016,20(12):2028-2042.[6]LIUH,LVY,LIY,etal.Anovelandefficientsynthesisofanti⁃canceragent,mereletinib[J].JournalofChemicalResearch,2015,39:318-320.[7]王永,吴亚闯,范旭旭,等.奥默替尼的合成[J].中国医药工业杂志,2016,47(8):981-984.WANGY,WUYC,FANXX,etal.Synthesisofosimertinib[J].ChineseJournalofPharmaceuticals,2016,47(8):981-984.[8]潘听听,王盼盼,郭雅俊,等.甲磺酸奥希替尼的合成[J].中国医药工业杂志,2017,48(4):483-487.PANTT,WANGPP,GUOYJ,etal.Synthesisofosimertinibmesylate[J].ChineseJournalofPharmaceuticals,2017,48(4):483-487.[责任编辑:徐元清]。

奥希替尼结构式-回复奥希替尼(Axitinib)是一种口服靶向治疗肾细胞癌(Renal Cell Carcinoma,RCC)的药物。
它属于酪氨酸激酶抑制剂,通过抑制肿瘤细胞中的血管内皮生长因子受体(Vascular Endothelial Growth Factor Receptor,VEGFR)来阻止肿瘤生长和进展。
奥希替尼的结构式如下:[图片插入奥希替尼的结构式]在本文中,我们将一步一步回答关于奥希替尼结构式的相关问题,并探讨它的作用机制以及在肾细胞癌治疗中的应用。
第一步:理解奥希替尼的结构奥希替尼的结构式中包含多个环和侧链,每个原子都有特定的位置和键。
通过仔细观察结构式,我们可以看到氮原子、氧原子和氢原子的排列方式。
这些原子的位置和键的连接方式决定了奥希替尼的化学性质和药理学特性。
第二步:认识酪氨酸激酶(Tyrosine Kinase)抑制剂酪氨酸激酶是一类蛋白酶,参与调控细胞的生长、分化和凋亡。
在肾细胞癌中,血管内皮生长因子(VEGF)的过度表达会导致血管生成和肿瘤细胞的增殖,从而促进肿瘤的生长和转移。
酪氨酸激酶抑制剂通过抑制VEGF 受体(VEGFR)的激活,阻断信号传导通路,抑制血管生成和肿瘤细胞增殖,从而抑制肿瘤生长并延长患者的生存期。
第三步:奥希替尼的作用机制奥希替尼是一种选择性VEGFR抑制剂,它主要抑制VEGFR-1、VEGFR-2和VEGFR-3的激活。
VEGFR-1和VEGFR-2被认为是VEGF信号传导的关键受体,其过度激活与肾细胞癌的发展有关。
奥希替尼的结构与VEGFR 结构相似,可以与VEGFR结合并竞争性抑制VEGF的结合,从而阻断VEGF 信号传导通路。
第四步:奥希替尼在肾细胞癌治疗中的应用奥希替尼已被美国食品药品监督管理局(FDA)批准用于晚期或转移性肾细胞癌的治疗。
临床试验表明,奥希替尼与传统的免疫疗法相比,能够延长患者的生存期。
它被广泛应用于一线和二线治疗中,通常与其他化疗药物或免疫治疗方案联合使用。

奥希替尼合成工艺
奥希替尼的合成工艺较为复杂,以下是其中一种可能的合成路线:
1. 以2-甲氧基-4-氟苯胺为原料,用硝酸铵代替硝酸钾进行硝化反应得到2-氟-4-甲氧基-5-硝基苯胺;
2. 将2-氟-4-甲氧基-5-硝基苯胺与丙烯酰氯进行酰胺化反应,得到N-(2-氟-4-甲氧基-5-硝基)苯基-2-丙烯酰胺;
3. 在N-(2-氟-4-甲氧基-5-硝基)苯基-2-丙烯酰胺与N,N,N-三甲基乙二胺进行亲核取代反应时,加入阻聚剂对羟基苯甲醚,减少副反应Michael加成反应的发生,得到N-(2-((2-(二甲基氨基)乙基)甲基氨基)-4-甲氧基-5-硝基)苯基-2-丙烯酰胺;
4. 用锌粉、无水氯化钙代替Pd/C催化对N-(2-((2-(二甲基氨基)乙基)甲基氨基)-4-甲氧基-5-硝基)苯基-2-丙烯酰胺的还原反应,产物不经纯化直接与3-(2-氯嘧啶-4-基)-1-甲基吲哚进行偶联,最终得到奥希替尼。
奥希替尼的合成工艺需要高度专业的知识和技能,同时也需要谨慎操作以确保安全。
如果你需要了解更多关于奥希替尼的信息,请咨询专业的化学或药物专家。
![一种奥希替尼中间体的合成方法[发明专利]](https://uimg.taocdn.com/b6588630d15abe23492f4dc5.webp)
专利名称:一种奥希替尼中间体的合成方法专利类型:发明专利
发明人:陈化群,位晓梅,史汝金,申川生
申请号:CN202011186284.X
申请日:20201030
公开号:CN112341346A
公开日:
20210209
专利内容由知识产权出版社提供
摘要:本发明涉及一种奥希替尼中间体的合成方法,包括以下步骤:1、取3‑氟苯甲醚作为起始原料,添加到浓硫酸中,在低温环境下滴加浓硝酸,滴加完毕后,进行第一次升温搅拌,后将体系注入冰水中淬灭,然后进行第二次升温搅拌,过滤得产品3‑氟‑4,6‑二硝基苯甲醚;2、将第一步所得化合物3‑氟‑4,6‑二硝基苯甲醚加入到水中,再加入碱,升温,分批加入弱还原剂,保温搅拌至反应终点,过滤后得到粗品,再依次进行洗涤、用甲醇重结晶、低温析晶过滤、烘干,最终得到4‑氟‑2‑甲氧基‑5‑硝基苯胺。
本发明解决了现有技术中奥希替尼中间体的合成方法存在原材料价格昂贵且市场不易得、工艺复杂和收率低的问题。
申请人:烟台舜康生物科技有限公司
地址:265200 山东省烟台市莱阳市经济技术开发区峨嵋路东部路南
国籍:CN
代理机构:烟台双联专利事务所(普通合伙)
代理人:牟晓丹
更多信息请下载全文后查看。
![一种奥希替尼二聚体、其制备方法及其用途[发明专利]](https://uimg.taocdn.com/7ace144d1611cc7931b765ce050876323012745d.webp)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202011219873.3(22)申请日 2020.11.05(71)申请人 北京鑫开元医药科技有限公司地址 101102 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号20号楼二层B申请人 甘肃海普诺睿创制药有限公司(72)发明人 袁兵占 蒋兴凯 喻赞伟 吴迪 李彬 戴信敏 (74)专利代理机构 北京嘉科知识产权代理事务所(特殊普通合伙) 11687代理人 杨超(51)Int.Cl.C07D 403/14(2006.01)(54)发明名称一种奥希替尼二聚体、其制备方法及其用途(57)摘要本发明属于药物领域,具体涉及一种奥希替尼二聚体、其制备方法及其用途,所述奥希替尼二聚体化学结构为:。
奥希替尼二聚体的合成是以化合物1为起始物料,中间反应过程中按照合成路线逐步加入丙烯酸酐和丙烯酸,经还原、酰化、加成及缩合制备得奥希替尼二聚体,该制备方法简单,操作方便,设备条件要求不高,极易实现,且后处理简单,通过该制备方法合成的奥希替尼二聚体纯度高,可以作为杂质对照品应用于奥希替尼杂质的定性、定量研究和检测,对有效控制奥希替尼的质量有重要意义。
权利要求书2页 说明书12页 附图2页CN 112028880 A 2020.12.04C N 112028880A1.一种奥希替尼二聚体,其特征在于,所述奥希替尼二聚体的化学结构式为:。
2.一种如权利要求1所述的奥希替尼二聚体的制备方法,其特征在于,包括如下步骤:中间体2的合成:化合物1在催化剂和氢气作用下于第一反应溶剂中进行还原反应,得到中间体2;中间体3的合成:所述中间体2与丙烯酸酐在缚酸剂作用下于第二反应溶剂中进行酰化反应,得到中间体3;中间体4的合成:所述中间体3与丙烯酸于第三反应溶剂中加热进行加成反应,得到中间体4;奥希替尼二聚体的合成:所述中间体4与所述中间体2在缩合剂作用下于第四反应溶剂中加热进行缩合反应,得到奥希替尼二聚体。
![氘代奥希替尼药用盐的晶型及其制备方法[发明专利]](https://uimg.taocdn.com/7ffcddf8db38376baf1ffc4ffe4733687e21fc81.webp)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202010255512.8(22)申请日 2020.04.02(71)申请人 广州博济医药生物技术股份有限公司地址 510640 广东省广州市天河区华观路1933号701房(72)发明人 马仁强 田玉婷 陆静云 (74)专利代理机构 广州瑞之凡知识产权代理事务所(普通合伙) 44514代理人 邹俊煊(51)Int.Cl.C07D 403/04(2006.01)C07C 303/32(2006.01)C07C 309/04(2006.01)(54)发明名称氘代奥希替尼药用盐的晶型及其制备方法(57)摘要本发明涉及化合物晶型及其制备方法,具体涉及一种氘代奥希替尼药用盐晶型I及其制备方法和应用。
本发明所述晶型以2θ角度表示的X射线粉末衍射图还在以下位置:5.49±0.2°、6.42±0.2°、11.01±0.2°、11.61±0.2°、12.46±0.2°、13.42±0.2°、14.22±0.2°、15.58±0.2°具有特征衍射峰。
该晶型不易吸湿、更高的溶解度、具有更好的稳定性、更好的流动性及制剂加工性能,在制备EGFR酪氨酸激酶抑制剂药物中具有重要意义。
本发明还公开了一种氘代奥希替尼药用盐的晶型I的制备方法,该制备方法所得晶型具有较高的纯度,收率更高。
权利要求书1页 说明书9页 附图2页CN 111285852 A 2020.06.16C N 111285852A1.一种氘代Osimertinib药用盐晶型,其特征在于,其X -射线粉末衍射图在衍射角2θ为5.49±0.2°、6.42±0.2°、11.01±0.2°、11.61±0.2°、12.46±0.2°、13.42±0.2°、14.22±0.2°、15.58±0.2°处具有特征衍射峰;其中所述氘代Osimertinib药用盐,其结构式如下所示:。
专利名称:甲磺酸奥希替尼在制备治疗真菌感染药物中的应用专利类型:发明专利
发明人:王慧,刘宁宁
申请号:CN201910952444.8
申请日:20191009
公开号:CN110548029A
公开日:
20191210
专利内容由知识产权出版社提供
摘要:本发明属于医药制备领域,特别涉及甲磺酸奥希替尼在制备治疗真菌感染药物中的应用。
甲磺酸奥希替尼对于真菌感染有治疗效果,尤其是与氟康唑联合使用时,对抗真菌感染不仅仅抑菌效果良好而且达到了杀菌的效果,此外还具有广谱的抗菌效果,对于临床上氟康唑的白色念珠菌耐药株、新型隐球菌和酿酒酵母具有良好的杀灭效果。
本发明通过实验验证了甲磺酸奥希替尼的杀菌机制与破坏细胞囊泡内pH稳态相关。
因此本发明从大规模筛选到机制验证的角度为开发pH稳态作为抗真菌感染药物提供了新的证据和思路。
本发明发现了基因PDR5和VMA1是甲磺酸奥希替尼抗真菌感染作用的药物靶点,为真菌感染的治疗及治疗药物的研究开发提供了新的发展方向和作用机理。
申请人:上海交通大学医学院
地址:200025 上海市黄浦区重庆南路280号
国籍:CN
代理机构:上海伯瑞杰知识产权代理有限公司
代理人:曹莉
更多信息请下载全文后查看。
抗菌药奥替尼啶的合成
吕加国;杨济秋;万维勤
【期刊名称】《中国医药工业杂志》
【年(卷),期】1991(22)8
【摘要】报道了新型抗菌药奥替尼啶的合成。
对氨化、还原两步作了改进。
初步临床试验表明其抑制菌斑和防止牙龈炎具有较好的效果。
【总页数】2页(P342-343)
【关键词】奥替尼啶;抗菌药;合成
【作者】吕加国;杨济秋;万维勤
【作者单位】第二军医大学药学院药化教研室
【正文语种】中文
【中图分类】TQ463.54
【相关文献】
1.普莱克尼啶中间体9-甲基-2,4-二硝基-5-氯吖啶的合成 [J], 刘殿卿;李德鹏;由业诚;于小松;王爱玲
2.盐酸奥替尼啶在宠物临床上的应用 [J], 陈俊;王亮;夏勇;杨朔;张驿
3.基于茶树油/盐酸奥替尼啶的纳米胶囊的制备及抗菌性能 [J], 邢幸;康宁;曾天;徐云龙
4.奥希替尼的合成工艺改进 [J], 高梦康;张华霖;王玉睢;乔振蕊;严琳
5.奥拉帕尼合成路线图解 [J], 倪雅婧;陈婷婷;杨昊朋;赵燕芳
因版权原因,仅展示原文概要,查看原文内容请购买。