流式细胞仪中文操作手册
- 格式:pdf
- 大小:9.25 MB
- 文档页数:35

BD FACSCalibur流式细胞仪简明操作规程一.开机程序1.把稳压器电源开关设到ON。
2.打开储液箱,把黑色开关开到TANK CHANGE位置,鞘液桶加满鞘液,倒空废液桶,把黑色开关开到Pressurize位置。
3.将FACSCalibur右侧下面的绿色按钮按开。
4.打开电脑。
二.仪器条件设定1.点击“苹果”菜单项下的CELLQuest,建立一个新视窗。
2.点击“Acquire”菜单下的“Parameter description”建立自己的文件夹,保留在屏幕上。
3.点击“Acquire”菜单下的“Connect to Cytometer”联机,这时出现“Acquisiton Control”对话框,保留在屏幕上。
4.点击“Cytometer”菜单下的“Detectors/Amps”、“Threshold”、“Compensation”三个对话框,保留在屏幕上。
5.点击“Cytometer”菜单下的“Instrument settings”,出现对话框,点击对话框中“open”,选择自己的实验条件后,点击“set”,然后点击“Done”6.加上对照样本,样品支撑架置于中位,用LO 流速RUN,点击AcqusiotionControl 对话框的Acquire,观察样品的散射光和荧光参数是否合适,调节“Detectors/Amps”对话框的相关参数,直到各个参数都合适为止。
7.点击”Acqusiotion Control”对话框的“Setup”,开始测试样品。
当所有样品分析完毕,即换上双蒸水,并将流式细胞仪置于“STANDBY”状态,以保护激光管。
三.关机程序1.测试完毕样品后,从File中选择Quit, 退出软件,点击“Special”菜单项下的“Shutdown”关机。
2.试管中加入3 ml Clean液,将样品支撑架置于旁位清洗外管,以外管吸入1ml Clean液,将样品支撑架置于中位,用HI流速RUN5分钟清洗内管,。

流式细胞仪的使用程序------血液病实验诊断中心一.开机程序1.检查稳压器电源,打开电源,稳定5分钟。
2.打开储液箱,倒掉废液, 并在废液桶中加入400ml漂白水原液。
打开压力阀,取出鞘液桶,将鞘液桶加至4/5满(一般可用三蒸水,做分选必须用PBS 或FACSFlow),合上压力阀。
确实盖紧桶盖,检查所有管路是否妥善安置。
3.将FACSCalibur开关打开,此时仪器功能控制钮的显示应是STANDBY,预热5-10分钟。
排出过滤器内的气泡。
4.如果需要打印,打开打印机电源。
5.打开电脑,等待屏幕显示出标准的苹果标志。
6.执行仪器PRIME功能一次,以排除Flow cell中的气泡。
7.分析样品时,先用FACAFlow 或PBS进行HIGH RUN约2分钟。
做过分选后,每次开机后需冲洗管道:向分选装置上装上两个50ml离心管,不接通浓缩系统,摁下右下角白色按钮开始冲洗。
待自动停止后接通浓缩装置,同上法冲洗一次。
二.预设获取模式文件(Acquisition Template Files)1.从苹果标志中选择CELLQuest见一个新视窗,可利用此视窗编辑一个获取模式文件。
2.选取屏幕左列绘图工具中的Dot plot,绘出一个或多个Dot Plots(点图)。
从Dot Plot对话框中选取Acquisition作为图形资料来源,并确定适当的x 轴和y轴参数。
3.选取屏幕左列绘图工具中的Histogram,同上法可绘出Histogram(直方图)。
4.将此视窗命名后储存于FACStation G3\BD Applications \CELLQuestFolder \EXP文件夹中,下次进行相同实验时可直接调用。
. 本计算机中已设定两个模式文件:ACQ和EXP,储存于FACStation G3\BD Applications \CELLQuest \EXP文件夹中,ACQ用于细胞DNA检测, EXP用于细胞表面标志分析。

flowjo中文使用手册【实用版】目录1.引言2.FlowJo 软件简介3.FlowJo 的使用方法4.应用实例5.结论正文【引言】FlowJo 是一款用于流式细胞术数据分析的软件,广泛应用于生物科学研究和临床实验室。
本文将为您介绍如何使用 FlowJo 软件进行数据分析。
【FlowJo 软件简介】FlowJo 是一款功能强大的流式细胞术数据分析软件,适用于科研和临床实验室。
它能够对流式细胞仪产生的数据进行快速、准确的处理和分析。
FlowJo 具有用户友好的界面,支持多种数据格式,可以进行多种分析,如细胞计数、细胞分类、细胞表面标志物分析等。
【FlowJo 的使用方法】1.打开 FlowJo 软件:在 Windows 操作系统下,点击“开始”菜单,找到 FlowJo 软件并双击打开。
2.读取数据:在软件主界面,点击“File”菜单,选择“Open”,找到流式细胞仪产生的数据文件并导入。
3.数据预处理:导入数据后,可以对数据进行预处理,如去除死细胞、噪声等。
4.数据分析:在数据预处理完成后,可以进行数据分析。
FlowJo 提供了多种分析功能,如细胞计数、细胞分类、细胞表面标志物分析等。
5.结果导出:分析完成后,可以将结果导出为 Excel、CSV 等格式。
【应用实例】假设我们有一份 PBMC(外周血单个核细胞)的流式细胞术数据,我们可以使用 FlowJo 进行以下分析:1.细胞计数:通过 FlowJo 软件,我们可以对 PBMC 样本中的细胞数量进行计数。
2.细胞分类:FlowJo 可以根据细胞表面标志物的表达情况,将 PBMC 细胞分为不同的亚群,如 CD4+ T 细胞、CD8+ T 细胞等。
3.细胞表面标志物分析:FlowJo 可以分析 PBMC 细胞表面标志物的表达情况,如 CD3、CD4、CD8 等。
【结论】FlowJo 是一款实用的流式细胞术数据分析软件,可以帮助生物科学研究人员和临床实验室人员快速、准确地分析流式细胞术数据。

流式细胞仪的使用程序------分子病毒实验室一.开机程序1.检查稳压器电源,打开电源,稳定5分钟。
2.打开储液箱,倒掉废液, 并在废液桶中加入400ml漂白水原液。
打开压力阀,取出鞘液桶,将鞘液桶加至4/5满(一般可用三蒸水,做分选必须用PBS或FACSFlow),合上压力阀。
确实盖紧桶盖,检查所有管路是否妥善安置。
3.将FACSCalibur开关打开,此时仪器功能控制钮的显示应是STANDBY,预热5-10分钟。
排出过滤器内的气泡。
4.如果需要打印,打开打印机电源。
5.打开电脑,等待屏幕显示出标准的苹果标志。
6.执行仪器PRIME功能一次,以排除Flow cell中的气泡。
7.分析样品时,先用FACAFlow 或PBS进行HIGH RUN约2分钟。
。
做过分选后,每次开机后需冲洗管道:向分选装置上装上两个50ml离心管,不接通浓缩系统,摁下右下角白色按钮开始冲洗。
待自动停止后接通浓缩装置,同上法冲洗一次。
二.预设获取模式文件(Acquisition Template Files)1.从苹果标志中选择CELLQuest见一个新视窗,可利用此视窗编辑一个获取模式文件。
2.选取屏幕左列绘图工具中的Dot plot,绘出一个或多个Dot Plots(点图)。
从Dot Plot对话框中选取Acquisition作为图形资料来源,并确定适当的x轴和y轴参数。
3.选取屏幕左列绘图工具中的Histogram,同上法可绘出Histogram(直方图)。
4.将此视窗命名后储存于FACStation G3\BD Applications \CELLQuest Folder \EXP文件夹中,下次进行相同实验时可直接调用。
. 本计算机中已设定两个模式文件:ACQ和EXP,储存于FACStation G3\BD Applications \CELLQuest \EXP文件夹中,ACQ用于细胞DNA检测,EXP用于细胞表面标志分析。

Invitrogen Attune NxT流式细胞仪应用手册成就稀有细胞超灵敏高通量分析梦想实现全血样本无需裂解无需洗涤夙愿21人全血样本免洗免裂解白细胞分析(三种方法)...............................................................................................2人全血6色T 细胞无需补偿且免洗免裂解检测................................................................................................6人全血10色免疫表型分析.....................................................................................................................10人全血13色免疫表型分析.....................................................................................................................13人全血吞噬细胞检测...........................................................................................................................17小鼠脾细胞10色免疫表型分析...............................................................................................................22小鼠调节性T 细胞检测........................................................................................................................25藻类存活率分析...........................................................................................................................28使用Attune NxT 流式细胞仪进行荧光蛋白检测...........................................................................................30hPSC 来源的心肌细胞分化过程中转录因子表达的流式细胞分析......................................................................37利用Attune NxT 流式细胞仪检测全血中的血小板............................................................................................42利用Attune NxT 流式细胞仪设计T 细胞基础配色方案......................................................................51利用Attune NxT 流式细胞仪快速准确地进行植物细胞核DNA 含量分析................................................................59使用 ModFit LT 软件分析 Attune NxT FCS 数据文件的操作指南 . (66)利用Invitrogen Attune NxT 流式细胞仪对单细胞生物中的中性脂进行检测 (74)利用Attune NxT 流式细胞仪进行精确浓度测定的推荐方法 (78)Attune NxT 自动进样器实现流式高通量自动化检测:在所有板孔和微孔板之间保持结果的一致性 (80)使用FlowJo 软件分析Invitrogen Attune NxT FCS 数据文件的操作指南 (88)使用FCS Express 6软件分析Attune NxT FCS 数据文件 (96)目录2人全血免洗免裂解白细胞分析(三种方法)无需洗涤/裂解检测人全血中的白细胞简介从人的全血中分离并检测白细胞的传统方法十分耗时,且通常需要大量处理和富集方可进行分析。

一、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中气压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中气泡。
二、运行FACSComp软件、检查仪器状况1.制备三色标准微球样本。
一般情况向1ml鞘液(或过滤PBS)中加入1滴质控小微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使用的微球是新一批产品要输入微球的批号。
3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器自动检查,并做电压、补偿等设置。
6.FACSComp软件运行完毕,显示结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。
在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro软件,选择“联机”。
1.(2)对实验样本进行命名;(3)对实验通道进行预设(FSC,SSC,FL1-FL4)。
备注:如果界面被关闭,重新调出步骤:2.调出质控模板。
3.画图选择画图工具(一般选择散点图),Inspect界面会自动弹出,对几选中图形),将更改横纵坐备注:第一个散点图横坐标为FSC,纵坐标为SSC。
(1一般获取10000个细胞。
(2(3)将所有补偿调为0(4)将非52(5)FSC和SSC(64.上阴性对照将阴性对照管混匀,上机,功能键设置在“RUN”,散点图出现细胞信号,第一个图:让细胞信号出现在自己看上去舒服的区域;其他三个散点图,要将细胞信号调整到阴性区域,即左下角区域。

流式细胞仪操作步骤(FACSCalibur)一、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中气压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中气泡。
二、运行FACSComp软件、检查仪器状况1.制备三色标准微球样本。
一般情况向1ml鞘液(或过滤PBS)中加入1滴质控小微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使用的微球是新一批产品要输入微球的批号。
3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器自动检查,并做电压、补偿等设置。
6.FACSComp软件运行完毕,显示结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。
在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro1.软件,选择“联机”。
Acq Connect(1)在弹出的界面中的选择数据存储路径(Directory 菜单);(2) 对实验样本进行命名;(3) 对实验通道进行预设(FSC,SSC,FL1-FL4)。
备注:如果界面被关闭,重新调出步骤:2.调出质控模板。
3. 画图 选择画图工具(一般选择散点图),Inspect 界面会自动弹出,对几够选中图形),将 改为 ,更改横纵备注:第一个散点图横坐标为FSC ,纵坐标为SSC 。
FACSAri aⅡ流式细胞仪一、开机准备(一)准备液路1.将流式细胞仪的上盖打开;2.开启计算机,等待所有程序载入。
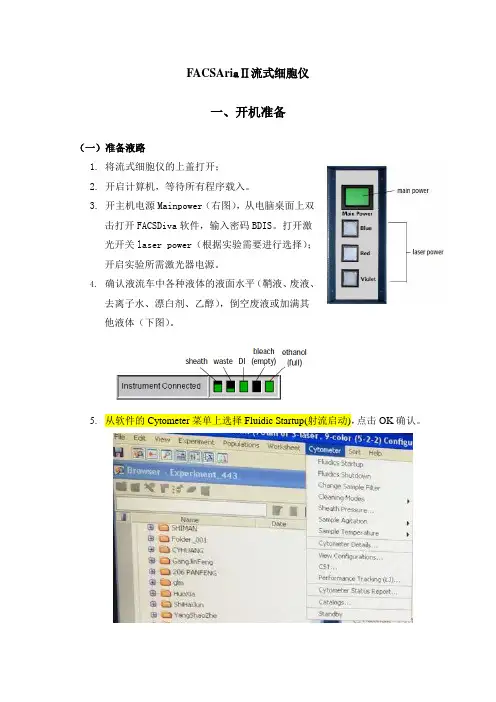
3.开主机电源Mainpower(右图),从电脑桌面上双击打开FACSDiva软件,输入密码BDIS。
打开激光开关laser power(根据实验需要进行选择);开启实验所需激光器电源。
4.确认液流车中各种液体的液面水平(鞘液、废液、去离子水、漂白剂、乙醇),倒空废液或加满其他液体(下图)。
5.从软件的Cytometer菜单上选择Fluidic Startup(射流启动),点击OK确认。
将出现如下窗口:6.将液路和气路管道从酒精桶断开,连接到鞘液桶;完成后点Done;7.将Closed-loop 喷嘴(闭环喷嘴)插入流动室;完成后点Done;会出现右侧窗口,提示液流开启进行中;8.达到100%,移去Closed-loop喷嘴,完成后点Done;9.按照实验要求,插入直径合适的喷嘴(喷嘴直径应该是分选颗粒直径的3-6倍);10.然后点OK,完成整个过程;11.从菜单上选择Sort(分类)sort setup,确认setup模式与喷嘴大小匹配。
(二)开液流1.打开液流窗口的液流;♦点击软件界面上(如下图)的按钮打开分选液流窗口(如下图)♦点击分选液流窗口的按钮(stream 的前面按钮),开启液流2.打开分选仓前的门,检查液流。
液流应为一条细线落入废液槽正中(可通过调整红色标志的键);(如果液流不稳,检查流动室中是否有气泡,将液流关闭,10秒钟后再开,排除气泡。
)3.关上分选仓前的门。
(三)设定液流断点1.调整液流震幅(Ampl),使断滴位于窗口上方1/3处。
(Ampl不要超过70,如果超过,检查流动室是否有气泡;确认鞘液压力和震动频率是否合适);2.确认卫星液滴与大液滴融合,应该在断滴的6滴之内融合(红色箭头数起,左图的左侧合格,右侧不合格),如果没有融合,重新安装喷嘴。
二、建立实验模板1.在软件界面左侧Browser面板下,依次点击New Folder、Experiment、Specimen (均可重命名),单击Specimen左侧“+”符号,显示下方的Tube,点击左侧灰色指示箭头,使之变成绿色(当前指示)。

BeamCyte 流式细胞仪快速操作指南流程开机首先打开电脑,电脑正常开机后打开仪器后面板电源键启动仪器,在配套电脑上打开Cytosys 软件,待仪器初始化完成,软件状态栏将显示“就绪”,即可进行下一步操作。
QC 测试1 制备BeamCyte QC微球悬液。
2 点击主菜单“系统维护”→“QC测试”,根据软件提示完成QC测试。
3 QC测试所有项目结果均为 Pass 时,可进行下一步操作。
新建实验1 点击主菜单“文件”→“新建”→“新建实验”,建立新的实验文件。
2 用以下多种方式新建实验样本或标本:在“实验管理”面板,右键点击“实验文件名”,在本实验文件下新建标本。
右键点击“标本”,在选中的标本下新建样本。
如果已有模板文件,点击主菜单“文件”→“新建”→“从模板新建”,将新建有相同模板的标本或样本。
3 点击主菜单“文件”→“保存”,保存选中的实验文件或其他文件。
注:如果已导出fcs文件,文件名会变色。
荧光补偿1.自动荧光补偿准备各个荧光参数的单染样本和未染色对照样本。
点击菜单“开始”→“自动补偿”,弹出“新建自动补偿”对话框,进行自动补偿条件设置。
选择需要使用的样本,并点击“确定”。
软件将自动新建“补偿标本”。
逐管采集单染样本,软件自动计算荧光补偿。
将自动计算的荧光补偿右键导出保存。
2.手动荧光补偿两种方式手动调节荧光补偿:需要补偿的参数两两做密度图,点击快速补偿按钮,拖动快速补偿滚动条,使某一荧光单阳性细胞与阴性细胞在另一荧光通道的荧光强度相等。
逐个调节直到所有参数之间的补偿完成。
补偿前补偿后补偿调节的过程也可以通过点击菜单“开始”→“当前补偿”调出当前样本的补偿矩阵,不断调整溢出矩阵中相应单元格的补偿系数来实现。
采集样本1 在“实验管理”面板,双击试管,使之成为当前试管(蓝色箭头指示)。
2 设置采集条件:设置采集使用的“参数”,,包括选择采集通道并定义别名和电压,初次实验的电压需用调试模式调整。
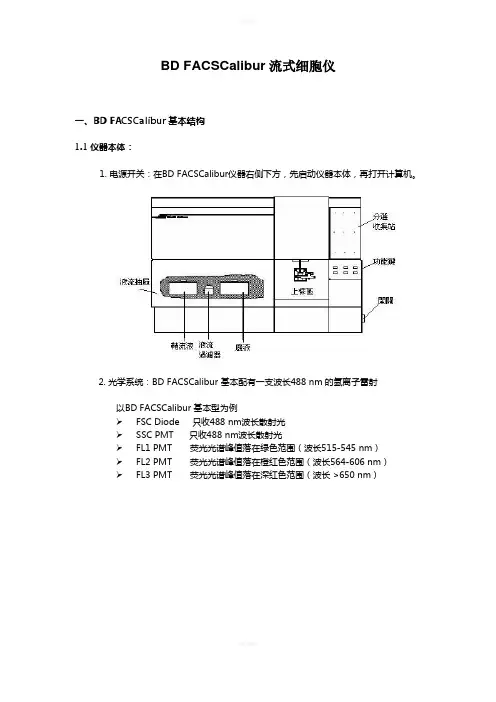
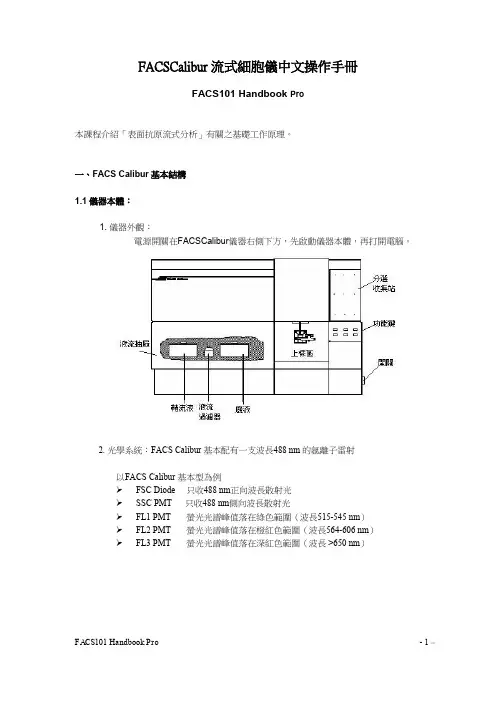
BD FACSCalibur流式细胞仪一、BD FACSCalibur基本结构1.1仪器本体:1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564-606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长 >650 nm)3. 仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键。
流速控制:LO:样品流速:12 l /minMED:样品流速:35 l /minHI: 样品流速:60 l /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室。
(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态。
4. 储液箱抽屉:在主机左下方之储液箱抽屉。
可向前拉开,内含鞘流液筒、废液筒、鞘液过滤器Sheath Filter,及空气滤网 Air filter。
请注意气路减压阀VENT TOGGLE之位置。
•鞘液筒:位于抽屉左侧,容积4升。
装八分满鞘液筒,仪器可以运行大约 3小时。
筒上装有液面感应器,鞘液用完时,仪器软件上会有显示。
鞘液筒盖上有金属环扣,保证鞘液筒密闭。
•废液筒:位于抽屉右侧,容积4升。
筒上装有液面感应器,废液盛满时,仪器软件上会有显示。
目 录第一章流式细胞仪简介 (1)1.1 流式细胞术发展史 (1)1.2 流式细胞仪构造和工作原理 (2)1.2.1 概述 (2)1.2.2 流式细胞仪构造 (2)1.3 流式细胞仪的主要技术指标 (10)第二章 FACSCalibur 的日常操作 (12)2.1 FACSCalibur系统 (12)2.2 FACSCalibur开机程序 (15)2.3 FACSCalibur关机程序 (16)2.4 FACSCalibur的维护与保养 (17)2.4.1 FACSCalibur的每月维护 (17)2.4.2 FACSCalibur的定期维护 (18)2.5 常见故障排除 (20)第三章 FACSComp软件 (22)3.1 FACSComp简介 (22)3.1.1 FACSComp运行条件 (22)3.1.2 FACSComp的文件类型 (23)3.2 FACSComp的功能 (24)3.2.1 光电倍增管(PMT)电压的调节 (24)3.2.2 荧光补偿的调节 (24)3.2.3 灵敏度的测试 (24)3.2.4 时间延迟的校准(对于双激光,配有FL4 PMT) (25)3.2.5 HLA-B27的校准 (25)3.2.6 LeucoCOUNT (25)3.2.7 优化 (25)3.3 FACSComp的运行 (25)3.3.1 CaliBRITE Beads的准备 (25)3.3.2 软件环境的设置 (26)3.3.3 Beads的检测 (26)3.3.4 Optimization (28)第四章 FACStation 数据管理系统 (30)4.1 FACStation 数据管理系统组成 (30)4.2 FACStation文件组成 (31)4.2.1 如何建立文件夹 (31)4.2.2 FACStation文件的类型 (31)4.2.3 如何管理文件 (32)4.3 实用的Macintosh OS X功能 (34)4.3.1 菜单栏 (35)4.3.2 Dock (37)4.3.3 查找窗口 (37)4.3.4 键盘快捷键 (38)4.4 如何设置模版 (39)4.5 实验练习:如何将ModFit LT的别名添加到Dock菜单下 (40)4.6 可选性存储装置 (40)4.6.1 可选性存储装置的基本工作原则 (40)4.6.2 光驱的维护 (41)4.6.3 光盘的维护 (41)第五章 CellQuest Pro软件 (42)5.1 概述 (42)5.1.1 获取(Acquisition) (42)5.1.2 分析(Analysis) (42)5.1.3 从获取到分析(Acquisition Analysis) (42)5.2 工具栏 (42)5.3 CellQuest Pro 的文件 (43)5.3.1 FCS数据文件 (43)5.3.2 实验文件 (44)5.3.3 仪器条件文件 (44)5.3.4 统计文件 (44)5.4 CellQuest Pro 的仪器控制 (44)5.4.1 探测器 (45)5.4.2 放大器 (45)5.4.3 阈值 (46)5.4.4 补偿 (46)5.6.1 质控-运行FACSComp (48)5.6.2 优化 (50)5.6.3 调出储存的由FACSComp 生成的仪器条件 (52)5.6.4 调节FSC/SSC探测器(电压)及FSC阈值 (53)5.6.5 设置淋巴细胞Region (53)5.6.6 调节FL1、FL2、FL3的探测器(电压) (53)5.6.7 调节荧光补偿 (55)5.7 实验练习:3色/4色预获取 (55)5.7.1 设置Acquisition & Storage 窗口 (56)5.7.2 设置Parameter Description (57)5.7.3 编辑Reagent Panel (58)5.8 实验练习:数据获取 (59)5.9 储存、恢复仪器设置 (60)5.9.1 储存仪器设置 (60)5.9.2 恢复仪器设置 (60)5.10 储存实验模板文件 (60)5.11 练习:数据分析 (60)5.11.1 画Region (61)5.11.2 限定象限marker (61)5.11.3 分析四色 (63)5.11.4 批分析其余数据 (63)5.11.5 分析数据 (64)5.11.6 将分析文件以模板形式保存 (64)5.11.7 创建文具簿(stationery pad) (64)5.11.8 将统计改为电子表格 (65)5.12 Regions 和Gating(画门) (65)5.12.1 设置Region (65)5.12.2 改变Region (65)5.12.3 用Region 统计来分析数据 (66)5.12.4 门 (66)5.12.5 多色门 (66)5.12.6 组合门 (67)5.12.7 在直方图上使用组合门分析 (68)收集系统6.1.2 分选模式 (70)6.2 分选窗口 (71)6.2.1 Sort Setup (71)6.2.2 Sort Counters (72)6.3 准备收集管 (72)6.4 分选 (73)6.4.1 清洗分选管线 (73)6.4.2 准备 (73)6.4.3 收集分选前数据 (74)6.4.4 分选条件设置 (74)6.4.5 分选目的细胞 (74)6.4.6 清洗分选管路 (75)6.4.7 浓缩样本 (76)6.5 检验分选纯度 (76)6.6 分选问题讨论 (77)6.7 FACSCalibur无菌分选 (79)6.8 分选细胞浓缩系统 (80)6.8.1 系统简介 (80)6.8.2 细胞培养基嵌入物和滤膜的制备 (81)6.8.3 确定气压参数 (82)6.8.4 如何用细胞浓缩系统进行分选 (82)6.8.5 分选浓缩细胞 (84)6.8.6 从分选管路中回收细胞 (84)6.8.7 回收细胞做进一步分析 (85)6.8.8 清洗分选管路 (85)6.8.9 清洗浓缩器 (85)第七章 DNA分析 (87)7.1 概述 (87)7.2 细胞周期 (87)7.3 DNA检测的常用术语 (87)7.3.1 Coefficient of Variation(CV):变异系数 (87)7.4.1 分辨率(CV) (88)7.4.2 线性度 (88)7.4.3 碎片 (88)7.4.4 细胞双粘体 (89)7.5 DNA质量控制(DNA QC Particles) (89)7.5.1 样本制备 (89)7.5.2 上机检测 (89)7.5.3 常见错误排除 (90)7.6 用CellQuest Pro软件获取DNA 数据 (91)7.6.1 样本制备 (91)7.6.2 用CellQuest Pro软件上机获取数据 (92)7.6.3 质量控制 (95)7.7 用ModFit 软件分析DNA数据 (95)7.7.1 运用ModFit 进行自动分析 (96)7.7.2 运用ModFit 进行手动分析 (96)7.7.3 运用ModFIT进行同步化分析 (98)7.7.4 运用ModFIT 进行增殖分析 (98)第八章 HLA-B27分析 (99)8.1 检测HLA-B27的意义 (99)8.2 HLA-B27的检测方法 (99)8.2.1 传统方法 (99)8.2.2 流式细胞术 (100)8.2.3 试剂盒介绍 (100)8.2.4 实验原理 (100)8.2.5 样本的收集和准备 (101)8.2.6 流式检测 (102)8.3 质量控制 (110)附录1:组织相容性抗原和疾病的关系 (111)附录2:强直性脊柱炎——一个常见但易被忽略的疾病 (112)第九章 MultiSET软件 (113)9.1 简介 (113)软件内容9.4.1 MultiSET界面功能分区 (116)9.4.2 MultiSET命令菜单 (116)9.4.3 MultiSET实验报告 (117)9.4.4 MultiSET运行程序 (117)9.5 利用Multiset软件的Tools和Preferences (126)9.6 Control Panels (绝对计数质控) (128)9.7 MultiSET画门及Attractor方案 (128)9.8 注意事项及常见问题处理 (129)第十章练习题 (135)10.1 补偿 (135)10.2 流式简介 (135)10.3 CellQuest 获取与分析 (136)10.4 分选 (139)第一章流式细胞仪简介1.1 流式细胞术发展史纵观历史,几乎没有哪一门科学技术象流式细胞术这样凝结了众多不同学术背景、不同科研领域的科学家的心血。
流式细胞仪的使用程序------血液病实验诊断中心一.开机程序1.检查稳压器电源,打开电源,稳定5分钟。
2.打开储液箱,倒掉废液, 并在废液桶中加入400ml漂白水原液。
打开压力阀,取出鞘液桶,将鞘液桶加至4/5满(一般可用三蒸水,做分选必须用PBS或FACSFlow),合上压力阀。
确实盖紧桶盖,检查所有管路是否妥善安置。
3.将FACSCalibur开关打开,此时仪器功能控制钮的显示应是STANDBY,预热5-10分钟。
排出过滤器内的气泡。
4.如果需要打印,打开打印机电源。
5.打开电脑,等待屏幕显示出标准的苹果标志。
6.执行仪器PRIME功能一次,以排除Flow cell中的气泡。
7.分析样品时,先用FACAFlow 或PBS进行HIGH RUN约2分钟。
。
做过分选后,每次开机后需冲洗管道:向分选装置上装上两个50ml离心管,不接通浓缩系统,摁下右下角白色按钮开始冲洗。
待自动停止后接通浓缩装置,同上法冲洗一次。
二.预设获取模式文件(Acquisition Template Files)1.从苹果标志中选择CELLQuest见一个新视窗,可利用此视窗编辑一个获取模式文件。
2.选取屏幕左列绘图工具中的Dot plot,绘出一个或多个Dot Plots(点图)。
从Dot Plot对话框中选取Acquisition作为图形资料来源,并确定适当的x轴和y轴参数。
3.选取屏幕左列绘图工具中的Histogram,同上法可绘出Histogram(直方图)。
4.将此视窗命名后储存于FACStation G3\BD Applications \CELLQuest Folder \EXP文件夹中,下次进行相同实验时可直接调用。
. 本计算机中已设定两个模式文件:ACQ和EXP,储存于FACStation G3\BD Applications \CELLQuest \EXP文件夹中,ACQ用于细胞DNA检测,EXP用于细胞表面标志分析。
流式细胞仪操作规程一、开机程序1、检查稳压器电源,打开电源,稳定 5 分钟。
2、打开储液箱,倒掉废液, 并在废液桶中加入 400ml 漂白水原液。
打开压力阀,取出鞘液桶,将鞘液桶加至 4/5 满(一般可用超纯水,特殊情况需要用PBS),合上压力阀。
确实盖紧桶盖,检查所有管路是否妥善安置。
3、将 FACSCalibur 开关打开,此时仪器功能控制钮的显示应是 STANDBY,预热 5-10 分钟。
排出过滤器内的气泡。
4、如果需要打印,打开打印机电源。
5、打开电脑,等待屏幕显示出标准的苹果标志。
6、执行仪器 PRIME 功能一次,以排除 Flow cell 中的气泡。
7、分析样品时,先用 FACAFlow 或 PBS 进行 HIGH RUN 约 2 分钟,以去除可能的管路残片。
二.预设获取模式文件(Acquisition Template Files)1、从苹果标志中选择 CELLQuest,建一个新视窗,可利用此视窗编辑一个获取模式文件。
2、选取屏幕左列绘图工具中的 Dot plot,绘出一个或多个 Dot Plots(点图)。
从 Dot Plot 对话框中选取 Acquisition 作为图形资料来源,并确定适当的 x 轴和 y 轴参数。
3、选取屏幕左列绘图工具中的 Histogram,同上法可绘出 Histogram(直方图)。
4、将此视窗命名后储存于 FACStation G3\BD Applications \CELLQuest Folder\EXP 文件夹中(也可以自己取名,但每个实验人员只能建立一个文件夹),下次进行相同实验时可直接调用。
三.用 CELLQuest 进行仪器的设定和调整1、从苹果画面中选取 CELLQuest,进入 CELLQuest 后在 File 指令栏中打开合适的获取模式文件。
2、从屏幕上方 Acquire 指令栏中,选取 Connect to Cytometer(快捷键:+B)进行电脑和仪器的连机。