第四章 手性药物的制备技术
- 格式:ppt
- 大小:2.40 MB
- 文档页数:81





第三节利用前手性原料制备手性药物-、不对称合成的定义和发展(一)不对称合成Morrison和Mosher的将不对称合成定义为“一个反应, 底物分子中的非手性单元在反应剂作用下以不等量地生成立体异构产物的途径转化为手性单元。
也就是说不对称合成是这样一个过程,它将潜手性单元转化为手性单元,并产生不等量的立体异构产物。
”不对称合成分为对映体选择合成和非对映异构体选择合成两类。
对映体选择合成指潜手性底物在反应中有选择的生成一种对映体;非对映异构体选择性合成指手性底物在生成一个新的不对称中心时,选择性生成一种非对映异构体。
R -CH -CH 2+ R 1COOH例如潜手性烯桂和手性烯炷的环氧化反应: 由此可见:在不对称合成反应中,底物和反应剂结合 形成非对映过渡态,两个反应物中至少有一个手性中 心以便在反应位点上诱导不对称性。
通常不对称性是 在官能团点位上由三面体碳转化为四面体碳时产生的, 这些官能团包括拨基、烯胺、烯醇、亚胺或碳■碳不饱 和双键。
手蛙傕化剂■R'COjll+ RTOOH不对称合成的目标不仅是得到光学活性化合物,而且要达到高度的非对映选择性。
因此,一个成功的不对称合成反应的标准是:(1)具有高的对映体过量;;;;;;(2)手性试剂易于制备并能循环使用;:!(3)可以制备R和S两种构型的目标产物;(4)最好是催化型的合成反应。
(二)不对称合成的发展20世纪60年代以前,手性非均相催化反应是不对称合成研究的主流。
60年代后期发现了均相催化剂三苯麟氯化错(Rh(PPh3)3Cl) ,1971 年,Kagan和Dang发明了含有手性二麟DIOP的不对称催化氢化催化剂, DIOP-Rh⑴配合物催化a-(酰胺)丙烯酸及其酯的不对称催化氢化反应,生成相应的氨基酸衍生物,对映体过量高达80%,由此带来了不对称催化领域的突破性进展。
30年来,许多研究结果表明含有手性取代基的二麟类化合物在有机过渡金属催化的反应中是最有效的多功能配体,已在氢化、环氧化、环丙烷化、烯桂异构化、氢氧化和双烯加成等几十种反应中取得成功,其中DIOP、BINAP等手性二麟配体催化某些反应, 立体选择性达到或接近100%oPPh2PP%("-DKJPH3C ctiy/_\ph2p PPh? Ph* pPh2 (R) - PROPHOS ⑴ 5>CHIRAPHOSH3e{RRASKEWPHOS (凡&-CH1RAPH0S(RR)-NORPHOS(R&卜PYRPHOS(55)-8PPM水溶性手性麟配体的过渡金属配合物解决了均相催化剂不易貞原与回q攵的问题。

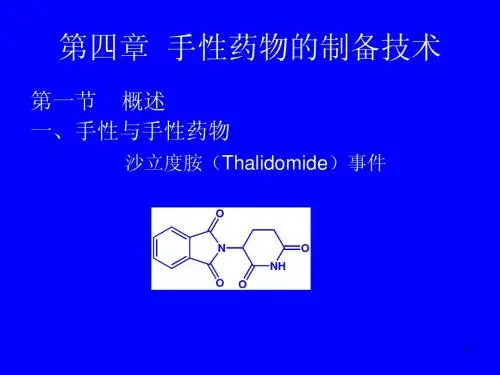
第四章手性制药技术4.1 概述4.1.1 手性及其标记1、手性手性(chirality)是用来表达化合物分子结构不对称性的术语,是指一个实物与其镜中的影像不能重合的性质,正如我们的左、右手互为镜像却永远不能重合。
如果化合物的实物和其镜像不能重合,则这个分子具有手性,就是手性分子。
反之,实物和镜像能重合,此物质是非手性的,无旋光性。
表示分子的立体结构关系可用透视式和费歇尔投影式(图4-1)。
透视式用实楔和虚楔,实楔代表指向纸前,虚楔代表指向纸后。
费歇尔的投影规则是:(1)把手性C原子置于纸面,用横竖两线交点代表C原子;(2)投影时竖线上的取代基在纸面的下方,横线的取代基在纸面的上方;(3)习惯上把含C原子的基团放在竖线方向,并把“最大”的取代基(编号最小的基团)放在上端。
COOH镜面费歇尔投影式透视式HOCOOHCH3HCCOOH3图4-1 乳酸的透视式(左)和费歇尔投影式(右)具有药理活性的手性化合物就是手性药物。
目前临床使用的药物相当一部分具有手性,其药理作用是通过与酶、核酸等手性大分子进行严格的手性匹配,产生分子识别而实现的。
为了使药物对人体内的各种酶、核酸有识别和选择性,就要选择与之匹配的药物的立体结构。
2、手性的种类手性化合物根据其不对称元素的不同,又有四面体中心手性、轴手性、平面手性和螺旋手性之分,它们的构型的定义方法也根据不对称元素的不同而各有不同。
(1)四面体中心手性绝大部分手性化合物是四面体中心手性的,当一个原子上连接的四个原子或基团(包括孤对电子)不同时,这个原子就是中心手心原子。
假设中心手性原子C上连接有四个不同基团x、y、z、w,其中x > y > z > w,如果从C到w的方向看,x→y→z 是顺时针方向,则这个碳的构型被定义为R;否则,就定义为S。
C x zRC xS(2) 轴手性对于四个基团围绕一根轴排列在平面之外的体系,当每对基团不同时,有可能是不对称的,这样的体系称之为轴手性体系。


第四章手性制药技术
4.1 概述
4.2 化学法制备手性药物
4.3 生物酶法制备手性药物
1
4.1 概述
(一)基本概念
(二)手性化合物的标记
(三)手性药物的纯度表征
(四)手性药物的构型与活性
2
CHFClBr分子
R S
侧时叫苏式。
赤式苏式
4.2 化学法制备手性药物
化学法制备手性药物的方法(一)拆分法(二)不对称合成
1)直接结晶拆分法2)化学拆分法
3)柱色谱法
4)动力学拆分法1)手性源法
2)手性辅助剂法
3)手性试剂法
4)不对称催化合成法5)双不对称诱导法
26
4.3生物酶法制备手性药物
生物酶法制备手性药物的优势
1)反应条件温和;
2)催化效率高;
3)专一性强;
4)涉及的反应广泛;
5)底物的结构多样;
6)无毒可降解,环境友好。
49
思考题
4-1 手性药物单一对映体的制备方法有哪几种?分析它们的优缺点及使用范围。
4-2 化学拆分外消旋药物有几种方法?分别举例加以阐述。
4-3 不对称化学合成在手性药物制备中的原理及其应用。
4-4 举例叙述生物酶法制备手性药物的原理及其应用。
50。

