各种还原剂的还原能力
- 格式:pdf
- 大小:29.78 KB
- 文档页数:1
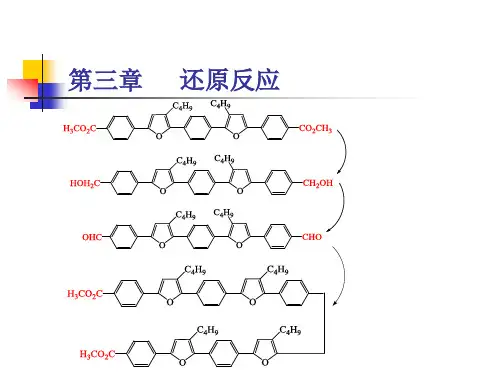

常见氧化剂和还原剂及氧化还原反应的规律一、理清氧化还原反应概念及其关系1、氧化性和还原性(1)氧化性:物质中元素的原子或离子得到电子表现出来的性质,得电子能力越强,其氧化性越强,表现在反应中是化合价有降低趋势的一种表现能力(2)还原性:物质中元素的原子或离子失去电子表现出来的性质,失电子能力越强,其还原性越强,表现在反应中是化合价有升高趋势的一种表现能力2、氧化还原反应概念之间的联系口诀:升.(化合价升高)失.(失电子)氧.(被氧化,发生氧化反应)还.(作还原剂,本身具有还原性) 降.(化合价降低)得.(得电子)还.(被还原,发生还原反应)氧.(作氧化剂,本身具有氧化性) 3、中学化学常见的氧化剂和还原剂(1)常见的氧化剂①活泼性较强的非金属单质:如Cl2、O2②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3③过氧化物:如Na2O2、H2O2④其他:如HClO、漂白粉、MnO2(2)常见的还原剂①活泼性较强的金属单质:如Al、Fe、Zn②某些非金属单质:如H2、S、C等③含有较低价态元素的化合物:如CO、SO2④其他:如浓盐酸、NH3【即学即练1】1、判断正误(正确的打“√”,错误的打“×”)(1)氧化剂得电子被氧化为还原产物()(2)非金属单质在反应中只作氧化剂()(3)在氧化还原反应中,金属单质作反应物时一定是还原剂()(4)还原剂失去电子具有氧化性()(5)碘化氢中碘为最低价,碘化氢只具有还原性()(6)阳离子只能得电子被还原,阴离子只能失电子被氧化()二、氧化性、还原性强弱的判断方法1、根据氧化还原反应方程式来判断氧化还原反应发生规律可用如下式子表示规律氧化性:氧化剂>氧化产物还原性:还原剂>还原产物特点:比什么性,找什么剂,产物之性小于剂【即学即练2】1、现有下列几个离子反应,下列有关性质的比较正确的是()①Cr2O2-7+14H++6Cl-===2Cr3++3Cl2↑+7H2O②2Fe2++Cl2===2Fe3++2Cl-③2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+A.氧化性:Cr2O2-7>Cl2>Fe3+>SO2-4B.氧化性:Fe3+>SO2-4>Cl2>Cr2O2-7C.还原性:SO2<Fe2+<Cl-<Cr3+D.还原性:Cl->Cr3+>Fe2+>SO22、根据反应式:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是()A.Br-、Fe2+、I-B.I-、Fe2+、Br-C.Br-、I-、Fe2+D.Fe2+、I-、Br-3、已知反应:①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2===2FeCl3,③I2+SO2+2H2O===H2SO4+2HI。
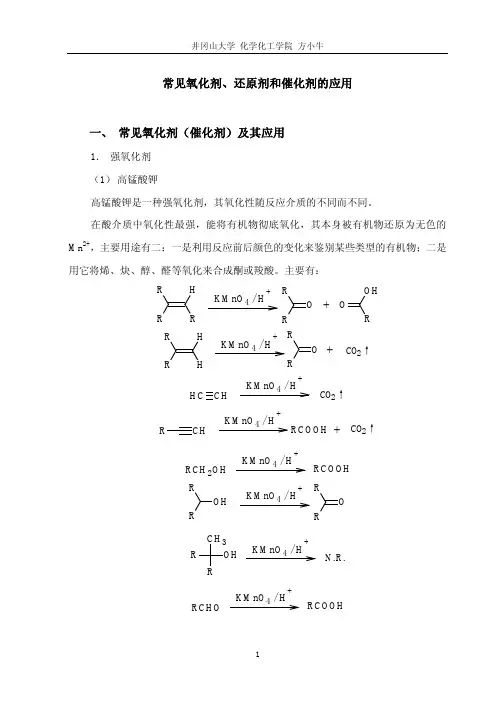
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。

纺织常用还原剂随着纺织工业的发展,还原剂在纺织过程中起着重要作用。
纺织常用还原剂是指在纺织工艺中用于还原染料、去除染料残留或改变纤维物质性质的化学物质。
本文将介绍几种常用的纺织还原剂及其应用。
一、硫酸亚铁硫酸亚铁是一种常用的还原剂,具有良好的还原性能。
它可以将染料还原为无色或不溶于水的物质,从而实现染料的去除或改变颜色的目的。
硫酸亚铁还可用于纺织品的漂白和脱色过程。
在染色过程中,硫酸亚铁可以与染料发生化学反应,使染料变成可溶于水的物质,从而实现染色的目的。
二、硫代硫酸钠硫代硫酸钠是一种常用的还原剂,具有较强的还原能力。
它可以将染料还原为无色或不溶于水的物质,从而实现染料的去除或改变颜色的目的。
硫代硫酸钠还可用于纺织品的漂白和脱色过程。
在染色过程中,硫代硫酸钠可以与染料发生化学反应,使染料变成可溶于水的物质,从而实现染色的目的。
三、亚硫酸钠亚硫酸钠是一种常用的还原剂,具有较强的还原能力。
它可以将染料还原为无色或不溶于水的物质,从而实现染料的去除或改变颜色的目的。
亚硫酸钠还可用于纺织品的漂白和脱色过程。
在染色过程中,亚硫酸钠可以与染料发生化学反应,使染料变成可溶于水的物质,从而实现染色的目的。
四、氢氧化钠氢氧化钠是一种常用的还原剂,具有较强的还原能力。
它可以将染料还原为无色或不溶于水的物质,从而实现染料的去除或改变颜色的目的。
氢氧化钠还可用于纺织品的漂白和脱色过程。
在染色过程中,氢氧化钠可以与染料发生化学反应,使染料变成可溶于水的物质,从而实现染色的目的。
五、硫酸硫酸是一种常用的还原剂,具有较强的还原能力。
它可以将染料还原为无色或不溶于水的物质,从而实现染料的去除或改变颜色的目的。
硫酸还可用于纺织品的漂白和脱色过程。
在染色过程中,硫酸可以与染料发生化学反应,使染料变成可溶于水的物质,从而实现染色的目的。
六、亚硫酸氢钠亚硫酸氢钠是一种常用的还原剂,具有较强的还原能力。
它可以将染料还原为无色或不溶于水的物质,从而实现染料的去除或改变颜色的目的。


常用蛋白还原剂1.DTT中文名称为二硫苏糖醇(Dithiothreitol,简称为DTT),是苏糖醇的C-1及C-4位羟基置换成巯基的化合物。
在生化反应中用做还原剂,保护蛋白质或酶中的巯基不致氧化而失活。
也常用于还原蛋白质分子中的二硫键等。
DTT是一种小分子有机还原剂,化学式为C4H10O2S2。
其还原状态下为线性分子,被氧化后变为包含二硫键的六元环状结构。
二硫苏糖醇的名字衍生自苏糖(一种四碳单糖)。
DTT的异构体为二硫赤糖醇(DTE),即DTT的C3-差向异构体。
DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
但DTT往往无法还原包埋于蛋白质结构内部(溶剂不可及)的二硫键,这类二硫键的还原常常需要先将蛋白质变性(高温加热或加入变性剂,如6M 盐酸胍、8M 尿素或1% SDS)。
反之,根据DTT存在情况下,二硫键还原速度的不同,可以判断其包埋程度的深浅。
2.β-巯基乙醇英文名称:β-Mercaptoethanol,化学式:HOCH2CH2SH,分子量:78.13,是一种具有特殊臭味的无色透明液体,易燃、易溶于水和醇、醚等多种有机溶剂。
β-巯基乙醇(又称为2-巯基乙醇、1-硫代乙二醇、2-羟基乙硫醇、β-硫醇代乙醇)是一种有机化合物,其化学式为HOCH2CH2SH,英文通用缩写为ME或β-ME。
它兼具乙二醇(HOCH2CH2OH)和乙二硫醇(HSCH2CH2SH)的官能团,为挥发性液体,具有较强烈的刺激性气味。
β-ME通常用于二硫键的还原,可以作为生物学实验中的抗氧化剂。
它被广泛使用的原因是它的羟基使它能够溶解于水中,并且降低它的挥发性。
由于具有较低的蒸汽压,它的难闻的情况比起恶臭的硫醇要好得多。
2-巯基乙醇可以打开蛋白质中存在的二硫键:cysS-Scys+2HOCH2CH2SH→2cysSH+ HOCH2CH2S-SCH2CH2OH,二硫键被打开后可以使蛋白质的四级或三级结构被破坏。


《金属纳米颗粒制备中的还原剂与修饰剂》总结一:金属纳米材料具有表面效应(比表面积大,表面原子多,表面原子可与其他原子结合稳定下来,使材料化学活性提高。
)和量子尺寸效应,因而有不同于体相材料的光学、电磁学、化学特性。
目前制备方法为液相合成(操作简便、成本低、产量高、颗粒单分散性好)。
——以金属盐或金属化合物为原料将其还原得到金属原子后聚集成金属纳米粒子。
而金属纳米粒子比表面积大、物化活性高、易氧化、易团聚,所以需要引入修饰剂来控制形貌、稳定或分散纳米颗粒。
液相还原法按照溶剂不同可分为有机溶剂合成法(结晶性好、单分散性好、形貌易控、不能直接用于生物体系、环境不友好)和水溶液合成法(水溶性、制备方法简单环保、成本低、颗粒大小不均一)。
按照还原手段不同可分为化学试剂还原法、辐射还原法、电化学还原法。
二:化学试剂还原法中常用的还原剂及其还原机理还原能力不同:1)强还原剂(硼氢化物、水合肼、氢气、四丁基硼氢化物),还原能力强、反应速率快、纳米颗粒多为球形或类球形、尺寸小。
2)弱还原剂(柠檬酸钠、酒石酸钾、胺类化合物、葡萄糖、抗坏血酸、次亚磷酸钠、亚磷酸钠、醇类化合物、醛类化合物、双氧水、DMF),反应体系一般需要加热。
例如多元羟基类化合物可做溶剂和还原剂,通过控制反应条件可制备多种形貌的材料。
柠檬酸钠、抗坏血酸做还原剂的同时可做保护剂。
(一)无机类还原剂1,硼氢化物(硼氢化钠钾、硼氢化四丁基铵TBAB),硼氢化钠化学性质活波与水反应放出氢气,与金属盐反应时所需浓度低。
2,氢化铝锂,还原性极强,应用不及硼氢化钠。
3,水合肼N2H4·H2O,应用广泛。
在碱性介质中为强还原剂。
4,双氧水。
5,有机金属化合物,二茂铁还原制备银纳米线。
6,氢气,(可以合成相当稳定无保护的可进一步修饰的银纳米颗粒。
),控制反应时间可以得到相当大尺寸跨度的纳米颗粒,进一步处理如过滤离心可以得到尺寸分布窄的颗粒。
7,次亚磷酸盐,弱还原剂,因为容易与氧气反应所以一般用3-4倍。

还原能力测定抗氧化剂(还原剂)是通过自身的还原作用,给出电子而清除自由基的,还原能力越强,抗氧化性越强。
实验中,样品的抗氧化剂能使铁氰化钾的三价铁还原成二价铁(亚铁氰化钾),二价铁(亚铁氰化钾)进一步在和三氯化铁的反应下生成在700nm处有最大吸光度的普鲁士蓝(Fe4[Fe(CN)6]3 ),因此测定700nm处的高低可以间接反映抗氧化剂的还原能力大小,吸光度越大,还原能力越强。
配置不同浓度的样品溶液梯度(如50、100、250、500、1000PPm,过小时吸光度数值小,误差较大),依次加入一定量磷酸缓冲液(保证溶液反应的PH环境,如2.5ml pH=6.6)、一定量和浓度的铁氰化钾溶液(与样品中的抗氧化剂反应生成二价铁,如2.5ml 1% m/v ),混合均匀,将该体系置于一定温度下(比如:50℃,不能过高,不然会使物质失活,适当加热可以保证反应程度和时间)恒温水浴放置一定时间(如30min,以反应充分为宜),取出加入三氯乙酸溶液(铁氰化钾溶液为黄色,猜测用三氯乙酸与反应剩余铁氰化钾生成沉淀,离心除去,排除对吸光度数值的影响),混匀,置于离心机内3000转离心10min(离心机使用时一定保证对侧样品等重),取一定量上清液于另一试管中,加入二次水和三氯化铁溶液(3K4Fe(CN)6 + 4FeCl3 → Fe4[Fe(CN)6]3 + 12KCl ,黄色晶体亚铁氰化钾放进三氯化铁的溶液中,产生颜色很鲜艳的蓝色沉淀,即普鲁士蓝,测定吸光度时要摇匀,且普鲁士蓝耐热性在140℃,光照下较稳定,不用避光),混匀后用分光光度计在700nm下测定溶液吸光度。
设置:实验组(A i):样品+缓冲液+铁氰化钾+三氯乙酸+DW+三氯化铁对照组 (Ao):DW+缓冲液+铁氰化钾+三氯乙酸+DW+三氯化铁空白组 (A j): 样品+缓冲液+DW(加入量=铁氰化钾+三氯乙酸+DW+三氯化铁的总量)注:实验组全加,对照组去除样品的影响,空白组去除反应试剂的影响(如铁氰化钾+三氯乙酸+DW+三氯化铁),所有反应溶液均需要在要求的环境下反应,及每个组都需加缓冲液。

铋还原能力-概述说明以及解释1.引言1.1 概述铋是一种化学元素,属于周期表中的重金属。
它具有良好的还原能力,是很多化学反应和工业过程中的重要参与者。
铋的还原能力在多个方面发挥着重要作用,影响着其在不同环境和化学反应中的应用。
铋是一种具有特殊性质的元素,其化学性质独特而复杂。
它在常温下为固体,具有明亮的银白色。
铋是一种相对稳定的元素,但在一些条件下它也能发生化学反应,表现出还原能力。
铋的还原能力指的是其参与还原反应的能力。
还原反应是一种化学反应,其中原本具有较高价态的物质通过失去电子而转化为较低价态。
铋通过与其他物质发生反应并接受电子,从而使其发生还原反应。
这种还原能力对于很多重要的化学过程和工业应用具有重要作用。
影响铋还原能力的因素有很多,其中两个最主要的因素是温度和pH 值。
温度的变化可以影响反应速率和反应平衡,从而影响铋的还原能力。
较高的温度通常会促使铋更容易发生还原反应。
pH值则与反应环境的酸碱性有关,不同的pH值会影响铋的电子交换速率,从而影响其还原能力。
总之,铋的还原能力是一个值得研究和关注的领域。
了解铋的化学性质和其还原能力对于开发其在化学工程、材料科学和环境科学等领域的应用具有重要意义。
进一步研究铋的还原能力,探索其在不同条件下的反应行为和性质变化,将有助于深入理解铋的化学特性,并为相关领域的应用提供更多可能性。
1.2文章结构文章结构部分的内容可以如下所示:文章结构本文分为以下几个部分来深入探讨铋的还原能力。
首先,引言部分将为读者提供一个总体的概述,介绍铋还原能力研究的背景和意义。
接下来,在正文部分中,将详细讨论铋的还原能力及其相关化学性质和还原反应。
此外,文章还将探讨影响铋还原能力的因素,包括温度和pH值。
最后,在结论部分,将总结铋的还原能力的重要性,并提出对其进一步研究的展望。
通过这样的文章结构,读者可以逐步了解铋的还原能力的背景和基本概念,然后深入了解铋的化学性质和还原反应机制,并了解温度和pH值等因素对铋还原能力的影响。

常见的氧化剂与还原剂、氧化还原规律知识导航知识精讲一、常见的氧化剂与还原剂常见的氧化剂常见的还原剂活泼的非金属单质Cl2、O2活泼的金属单质Al、Fe、Zn 高价态化合物浓硫酸、KMnO4、HNO3、FeCl3低价态化合物CO、SO2、KI 过氧化物Na2O2、H2O2某些非金属单质C、H2、S 资料卡片——常见的氧化剂/还原剂及其一般对应产物氧化剂对应还原产物还原剂对应氧化产物Fe3+Fe2+Fe2+Fe3+浓H2SO4SO2SO2、SO32-、S2O32-SO42-H2O2H2O H2O2O2 KMnO4(H+)、MnO2Mn2+H2C2O4CO2 K2Cr2O7(H+)Cr3+I-I2 O2O2-CO、C CO2浓HNO3NO2S2-、H2S S稀HNO3NO NH3N2、NO Cl2、ClO-、ClO3-Cl-二、氧化性、还原性的理解氧化性指物质得电子的性质(或能力);还原性指物质失电子的性质(或能力)。
注意三、氧化性、还原性强弱的判断1.根据氧化还原反应原理来判断(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.根据元素的活动性顺序来判断(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;非金属单质的氧化性越强,其阴离子的还原性越弱。
3. 根据反应条件的难易来判断反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
举个例子物质的氧化性或还原性的强弱取决于物质得、失电子的难易程度,与得失电子数目的多少无关。
例如:Na - e-===Na+,Al - 3e-===Al3+,Al失去电子的数目较多,但Na比Al的还原性比铝强。
【答案】KMnO 4>MnO 2>O 24. 根据元素被氧化/还原的程度来判断某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
氧化性:F2>Cl2>Br2>Fe3+>I2>SO2>S高锰酸钾溶液的酸性越强,氧化性越强。
还原性:S2->SO3(2-)>I->Fe2+>Br->Cl->F-推荐:常见的氧化剂有:1活泼的金属单质,如X2(卤素)、O2、O3、S等2高价金属阳离子,如Cu²+,Fe3+等或H+3高价过较高价含氧化合物,如MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4(浓)、KClO3、HClO等4过氧化物,如Na2O2、H2O2等常见的还原剂有1活泼或较活泼的的金属,如K,Na,Mg,Al,Zn,Fe等2低价金属阳离子,如Fe3+,Sn2+等3非金属阳离子,如Cl-,B-,I-,S2-等4某些非金属单质,如H2,C,Si在含可变化合价的化合物中,具有中间价态元素的物质(单质或化合物)即可作氧化剂,又可做还原剂,例如Cl2,H2O2,Fe2+,H2SO3等既具有氧化性,又具有还原性。
(1)根据化学方程式判断氧化性、还原性的强弱氧化性:氧化剂>氧化产物还原性:还原剂>还原产物(2)根据物质活动顺序判断氧化性、还原性的强弱1金属活动顺序K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au原子还原性逐渐减弱,对应阳离子氧化性逐渐增强。
(金属还原性与溶液有关,如在稀盐酸,稀硫酸中Al比Cu活泼,但在浓硝酸中Cu比Al 活泼2非金属活动顺序F Cl Br I S原子(或单质)氧化性逐渐减弱,对应阳离子还原性逐渐增强。
(3)根据反应条件判断氧化性和还原性的强弱当不同的氧化剂作用于同一还原剂时,若氧化剂价态相同,可根据反应条件的高、低来进行判断,例如:16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2(1)4HCl+MnO2=(加热)MnCl2+2H2O+Cl2(2)4HCl+O2=(CuCl2,500摄氏度)2H2O+2Cl2(3)上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl2,而氧化剂分别是KMnO4,MnO2,O2,(1)式中KMnO4常温下就可以把浓盐酸中的氯离子氧化成氯原子,(2)式中MnO2需要在加热条件下才能完成,(3)式中O2不仅需要加热,而且还需要CuCl2做催化剂才能完成,由此可以得出氧化性KMnO4>MnO2>O2(4)根据氧化产物的价态高低判断当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱,如:2Fe+3Cl=(加热)2FeCl3Fe+S=(加热)FS可以判断氧化性:Cl2>S.(5)根据元素周期表判断氧化性,还原性的强弱1同主族元素(从上到下)F Cl Br I非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强。
硼氢化钠还原后产物硼氢化钠是一种典型的还原剂,它具有令人惊叹的还原能力,可以将大量的有机或无机物质还原成其他类型。
在物理术语中,这种还原反应被称为“硼氢化”。
硼氢化钠具有多种用途。
它可以用于将有机物质还原成非有机物质,例如有机酸可以被还原成非有机溶液。
此外,它还可以用于分离混合溶液中的不同成分,例如高分子物质和低分子物质。
另外,它还可以用于去除某些化学物质的污染物,如铅、镉和鲁氏气体。
在实际应用中,硼氢化钠有多种不同的还原后产物。
硼氢化钠可以将有机酸还原成无机酸,例如乙酸可以还原成硫酸。
此外,它还可以将有机溶剂还原成无机溶剂,例如碳酸钠可以还原成氢氧化钠和氢氧化钾。
在有机分子还原方面,硼氢化钠可以将醛和酮还原成醇,例如甲醛可以还原成乙醇。
硼氢化钠也可以将烯烃还原成烃,例如丙烯可以还原成乙烷。
另外,它还可以将亚硝酸盐还原成还原硝酸盐,例如硝酸钠可以还原成亚硝酸钠。
硼氢化钠还可以用于去除污染物。
这种反应称为硼脱除反应。
在这种反应中,硼氢化钠可以将离子性污染物转变成无机离子,例如氧化铅可以转变成其无机形式中的Pb2+离子。
硼氢化钠还可以用于制备高分子材料及其他各种物质。
这种反应称为硼聚合反应。
在这种反应中,硼氢化钠可以将低分子物质聚合成更大的分子,这些分子组成的物质可以用于制备多种高分子材料。
硼氢化钠还可以用于溶解有机物质。
这种反应称为硼溶解反应。
在这种反应中,硼氢化钠可以将有机物质溶解,并能够分子中解离出不同的成分,例如糖可以分离为糖类和碳水化合物。
综上所述,硼氢化钠是一种能够生成多种不同还原后产物的特殊还原剂。
它能够用于将有机物质还原成无机物质,用于分离混合物,去除有机分子中的污染物,制备高分子材料以及溶解有机物质。
因此,硼氢化钠是目前还原剂中最常用的一种,并且在多种应用领域中发挥着重要作用。
物质的还原性实验测试物质的还原反应能力还原性是物质化学中一个非常重要的概念,它指的是物质在反应中失去氧化态,同时还原剂被氧化的过程。
在化学实验中,我们可以通过一系列实验来测试物质的还原性,以验证它们的还原反应能力。
一种常用的测试物质还原性的实验是金银水试验。
金银水是一种强氧化剂,由硝酸银和氢氧化钠混合而成。
通常,我们可以用一些常见的物质来测试金银水的还原性能。
首先,我们可以选择一小块铜片作为实验对象。
将铜片放入金银水中,观察是否有明显的反应发生。
如果金银水起到还原剂的作用,铜片将被氧化,产生黑色的氧化铜。
接着,我们可以测试铁片的还原性。
将铁片放入金银水中,观察是否有气泡产生,并且铁片变成了铁离子溶液中的二价铁离子。
这是因为金银水中的硝酸银能够将铁还原成了二价离子。
类似地,我们还可以测试锌片的还原性。
金银水和锌发生反应时会产生大量气体。
这是因为锌具有很强的还原性,可以迅速还原金银水中的银离子。
此外,我们可以使用金银水来检测某些物质的还原性。
例如,某些还原糖可以被金银水还原成糖醇,从而产生反应。
这是因为金银水中的硝酸银能够将还原糖中的醛基还原为醇基。
物质的还原性测试还可以通过其他方法进行。
例如,可以使用过氧化氢溶液来测试物质的还原性。
过氧化氢是一种常见的氧化剂,可以与物质发生氧化还原反应。
通过观察反应的颜色变化、气泡产生或是气体逸出等现象,我们可以测试出物质的还原反应能力。
此外,物质的还原性测试还可以借助于电化学方法。
例如,可以使用电化学电路中的电极来测试物质的还原性。
通过测量还原剂的氧化态和还原态之间的电位差,我们可以评估物质的还原性能。
总的来说,物质的还原性是一种重要的物质特性,通过一系列实验我们可以测试物质的还原反应能力。
金银水试验、过氧化氢反应和电化学方法都是常用的测试手段。
通过这些实验的结果,我们可以更好地了解物质的化学性质,进一步应用于实际生活和科学研究中。
水处理剂之强力还原剂
简介
主要成分:甲脒亚磺酸【(英文名称:Formamidinesulfinicacid),中文别名:二氧化硫脲(英文名称:thioureadioxide,TDO,分子式(NH2)2CSO2)】及其衍生物、氨基亚氨基磺酸等,是保险粉(连二亚硫酸钠)的替代产品。
物化性质
自身还原电位较低,具有优异的还原能力。
热稳定性好、储存运输方便。
用途
在印染工业广泛用于羊毛漂白、还原染料与硫化染料的染色、分散染料染色用的还原洗净剂、拔染脱色剂。
在有机合成中用来还原酮、醌、硝基、偶氮、氧化偶氮、次联氨基化合物以及有机硫化物等。
二氧化硫脲还原脱色剂、照相乳胶的敏化剂、聚乙烯稳定剂、稀有金属的分离萃取剂。
在丙烯腈聚合与蒸发过程中,加入二氧公硫脲,能使聚丙烯腈纺丝后的拉力增强,色泽得到改善。
氧化剂与还原剂总结以氧化剂与还原剂为题,我们来探讨一下这两个化学概念及其在化学反应中的作用。
一、氧化剂氧化剂是指在化学反应中能够氧化其他物质的化合物或元素。
它能够接受被氧化物中的电子,并自身被还原。
氧化剂通常具有较高的氧化态,如高电子亲和性、高电离能和高氧化还原电位。
氧化剂的作用是从被氧化物中获得电子,从而使被氧化物发生氧化反应。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
其中,氧气是最常见的氧化剂,它能够与其他物质发生氧化反应,如与金属形成金属氧化物。
而过氧化氢则能够氧化有机物,起到消毒和漂白的作用。
高锰酸钾是一种强氧化剂,能够氧化许多物质,如硫酸亚铁、二氧化硫等。
氧化剂在许多化学反应中起到重要作用。
例如,在燃烧反应中,氧气是必不可少的氧化剂。
当有机物燃烧时,它会与氧气反应,产生二氧化碳和水,释放出大量的能量。
此外,氧化剂还常用于化学分析和有机合成中。
在化学分析中,氧化剂可以用于测定物质的含量或鉴别物质的性质。
在有机合成中,氧化剂可以将有机物氧化为相应的含氧化合物,如醛、酮等。
二、还原剂还原剂是指在化学反应中能够将其他物质还原的化合物或元素。
它能够提供电子给被还原物,从而自身被氧化。
还原剂通常具有较低的氧化态,如低电子亲和性、低电离能和低氧化还原电位。
还原剂的作用是提供电子给被还原物,从而使被还原物发生还原反应。
常见的还原剂有金属、还原金属、氢气等。
金属具有很强的还原性,例如钠、铝等金属能够与水反应生成氢气,并还原水中的氧为氢气。
还原金属如锌、铁等也具有较强的还原能力,它们可以将二价或三价金属还原为单价金属。
氢气是一种常用的还原剂,它能够与氧气反应生成水,同时释放出大量的能量。
还原剂在化学反应中起到重要作用。
例如,在电化学反应中,还原剂是电子的供应者,它能够将电子传递给另一个物质,从而使该物质发生还原反应。
在电池中,还原剂是正极的材料,它能够将电子输送到负极,从而产生电流。
此外,还原剂还常用于金属提取和有机合成中。
还原剂还原能力
还原剂是指能够将物质从氧化状态还原为较低氧化态的化合物的物质。
还原能力是指还原剂具有将其他物质还原的能力的度量。
通常情况下,还原剂是通过捐赠电子给其他物质来实现还原的过程。
还原能力的强弱取决于还原剂的电子捐赠能力和反应条件,例如温度、pH值等。
一般来说,具有较强还原能力的还原剂能够捐赠更多的电子,从而使被还原物质的氧化态降低。
常见的还原剂有金属、非金属和有机物等。
金属还原剂如铁、锌、铝等常用于电化学反应中。
非金属还原剂如硫酸亚铁、亚硫酸钠等常用于化学反应中。
有机物还原剂如氢气、亚硫酸氢钠等常用于有机合成反应中。
还原剂在化学和生物化学领域中具有广泛的应用,例如用于还原金属离子、降解有机污染物、还原蛋白质和酶等。