NO1重要的氧化剂和还原剂.
- 格式:docx
- 大小:15.02 KB
- 文档页数:3
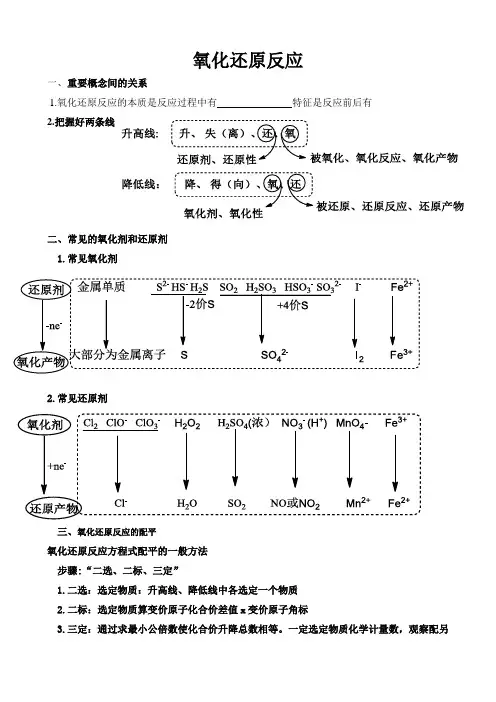
氧化还原反应一、重要概念间的关系1.氧化还原反应的本质是反应过程中有特征是反应前后有2.把握好两条线二、常见的氧化剂和还原剂1.常见氧化剂2.常见还原剂三、氧化还原反应的配平氧化还原反应方程式配平的一般方法步骤:“二选、二标、三定”1.二选:选定物质:升高线、降低线中各选定一个物质2.二标:选定物质算变价原子化合价差值x变价原子角标3.三定:通过求最小公倍数使化合价升降总数相等。
一定选定物质化学计量数,观察配另外两个物质计量数;二定电荷守恒,三定其他物质和化学计量数。
四、氧化还原反应的规律1、氧化性:氧化剂>氧化产物还原性:还原剂>还原产物2、归中规律高变高,低变低题组一1.高炉炼铁中存在反应: 。
下列说法正确的是( )A.CO是氧化剂B.CO是还原剂C.CO既是氧化剂又是还原剂D.CO既不是氧化剂又不是还原剂2.工业上制备硝酸的一个重要反应为: 下列有关该反应的说法正确的是( )A.O2是还原剂B.NH3是氧化剂C.O2失去电子D.NH3发生氧化反应3.下列变化过程中,加入氧化剂才能实现的是( )A.Cl2→C l-B.I-→I2C.SO2→SO32-D.CuO→Cu4.下列物质应用时,起还原作用的是( )A明矾作净水剂B.甘油作护肤保湿剂C.漂粉精作消毒剂D.铁粉作食品袋内的脱氧剂5.下列实验中的颜色变化,与氧化还原反应无关的是( )7.下列变化中,气体被还原的是( )A.二氧化碳使Na2O2固体变白B.氯气使KBr溶液变黄C.乙烯使Br2的四氯化碳溶液褪色D.氨气使AlCl,溶液产生白色沉淀8.下列判断不正确的是[双选]( )A. 向CuSO4溶液中加入铁粉,有红色固体析出。
说明:Fe2的氧化性强于Cu2+的氧化性B. 1 mol甲烷完全燃烧转移的电子数为8NAD.2Na2O2+2H2O= 4NaOH+O2↑与Cl2+H2O= HCl+HCIO,均为水作还原剂的氧化还原反应反应2Cu2++ 5I-= 2Cul↓+ I3-,中的氧化剂为10.Fe2O3与FeS2混和物在缺氧条件下焙烧生成Fe3O4和SO2理论上完全反应消耗的n(FeS2): n(Fe2O3)=题组二1.[16全国11,28]写出“煅烧“偏钒酸铵(NH4VO3)得到V2O5的化学方程式:2.[15全国1,27]写出Mg2B2O5·H2O与硫酸反应制备硼酸(H3BO3)的化学方程式:3.[15全国I ,27]以硼酸(H3BO3)和金属镁为原料在加热条件下可制备单质硼,用化学方程式表示制备过程:4.[15全国1I,37] 单质Cl2与湿润的Na2CO3反应可制备Cl2O,其化学方程式为:5.[17全国I ,27]钛铁矿(FeTiO3)用盐酸“酸浸"后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式:6.[18全国II, 28] SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式7.(18全国1,27] Na2S2O5可用作食品的抗氧化剂,可用碘标准液滴定。


第七讲常见氧化剂和还原剂及氧化还原反应的规律【教学目标】1、掌握氧化还原能力的大小比较2、掌握氧化还原反应中的一些重要规律【知识梳理】一、理清氧化还原反应概念及其关系1、氧化性和还原性(1)氧化性:物质中元素的原子或离子得到电子表现出来的性质,得电子能力越强,其氧化性越强,表现在反应中是化合价有降低趋势的一种表现能力(2)还原性:物质中元素的原子或离子失去电子表现出来的性质,失电子能力越强,其还原性越强,表现在反应中是化合价有升高趋势的一种表现能力【微点拨】氧化剂、氧化产物具有氧化性;还原剂、还原产物具有还原性2、氧化还原反应概念之间的联系口诀:升.(化合价升高)失.(失电子)氧.(被氧化,发生氧化反应)还.(作还原剂,本身具有还原性) 降.(化合价降低)得.(得电子)还.(被还原,发生还原反应)氧.(作氧化剂,本身具有氧化性)概括为:升失氧、降得还,剂性一致、其他相反3、中学化学常见的氧化剂和还原剂(1)常见的氧化剂①活泼性较强的非金属单质:如Cl2、O2②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3③过氧化物:如Na2O2、H2O2④其他:如HClO、漂白粉、MnO2(2)常见的还原剂①活泼性较强的金属单质:如Al、Fe、Zn②某些非金属单质:如H2、S、C等③含有较低价态元素的化合物:如CO、SO2④其他:如浓盐酸、NH3【即学即练1】1、判断正误(正确的打“√”,错误的打“×”)(1)氧化剂得电子被氧化为还原产物()(2)非金属单质在反应中只作氧化剂()(3)在氧化还原反应中,金属单质作反应物时一定是还原剂()(4)还原剂失去电子具有氧化性()(5)碘化氢中碘为最低价,碘化氢只具有还原性()(6)阳离子只能得电子被还原,阴离子只能失电子被氧化()二、氧化性、还原性强弱的判断方法1、根据氧化还原反应方程式来判断氧化还原反应发生规律可用如下式子表示规律氧化性:氧化剂>氧化产物还原性:还原剂>还原产物特点:比什么性,找什么剂,产物之性小于剂1、现有下列几个离子反应,下列有关性质的比较正确的是()①Cr2O2-7+14H++6Cl-===2Cr3++3Cl2↑+7H2O②2Fe2++Cl2===2Fe3++2Cl-③2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+A.氧化性:Cr2O2-7>Cl2>Fe3+>SO2-4B.氧化性:Fe3+>SO2-4>Cl2>Cr2O2-7C.还原性:SO2<Fe2+<Cl-<Cr3+D.还原性:Cl->Cr3+>Fe2+>SO22、根据反应式:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是()A.Br-、Fe2+、I-B.I-、Fe2+、Br-C.Br-、I-、Fe2+D.Fe2+、I-、Br-3、已知反应:①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2===2FeCl3,③I2+SO2+2H2O===H2SO4+2HI。

第2课时氧化剂和还原剂A组1.在泡沫橡胶的制造中,要利用下列反应放出氧气:2H2O22H2O+O2↑,其中H2O2()A.是氧化剂B.是还原剂C.既是氧化剂,又是还原剂D.既不是氧化剂,又不是还原剂解析:在反应的过程中,H2O2中的氧元素,化合价既上升又降低,因此H2O2既是氧化剂又是还原剂。
答案:C2.氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O Ca(OH)2+2H2↑,下列说法错误的是()A.CaH2既是氧化剂,又是还原剂B.H2既是氧化产物,又是还原产物C.CaH2是还原剂,H2O是氧化剂D.氧化产物与还原产物的质量比为1∶1解析:此题的关键是确定CaH2中氢元素的化合价为-1价。
然后纵观组成物质的每种元素的化合价变化可知:反应中只有氢元素化合价发生了变化,其余元素化合价均未变化。
而氢元素分布在反应前后的各物质中,此时应先找出未变价的部分。
生成物Ca(OH)2中的氢为+1价,这两个氢原子肯定来自H2O分子,而2H2O中共4个+1价的氢原子,明显H2O中另一部分氢必定得电子被还原。
然后再从生成物H2中分析,H2分子是由CaH2中-1价氢元素被氧化和一部分H2O中+1价的氢元素被还原而生成的。
故可得到结论:题中B选项是对产物的解析,C选项是对反应物的解析,都是正确的,从而可知A选项不正确,D选项是对产物的定量解析,也正确,故答案为A。
答案:A3.下列微粒既有氧化性又有还原性的是()A.Cu2+B.SO2C.AlD.○+17◝2◞◝8◞◝8◞解析:+4价属于硫元素的中间价态,既有氧化性又有还原性。
答案:B4()A.Na+、Ba2+、Cl-、S O42-B.Ca2+、HC O3-、Cl-、K+C.Mn O4-、K+、I-、H+D.H+、Cl-、Na+、C O32-解析:A中Ba2+与S O42-由于发生复分解反应生成沉淀不能大量共存;B中离子能大量共存;C中Mn O4-具有强氧化性,而I-具有强还原性,两种离子在酸性溶液中会发生氧化还原反应;D中H+与C O32-会发生复分解反应生成CO2和H2O而不能大量共存。

化学常用还原剂知识点整理归纳化学常用还原剂知识点整理归纳还原剂是指在化学反应中能够接受氧化剂的电子,从而被自身氧化的化学物质。
常见的还原剂有金属、非金属、有机化合物和无机化合物等。
在实际应用中,常常需要选择合适的还原剂来完成化学反应。
以下是对常用还原剂的知识点整理和归纳。
1. 羟基自由基(•OH)羟基自由基具有强氧化性和还原性,在化学反应中普遍用作还原剂、氧化剂和主要自由基反应物之一。
一般情况下,羟基自由基通过氢氧离子产生,其氧化性主要来源于其自身含氧性羰基和过渡金属催化作用的情况下。
羟基自由基的应用场合非常广泛,例如常见的硝基苯还原反应、甲醛氧化反应、过去氧化反应等都要求使用它。
此外,在大气化学中,羟基自由基也是大气中自由基化学反应的主要参与者之一。
2. 亚硫酸氢盐(NaHSO3)亚硫酸氢盐的电荷中心在硫上,其中硫的氧化态在+4和+5之间变化。
亚硫酸氢盐的还原性较强,它一般被用作食品添加剂、抗坏血酸等化学品的还原剂,并可用于医药、卡片纸生产等多个领域。
亚硫酸氢盐在还原过程中能够接受氧化剂,自身被氧化为硫酸盐,因此在银盐摄影和漂白等行业中常被用来作为还原剂。
同时它还经常用于鱼行业,可以使新鲜的鱼维持略呈弱酸性环境最佳状态。
3. 亚硝酸盐(NaNO2)亚硝酸盐在水溶液中能够形成亚硝酸根离子NO2-,并通过与氢离子互换产生亚硝酸HNO2。
亚硝酸盐比亚硫酸氢盐还原性略弱,但在酸性条件下可被加强。
亚硝酸盐在化学反应中被广泛应用,例如:在食品工业中,亚硝酸盐可以使食物维持鲜艳的红色,保持香肠、熟肉等的色泽和香味;在纺织工业中,亚硝酸盐可以作为还原剂,还可以用于处理文化遗产等。
4. 氢气(H2)氢气具有非常强的还原性,它能够与氧气形成水,可以作为高效的还原剂。
氢气还具有比较好的可控性,可以通过改变反应条件来控制化学反应的速率。
同时在许多领域中,人类利用水来产生氢气以用做燃料。
氢气在化学反应过程中具有非常重要的应用,例如有机合成法、烷基化反应等。

压轴题01 氧化还原反应的概念及规律氧化还原反应是中学化学的重点内容,也是高考的必考点,近年来新高考地区考查氧化还原反应相关的题显著增加,常以生产、生活实际为载体,以选择题型考查氧化还原反应基本概念和相关规律,主要的考查点有氧化剂、还原剂、氧化还原反应等概念的判断,电子转移,氧化性、还原性强弱的判断,化学方程式配平,依据电子守恒的计算等。
1.相关概念及其关系2.相关规律及其应用一、选择题:本题共20小题,每小题只有一个选项符合题意。
1.关于反应322222NH OH 4Fe N O O =4Fe 4H H ++++↑+++,下列说法正确的是A .生成21molN O ,转移4mol 电子B .2NH OH 是还原产物C .2NH OH 既是氧化剂又是还原剂D .若设计成原电池,2Fe +为负极产物2.某MOFs 多孔材料孔径大小和形状恰好将24N O “固定”,能高选择性吸附2NO 。
废气中的2NO 被吸附后,经处理能全部转化为3HNO 。
原理示意图如下。
已知:2242NO (g)N O (g) ΔH<0下列说法不正确...的是 A .温度升高时不利于2NO 吸附 B .多孔材料“固定”24N O ,促进2242NO (g)N O (g)平衡正向移动C .转化为3HNO 的反应是242232N O +O +2H O=4HNOD .每获得30.4molHNO 时,转移电子的数目为226.0210⨯3.科学家发现某些生物酶体系可以促进+H 和-e 的转移(如a 、b 和c),能将海洋中的2NO -转化为2N 进入大气层,反应过程如图所示。
下列说法正确的是A .过程Ⅰ中2NO -发生氧化反应 B .a 和b 中转移的-e 数目相等C .过程Ⅰ中参与反应的()4+n(NO):n NH =1:4D .过程Ⅰ→Ⅰ的总反应为-+2422NO +NH =N +2H O ↑4.燃油汽车行驶中会产生CO 、NO 等多种污染物。

氧化还原反应教案(最新6篇)氧化还原反应教案篇一教学准备教学目标知识与技能1、通过分析多个化学反应,是学生认识到有的化学反应中存在着元素化合价的变化,建立氧化还原反应的概念;2、通过实验事实和思考,知道氧化还原反应的实质是电子的转移;3、初步掌握根据化合价的变化和电子转移的观点分析氧化还原反应的方法;过程与方法1、通过提出问题、讨论交流、分组合作,揭示氧化还原反应的实质和特征,培养学生从微观角度准确理解概念的能力。
2通过设计问题情境,由表及里培养学生思维的深刻性,由此及彼培养思维的逻辑性。
情感、态度和价值观了解氧化还原反应在工农业生产、日常生活中的应用,认识并理解化学对提高人类生活质量、促进社会发展的重要作用。
教学重难点教学重点:用化合价升降的观点理解氧化还原反应。
教学难点:理解氧化还原反应的实质是电子转移。
教学过程1、基本反应类型化合反应分解反应置换反应复分解反应一、化学反应的类型A+B=AB AB=A+BA+BC=AC+BAB+CD=AD+CB2、氧化反应和还原反应按下列要求各举一个符合条件的化学反应,并写出化学方程式Fe2O3 + 3CO = 2Fe + 3CO2的反应属于哪种基本反应类型?氢气还原氧化铜是氧化反应还是还原反应?初中时所学的氧化还原反应讨论结果同一个化学反应用不同的分类方法去分析,结果也不相同。
四种基本反映类型并不能包括所有的反应。
初中所学的氧化还原反应比较片面,不能真实地反映氧化还原反应的本质。
对于这一反应,谁得到氧,谁失去氧,得到氧与失去氧的数目关系怎样。
哪种元素化合价升高?哪种元素化合价降低?升高的化合价降低的化合价关系怎样?二、氧化还原反应1、什么叫氧化还原反应?2、特征:反应前后化合价发生变化(也是判断依据)一种物质被氧化,同时另一种物质被还原的反应[练习] 用化合价升降的观点去判断下面的反应,哪些是氧化还原反应?关键:1)正确判断各反应物、生成物各元素的化合价及其变化;2)凡是有化合价升降的化学反应都是氧化还原反应在氧化还原反应中,为什么会发生化合价的变化呢?[小结] 从NaCl的形成看化合价升降的根本原因是电子的得失,即氧化还原反应的实质是有电子的得失。


高考一轮复习之氧化还原专题讲解【考点解读】氧化还原不会单独作为一个题目考点进行考查,但是会渗透在高考考查的方方面面。
选择题大部分会运用进行考查,例如:物质的量选择题、电化学选择题、电离水解选择题等,四道大题必定有考查到相关内容,用氧化还原概念分析反应物质更是解决大题的关键。
特别的是,大题中,氧化还原方程式占的分值一般在6-8分,而且几乎都是陌生的方程式,所以掌握陌生的氧化还原方程式的书写十分重要。
【知识讲解】一、概念辨析1.化学反应的分类:2.氧化还原反应:。
(1)氧化剂:(2)还原剂(3)被氧化:(4)被还原(5)氧化产物:(6)还原产物3.规律:氧化剂:得(电子)→降(价降低)→还(还原反应,被还原)→还(还原产物)还原剂:失(电子)→升(价)→氧(,被)→氧()二、常见的氧化剂还原剂常见的氧化剂:KMnO 4,浓H 2SO 4,浓、稀HNO 3,Cl 2,ClO - 等常见的还原剂:H 2、CO 、C 、大多数金属。
三、氧化性和还原性及其强弱的判断方法1、氧化剂的氧化性>氧化产物的氧化性还原剂的还原性>还原产物的还原性则:还原性:H 2>Cu2、(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe 3+外)(2)对于非金属单质氧化性逐渐减弱 还原性逐渐增强 3、从反应条件来比较。
一般来讲,一组反应中,反应条件越简单,对应反应++氧化产物还原产物氧化剂还原剂H 2O Cu CuO H 2例如:K 、Ca 、Na 、Mg 、Al 、Zn 、Fe 、Sn 、Pb 、(H)、Cu 、Hg 、Ag−−−−−−−−−−−−−−−−−−−−−→+2++2+3+2+2++2+3++、、、、、、、、、、K Ca Na Mg Al Zn Fe Cu Fe Ag H −−−−−−−−−−−−−−−−−−−−−−−→22222F 、Cl 、Br 、I 、S 、P 、C 、Si 、H−−−−−−−−−−−−−→2F 、Cl 、Br 、I 、S -----−−−−−−−−−→还原性逐渐减弱 氧化性逐渐增强物的氧化性或还原性越强.从反应条件可以看出氧化剂的氧化能力:KMnO 4>MnO 2>O 24、根据氧化产物的价态高低判断:当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。

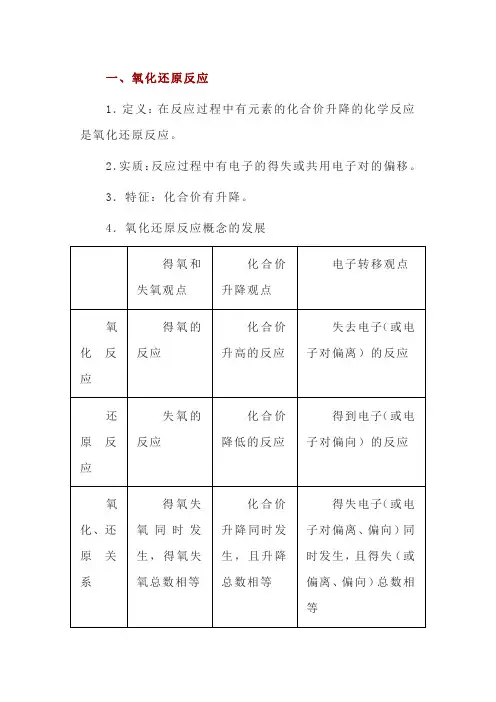
一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展二、氧化还原反应与四种基本反应类型1.四种基本类型的反应2.氧化还原反应与四种基本类型反应的关系①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!解释:四、氧化还原反应电子转移表示方法双线桥法:(1)两条桥线从反应物指向生成物,且对准同种元素;(2)要标明“得”“失”电子,且数目要相等;(3)箭头不代表电子转移的方向。
单线桥法:(1)一条桥线表示不同元素原子得失电子的情况;(2)不需标明“得”“失”电子,只标明电子转移的数目;(3)箭头表示电子转移的方向;(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)(2)元素处于高价时的含氧酸(硝酸、浓硫酸)(3)元素处于高价时的盐:(KClO3、KMnO4、FeCl3)(4)过氧化物(H2O2、Na2O2)(5)其它(HClO)常见的还原剂(处于低价态的元素的单质或化合物):(1)活泼的金属单质:K、Na、Mg等;(2)非金属单质:H2、C、Si等;(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
氧化还原反应一、氧化还原反应的基本概念及相互关系1.氧化还原反应的实质,特征是;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2.基本概念3.氧化还原反应的表示方法(1)双线桥法(2)单线桥法1.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
2.常见的氧化剂和还原剂重要的氧化剂一般有以下几类:(1)活泼的非金属单质,如Cl2、Br2、O2等。
(2)处于高化合价时的氧化物,含氧酸,盐,如MnO2等。
(3) 过氧化物,如Na2O2、H2O2等。
重要的还原剂一般有以下几类:(1)活泼的金属单质,如Na、Al、Zn、Fe等。
(2)某些非金属单质,如H2、C、Si等。
(3)处于低化合价时的氧化物,酸、盐二、氧化性、还原性及其强弱比较1.根据氧化还原反应的方向氧化性:氧化剂>氧化产物,氧化剂>还原剂;还原性:还原剂>还原产物,还原剂>氧化剂。
12.根据元素的化合价3.根据金属活动性顺序表4.根据非金属活动性顺序来判断5.根据元素周期表6.根据反应的难易程度7.根据电化学原理判断a.根据原电池原理判断:两种不同的金属构成原电池的两极。
b.根据电解池原理判断:8.其他条件一般溶液的酸性越强或温度越高,则氧化剂的氧化性和还原剂的还原性就越强,反之则越弱。
三、氧化还原反应规律1.价态变化规律(1)归中规律:(2)歧化规律:2.优先规律3.得失电子守恒规律四、氧化还原反应的计算:1、主要类型:求氧化剂与还原剂或氧化产物与还原产物的物质的量之比或质量之比通过计算确定元素的化合价或氧化产物、还原产物的组成根据氧化还原反应进行的先后次序进行计算2、基本方法:电子守恒法:公式例:250mL 1mol/L的K2Cr2O7能将500mL 3mol/LFeSO4恰好完全氧化成Fe3+,求重铬酸钾还原产物中铬元素的价态注:对于多步连续进行的氧化还原反应,只要中间各步反应过程电子没有损耗,就可直接找出起始反应物和最终产物,略去中间产物,建立二者之间的守恒关系。
N0.1重要的氧化剂和还原剂
教学目标: 1 •从得失电子的角度加深对氧化还原反应及氧化剂、还原剂的理解,了解氧化产物和还原产物。
2•掌握氧化剂、还原剂中所含元素化合价的情况,掌握用单线桥表示氧化还原反应的电子转移情况。
3•掌握重要的氧化剂、还原剂的常见反应;学会比较氧化剂、还原剂的相对强弱。 教学过程:
一、用单线桥表示下列反应,并指明氧化剂与还原剂 (1) Fe + H2SO4 = FeS04 + H2f ⑵ 2H2 + 02 = 2H2O (3) CI2 + H20 = HCl + HC10 二、 分析并配平下列氧化还原反应,指出氧化剂,还原剂,氧化产物,还原产物,标出电子转移的方向和数目 (1) _KCI0 3 + _HCI ——_ KCI + _CI2 + ____________ (2) CI2 + ~NH3 N2 + HCI (3) _NO + _NH3 ——_N2 +_H20 三、 读课本24页,请归纳:— — 氧化还原反应的实质是 ________________________________________________________ , 判断氧化还原反应的依据
四、讲解图3—2,并 常见的氧化剂 得电子化合价降低 举例 (1)活泼非金属单质,如: Cl2、Br2、O2
等 0得e 1
Cl Cl
(2)元素处于高价的氧化物时,如 C02、 MnO2 等
(3)元素处于最高化合价时的酸,如 H2SO4、HN03等
(4)元素处于最高化合价时的盐,如 KMnO4、KCI0 3、FeCl3 等
2FeCl3 + Cu= 2FeCl2 + CuCl2
(5)过氧化物如 Na2O2、H2O2等 常见的还原剂 失电子化合价升高 举例
(1)活泼金属单质,如: Na、Al、Zn、 Fe等
0 失 3e 3 Al Al
(2)某些非金属单质,如:H2、C、Si等
(3)元素处于低化合价时的氧化物,如 CO、 SO2等
(4)元素处于低化合价时的酸,如 HCI、
H2S等
(5 )元素处于低化合价时的盐,如
Na2S03 FeCl2等
2FeCl2 + Cl 2 = 2FeCl3
【评价】 1 •下列下画线的元素是被氧化还是被还原,要加氧化剂还是加还原剂才能实现
(1) Kl_—J2 ⑵ SO2— S03
HgCI 2—
⑷ NO2—H N03
(5) FeCl3—FeCl2
2. IBr + H 20 = HBr + HI0 是氧化还原反应吗?为什么?
3. S02与H2S可发生下列反应,S02 + 2H2S = 3S + 2H 20,当生成硫48 g时,氧化产物比还原产物多还是少 多
少克?
N0.2氧化还原反应:
1:判断下列那些为氧化还原反应,并说出理由
IBr + H 20 = HBr + HI0 K0H+CI 2=KCI +KCI0+H 20 NaH+H 20 =Na0H+H 2
Ca02+H20 =Ca(OH) 2 +H 2O2
5C2H5OH +2KMnO 4+3H2SO4 — 5CH3CHO +K 2SO4+2MnSO 4 +8H2O
氧化还原反应的实质是 _______________________________________________________ 判断氧化还原反应的依据是 __________________________________________ 。 小结:氧化还原反应发生规律和有关概念。
?两者相差 练习:练习1中是氧化还原反应的,请指岀氧化剂,还原剂,氧化产物,还原产物,标岀电子转移的方向和数目。 2、物质氧化性和还原性相对强弱的判断方法
(1)根据金属活动顺序进行判断 K,Ca,Na,Mg,AI,Zn,Sn,Fe,Pb,(H ),Hg,Pt,Au K ,Ca2 ,Na ,Mg2 , Al3 ,Zn2 ,Sn2 ,Fe2 , Pb,(H ),Hg2 ,Ag
金属的活动性逐渐减弱(还原性逐渐减弱) 氧化性逐渐增强
[说明]一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱; 反之,越不
活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。女口 Cu2++2e
TCu远比Na+ +e宀Na容易,即氧化性 CLJ+>NSI,还原性Na> Cu (2) 根据非金属活动顺序进行判断
F ,O,CI ,Br,l ,S F ,CI ,Br ,I ,S2 氧化性逐渐减弱 还原性逐渐增强
(3) 根据氧化还原反应的发生规律判断 氧化还原反应发生规律可用如下式子表示:
化合价升高、失电子、变成
氧化剂+还原剂 还原产物+氧化产物 化合价降低、得电子、变成 氧化性:反应物中的强氧化剂,生成物中的弱氧化剂 还原性:反应物中的强还原剂,生成物中的弱述原剂 例:已知① 2FeCl3+2KI=2FeCl2+12+2KCI ② 2FeCL+Cl2=2FeCl3
由①知,氧化性Fe3+>l 2,由②知,氧化性 Cl2>Fd+,综合①②结论,可知氧化性 Cl2>Fd+
(4)根据氧化还原反应发生反应条件的不同进行判断 女口: MnQ十 4HCl(浓) MnC2+C1 f +2H0 2KMn0 4十 16HCl(浓)=2MnCL+5Cl2 f +8HO 后者比前者容易(不需要加热),可判断氧化性KMn04>Mn0 (5) 根据被氧化或被还原的程度的不同进行判断 Cu 十 Cl2=CuCl2
2Cu+S =CuzS
C1 2可把Cu氧化到Cu(+2价),而S只能把Cu氧化到Cu(+1价),这说明氧化性 Cl2>S (6) 根据元素周期表判断 ① 对同一周期金属而言,从左到右其金属活泼性依次减弱。如 Na、Mg A1金属性依次减弱,其还原性也依次减弱。 ② 对同主族的金属和非金属可按上述方法分析。 3、氧化还原反应的基本规律
1)表现性质规律
当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有原性,处于中间价态时既具有氧化 性又具有还原姓。如:浓 HSO的S只具有氧化性,HS中的S只具有还原性,单质 S既具有氧化性又具有还原性。 (2)性质强弱规律 在氧化还原反应中,强氧化剂 +强还原剂=弱氧化剂(氧化产物)+弱还原剂(还原产物),即氧化剂的氧化性比氧化产物强, 还原剂的还原性比还原产物强。 如由反应2FeCb+2KI=2FeC3+2KCI+l 2可知,FeCl 3的氧化性比I 2强,KI的还原性比FeCk强。 一般来说,含有同种元素不同价态的物质,价态越高氧化性越强 (氯的含氧酸除外),价态越低还原性越强。如氧化性: 浓 HSO,S02(H2SC3),S;还原性:H2S>S>SQ 在金属活动性顺序表中,从左到右单质的还原性逐渐减弱,阳离子 (铁指Fe2+)的氧化性逐渐增强。 (3) 反应先后规律 同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质; 同一还原剂与含多种 氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。如:将 CI2通人物质的量浓度相同的 NaBr 和Nal的混合液中,C12首先与Nal反应;将过量铁粉加入到物质的量浓度相同的 Fe2+、和Cf的混合溶液中,Fe首先与Fe3+ 反应。FeBr2中通入 CI2 ,HBr和HSO中通入Ch (4) 价态归中规律 含不同价态同种元素的物质问发生氧化还原反应时, 该元素价态的变化一定遵循 “高价+低价一中间价”,而不会岀现交 错现象。 KCIO3+6HCI =KCI+3CI 2+3HO 而不是 KCIQ+2HCI=KCI+3Cl2+3H2O (5)歧化反应规律
发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。其反应规律是:所得产物中,该元 素一部分价态升高,一部分价态降低,即“中间价T高价 +低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生 歧化反应,如: CI 2十 2NaOH=NaC十 NaCI0十 H0 练习: 1.已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为 CI-vFe2+vH2Ox|-vSO2。则下 列反应不能发生的是( )。 A. 2Fe3+ + SO2 +2 H2O = 2F0 + SO42- + 4H + B. I2 + SO2 + 2H2O = H2SO4 + 2HI C. H2O2 + H2SO4 = SO2 +。2 + 2H2O D. 2Fe2+ + |2 = 2Fe3+ + 2I- 2•化合物BrFx与水按物质的量之比3 : 5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。
(1) BrFx 中,x = ____ 0 (2) 该反应的化学方程式是: o
(3) 此反应中的氧化剂和还原剂 —? 氧化剂是 ;还原剂是 。