物质构成的奥秘复习课
- 格式:doc
- 大小:49.00 KB
- 文档页数:4








可编辑修改精选全文完整版课题第四单元物质构成的奥秘课型复习课编写张宏修订张廷国教学目标知识与技能1认识物质的构成的微粒性,理解有关物质构成的微观概念,知道原子构成及各粒子数的等量关系,了解原子结构与元素化学性质的关系,初步认识元素周期表。
2.了解元素符号化学式及其表示的意义,梳理辨析元素、原子、分子物质间的关系。
3.能用化学式表示某些常见物质的组成,把握化合价、化学式之间的相互关系。
4.利用相对原子质量及相对分子质量进行物质组成的简单计算过程与方法通过对所学知识的复习深化,培养学生的逻辑推理思辨计算能力,了解研究化学问题的基本思路与方法。
情感态度与价值观1.通过探究学习,培养学生善于合作,勇于探索、严谨求实的科学态度2.通过合作交流培养合作交流能力,形成良好的学习习惯,培养科学精神教学重点 1.原子的构成,离子的形成,元素符号及化学式2.知识结构的形成与完善教学难点核外电子排布、化合价教学流程设计问题与教学设计学案与导学设计教学问题最佳解决方案创设情景生成问题如图是水分解示意图,你能从中获取哪些信息?(1)组成:水由____________组成;(2)构成:水分子由____________构成,1个水分子由______构成;从知识回顾进入本节内容复习定位提升通过本课的学习,你有哪些收获?通过投影、板书展现这些知识间的关系【板书设计】智能应用1. 构成物质的微粒例1 关于氧气和铁的构成,下列说法正确的是()A. 分别由氧元素、铁元素构成B. 分别由氧分子、铁原子构成C. 分别由氧原子、铁原子构成D. 分别由氧分子、铁分子的构成例2 在一定条件下,分解高锰酸钾、氯酸钾、过氧化氢三种物质,都可以得到氧气。
说明这三种物质中含有A.氧气B.氧分子C.氧元素D. 氧化物2. 微粒的构成例1 在下列微粒中,属于原子的有(用序号填空,下同),属于阳离子的有,属于阴离子的有,属于同种元素的有。
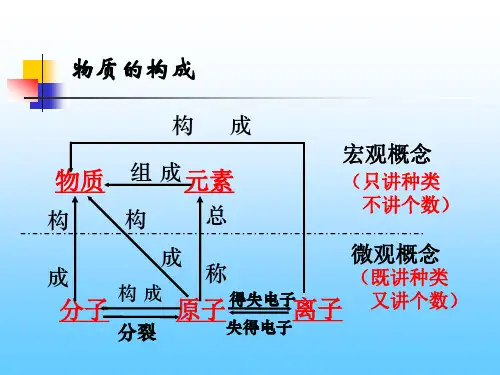
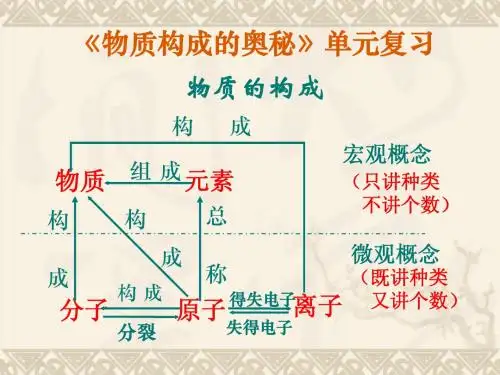
1 2 34 5 6分析:分子、原子、离子是微观概念形成物质时用“构成”表示,元素是宏观概念,形成物质时,用“组成”来表示,故A不正确。
《物质的构成奥秘》复习课【考点归纳】一、物质构成的奥秘分子与原子的关系:元素与原子的关系:原子与离子的关系:二、元素的化合价1.化合价是元素的性质,有正价和负价,其正负是由元素的原子结构决定的。
2.常见元素的化合价:氢、锂、钾、钠、银显+1价,钡、钙、镁、锌显+2价,氧显-2价,铝显+3价等(某些元素可显几种化合价)。
3.在化合物中,元素的正负化合价的代数和为0(单质分子里元素的化合价也为0)。
4.通过原子团或其他有固定化合价的元素,可求出不易确定的元素的化合价。
【问题探究】【例1】:已知六种微粒结构示意图分别为:F(1)A、B、C、D、E、F共表示种元素;(2)表示原子的微粒是(填序号);(3)表示离子的微粒是(填序号)。
审题与思路:元素是具有同相同核电荷数的一类原子的总称。
在题所示的六种微粒中,(A)与(B)核电荷都是+8,(E)与(F)核电荷都是+12,所以这六种微粒结构代表核电荷为+8、+10、+11、+12四种元素。
原子的核电荷数与核外电子总数相等;阳离子的核电荷数比核外电子总数大,阴离子的核外电子总数小,即离子的核电荷数与核外电子总数不相等。
解答:(1)四(2)A、C、F (3)B 、D、E总结:对于微粒结构成示意图的含义,我们要深刻理解,要判断是原子、阳离子还阴离子,主要依据是质子数与核外电子数是否相等。
【例2】:求以下化合物中带点元素的化合价。
K2M.nO4 K2C.r2O7 F.e(OH)3 N.H4N.O3审题与思路:(1)K2MnO4中K、O有固定化合价,故设Mn价为x,则利用化合价代数和为零这一原则,有:(+1)×2+x+(-2)×4=0 解得x=+6 (其中“+”号不能省略!)(2)K2Cr2O7同上,Cr为+6价。
(3)Fe(OH)3中,直接利用OH为-1价可极快速求出Fe为+3价。
(4)NH4NO3中,单独由NH4的+1价,设N的化合价为a,则+1=a+(+1)×4 得:a=-3同理由NO3为-1价,设N的化合价为b,则:-1=b+(-2)×3 得:b=+5总结:元素的化合价在不同的化合物中是不同的,正如我们的身份一样,随环境的改变而改变:我们在父母面前,是子女的身份;在老师是学生的身份;在同学的面前,则以同学的身份出现。
第三单元物质构成的奥秘复习课
一、教学背景分析:
1.学情分析:
本单元学生通过6课时的新课学习,已经初步认识到:物质由元素组成;构成物质的微粒有三种----分子、原子和离子,大多数纯净物是由分子构成的,如氧气、水、二氧化碳等,稀有气体、金属、金刚石等由原子直接构成,氯化钠等物质由离子构成;原子由质子、中子和电子等更微小粒子构成,原子内部有很大的空间,核外电子在原子核分层排布,知道元素的化学性质取决于原子的最外层电子数,知道用原子结构示意图和离子结构示意图来表示原子和离子的结构,知道元素周期表是学习和研究化学的工具等有关物质结构方面的知识。
但由于缺乏总体上加深认识和理解,缺乏通过具体的实例加以运用,才能达到熟练运用的目的。
因此,需要作单元整理、归纳等复习。
2.功能与地位:
本单元所学习的有关物质构成奥秘的知识是初中化学重要的基础知识,是能从本质上理解物质的性质、用途等化学知识的关键。
因此,有必要通过对本单元的复习课使所学习的物质组成与结构方面的知识系统化、理清知识之间的联系,使学生能够较好地学习化学,具有非常重要的地位。
二、教学目标
1.知识与技能
(1)加深对物质组成元素、构成物质的微观粒子(分子、原子和离子)的认识和理解。
(2)进一步认识原子的内部构成及用结构示意图来表示结构,理解原子不显电性和离子带电的原因是粒子的原子核内质子数与核外电子数目的不同。
(3)知道元素的化学性质与原子最外层电子数有密切联系的观念,理解稀有气体原子化学性质极不活泼和金属原子、非金属原子在反应中化学性质活泼是由最外层电子数所决定的。
(4)进一步巩固和熟练书写一些常见的元素符号、知道相对原子质量的概念,能从元素周期表中查找有关元素的信息,用于解决实际的化学问题。
2.过程与方法
(1)通过单元知识的整理复习,学习比较、归纳等复习巩固知识的方法,提高复习效率。
(2)通过与他人的交流,提高自己的表达能力,形成良好的合作学习习惯。
3.情感态度价值观
(1)增进对化学科学的理解,强化用元素观、微粒观统领化学知识的学习的意识和观念。
(2)知道化学学科学习需要在理解的基础上进行必要的记忆、积累,才能更好地学习化学的观念,发展学习化学的兴趣,激发学生的求知欲。
三、教学重难点
1.重点:
(1)单元知识的整理方法,学习将本单元知识通过整理、归纳形成知识网络。
(2)加深对元素、分子、原子、离子、核外电子排布的理解,并能达到熟练掌握。
2.难点:运用知识分析解决化学实际问题能力的培养
四、教学方法:学生展示、讲解、讨论、多媒体辅助等
五、教学准备:ppt课件、课外练习(单元检测题)
六、教学安排:2课时
第一课时:单元知识整理
第二课时:习题课
七、教学过程设计:
第一课时:单元知识整理与归纳
上?
(讲解)(1)构成原子的基本粒子是质子、
中子、电子。
在原子里,核电荷数=质子数=核外电子数
(2)原子核体积小,但质量近似等于原子的质量,所以原子的质量主要集中在原子核上。
即:相对原子质量=质子数+中子数(3)原子结构示意图和离子结构示意图。
5.例命题讲解与分析(例1~例9)交流、评价、听讲、领悟
元素组成物质1.元素
(提问)元素的定义、什么决定元素种类?
元素与原子的区别、元素的分类、地壳中含
量最多的4种元素是哪些?
(讲解)(1)概念:质子数(即核电荷数)相同
的一类原子的总称。
①元素是宏观概念,只讲种类,不讲数目;
②决定元素种类的是核内质子数目。
(2)分类
金属元素(原子的最外层电子数一般少于4
个)
非金属元素(原子最外层电子数一般多于4
个)
稀有气体元素(最外层电子数为8个[He为2
个])
2.元素符号
(听写)一些常见的元素符号。
(提问)元素符号书写、表示的意义。
(讲解)(1)写法:一大二小的原则
(2)意义:
①表示某种元素;②表示这种元素的一个原
子
3.元素周期表
(提问)元素周期律是谁发现的?现行的元
素周期表共的几个周期、族?原子序数等于
什么?
(提问)如右图所示是哪种元素?
从中你能获取的信息有哪些?
(讲解)(1)周期:
①元素周期表共有七个周期
②周期数=原子的核外电子层数
(2)族
①元素周期表共有十八个纵行,16族(其
中第8、9、10纵合为第Ⅷ族)。
②A族的族序数=原子的最外层电子
回答、补充
观看听讲、
领悟
书写、汇报
回答、补充
听讲、领悟、
记录。
回答、补充
听讲、领悟、
记录。
观看、解答、
听讲、订正
通过提问,检查
学生对元素、元
素符号及元素周
期表等知识的掌
握情况。
通过例
题的分析与讲
解,加深对这些
知识的理解,提
高学生应用所学
知识解决实际化
学问题的能力,
培养学生应用知
识分析问题的方
法与策略。
初步
形成关于物质宏
观组成方面的知
识体系。
第二课时:习题课A.讲解作业中典型错题
B.布置作业:“九年级化学(上)第三单元测试卷”。