痰液及下呼吸道分泌物培养简易操作规程
- 格式:doc
- 大小:1.20 MB
- 文档页数:11

痰和呼吸道分泌物标本采集规范一、微生物学【概述】痰标本采集方便,无创伤性,临床应用广泛,对病原学诊断具有重要价值。
痰标本的正确采集、处理是临床细菌检验成功的关键,标本采集与处理的规范化是准确、及时向临床提供重要的感染信息的基础。
目前咳痰标本仍是最常用、最简单的采样方法,必须指导或辅助患者深咳痰,及时送检,并通过镜检筛选合格标本。
损伤性采样技术仅在选择病例(抗生素治疗反应不佳;可疑特殊病原体感染,如寄生虫、痰菌阴性肺结核、混合感染或二重感染等)使用。
【操作方法】1、咳痰标本采集要求患者在清晨用药前留取,因为晨痰量多,且含菌量也多。
留取前刷牙,用清水漱口3次,以除去口腔内大部分杂菌,之后用力咳痰。
咳痰较困难者可用3%~5%氯化钠溶液雾化蒸气吸入进行导痰;对咳嗽乏力或昏迷患者,可用普通吸痰管经鼻腔或口腔吸引下呼吸道分泌物;对不能咳痰的婴幼儿或病重患者,如须采集痰标本做结核杆菌培养,可插胃管抽吸胃液标本送检,也可留取12~24h痰液,经漂浮浓集后检查,以提高结核杆菌检出率。
若做细菌或真菌培养,痰液必须盛于无菌容器内送检。
观察痰量应留取24h痰液,必要时在容器内加入少许防腐剂。
2、咽拭子采样上呼吸道感染可通过咽拭子获取标本。
标本采集前数小时内不得用消毒药物漱口或涂抹病灶局部。
用咽拭子采集标本时应小心、认真、准确,避免触及舌、口腔黏膜和唾液,以防污染。
如咽拭子标本发现致病菌,如肺炎链球菌、流感杆菌、金黄色葡萄球菌、肺炎克雷伯菌等,且数量较多时,提示有该菌所致感染存在。
3、纤维支气管镜抽吸采样以利多卡因做咽喉部局部麻醉后,插入纤维支气管镜(纤支镜),达到肺炎病灶引流支气管内,纤支镜吸引口依次连接标本采集瓶或试管及负压吸引装置,用负压将下呼吸道分泌物经纤支镜吸人标本采集瓶内送检。
气管切开或气管插管患者也可用普通无菌吸痰管直接经人工气道插至大约叶支气管水平,接负压装置将痰液经吸痰管吸入标本采集瓶内。
纤支镜直视下可准确采集病灶部位的分泌物,但插入时纤支镜顶端和内孔常受咽喉部正常菌群污染,所以纤支镜吸引物常规培养结果不能完全代表肺部感染的病原体。
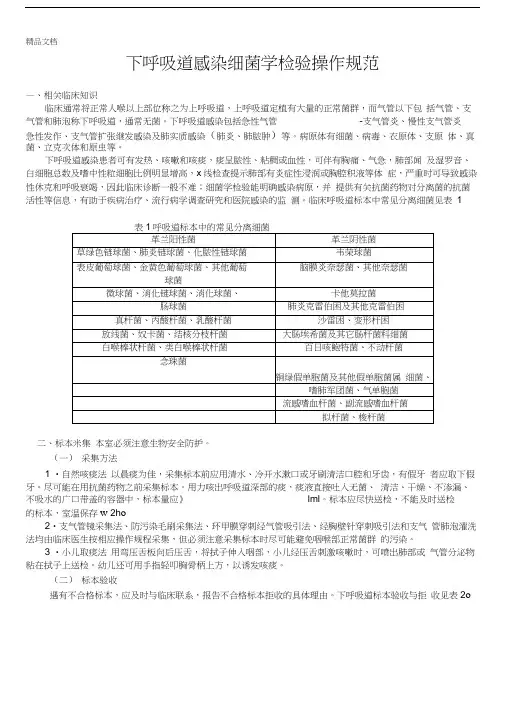
下呼吸道感染细菌学检验操作规范—、相关临床知识临床通常将正常人喉以上部位称之为上呼吸道,上呼吸道定植有大量的正常菌群,而气管以下包括气管、支气管和肺泡称下呼吸道,通常无菌。
下呼吸道感染包括急性气管-支气管炎、慢性支气管炎急性发作、支气管扩张继发感染及肺实质感染(肺炎、肺脓肿)等。
病原体有细菌、病毒、衣原体、支原体、真菌、立克次体和原虫等。
下呼吸道感染患者可有发热、咳嗽和咳痰,痰呈脓性、粘稠或血性,可伴有胸痛、气急,肺部闻及湿罗音、白细胞总数及嗜中性粒细胞比例明显增高,x线检查提示肺部有炎症性浸润或胸腔积液等体症,严重时可导致感染性休克和呼吸衰竭,因此临床诊断一般不难;细菌学检验能明确感染病原,并提供有关抗菌药物对分离菌的抗菌活性等信息,有助于疾病治疗、流行病学调查研究和医院感染的监测。
临床呼吸道标本中常见分离细菌见表1表1呼吸道标本中的常见分离细菌二、标本米集本室必须注意生物安全防护。
(一)采集方法1 •自然咳痰法以晨痰为佳,采集标本前应用清水、冷开水漱口或牙刷清洁口腔和牙齿,有假牙者应取下假牙。
尽可能在用抗菌药物之前采集标本。
用力咳出呼吸道深部的痰,痰液直接吐入无菌、清洁、干燥、不渗漏、不吸水的广口带盖的容器中,标本量应》lml。
标本应尽快送检,不能及时送检的标本,室温保存w 2h o2•支气管镜采集法、防污染毛刷采集法、环甲膜穿刺经气管吸引法、经胸壁针穿刺吸引法和支气管肺泡灌洗法均由临床医生按相应操作规程采集,但必须注意采集标本时尽可能避免咽喉部正常菌群的污染。
3 •小儿取痰法用弯压舌板向后压舌,将拭子伸入咽部,小儿经压舌刺激咳嗽时,可喷出肺部或气管分泌物粘在拭子上送检。
幼儿还可用手指轻叩胸骨柄上方,以诱发咳痰。
(二)标本验收遇有不合格标本,应及时与临床联系,报告不合格标本拒收的具体理由。
下呼吸道标本验收与拒收见表2o三、实验室检查(一)肉眼观察 观察痰液的颜色、粘度、有无血丝和是否呈脓性,如见有颗粒存在,则应注意可能 与放线菌属及奴卡菌属感染有关。

简易吸痰器的使用流程概述简易吸痰器是一种常见的医疗器械,用于清除呼吸道分泌物,帮助呼吸困难或痰液较多的患者顺利呼吸。
本文将介绍简易吸痰器的使用流程,帮助操作人员正确使用吸痰器,确保患者的呼吸畅通。
材料准备在使用简易吸痰器之前,需要准备以下材料: - 简易吸痰器装置 - 吸痰管 - 痰液容器 - 消毒液 - 无菌手套 - 消毒棉球使用步骤1.手部消毒–戴上无菌手套。
–取一块消毒棉球,用消毒液擦拭双手,确保双手彻底消毒。
2.准备吸痰器装置–打开吸痰器包装袋,取出吸痰器装置。
–检查吸痰器装置是否完好无损。
3.连接吸痰管–取出吸痰管,确保吸痰管无损。
–将吸痰管插入吸痰器装置的连接口上。
4.准备痰液容器–取出痰液容器,确保痰液容器干净。
–将痰液容器放置在合适的位置,容器底部留一定空间以放置痰液。
5.开始吸痰–让患者取姿势,一般为坐位或半卧位。
–轻轻握住吸痰器装置,将吸痰管的一端放入患者嘴巴或鼻孔,另一端连接到吸痰器装置上。
–慢慢转动吸痰器装置上的旋钮或按下吸痰器装置上的按钮,吸痰器将会产生负压吸力。
–注意观察痰液的颜色、稠度和量,确保痰液被顺利吸出。
6.清理器械–吸痰完成后,将吸痰管从吸痰器装置上拔出。
–将吸痰管放入痰液容器中,确保吸痰管完全覆盖在痰液中。
–拆开吸痰器装置,取出痰液容器,密封并正确处理。
7.清洁与消毒–将使用过的吸痰器装置和痰液容器进行清洗,使用消毒液进行消毒,确保无菌。
–将清洁消毒后的吸痰器装置和痰液容器存放在干净的地方,以备下次使用。
注意事项•操作人员在操作吸痰器时,应尽量避免与患者的痰液接触,以免交叉感染。
•患者使用吸痰器过程中,应保持呼吸平稳,避免突然咳嗽或吞咽,以免引起异物误吸。
•使用过的吸痰器装置和痰液容器应及时清洁消毒,确保无菌。
以上是简易吸痰器的使用流程,通过正确操作简易吸痰器,可以帮助呼吸困难或痰液较多的患者清除呼吸道分泌物,保证呼吸通畅。
在操作过程中,操作人员应注意手部消毒、器械清洁、消毒等环节,确保操作过程的无菌,以最大限度地保护患者的健康。

新型冠状病毒感染的肺炎患者下呼吸道标本采集操作规程
下呼吸道标本分为三种:痰液、支气管细胞灌洗液、支气管分泌物,主要以痰液为主。
采集方法包括:自行咳痰法、吸引器经口鼻吸痰法、支气管镜下留取标本法。
一、目的:
取患者下呼吸道分泌物做病毒分离,以帮助诊断。
二、评估:
1、评估患者:
(1)双人核对医嘱,打印标签,准备无菌痰杯或一次性痰液收集器。
(2)核对患者,了解患者病情、咳嗽咳痰情况。
(3)向患者解释,取得配合。
2、评估环境:
安静整洁、宽敞明亮、室温适宜、光线充足。
三、操作前准备:
(1)人员准备:防护级别:三级防护(医用防护口罩、一次性帽子、防护服、护目镜、防护面屏、乳胶手套2双、防护靴套)。
(2)物品准备:治疗车上层:无菌痰杯或一次性痰液收集器、温开水、漱口杯、负压吸引装置一套(检查处于备用状态)、一次性吸引器连接管、密封袋2个、75%酒精、纱布数块、快速手消液、必要时备口咽通气道。

痰液常规检查标准操作规程【操作人员】经批准人授权的同志。
【部门主管】【质量控制员】【目的】保证测试结果的准确性。
【适用仪器范围】双目显微镜。
【该SOP变动程序】该标准操作程序的更改,可由任一使用本程序的操作人员提出并报请专业主管及科主任签字后生效。
【应用范围】痰液常规检查的手工操作。
【标本采集】痰液标本收集法因检验目的不同而异,但所用容器须加盖,痰液勿污染容器外(用不吸水容器盛留)。
1.痰液的一般检查应收集新鲜痰,病人起床后刷牙,漱口(用3%H2O2及清水漱3次) 用力咳出器官深部痰液,勿混入唾液及鼻咽分泌物。
2.细胞学检查用上午9-10时深咳的痰液及时送检(清晨第一口痰在呼吸道停留时久,细胞变性结构不清),应尽量送含血的病理性痰液。
3.浓缩法找抗酸杆菌应留24h痰(量不少于5ml),细菌检验应避免口腔、鼻咽分泌物污染。
4.困难者用45摄氏度10%NaCl水溶液雾化吸入,刺激咳痰。
【一般性状检查】正常人一般无痰或仅有少量泡沫痰或粘液样痰。
1.颜色正常参考值:无色或灰白色。
临床意义:(1)黄色提示呼吸道化脓性感染,见于化脓性支气管炎、金黄色葡萄球菌性肺炎、支气管扩张、肺脓肿等;(2)红色或咖啡色因痰中含有血液或血红蛋白,见于肺癌、肺结核、支气管扩张等;(3)绿色痰可见于黄疸、吸收缓慢的大叶性肺炎或肺部铜绿假单胞菌感染;(4)铁锈色多因血红蛋白所致,见于大叶性肺炎或肺坏死等;(5)棕褐色见于慢性充血性心脏病肺淤血、阿米巴肺脓肿;(6)灰黑色因吸入大量煤炭粉尘或长期吸烟所致,见于各种肺尘埃沉着症。
(7)烂桃样或果酱样痰见于肺吸虫病。
2.性状正常参考值:稍粘稠状。
临床意义:(1)浆液脓性肺组织坏死、支气管哮喘、肺脓肿。
(2)粘液性支气管哮喘、大叶性肺炎等。
(3)血性肺结核、肺吸虫、支气管扩张、肺梗塞、肺癌。
(4)脓性肺脓肿、穿透性脓胸、支气管扩张。
3. 肉眼可见的异样物质(1)支气管管型:是由纤维蛋白、粘液等在支气管内塑型而成的白色、灰白色树枝状。

《体位排痰技术》操作规程体位排痰技术是指通过调整患者的体位,利用重力作用帮助患者排除呼吸道分泌物的一种操作方法。
它被广泛应用于呼吸系统疾病的护理中,可以有效地改善患者的呼吸道通畅度,减少呼吸困难的发生。
以下是《体位排痰技术》的操作规程,旨在帮助临床护理人员正确使用该技术,提升患者护理质量。
一、准备工作1.检查患者的呼吸道分泌物:了解患者的病情,包括痰液的性质、黏稠度等,以便选择适当的体位。
2.检查患者体位的限制:了解患者是否有体位限制或禁忌,如颈椎骨折、脑部手术等,以避免对患者造成不适或损伤。
3.消毒准备:洗手并戴上一次性手套。
准备护理床单、盆和护理巾等辅助用具,并进行消毒。
二、操作步骤1.辅助患者排空膀胱:提醒患者排空膀胱,以免排痰过程中因咳嗽而造成尿失禁。
2.协助患者取适当体位:基于患者的病情和身体限制,选择适当的体位。
常用的体位有:半坐位、仰卧位、卧位、矮床位等。
3.调整床位高度:根据患者的具体情况,适当调整床位的高度,以保证患者舒适和护理的方便。
4.托住患者的头部:用一只手托住患者的头部,保持患者的颈部、肩膀和背部的舒适度。
5.让患者深呼吸:鼓励患者深呼吸数次,以增加胸廓的运动和呼吸肌的收缩。
6.胸部敲击:用手指轻轻敲击患者的胸部,从上至下、从前至后,以松散的拳头敲击为宜,来刺激和松动患者的呼吸道分泌物。
7.侧身体位:将患者的身体向一侧倾斜,对于需要排痰的侧肺,将患者的身体向下倾斜,以利于呼吸道分泌物的排出。
8.背部按摩:用手掌轻轻按摩患者的背部,从上至下、从前至后,以促进呼吸道分泌物的松动和流动。
9.轮换体位:根据患者的情况,适时轮换体位,以促进呼吸道分泌物在不同部位的排出。
10.清理呼吸道分泌物:使用组织纸或吸痰器等工具,及时清理患者口腔、鼻腔和咽部的呼吸道分泌物,以保持通畅。
11.观察患者的反应:在操作过程中,密切观察患者的生命体征变化、排痰情况和不适表现,及时做好记录和报告。
三、操作注意事项1.操作前要与患者进行沟通,详细告知操作目的和过程,并征得其同意。

吸痰操作规程及清洁技巧引言:吸痰作为一项护理技术,主要应用于需要排除呼吸道分泌物的病患。
正确操作吸痰过程以及合理清洁工具对于患者的呼吸道健康具有重要意义。
本文将介绍吸痰操作规程以及清洁技巧,帮助护理人员正确、高效地完成吸痰操作。
一、吸痰操作规程1. 确定吸痰操作的适用对象:吸痰操作主要适用于以下病患:- 有明显呼吸困难或咳嗽并伴有痰液积聚的患者;- 感染性疾病患者,特别是喉咙、气管和支气管感染;- 患有肺炎、乙肝肺炎等疾病的患者;- 高龄、弱敏、昏迷状态下的病人。
2. 准备吸痰操作所需的工具和设备:进行吸痰操作前,应准备以下工具和设备:- 吸痰器:可选择手动或电动吸痰器;- 吸痰管:使用一次性吸痰管,确保卫生;- 纱布和生理盐水:用于擦拭和清洁呼吸道;- 无菌手套和口罩:保护护理人员和患者的卫生。
3. 患者准备:在吸痰操作前,需要做好患者准备工作:- 保持患者舒适和安静;- 位置可以如半躺位或坐位,选取患者最适合的姿势;- 让患者口服或注射镇静剂以缓解不适感。
4. 操作流程:下面是吸痰操作的基本流程:- 洗手并戴上无菌手套和口罩;- 清洁吸痰器和吸痰管;- 轻轻将吸痰管插入患者咽喉或气管内,直到遇到阻力或患者出现咳嗽反应;- 吸出痰液,维持负压直到吸尽痰液;- 在每次吸痰后,应用生理盐水清洗管道;- 完成吸痰操作后,将吸痰管和吸痰器进行清洁和消毒。
二、吸痰操作的注意事项1. 遵循无菌操作原则:吸痰操作需要保持无菌状态,避免交叉感染。
操作前请正确洗手并戴上无菌手套和口罩,操作环境也需要清洁,以保证吸痰过程的卫生。
2. 注意操作顺序:在插入吸痰管时,请确认吸痰管的长度以及患者的病情需要,避免不必要的刺激或伤害。
同时,在每次吸痰后,应用生理盐水清洗管道,以维持通畅的呼吸道和避免细菌侵入。
3. 观察患者反应:吸痰操作过程中,应随时关注患者的反应。
如果患者出现不适或明显咳嗽、呼吸困难等症状,应停止吸痰并及时给予处理。

吸痰操作流程口述吸痰是一种常见的护理操作,通常用于呼吸道分泌物较多、患者自主咳痰能力较弱或无法咳出痰液时。
正确的吸痰操作可以有效清除呼吸道分泌物,减少感染的风险,保持呼吸道通畅,提高患者的舒适度。
下面将为您详细介绍吸痰操作的流程及注意事项。
1. 准备工作。
在进行吸痰操作之前,首先要做好准备工作。
包括准备好吸痰器、生理盐水、护理垫、口腔护理用品等。
同时,要确保患者处于适当的体位,通常为半坐位或侧卧位,以利于呼吸道分泌物的排出。
2. 洗手。
在进行吸痰操作之前,护理人员需要进行充分的手部卫生,使用肥皂和流动水洗手,并在手部消毒后再进行吸痰操作,以避免交叉感染。
3. 吸痰器准备。
将吸痰器连接好,确认吸痰器的吸引力适中,不宜过大或过小,以免损伤呼吸道黏膜或无法有效吸出分泌物。
4. 通知患者。
在进行吸痰操作之前,要向患者说明吸痰的目的和过程,取得患者的配合和理解,让患者尽量放松,以利于吸痰操作的顺利进行。
5. 口腔护理。
在进行吸痰操作之前,可以给患者进行口腔护理,包括擦拭口腔、清洁牙齿等,以减少吸痰时细菌的传播。
6. 吸痰操作。
将吸痰管插入患者口腔,通过口腔吸痰或气管插管吸痰的方式进行,注意不要刺激咽部黏膜。
在吸痰的过程中,要控制吸引力,避免过度吸引导致呼吸道黏膜损伤。
吸痰的时间一般不宜过长,以免影响患者的呼吸。
7. 吸痰后的护理。
吸痰结束后,要及时给患者进行口腔护理,包括擦拭口腔、清洁牙齿等。
同时,要观察患者的呼吸情况,确保呼吸通畅。
8. 吸痰器的清洁。
吸痰器使用后,要及时进行清洁消毒,避免细菌的滋生和传播。
总结。
吸痰操作是一项重要的护理技能,正确的吸痰操作可以有效清除呼吸道分泌物,保持呼吸道通畅,减少感染的风险。
在进行吸痰操作时,护理人员需要做好充分的准备工作,与患者进行充分的沟通,掌握正确的吸痰技巧,确保操作的安全和有效。
希望以上内容能够帮助您更好地掌握吸痰操作的流程及注意事项。


简易吸痰器的操纵流程之杨若古兰创作【目的】清除患者呼吸道分泌物,坚持呼吸道通畅.【筹办】1、护士:着装整洁、洗手、戴口罩.2、用物:吸痰盘(内有一次性吸痰包2个、一次性医治碗、生理盐水、听诊器、手电筒、一次性压舌板(包纱布).须要时备开口器、舌钳.)吸引安装一套3、评估:患者病情、痰液地位、黏稠度及能否配合操纵.【操纵流程】1、携用物至床旁,医治盘放于床头桌,吸引安装置于患者床头.2、向患者或家属解释吸痰目的及可能发生的不良反应,并取得患者及家属的配合.3、协助患者头部偏向护士一侧,检查口腔、鼻腔粘膜,取下活动义齿.4、安装吸引器,打开负压开关,将吸引器负压调至0.04-0.06Mpa,试通畅,备用.吸氧的患者加大氧流量.5、打开吸痰包,戴手套,铺医治巾,连接吸痰管,试通畅.6、吸痰:先吸口咽部,再吸口腔;吸双侧鼻咽部至鼻腔.插管深度适宜,零压进、负压出,由深至浅摆布扭转提出,每处吸引终了后,均冲洗吸痰管;每处抽吸很多于3秒钟,冲洗吸痰管并分离,冲洗接头,拔出压脉带备用,关闭小开关.昏迷患者使用压舌板帮忙患者张口.7、擦净口鼻分泌物,检查口、鼻腔粘膜有没有损伤.(吸氧患者酌情调节氧流量)8、观察病情,协助患者取舒适卧位.9、清算用物,洗手,做记录.【留意事项】1、按照无菌操纵准绳,插管动作轻柔、敏捷.2、吸痰前评估患者病情、痰液地位、黏稠度及能否配合操纵;根据动脉血气分析结果、肺部听诊、胸片、病人咳嗽反应等判断是否须要吸痰及痰液潴留的部位.听诊部位:双侧肺尖(锁骨上窝),双侧肺底(腋中线第八肋间).听诊顺序为:右上、左上、左下、右下.3、吸痰指征:听诊双肺有痰鸣音、呼吸机的吸气峰压添加、患者血氧饱和度降低.4、选择合适的吸痰管,成人普通10—12号.小儿吸痰管5—8号,最大10号.5、未行机械通气病人吸痰前后应给予高流量吸氧,行机械通气的病人吸痰时应将呼吸机调至吸痰模式.吸痰时间每次不宜超出15秒,如痰液较多,须要多次吸引,应间隔3-5分钟,患者耐受后再进行.吸痰时将吸痰管末端反折,零压进负压出.6、吸痰过程中要留意观察病情如面色、呼吸情况、有没有特殊不适,心电监护病人同时观察其心率、血氧饱和度、血压等变更,如病人发生紫绀、心率降低等缺氧症状,应立即停止吸痰,加大吸氧流量,通知大夫,给予对症处理.7、观察痰液的性质、色彩、量、气味,如有异常应及时取深部痰液标本检验,为临床用药提供可靠材料.如果患者痰液黏稠,应酌情采纳各种湿化措施,便于痰液吸出.8、神志清醒病人,操纵前做好解释工作取得配合,清除紧张.病情危重、生命体征不波动者,吸痰前应向病人家属告知,须要时签署特殊医治和谈书,同时床边备简易呼吸器、气管插管用物或气管切开包等急救设备.9、若采取鼻塞吸氧,调节氧流量时应先将鼻塞取下,再进行调节.10、吸引的并发症:低氧血症、肺不张、气道损伤、心律失常、颅内压增高、咳嗽和支气管痉挛等,严重者可呼吸、心跳骤停 .。

痰培养标本采集方法及注意事项痰培养是临床微生物学中的重要检验项目,对于呼吸道感染的病原菌的诊断和治疗具有重要意义。
正确的痰标本采集方法和注意事项对于确保检验结果的准确性至关重要。
下面将详细介绍痰培养标本采集的方法及注意事项。
1. 采集时间,最佳的痰标本采集时间是清晨醒来后的第一次痰液,因为此时痰液中的病原菌浓度最高。
若患者有咳嗽,也可在咳嗽后采集。
2. 采集方法,患者在采集痰标本前应先漱口,以减少口腔细菌的污染。
然后深呼吸几次,使痰液从下呼吸道上涌,再用清水漱口。
用无菌痰杯或无菌干净的容器接集痰液,避免口水和唾液的混入。
3. 注意事项,在采集痰标本时,应避免将痰液与唾液混合,因为唾液中的细菌会干扰痰液中病原菌的检测。
另外,在采集痰标本时,应避免使用含有抗生素或消毒剂的痰杯,以免影响病原菌的培养和鉴定。
4. 保存条件,采集好的痰标本应尽快送至临床微生物实验室进行处理。
若不能立即送检,应将标本保存在4℃的冰箱中,但不宜超过24小时。
5. 送检要求,在送检时,应填写完整的病历资料和送检申请单,包括患者的姓名、性别、年龄、临床诊断、送检项目等内容。
同时,标本瓶上也应标注患者的姓名、病历号、标本种类和采集时间等信息。
6. 检验结果的解读,痰培养结果的解读应结合患者的临床表现和其他检查结果进行综合分析,不能单凭培养结果作出诊断。
总之,正确的痰培养标本采集方法和注意事项对于呼吸道感染的诊断和治疗具有非常重要的意义。
只有在严格按照规范操作的基础上,才能确保检验结果的准确性和可靠性,为临床医生的诊断和治疗提供有力的支持。
希望临床医务人员能够严格按照规范操作,确保痰培养检验结果的准确性,为患者的治疗提供科学依据。
下呼吸道感染细菌培养操作规范解读引言:下呼吸道感染是指细菌侵入呼吸道,引发炎症反应和感染。
细菌培养是诊断下呼吸道感染的重要方法之一,它可以确定感染的微生物种类以及对药物的敏感性,指导合理的抗感染治疗。
下面对下呼吸道感染细菌培养操作规范进行解读。
一、培养基选择:制备培养基是进行细菌培养的重要环节。
常见的下呼吸道感染细菌培养基有血琼脂培养基、MacConkey琼脂培养基、巴斯德培养基等。
血琼脂培养基适用于大多数细菌的培养,MacConkey琼脂培养基可用于选择性培养革兰阴性杆菌,巴斯德培养基则常用于痰液的培养。
二、样品采集:样品采集是细菌培养的前提,因此操作规范的制定对准确采集样品至关重要。
下呼吸道采样的常见方法包括痰液、支气管肺泡灌洗液和支气管肺泡灌洗液。
痰液是最常见的样品,正确的采集方法是由患者自行深呼吸后,咳出痰液至少5mL以上。
支气管肺泡灌洗液和支气管肺泡冲洗液的操作需要经验丰富的医护人员进行。
三、样品运输:样品运输是培养质量的重要环节。
样品需要尽快送至实验室进行处理,少数情况下可以在运输过程中使用冷藏剂保持样品的新鲜度。
样品应由医护人员妥善包装,标明患者信息、采集日期、样品性质等。
四、样品处理:样品进入实验室后,需要进行处理以提取细菌。
首先,将样品进行离心,然后用生理盐水洗涤,使样品含有细菌的液体分离。
接下来,可以进行细菌培养的操作。
五、细菌培养:细菌培养是最关键的步骤,操作规范对培养结果的准确性和可重复性具有重要影响。
常用的细菌培养方法有涂布法、点菌法、渗透法等。
涂布法适用于不同类型的细菌,点菌法适用于分离杂菌,渗透法适用于培养一些特定菌株。
细菌培养需要进行一系列步骤,如选取合适的培养基,调节pH值,控制培养温度和培养时间等。
六、结果的解读:培养结果需要经过专业人员进行解读,判断感染的微生物种类和数量,以及对药物的敏感性。
常见的痰液培养结果包括呼吸道常见细菌(如肺炎链球菌、流感嗜血杆菌等)、革兰阴性杆菌(如大肠杆菌、克雷伯氏菌等)以及其他细菌(如金黄色葡萄球菌等)。
下呼吸道感染细菌学检验操作规范下呼吸道感染细菌学检验操作规范1. 检验前准备检验前要检查所需器材是否齐备,且有使用期限、试剂是否过期。
根据标本性质准备适当的试验室和器材,如培养基、消毒剂、培养皿、显微镜、荧光显微镜等。
2. 标本的采集下呼吸道感染标本需由医生经过特殊训练后采集。
标本采集应在患者用药前进行,避免影响细菌培养。
应采集晨起的第一口咳痰标本,或在空腹情况下采集医生所要求的标本。
标本采集应该避免因细菌其他来源被污染。
3. 标本的存储和运输标本应在采集后尽快送至检验室。
标本在送到检验室的途中应密封,并且避免被震动或过热过冷。
气管切开标本应立即进行培养,对于咳痰标本应在收到后的半小时内进行处理。
4. 标本的处理将留有量行的痰液用橡皮塞挤入干净的西门子杯内,有时也可采用锡制雾化器或喷雾器快速将痰液或分泌物喷在玻片上。
用火焰或消毒器对冷凝吸入性肺炎标本进行消毒,尽可能在细菌沉淀区进行采样。
迅速挤压蓝色鼻咽拭子并置入培养皿内。
标本处理时要注意避免散播细菌。
5. 涂片染色将涂片涂上标本,然后进行染色。
无需特殊之处,可以参照常规的涂片染色法。
6. 培养用普通、选择性和不同的富集培养基进行培养。
常用的培养条件和相关的检测菌株如下:a. 长链球菌–用5%的羊血琼脂培养,将其置于CO2孵育箱中。
b. 肺炎球菌,草绿色链球菌,葡萄球菌–用血精灵琼脂培养。
c. 肺炎链球菌–用富集培养基,如VP培养基、耐苯唑芥庚烷琼脂(PBG琼脂)等。
为了纯化不同类型的肺炎链球菌,还可以选择使用灭菌的吞噬细胞进行富集,例如照片长杆菌(F. tularensis.)。
d. 泡沫状微生物和厌氧菌–分别用PPLO或厌氧和普通琼脂培养。
7. 鉴定和鉴别根据培养结果和临床表现,可对菌株进行初步鉴定和分类。
在进行鉴定过程中,应遵循规范化的步骤,选择正确的API、鉴定手段等,并在鉴定手册中查找相关鉴定概念、流程、依据以及最近的病原学方面的知识,避免误判或漏判。
痰培养标本采集方法及注意事项痰培养是一种常见的临床检查方法,用于检测呼吸道感染病原体。
正确的痰培养标本采集方法和注意事项对保证检测结果的准确性至关重要。
下面将介绍痰培养标本采集的方法和注意事项。
一、痰培养标本采集方法:1.采集时间:最佳采集时间是早上起床后,患者尚未进食或漱口。
2.患者准备:患者应先漱口,以清除口腔中的细菌。
然后深呼吸几次,以刺激喉部分泌物,并咳嗽2-3次。
3.采集器具:可用无菌的宽口塑料杯作为痰培养容器,避免使用铁罐、玻璃瓶等容器,以免残留的细菌影响培养结果。
4. 采集过程:患者在咳嗽时将痰直接咳出到容器中,或者在漱口后用唾液吐痰至容器中,以保持采集的痰液的干净和无菌。
采集量应达到2-5ml为宜,以保证培养的条件。
二、痰培养标本采集注意事项:1.避免污染:采集标本时要避免口腔的污染,患者可以先漱口,然后再咳嗽或吐痰类似的方法将痰液采集到容器中。
注意不要将痰液和唾液混在一起,以免影响病原体的检测结果。
2.采集时机:痰培养的最佳时机是早上起床后,此时呼吸道分泌物较多,容易采集到足够的标本。
如果患者口干舌燥,可以喝一些水以增加分泌物的量。
3. 采集量:痰液的采集量应达到2-5ml,以充分满足检测的需要。
如果痰液量不足,可以多次采集或者进行刺激咳嗽后再采集,但是注意避免过度刺激引起不适。
4.容器选择:选择无菌、宽口、密封性良好的容器作为痰液的采集容器。
避免使用金属容器,因为金属容器可能含有微量的抑菌剂,对病原体的生长产生干扰。
5.标本传送:采集完痰液后,应及时将标本送往实验室进行培养,以保证标本的新鲜度和培养结果的准确性。
标本可以存放在4°C的冰箱中,但是加热前要再次加热至室温。
6.严格遵守感染控制措施:在痰液采集过程中,医务人员要严格遵守感染控制措施,包括佩戴口罩、手套等防护用具,避免交叉感染的发生。
总结起来,痰培养标本的正确采集方法和注意事项包括避免污染、选择合适的采集时机、保证足够的采集量、选择无菌的容器、及时送往实验室进行培养,同时医务人员要严格遵守感染控制措施,以确保痰培养结果的准确性。
痰及下呼吸道标本的采集指征、采集方法、注意事项、标本运送及临床情况沟通采集指征有下列体征之一,应进行痰培养:①咳嗽、咳痰,痰液可为脓性、血性、铁锈色或红棕色胶胨阳痰。
②咯血,包括泡沫血痰、鲜血和痰中带血等。
③呼吸困难,呼吸急促或哮喘,常伴有胸痛。
④发热伴白细a胞增高尤其是中性粒细胞或CRP、PCT明显增高。
⑤胸部影像学检查提示有感染可能。
肺部感染的患者有25-50%可能发生菌血症,应同时作血培养。
采集方法1、自然咳痰法以晨痰为佳,咳痰前先用冷开水、纯净水反复漱口三次,然后用力咳出呼吸道深部的痰,痰液直接吐入痰杯中,1h 内送检。
尽可能在用抗菌药物之前采集标本。
标本量应>1ml。
痰量少或无痰者可采用雾化吸入加温至45℃的10%Nacl水溶液,使痰液易于排出。
对难于自然咳痰患者可用无菌吸痰管)抽取气管深部分泌物。
2、对昏迷、重症、难治,或伴免疫抑制,或疑是厌氧菌引起的院内感染者,可采用纤维支气管镜采集法、防污染毛刷采集法(PSB)、支气管肺泡灌洗法(BAL)、环甲膜穿刺经气管吸引法(TTA)、经胸壁针穿刺吸引法(TNA)采集标本,均由临床医生按相应操作规程采集,但必须注意采集标本时尽可能避免咽喉部正常菌群的污染。
3、小儿取痰法:用弯压舌板向后压舌,将棉拭子伸入咽部,小儿经压舌刺激咳嗽时,可喷出肺部或气管分泌物粘在拭子上。
幼儿还可用手指轻叩胸骨柄上方,以诱发咳痰。
注意事项痰标本不能及时送检者,可暂存4℃冰箱。
室温下延搁数小时定植于口咽部的非致病菌呈过度生长而肺炎链球菌、葡萄球菌和流感嗜血杆菌检出率则明显下降。
标本运送标本应尽快送检,不能及时送检的标本,室温保持<2h,4℃冰箱保存<12h。
一般每天只需做一次。
痰及下呼吸道标本验收与拒收见下:1、送检目的不合适者,如咽拭子、咳痰、吸出的分泌物做厌氧菌培养无意义,应拒收。
2、申请单应填写完整无误。
标本标识必须唯一,未标采集时间、部位或检验要求等拒收。
3、标本容器必须符合规定,溢漏、无盖者拒收。
痰标本处理标准操作程序1呼吸道标本细菌培养检测结果的准确、可靠。
2深部痰标本或下呼吸道分泌物。
3无菌痰杯或咽拭子。
4BD Phoenix 100 全自动细菌分析仪。
55.1 标本采集5.1.1 采样时机:在抗生素药物使用之前采集清晨第一次痰液送检。
a) 痰标本:最好在应用抗菌药物之前采集标本。
以晨痰为最好。
对支气管扩张症或与支气管相通的空洞患者,清晨起床后进行体位引流,可采集大量痰液。
b)下呼吸道分泌物、支气管纤维镜刷片:也宜早晨空腹采集为佳。
5.1.2 采集方法a) 痰液标本采集患者清晨起床后,用清水反复漱口后用力自气管咳出第一口痰于灭菌容器内,立即送检。
对于痰量少或无痰的患者可采用雾化吸入加温至 45℃的10%NaCl 水溶液,使痰液易于排出。
对咳痰量少的幼儿,可轻轻压迫胸骨上部的气管,使其咳嗽,将痰收集于灭菌容器内送检。
b) 环甲膜穿刺吸痰对于一些疑难、病情危重或免疫受损患者继发肺部感染可用一些侵入性诊断技术采集下呼吸道标本。
若采用环甲膜穿刺吸痰法取痰液标本,藉套管针自环甲膜插入消毒塑料管吸取分泌物,作病原体培养,不受口腔、咽部病原体的污染,可较准确地反映下呼吸道及肺部感染的病原菌。
本方法简便实用,阳性率高,结合定量培养可能区别假阳性。
但本检查有轻微创伤性,并发症包括皮下气肿、气管内出血等。
有出血倾向、严重心血管疾病者禁用。
c)纤维支气管镜采集法经(纤支镜)直接吸引下呼吸道分泌物,由于纤支镜通过口咽部时同样受到污染,因此认为也不比咳出的痰更好。
经纤支镜以附刷的双层套导管方式直接采集肺部分泌物,进行细菌、真菌、厌氧菌培养和免疫荧光等检查,往往能可靠地找到感染病原体。
由于其效果尚无法达到完全不受污染的情形,所以应进行定量培养,其细菌浓度>103cfu/ml 则有意义。
经过临床评估,此种采样方式临床应用价值颇高。
采样时防污染标本刷取样应深入,且应多方向旋转及上下移动,这样取痰可提高痰培养的敏感性。
小儿留取痰培养的注意事项及流程呼吸系统疾病是小儿常见病和多发病,其上呼吸道感染,支气管炎和支气管肺炎最为多见。
为提高呼吸系统疾病患儿治愈率,降低死亡率,常需采集痰标本做细菌培养加药品试验,指导临床合理使用抗生素。
标签:痰培养;注意事项;流程1痰培养概念可根据需要进行需氧菌培养,厌氧菌培养,结核杆菌培养或真菌培养,用于呼吸道感染的病因诊断。
2 痰培养的临床意义该项检查试用于各种原因不明的呼吸道感染疾病。
痰培养出致病菌后,进行菌种鉴定,可得出相应的病原菌。
常见的病原菌有:革兰阳性菌,革兰阴性菌,真菌,用于病毒分离等。
3 采集指征,有下列体征之一,应进行痰培养:3.1咳嗽:咳嗽咳痰是下呼吸道感染最常见的症状;3.2咯血:包括泡沫血痰,鲜血和痰中带血等;3.3呼吸困难:呼吸急促或哮喘,常伴有胸痛;3.4发热伴白细胞增高尤其是中性粒细胞或CRP明显增高;3.5胸部影象学检查提示有感染的可能。
4 注意事项4.1采集标本的最佳时机应在使用抗菌药物之前。
4.2严格无菌操作4.3及时送检标本,防止标本中的原始菌的死亡或繁殖,最好在半小时之内不得超过2小时。
4.4吸痰时插入深度要足够,从口腔进入长度正常是鼻尖到耳垂,从鼻腔进入适当延长,避免正常菌的污染。
4.5标本量要足够4.6有专用的培养杯。
5 小儿留取痰培养的流程5.1接到医嘱,双人核对5.2评估:患儿病情,意识,生命体征;向家属解释操作目的,配合要点,以取得配合;评估患儿呼吸道分泌物,听诊器听诊双肺呼吸音;评估患儿口鼻黏膜有无破损,鼻腔是否通畅有无堵塞;患儿空腹时间。
5.3准备用物;一次性无菌手套两副,一次性连接管,痰液收集器,纱布两块,化验单,负压装置,污物盒,手消剂等,必要时惫吸氧装置。
5.4携用物至床旁,核对,协助摆体位取侧卧位5.5安装负压装置及连接管,打开负压检查是否完好可以使用,调节负压,小儿应小于0。
4Mpa5.6撕开痰液收集器外包装,右手戴手套取出收集器与连接管连接5.7再次核对化验单5.8吸痰过程中观察患儿面色心率呼吸血氧等情况,如出现面色青紫呛咳应立即停止。
.痰液及下呼吸道分泌物培养标准操作流程
1 观察标本合格后操作。
一般为晨痰,再留取痰之前刷牙、反复漱口,应从气管深部咳出痰,吐进无菌容器内送检。
涂片白细胞小于10,上皮细胞大于25为不合格痰,相反白细胞大于25,上皮细胞小于10-25为合格痰标本。
2 点燃酒精灯,尽量保证无菌中间。
3 接种环灭菌—待冷却后—取痰液—接种到血平板、中国兰平板(或麦康凯平板上)。
平板划线分离培养:
(1)用接种环将标本涂布在平板第一区域并作数次划线,在第二三区依次用接种环划线。
(2)每划一区域应将接种环烧灼一次,冷却后再划下一区域,每一区域的划线应接触上一区域的接种线2-3次使菌量逐渐减少以形成单个菌落。
(3)划线完毕将平板加盖倒置(琼脂平板的底部向上)于35°C培养18-24小时。
4观察菌落特征涂片染色,确定阳性菌、阴性菌、球菌还是杆菌后鉴定种属。
5 做药敏试验-------报告结果。
便培养标准操作流程
1.收取有粘液或脓血、稀水粪便标本。
2.点燃酒精灯,尽量保证无菌中间。
3.接种环灭菌—待冷却后—取粪便—接种到血平板、SS平板、中国兰平板(或麦康凯平板上)。
平板划线分离培养:
(1)用接种环将标本涂布在平板第一区域并作数次划线,在第二三区依次用接种环划线。
(2)每划一区域应将接种环烧灼一次,冷却后再划下一区域,每一区域的划线应接触上一区域的接种线2-3次使菌量逐渐减少以形成单个菌落。
(3)划线完毕将平板加盖倒置(琼脂平板的底部向上)于35°C培养。
4培养18-24小时后观察菌落特征涂片染色,确定阳性菌、阴性菌、球菌还是杆菌后鉴定种属。
5 做药敏试验-------报告结果。
尿培养标准操作流程
1 收取晨尿第一泡清洁中段尿。
(把外阴用肥皂清洗一遍,再用清水清洗两遍,待干或用干净布擦干)用导尿管的病号需新换导尿管后取标本
2 点燃酒精灯,尽量保证无菌中间。
3 接种环灭菌—待冷却后将标本混匀,用定量接种环取尿液1ul(大约一接种环)—
接种到血平板,接种环灭菌---待冷后取标本接种到中国兰平板(或麦康凯平板上)。
(抗菌素治疗患者应增加一个10ul接种。
)
4 平板单区划线法:用灭菌接种环在血平板与中国兰(或麦康凯)平板的中间位置
单区划线(这种方法适合菌落计数,假如细菌多不容易分出单个菌落。
)
5划线完毕将平板加盖倒置(琼脂平板的底部向上)于35°C培养18-24小时。
6观察菌落特征涂片染色,确定阳性菌、阴性菌、球菌还是杆菌后鉴定种属。
7 做药敏试验------报告结果。
注:接种1ul尿量者,菌落数乘以10,接种10ul尿量者,菌落数乘以100.即为每ml尿液中所含有的细菌数(CFU/ml),如菌落数生长过多无法计数则报告大于100000 CFU/ml.
分泌物培养标准操作流程
1 在无菌环境下用一次性拭子快速取分泌物或脓液标本。
2 点燃酒精灯,尽量保证无菌中间。
平板划线分离培养:
(1)用拭子将标本涂布在平板第一区域并作数次划线,在第二三区依次用接种环划线。
(2)每划一区域应将接种环烧灼一次,冷却后再划下一区域,每一区域的划线应接触上一区域的接种线2-3次使菌量逐渐减少以形成单个菌落。
(3划线完毕将平板加盖倒置(琼脂平板的底部向上)于35°C培养18-24小时。
3观察菌落特征涂片染色,确定阳性菌、阴性菌、球菌还是杆菌后鉴定种属。
4 做药敏试验——报告结果。
穿刺液培养标准操作流程
1 收取合格的穿刺液标本。
(咨询下是否按要求取的标本)
2 点燃酒精灯,尽量保证无菌中间。
3 将穿刺液接种到增菌培养液进行培养。
(穿刺液含细菌数量较少,因此,必须做增
菌培养)
4 培养18-24小时候后,用酒精消毒培养液瓶口,用五毫升注射器抽取0.5毫升液体打入血平板、巧克力平板(CO2环境中以分离嗜血杆菌)中国兰平板(或麦康凯平板上)
接种环灭菌—待冷却后。
平板划线分离培养:
(1)用接种环将标本涂布在平板第一区域并作数次划线,在第二三区依次用接种环划线。
(2)每划一区域应将接种环烧灼一次,冷却后再划下一区域,每一区域的划线应接触上一区域的接种线2-3次使菌量逐渐减少以形成单个菌落。
(3)划线完毕将平板加盖倒置(琼脂平板的底部向上)于35°C培养18-24小时。
5观察菌落特征涂片染色,确定阳性菌、阴性菌、球菌还是杆菌后鉴定种属。
6 做药敏试验-------报告结果。
注:标本经增菌转种平板后,经35°C24-48小时孵育后,如无细菌生长,平板还应继续孵育至第3天.如怀疑有奴卡菌,平板应持续孵育7天证实无菌生长,才能报告阴性.
血培养标准操作流程
1 用严格无菌技术静脉采血法采集2套外周血,作培养标本。
2 检查培养瓶确保它们被安全放臵,检查瓶子上的标签确认与申请单上的患者资料是否一致。
3 保证获得适量的血液.小孩最少3ML,大人最少5ML,正常应该是10ML。
4 放入35°c孵育7天。
5 孵育至3天后和5天后分别用酒精消毒培养液瓶口,用五毫升注射器抽取0.5毫升液体打入血平板、巧克力平板(CO2环境中以分离嗜血杆菌)中国兰平板(或麦康凯平板上)
接种环灭菌—待冷却后。
平板划线分离培养:
(1)用接种环将标本涂布在平板第一区域并作数次划线,在第二三区依次用接种环划线。
(2)每划一区域应将接种环烧灼一次,冷却后再划下一区域,每一区域的划线应接触上一区域的接种线2-3次使菌量逐渐减少以形成单个菌落。
(3)划线完毕将平板加盖倒臵(琼脂平板的底部向上)于35°C培养18-24小时6 培养瓶继续孵育至第七天,每日早晨取出检查有无生长,并摇均培养液续孵。
下列几种情况提示细菌生长。
(1)均匀浑浊,发酵葡萄糖产生气泡。
(2)微浑浊有绿色变化。
(3)血球上面出现颗粒状或絮状沉淀物生长,或自下而上的严重溶血。
(4)浑浊并有胶冻状凝固,瓶壁有颗粒黏附。
(5)表面有菌膜、菌环状生长,下呈浑浊。
7 肉眼见有细菌生长做如下处理:
(1)取生长物涂片,做革兰染色。
(2)取生长物做药敏试验(直接试验)。
(3)取生长物做相应的生化鉴定。
(4)取生长物移种血平板、巧克力和中国兰(或麦康凯)等平板进行分离以获得纯培养。
8 革兰氏染色所见结果应及时报告临床医师。
9根据革兰染色的结果,以培养瓶内培养液为菌液,做直接法药物敏感性测定,争
取在较短时间内得出初步结果,供临床医师作为治疗的参考。
标本经平板分离纯
培养后须重复做鉴定及药敏试验,以验证用增菌液直接试验结果的可靠性。
10 无细菌生长表现的培养瓶,在观察的7天中,最少2次盲目转种。
需养培养瓶
用血琼脂平板、中国兰(或麦康凯)及巧克力平板(二氧化碳环境),分别于增菌
培养第3日和第5日各作一次盲目分离培养;培养48小时后观察结果,7天仍未
见生长-------报告阴性。
各种标本培养采样时的注意事项:采样时必须按采样要求操作,并且须在使用
抗菌素前进行,并及时送检。
结果判断时必须注意区别病原菌和正常菌群。
正常无
菌部位培养出细菌有临床意义。
有正常菌群存在的部位,培养出细菌须区分是否为
正常菌群并结合临床情况判断。
革兰氏染色标准操作流程
1 取干燥、标本薄而均匀的涂片。
2 加龙胆紫染色10秒,之后水洗,甩干。
3 加碘溶液染色10秒,之后水洗,甩干。
4加脱色液脱色(10-20)秒,之后水洗,甩干。
5 最后加沙皇溶液复染10秒,之后水洗。
6 以滤纸吸干或在空气中干后,镜检
7 报告结果(革兰氏阳性菌呈紫色;革兰氏阴性菌呈红色。
)
抗酸染色标准操作流程
1取干燥标本薄而均匀的涂片。
2涂片自然干燥后,放置染色架上,玻片间距保持10mm以上的距离;火焰固定(在5秒内将玻片置于火焰上烤4次)
3滴加石碳酸复红溶液盖满玻片,染色10分钟或更久。
(不需加温步骤)
4流水自玻片一端轻缓冲洗,冲去染色液,沥去标本上剩余的水。
5自痰膜上端外缘滴加酸性酒精溶液盖满玻片,脱色(1-2)分钟;如有必要,需流水洗去酸性酒精溶液后,再次脱色至痰膜无可视红色为止
6流水自玻片一端轻缓冲洗10-20秒冲去酸性酒精溶液,沥去玻片上剩余的水。
7滴加亚甲基蓝溶液,染色30秒钟。
8流水自玻片一端轻缓冲洗,冲去亚甲蓝溶液,然后沥去标本上剩余的水,待玻片干燥后镜检。
9 一张染色合格的玻片,痰膜肉眼观察为亮蓝色,无红色斑块。
10报告结果(在淡蓝色背景下,抗酸性菌(结核菌)呈红色,其他细菌及细胞呈蓝色。
)。