乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定2
- 格式:doc
- 大小:218.00 KB
- 文档页数:14

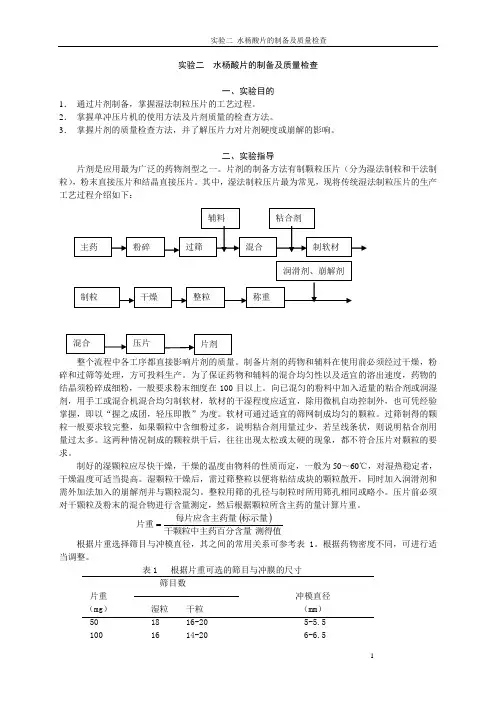
实验二 水杨酸片的制备及质量检查一、实验目的1. 通过片剂制备,掌握湿法制粒压片的工艺过程。
2. 掌握单冲压片机的使用方法及片剂质量的检查方法。
3. 掌握片剂的质量检查方法,并了解压片力对片剂硬度或崩解的影响。
二、实验指导片剂是应用最为广泛的药物剂型之一。
片剂的制备方法有制颗粒压片(分为湿法制粒和干法制粒),粉末直接压片和结晶直接压片。
其中,湿法制粒压片最为常见,现将传统湿法制粒压片的生产工艺过程介绍如下:整个流程中各工序都直接影响片剂的质量。
制备片剂的药物和辅料在使用前必须经过干燥,粉碎和过筛等处理,方可投料生产。
为了保证药物和辅料的混合均匀性以及适宜的溶出速度,药物的结晶须粉碎成细粉,一般要求粉末细度在100目以上。
向已混匀的粉料中加入适量的粘合剂或润湿剂,用手工或混合机混合均匀制软材,软材的干湿程度应适宜,除用微机自动控制外,也可凭经验掌握,即以“握之成团,轻压即散”为度。
软材可通过适宜的筛网制成均匀的颗粒。
过筛制得的颗粒一般要求较完整,如果颗粒中含细粉过多,说明粘合剂用量过少,若呈线条状,则说明粘合剂用量过太多。
这两种情况制成的颗粒烘干后,往往出现太松或太硬的现象,都不符合压片对颗粒的要求。
制好的湿颗粒应尽快干燥,干燥的温度由物料的性质而定,一般为50~60℃,对湿热稳定者,干燥温度可适当提高。
湿颗粒干燥后,需过筛整粒以便将粘结成块的颗粒散开,同时加入润滑剂和需外加法加入的崩解剂并与颗粒混匀。
整粒用筛的孔径与制粒时所用筛孔相同或略小。
压片前必须对干颗粒及粉末的混合物进行含量测定,然后根据颗粒所含主药的量计算片重。
()测得值干颗粒中主药百分含量标示量每片应含主药量片重=根据片重选择筛目与冲模直径,其之间的常用关系可参考表1。
根据药物密度不同,可进行适当调整。
表1 根据片重可选的筛目与冲膜的尺寸筛目数片重 冲模直径(mg ) 湿粒 干粒 (mm )50 18 16-20 5-5.5100 16 14-20 6-6.5150 16 14-20 7-8200 14 12-16 8-8.5300 12 10-16 9-10.5500 10 10-12 12制成的片剂需按照《中国药典》规定的片剂的质量检查项目进行检查。


复方乙酰水杨酸的含量测定复方乙酰水杨酸是一种广泛用于医药领域的药物,它由乙酰水杨酸和水杨酸组成,在治疗头痛、风湿痛、关节炎等方面具有显著的疗效。
因此,对复方乙酰水杨酸的含量进行准确的测定具有重要的临床应用价值。
本文将介绍复方乙酰水杨酸的含量测定方法。
一、试剂与仪器1、试剂:粉末状的复方乙酰水杨酸、氯仿、乙醇、六氯化铀、氢氧化钠、盐酸、石油醚、硫酸、甲苯和双氧水等。
2、仪器:电子天平、垂线式pH计、紫外-可见分光光度计、滴定管、离心机、高压液相色谱仪等。
二、含量测定方法1、前处理(1)、样品的制备首先,将复方乙酰水杨酸样品分别精密称量至0.1g以上的量,并分别置于两个不同的容量瓶中。
然后,向每个容量瓶中加入小量的氢氧化钠,并用足量的蒸馏水溶解,最后定容至50ml。
将上述制备好的样品瓶中的溶液过滤,并将滤液收集到干净的离心管中。
然后,加入等量的氯仿并摇匀,使乙酰水杨酸和水杨酸能够充分溶解。
将上述提取好的溶液放置在离心机中,离心一段时间,然后用沙漏或毛细吸管将下层液体分离出来,并过滤到50ml的瓶中,以便进一步分析。
(1)、紫外-可见分光光度法将去除蛋白质的样品溶液放入紫外-可见分光光度计中,测量其在274nm处的吸光度Au,并根据以下公式计算乙酰水杨酸的含量:含量= (Au×V×D×1000) / (ε×m)其中,Au为吸光度,V为取样量(单位为 ml),D为稀释倍数,ε为乙酰水杨酸在274nm处的摩尔消光系数,m为样品的质量。
(2)、高压液相色谱法将上述制备好的样品溶液直接注入高压液相色谱仪中,测定每个组分的峰面积,然后与已知浓度的乙酰水杨酸标准品的峰面积进行比较,计算出样品中乙酰水杨酸的含量。
将上述制备好的样品溶液放入垂线式pH计中,调节其 pH 值至 9-10,然后加入硫酸,产生水杨酸。
将生成的水杨酸与六氯化铀溶液混合,等待2min后,加入甲苯,并用滴定管滴入盐酸,将生成的水杨酸中的六氯化铀还原,最后测定其滴定溶液的体积,并计算出样品中水杨酸的含量。


年易学老难成.一寸光阴不可轻-百度文库乙酰水杨酸片的制备一、实验目的掌握湿法制粒压片的一般工艺、单冲压片机的使用方法及片剂质量的检查方法。
通过本实验,使学生对工业药剂学、药物分析课程的知识进一步加深理解,达到温故知新,提高学生动手能力的目的。
二、实验要求要求学生认真预习实验讲义;复习片剂常用的辅料、片剂的制备工艺与常用设备、片剂生产的洁净度要求、片剂成品质量检查的标准与方法等内容;掌握压片机、片剂四用仪等的使用方法;认真记录原始数据;填写实验报告,包括试验目的、实验原理、实验内容(仪器与试剂、方法与步骤)、实验结果与讨论、思考题等内容。
三、实验原理片剂是应用最广泛的剂型之一,压片的工艺流程中各工序都直接影响片剂的质量。
1、优点:剂量准确、质量稳定、服用方便、成本低。
2、制片的方法:制颗粒压片、结晶直接压片、粉末直接压片等。
3、制颗粒的方法:干法和湿法。
湿法制料压片的工艺流程:主药+辅料(填充剂或吸收剂、崩解剂)混合均匀'混合粉料湿润剂或粘合剂软材过筛.湿颗粒干燥.干颗粒整粒打润滑剂、崩解剂.压片原、辅料均应符合有关标准。
必要时,原、辅料应经粉碎、过筛,以利于混合均匀,并利于难溶性药物的溶出。
处方中个组分用量差异大,应采用递加稀释法或溶剂分散法以保证混合均匀。
颗粒的制造是制片的关键。
在湿法制粒压片工艺中,欲制好颗粒,首先必须根据主药的性质选好粘合剂或润湿剂,制软材时要控制粘合剂或润湿剂的用量,使之“握之成团,轻压即散”,并握后掌上不沾粉为度。
过筛制得的颗粒一般要求较完整,可有一部分小颗粒。
如果颗粒中含细粉过多,说明粘合剂用量太少,若呈现条状,则说明粘合剂用量太多这两种情况制出的颗粒烘干后,往往出现太松或太硬,都不能符合压片的颗粒要求,从而不能制好片剂。
颗粒大小根据片剂大小由筛网孔径来控制,一般大片(0.3〜0.5g)选用14〜16目筛,小片(0.3g以下)选用18〜20目筛制粒。
颗粒一般宜细而圆整。



Ⅱ.片剂溶出度与溶出速度的测定一.实验目的1.掌握片剂溶出度和溶出速度测定的基本操作和数据处理方法。
2.掌握溶出试验仪的调试与使用。
二.实验原理片剂等固体制剂服用后,在胃肠道中要先经过崩解和溶出两个过程,然后才能透过生物膜吸收,对于许多药物来说,其吸收量通常与该药物从剂型中溶出的量成正比。
其溶出过程可用Noyes-Whitney方程表示:dC/dt=KS(Cs-C) (9-1)式中:dC/dt为溶出速度;K为溶出速度常数(对体内某一药物来说K=D/(V.δ),其中D为药物扩散系数,V为溶出介质的体积,δ扩散层的厚度);S为固体药物的表面积;C S为固体药物的溶解度;C为t时间药物在溶出介质中的浓度。
因溶出了的药物往往立即透过生物膜被吸收,则C S》C,故上式可简化为:dC/dt=KSCs (9-2)式(9-2)表明药物的吸收是受扩散层控制的溶出过程,即药物的吸收速度与K、S、C S成正比。
对难溶性药物而言,溶出是其主要过程,故崩解时限往往不能作为判断难溶性药物制剂吸收程度的指标。
溶解度小于0.1—1.0g/L的药物,体内吸收常受其溶出速度的影响。
溶出速度除与药物的晶型、粒径大小有关外,还与制剂的生产工艺、辅料、贮存条件等有关。
为了有效地控制固体制剂质量,除采用血药浓度法或尿药浓度法等体内测定法推测吸收速度外,体外溶出度测定法不失为一种较简便的质量控制方法。
溶出度系指在规定溶剂中药物从片剂等固体制剂内溶出的速度和程度。
但在实际应用中溶出度仅指一定时间内药物溶出的程度,一般用标示量的百分率表示,如药典规定30min内对乙酰氨基酚的溶出限度为标示量的80%。
溶出速度则指在各个时间点测得的溶出量的数据,经过计算而得出的各个时间点与单位时间内的溶出量,它们之间存在一定的规律,可根据不同处理方法求出相应的参数。
因此,对于口服固体制剂,特别是对那些在体内吸收不良的难溶性药物的固体制剂,以及治疗剂量与中毒剂量接近的药物的固体制,均应作溶出度检查并作为质量标准。

阿司匹林胶囊剂的制备实验报告一、实验目的1、掌握阿司匹林胶囊剂的制备方法。
2、熟悉胶囊剂制备过程中的质量控制要点。
3、了解胶囊剂的特点和应用。
二、实验原理阿司匹林(化学名:乙酰水杨酸)是一种常用的解热镇痛药。
胶囊剂是将药物填充于空心胶囊中制成的固体制剂,具有掩盖药物不良气味、提高药物稳定性、便于服用等优点。
阿司匹林胶囊剂的制备主要包括药物的粉碎、过筛、混合、填充等步骤。
通过合理的工艺操作,使药物均匀分散在胶囊中,保证每粒胶囊的含量准确、质量稳定。
三、实验材料与设备1、材料阿司匹林原料药淀粉滑石粉空心胶囊(0 号)2、设备电子天平粉碎机标准筛(80 目、100 目)混合器胶囊填充板四、实验方法1、阿司匹林的粉碎与过筛称取适量的阿司匹林原料药,放入粉碎机中粉碎。
将粉碎后的阿司匹林通过 80 目筛,收集筛下物备用。
2、辅料的准备称取适量的淀粉,通过 100 目筛,备用。
称取适量的滑石粉,备用。
3、混合将阿司匹林筛下物、淀粉和滑石粉按照一定比例放入混合器中,充分混合均匀。
4、填充胶囊将混合好的药物粉末置于胶囊填充板中,逐个填充空心胶囊。
五、实验过程1、首先,按照实验要求准确称取所需的阿司匹林原料药、淀粉和滑石粉。
在称量过程中,使用电子天平进行精确称量,确保物料的量符合配方要求。
2、对阿司匹林原料药进行粉碎处理,粉碎过程中注意控制粉碎的程度,避免过度粉碎导致药物性质改变。
粉碎完成后,用 80 目筛对药物进行筛选,去除过大的颗粒,以保证药物的粒度均匀。
3、接着,对淀粉进行过筛处理,使用 100 目筛,使淀粉的粒度更加细小,有利于在后续的混合过程中与阿司匹林充分混合。
4、将处理好的阿司匹林、淀粉和滑石粉按照预定的比例加入混合器中。
混合时,设定适当的混合时间和速度,以确保物料混合均匀。
为了验证混合的均匀性,可以在不同部位取样进行含量测定。
5、混合完成后,开始进行胶囊的填充操作。
将混合好的药物粉末小心地倒入胶囊填充板的孔中,然后使用胶囊填充工具将药物压实,并盖上胶囊帽。

一、实验目的1. 熟悉乙酰水杨酸(阿司匹林)的制备原理和方法。
2. 掌握固体药物片剂的制备工艺。
3. 了解片剂制备过程中可能遇到的问题及解决方法。
二、实验原理乙酰水杨酸(阿司匹林)是一种常用的非甾体抗炎药,具有解热、镇痛、抗炎、抗风湿等作用。
本实验采用水杨酸与乙酸酐在浓硫酸催化下反应制备乙酰水杨酸,然后将其与辅料混合,压制成片。
三、实验材料与仪器1. 实验材料:- 水杨酸(分析纯)- 乙酸酐(分析纯)- 浓硫酸(分析纯)- 碳酸氢钠(分析纯)- 淀粉浆- 硅藻土- 稀盐酸- 碳酸钙- 乳糖- 纯化水2. 实验仪器:- 烧杯- 搅拌器- 圆底烧瓶- 抽滤瓶- 离心机- 压片机- 干燥箱- 电子天平- 粉碎机四、实验步骤1. 乙酰水杨酸的制备- 在圆底烧瓶中加入2.0g水杨酸和5ml乙酸酐,然后逐滴加入5滴浓硫酸,充分搅拌,使水杨酸溶解。
- 将烧瓶置于水浴中加热,保持温度在85-90℃之间,缓慢搅拌,维持5-10分钟。
- 取出烧瓶,室温冷却,加入50ml水,搅拌,然后在冰水浴中冷却,并用玻璃棒摩擦瓶壁。
- 室温冷却无晶体析出,冰水浴冷却出现大量白色晶体。
- 抽滤,冷水洗涤几次,抽干粗产品。
- 将粗产品置于100ml烧杯中,缓慢加入25ml饱和NaHCO3溶液,不断搅拌。
固体大部分溶解,并产生大量气泡。
- 用无颈漏斗过滤,将滤液转移至100ml烧杯中,缓慢加入15ml 4mol/L的盐酸,边加边搅拌,然后置于冷水浴中。
- 加盐酸有大量气泡产生,在冷水浴中有白色晶体析出。
- 抽滤,并用冷水洗涤2-3次,抽干。
- 将晶体转移到表面皿上,干燥25分钟,称量。
2. 片剂的制备- 将乙酰水杨酸与淀粉浆、硅藻土、碳酸钙、乳糖等辅料混合均匀。
- 使用压片机将混合物压制成片剂。
- 将压好的片剂置于干燥箱中干燥,直至恒重。
五、实验结果与分析1. 乙酰水杨酸的制备:实验制备得到的乙酰水杨酸纯度较高,符合药用要求。
2. 片剂的制备:实验制备得到的片剂外观光滑,色泽均匀,硬度适中,符合药用要求。
阿司匹林颗粒剂的制备及含量测定学生姓名专业班级指导教师阿司匹林(Aspirin),又名乙酰水杨酸、醋柳酸(Acetylsalicylic Acid),其化学名为2一(乙酰氧基)苯甲酸,化学式为C9H8O4,是水杨酸的衍生物,白色结晶或结晶性粉末,无臭或微带醋酸臭,味微酸。
微溶于水(1:3000),其饱和水溶液加FeC1 试液即生成紫红色,阿司匹林易溶于乙醇(1:7),可溶于乙醚(1:20),氯仿(1:17)。
熔点为135%-140%。
在温润空气中能缓慢分解,游离出醋酸和水杨酸,内服后对胃略有刺激。
到目前为止,已应用百余年,近年来又发现了很多新用途,引起了人们的广泛关注。
阿司匹林为传统的解热镇痛抗炎药,包括阿司匹林钙脲、阿司匹林锌、赖氨酸阿司匹林,其剂型有片剂、水溶片、肠溶片、缓释片、泡腾片、胶囊剂、软膏剂、栓剂、散剂等。
在实验中,采用湿法制粒压片工制备阿司匹林片。
此工艺制备阿司匹林片有较强的可操作性和质量可靠性。
实验目的:通过实验掌握湿法制粒的工艺及含量测定方法,并对该处方、工艺进行评价。
方法:实验制备并进行含量测定。
[ 关键词]阿司匹林;湿法制粒;含量测定1 仪器和药品1.1 仪器:分析天平,酸碱滴定管,烘箱,电炉,药筛(80目、120目),尼龙筛(14目、16目),搪瓷盘,乳钵等。
1.2 药品阿司匹林(药用),淀粉(药用),酒石酸(药用),0.5mol/lNAOH溶液,0.25mol/l硫酸溶液。
2 阿司匹林制备2.1 处方阿司匹林30g,淀粉3g,酒石酸0.15g,10%淀粉浆(适量)。
2.2 制备2.2.1 10%淀粉浆的制备将酒石酸细粉溶于少量蒸馏水中,加入淀粉混匀,加水至100m1分散均匀,加热制作。
2.2.2 制粒取阿司匹林细粉与淀粉过80目筛,按“等量递加法”混合均匀,加10%淀粉浆(50±0.5℃)适量,制软材,用l8目尼龙筛制粒,于60℃鼓风干燥,3 含量测定水解后剩余滴定方法;取本品1.5g,精密称定加氢氧化钠滴定(0.5mol/l)50ml.混合,缓缓煮沸10min,放冷,加酚酞指示液,用硫酸滴定液(0.25mol/l)滴定剩余的氢氧化钠。
实验四片剂的制备及影响片剂质量因素的考察一、实验目的1.通过片剂制备,掌握湿法制粒压片的工艺过程。
2.掌握单冲压片机的使用方法及片剂质量的检查方法。
3.考察压片力及崩解剂等对片剂的硬度或崩解的影响。
二、实验指导片剂是应用最为广泛的药物剂型之一。
片剂的制备方法有制颗粒压片(分为湿法制粒和干法制粒),粉末直接压片和结晶直接压片。
其中,湿法制粒压片最为常见,现将传统湿法制粒压片的生产工艺过程介绍如下:整个流程中各工序都直接影响片剂的质量。
制备片剂的药物和辅料在使用前必须经过干燥,粉碎和过筛等处理,方可投料生产。
为了保证药物和辅料的混合均匀性以及适宜的溶出速度,药物的结晶须粉碎成细粉,一般要求粉末细度在100目以上。
向已混匀的粉料中加入适量的粘合剂或润湿剂,用手工或混合机混合均匀制软材,软材的干湿程度应适宜,除用微机自动控制外,也可凭经验掌握,即以“握之成团,轻压即散”为度。
软材可通过适宜的筛网制成均匀的颗粒。
过筛制得的颗粒一般要求较完整,如果颗粒中含细粉过多,说明粘合剂用量过少,若呈线条状,则说明粘合剂用量过太多。
这两种情况制成的颗粒烘干后,往往出现太松或太硬的现象,都不符合压片对颗粒的要求。
制好的湿颗粒应尽快干燥,干燥的温度由物料的性质而定,一般为50~60℃,对湿热稳定者,干燥温度可适当提高。
湿颗粒干燥后,需过筛整粒以便将粘结成块的颗粒散开,同时加入润滑剂和需外加法加入的崩解剂并与颗粒混匀。
整粒用筛的孔径与制粒时所用筛孔相同或略小。
压片前必须对干颗粒及粉末的混合物进行含量测定,然后根据颗粒所含主药的量计算片重。
()测得值干颗粒中主药百分含量标示量每片应含主药量片重=根据片重选择筛目与冲膜直径,其之间的常用关系可参考表1。
根据药物密度不同,可进行适当调整。
表1 根据片重可选的筛目与冲膜的尺寸筛目数片重 冲膜直径 (mg ) 湿粒 干粒 (mm ) 50 18 16-20 5-5.5 100 16 14-20 6-6.5 150 16 14-20 7-8 200 14 12-16 8-8.5 300 12 10-16 9-10.5500 10 10-12 12制成的片剂需按照中国药典规定的片剂质量标准进行检查。
xxx 大学生命与环境科学学院药剂学实验报告2014年6月15日乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Preparation and Dissolution Rate Determination of Acetyl Salicylic Acid ’s Tablet and Capsule乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Xxx(xxx大学生命与环境科学学院,北京,100081)摘要:目的制备乙酰水杨酸的片剂及胶囊剂,并测定两种乙酰水杨酸剂型溶出度。
方法:《中国药典》2005年版中溶出度测定的基本操作和数据处理方法,用紫外分光光度仪在303nm下测定不同时间溶出度。
结果:乙酰水杨酸的片剂溶出度大于其胶囊剂。
关键词:乙酰水杨酸;片剂;胶囊剂;溶出度Preparation and Dissolution Rate Determinationof Acetyl Salicylic Acid’s Tablet and Capsulexxx(College of Life and Environmental Science, xxx, Beijing, 100081)Abstract:Objective: To prepare the Acetyl Salicylic Acid’s tablet and capsule, and determine their dissolution rate. Method: Dissolution rate was determined according to Pharmaeopoeia of China (2005) by testing the light absorption value (A) spectrophotometrically at 530 nm. Result: the Acetyl Salicylic Acid tablet’s dissolution rateis more than that of capsule. Conclusion: provide the scientifical data for choosing the form of Acetyl Salicylic Acid.Keywords: Acetyl salicylic acid;tablet and capsule;dissolution rate前言【研究背景】药物的有效性,不仅取决于药物的有效成分及药物的化学结构,口服固体制剂的溶出度也是影响人体生物利用度的一个重要因素,两者有着明显的相关性,特别是难溶性药物,如乙酰水杨酸,由于颗粒大小或加入赋型剂不同,尽管口服剂量相同,疗效却存在很大差异。
溶出度测定法标准操作规程目的:建立溶出度测定法标准操作规程。
适用范围:溶出度测定。
责任:质检员实施本操作规程,检验室主任负责监督本规程正确执行。
程序:1.简述1.1溶出度(中国药典2000年版二部附录X C)是指药物从片剂或胶囊剂等口服固体制剂在规定溶剂中溶出的速度和程度。
它是评价药物口服固体制剂质量的一个指标,是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外简易试验方法。
1.2溶出度测定法是将某种固体制剂的一定量分别置于溶出度仪的转篮(或烧杯)中,在37.0±0.5℃恒温下,在规定的转速、溶剂中依法操作,在规定的时间内测定其溶出的量。
1.3本方法适用于片剂、胶囊剂及颗粒剂的测定。
1.4中国药典2000年版收载三种测定方法,第一法转篮法第二法桨法及第三法小杯法。
1.5凡检查溶出度的制剂,不再进行崩解时限的检查。
2.仪器与用具2.1溶出度仪2.1.1仪器的组成溶出度仪主要由电动机、恒温水浴、篮体、篮轴、搅拌桨、圆底烧杯及杯盖组成,详见中国药典2000年版二部附录X C。
2.1.2仪器的装置与使用按仪器使用说明书及中国药典的规定进行安装与使用。
2.1.3仪器的校正为使同一药物的溶出度测定得到良好的再现性,应对新安装的溶出度仪采用溶出度校正片进行校正,对已使用过的仪器也应定期(或在出现异常情况时)进行校正。
2.1.3.1溶出度校正片分崩解型和非崩解型两种,崩解型为泼尼松片,非崩解型为水杨酸片。
目前国内仅有非崩解型校正片。
2.1.3.2校正前,应先调式所用仪器。
2.1.3.3溶剂:磷酸盐缓冲液(PH7.4)。
配制方法见中国药典2000年版二部附录XV D,要求PH值为7.40±0.05,临用前脱气。
2.1.3.4对照品溶液的制备取溶出度校正用水杨酸片1片,精密称定,置乳体中,研细,精密称取适量(约相当于水杨酸10mg),置100ml量瓶中,加乙醇1ml,摇匀,加溶剂适量,经超声处理30分钟,使水杨酸溶解,加溶剂到刻度,摇匀,经滤纸(不宜使用滤膜)滤过,取续滤液为对照品溶液。
水杨酸片溶出度测定篮法水杨酸片溶出度测定篮法是一种常用于药物质量控制的重要方法。
下面将详细介绍该方法的操作步骤,以及一些需要注意的实验技巧。
首先,准备实验所需材料和仪器。
我们需要水杨酸片样品、溶出度测定篮、适量的溶剂、恒温槽、磁力搅拌器和紫外可见分光光度计。
然后,取一定数量的水杨酸片样品,称重并将其放入溶出度测定篮中。
注意,所取样品的数量应当与实际服用剂量相匹配,以确保测试结果的可靠性。
接下来,将溶出度测定篮放入预先加热至37℃的恒温槽中,并加入适量的溶剂。
溶剂的选择需根据水杨酸片所需的理化特性和药物溶出度条件而定,常见的溶剂有磷酸氢二钠溶液、仿生介质等。
然后,开启恒温槽并设置合适的搅拌速度,通常为100 rpm。
在放置恒温槽中一定时间后,取出溶出度测定篮,并将篮内溶剂进行混合均匀。
接下来,用紫外可见分光光度计检测溶液中水杨酸的浓度。
通过比较不同时间点的测定结果,就可以获得水杨酸片的溶出度,并绘制出溶出曲线。
在进行水杨酸片溶出度测定篮法实验时,需要注意以下几点。
首先,确保使用的仪器和材料完好无损,并且事先进行必要的校准操作,以保证结果的准确性。
其次,恒温槽的温度应稳定在37℃,并且固定搅拌速度不变。
此外,测定的时间点应选择合适,以便获取准确的溶出度数据。
水杨酸片溶出度测定篮法是一种成熟、可靠的测定方法,广泛应用于药物质量检测和研发领域。
通过该方法可以评估药物的溶出速率和溶出度特性,为制定合理的药品质量标准提供参考。
同时,该方法也为药物设计与开发提供了重要的信息。
总之,水杨酸片溶出度测定篮法是一种简单实用、全面可靠的药物质量控制方法。
在进行实验时需要注意操作规范,确保仪器和材料的质量以及实验条件的准确性。
这一方法为药物行业的研发和质量控制提供了重要的技术支持。
xxx大学生命与环境科学学院药剂学实验报告乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Preparation and Dissolution Rate Determination of Acetyl Salicylic Acid’s Tablet and Capsule姓名:xxx学号:xxx 年级:xxx专业:xxx小组成员:xxx指导教师:xxx2014年6月15日乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Xxx(xxx大学生命与环境科学学院,北京,100081)摘要:目的制备乙酰水杨酸的片剂及胶囊剂,并测定两种乙酰水杨酸剂型溶出度。
方法:《中国药典》2005年版中溶出度测定的基本操作和数据处理方法,用紫外分光光度仪在303nm下测定不同时间溶出度。
结果:乙酰水杨酸的片剂溶出度大于其胶囊剂。
关键词:乙酰水杨酸;片剂;胶囊剂;溶出度Preparation and Dissolution Rate Determinationof Acetyl Salicylic Acid’s Tablet and Capsulexxx(College of Life and Environmental Science, xxx, Beijing, 100081) Abstract:Objective: To prepare the Acetyl Salicylic Acid’s tablet and capsule, and determine their dissolution rate. Method: Dissolution rate was determined according to Pharmaeopoeia of China (2005) by testing the light absorption value (A) spectrophotometrically at 530 nm. Result: the Acetyl Salicylic Acid tablet’s dissolution rate is more than that of capsule. Conclusion: provide the scientifical data for choosing the form of Acetyl Salicylic Acid.Keywords: Acetyl salicylic acid;tablet and capsule;dissolution rate前言【研究背景】药物的有效性,不仅取决于药物的有效成分及药物的化学结构,口服固体制剂的溶出度也是影响人体生物利用度的一个重要因素,两者有着明显的相关性,特别是难溶性药物,如乙酰水杨酸,由于颗粒大小或加入赋型剂不同,尽管口服剂量相同,疗效却存在很大差异。
难溶性药物制剂是药典规定需要进行溶出度测定的药物类型之一,由于药物的生物利用度试验操作过程较溶出度试验复杂,因此,在实际工作中,对于具有良好体内外相关性的药物,通过测定体外溶出度来预测难溶性药物的体内生物利用度,进筛选制剂处方和控制其质量具有重要的意义。
乙酰水杨酸也叫阿司匹林,是一种历史悠久的解热镇痛药,用于治感冒、发热、头痛、牙痛、关节痛、风湿病,还能抑制血小板聚集,用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成,也可提高植物的出芽率,应用于血管形成术及旁路移植术也有效。
乙酰水杨酸微溶于水,属难溶性药物,其溶出度是重要的质控指标,2010 年版药典规定溶出度不得小于标示量的80%。
对难溶性药物(溶解度小于0.1~1mg%)而言,溶解是其主要过程,崩解时限往往不能作为判断难溶性药物制剂的吸收指标。
因此,对口服固体制剂,尤其是在体内吸收不良的难溶性药物的固体制剂、缓控释制剂,以及治疗量与中毒量接近的药物固体制剂,均应做溶出度检查。
《中国药典》和许多国家药典对口服固体制剂的溶出度及其测定方法都有明确的规定。
溶出度系指药物从片剂或胶囊剂等固体制剂中在规定溶剂中溶出的速度和程度。
是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外试验法。
口服固体制剂在体内胃肠液中需经崩解和溶解过程才能经生物膜被机体吸收,对许多药物而言,其吸收量通常与该药物从剂型中溶出的量成正比,即溶出的药物量愈大,吸收的药量就愈大,药效就愈强。
【研究原理】片剂系指药物与适宜的辅料均匀混合,通过制剂技术压制而成的圆片状或异形片状的固体制剂,可供内服和外用,是医疗中应用最广泛的剂型之一,它具有剂量准确、质量稳定、服用方便、成本低等优点。
片剂成形的原理:1、湿法制粒颗粒形成原理:粉末间相互结合成颗粒与粘附作用和内聚作用有关。
在制颗粒时,粉末间存在的水分可引起粉末的粘附,如果粉末间只有部分空隙充满液体,则所形成的液桥可以使粉末相结合;如果粉末间的空隙都充满液体,并延伸到主孔隙的边缘时,则颗粒表面的表面张力及整个液体空间的毛细管吸力可使粉末结合;当粉末表面完全被液体包围时,粉末可凭借液滴表面张力彼此结合。
湿粒干燥后,粉末间形成固体桥,加强了粉末的结合。
对于无水的药物粉末,颗粒中粉末之间分子间力的作用很强,可使颗粒保持必要的强度。
2、颗粒压制成形的机理:1.机械力的作用,又称齿合力;2.粒子间力的作用;3.压缩致片剂组分熔融形成固体桥;4.可溶性成分重结晶形成固体桥。
制片的方法有制颗粒压片、结晶直接压片和粉末直接压片等。
制颗粒的方法又分为干法和湿法。
现将常用的湿法制粒压片的工艺流程介绍如下。
湿法制粒压片的工艺流程:制成的片剂需要按照药典规定的片剂质量标准进行检查。
检查的项目,除片剂的外观应完整光洁、色泽均匀,且有适当的硬度外,必须检查重量差异和崩解时限。
有的片剂药典还规定检查溶出度和含量均匀度。
并明确凡检查溶出度的片剂,不再检查崩解时限;凡检查含量均匀度的片剂,不再检查重量差异。
片剂重量差异、崩解时限和含量均匀度检查见2000版药典二部附录5~6页和72页,75~78页。
片剂压缩成形性的评价方法:1、硬度与抗张强度(TS):硬度是片剂的径向破碎力(kN),常用孟山都硬度计,硬度测定仪等测定。
抗张强度是表示单位面积的破碎力(kPa或MPa)。
抗张强度的大小反应物料的结合力和压缩成形性的好坏。
2、脆碎度(breakage,Bk):片剂受到震动或磨擦之后容易引起碎片,顶裂,破裂等。
脆碎度反映片剂的抗磨损震动能力,也是片剂质量标准检查的重要项目。
常用Roche脆碎度测定仪。
3、弹性复原率(elastic recovery,ER):将片剂从模中推出后,由于内应力的作用发生弹性膨胀。
把这种现象称为弹性复原或弹性后效。
弹性复原率是将片剂从模孔中推出后弹性膨胀引起的体积增加值和片剂在最大压力下的体积之比。
一般药物片剂的弹性复原率在2~10%,如果药物的弹性复原率较大,片剂的硬度低,甚至易于裂片,可加入可压性好的辅料以改善压缩成形性,裂片现象。
胶囊剂系指药物或加有辅料充填于空心胶囊或密封于软质囊材中制成的固体制剂。
主要供口服用,也可用于直肠、阴道等。
空胶囊的主要材料为明胶,也可用甲基纤维素、海藻酸盐类、聚乙烯醇、变性明胶及其他高分子化合物,以改变胶囊的溶解性或达到肠溶的目的。
根据胶囊剂的硬度与溶解和释放特性,胶囊剂可分为硬胶囊与软胶囊、肠溶胶囊和缓释胶囊。
硬胶囊剂的一般制备工艺流程为:1.空胶囊与内容物准备空胶囊分上下两节,分别称为囊帽与囊体。
空胶囊根据有无颜色,分为无色透明、有色透明与不透明三种类型;根据锁扣类型,分为普通型与锁口型两类;根据大小,分为000、00、0、1、2、3、4、5号八种规格,其中000号最大,5号最小,常用的为0号规格。
内容物可根据药物性质和临床需要制备成不同形式的内容物,主要有粉末、颗粒和微丸三种形式。
2.充填空胶囊大量生产可用全自动胶囊充填机充填药物,填充好的药物使用胶囊抛光机清除吸附在胶囊外壁上的细粉,使胶囊光洁。
小量试制可用胶囊充填板或手工充填药物,充填好的胶囊用洁净的纱布包起,轻轻搓滚,使胶囊光亮。
3.质量检查充填的胶囊进行含量测定、崩解时限、装量差异、水分、微生物限度等项目的检查。
胶囊剂的装量差异检查方法:取供试品20粒,分别精密称定重量后,倾出内容物,硬胶囊用小刷或其他适宜的用具拭净;再分别精密称定囊壳重量,求出每粒内容物的装量与平均装量。
按规定,超出装量差异限度的不得多于2粒,并不得有1粒超出限度1倍。
表1 胶囊剂装量差异限度平均装量装量差异限度0.3g以下±10%0.3g及0.3g以上±7.5%4.包装及贴标签质量检查合格后,定量分装于适当的洁净容器中,加贴符合要求的标签。
【研究目的】制备乙酰水杨酸片剂及胶囊剂,测定固体制剂(片剂、胶囊)溶出度。
1.材料和方法1.1 实验仪器天平、方瓷盘、研钵、不锈钢筛(14目~16目)、烘箱、空胶囊、s-100孔胶囊灌装器、天平、洁净的纱布、刀、指套、称量纸、药匙、圆口PE药用瓶子1.2 实验试剂乙酰水杨酸、淀粉、糊精、蔗糖粉、滑石粉、药物粉末、液状石蜡1.3试验方法1.3.1 乙酰水杨酸片剂的制备1.处方:乙酰水杨酸:20g(主药)、淀粉:280g(填充剂)、糊精:80g(填充剂)、蔗糖粉:40g(填充剂)、10%淀粉浆:适量(粘合剂)、滑石粉:5g(润滑剂)2.制法:乙酰水杨酸细粉与淀粉、糊精、滑石粉、蔗糖粉(需研磨至均匀、细粉、无结块),用等量递加法于研钵中研磨混合、混合均匀后,加淀粉,混匀后,通过100目筛得颗粒,以Ф8mm冲模压片。
3.片重差异:取药片20片,精密称定总重量,求得平均片重后,再分别精密称定各片的重量。
每片重量与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较)超出重量差异限度(见表1)的药片不得多于2片,并不得有1片超出限度1倍。
片重差异(±%)=100平均片重单片重-平均片重表2 重量差异限度平均片重重量差异限度0.30g以下±7.5%0.30g或0.30g以上±5%1.3.2 乙酰水杨酸胶囊剂的制备板装法:将胶囊体插入胶囊板中,将药粉置于胶囊板上,轻轻敲动胶囊板,使药粉落入胶囊壳中,至全部胶囊壳中都装满药粉后,套上胶囊帽。
装量差异检查:①先将20粒胶囊分别精密称定重量②再将内容物完全倾出,再分别精密称定囊壳重量③求出每粒内容物的装量与平均装量④将每粒装量与平均装量进行比较,超出装量差异限度的不得多于2粒,并不得有1粒超出装量差异限度的1倍,则装量差异检查合格。
1.3.3 溶出度测定按中国药典2010 年版,第一法( 转蓝法) 测定,溶出介质:稀盐酸( 取盐酸24 mL 稀释成1 000 mL)。
转速100 r/min,温度( 37±0.5) ℃,经5 min,15 min,30 min,45 min,60 min,取溶液10 mL滤过,每次取样后加溶出空白介质10 mL,精密量取续滤液3 mL 置50 mL 容量瓶中,加0.4% NaOH 液5 mL,置水浴上煮沸5 min,放冷,加稀H2SO4 2.5 mL,并用蒸馏水补至刻度,摇匀。