专题2 从海水中获得的化学物质第二单元钠第一课时
- 格式:doc
- 大小:22.50 KB
- 文档页数:4
2019-2020年高中化学专题2 从海水中获得的化学物质第二单元钠、镁及其化合物教案(3)苏教版必修1
[教学过程]
[反思与总结]
1.教学需要有精品意识,本节课是在观摩优质课评比后,借鉴了几个优秀片段,并融合了个人的教学思想形成的教学设计。
2.教学需要有情景意识,教师要在教学实践中,充分挖掘生活素材,理论联系实际,创设恰当的“最近发展区”,激发学生强烈的参与意识和浓厚的学习兴趣,开展有效教学。
3.教学需要有交流意识,本节课在板书设计上主要由学生书写结论,教师只作必要的补充,学生对知识点获取自然流畅,由此可见,互动、合作、讨论交流、经验和成果的分离对于转变学习方式,实现教学相长至关重要。


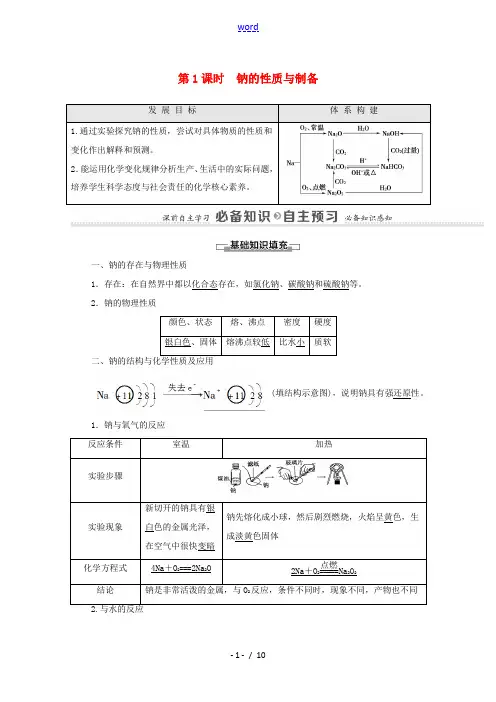
第1课时 钠的性质与制备发 展 目 标体 系 构 建1.通过实验探究钠的性质,尝试对具体物质的性质和变化作出解释和预测。
2.能运用化学变化规律分析生产、生活中的实际问题,培养学生科学态度与社会责任的化学核心素养。
一、钠的存在与物理性质1.存在:在自然界中都以化合态存在,如氯化钠、碳酸钠和硫酸钠等。
2.钠的物理性质颜色、状态 熔、沸点 密度 硬度银白色、固体 熔沸点较低 比水小 质软二、钠的结构与化学性质及应用(填结构示意图),说明钠具有强还原性。
1.钠与氧气的反应反应条件 室温 加热实验步骤实验现象 新切开的钠具有银白色的金属光泽,在空气中很快变暗钠先熔化成小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体化学方程式4Na +O 2===2Na 2O 2Na +O 2=====点燃Na 2O 2 结论 钠是非常活泼的金属,与O 2反应,条件不同时,现象不同,产物也不同实验现象解释 钠浮在水面上钠的密度比水小 与水反应发出“嘶嘶〞响声钠与水反应生成气体 钠熔化成闪亮的小球钠熔点低,反应放热 小球在水面上迅速游动,逐渐变小,最后消失反应产生的气体推动小球运动 反应后溶液的颜色逐渐变红 钠与水反应生成碱钠与水剧烈反应,生成NaOH 和H 2:2Na +2H 2O===2NaOH +H 2↑3.与熔融的金属卤化物反应Na 与熔融的TiCl 4反应的方程式为4Na +TiCl 4==========700~800 ℃4NaCl +Ti 。
4.钠的制备与应用(1)制备:电解熔融的氯化钠,反应方程式为2NaCl(熔融)=====通电2Na +Cl 2↑。
(2)用途:①冶炼金属。
②高压钠灯:其特点是黄光射程远,透雾能力强。
③钠钾合金:在常温下为液体,可用作快中子反应堆的热交换剂。
将一块钠投入到少量的盐酸中,发生哪些反应?写出反应的化学方程式。
[提示] 钠先与HCl 反应,过量的钠再与水反应。
反应的化学方程式分别为2Na +2HCl===2NaCl +H 2↑,2Na +2H 2O===2NaOH +H 2↑。

金属钠的性质与应用教学过程●活动1:创设情景,引入课题[新闻资料]我们说生活之中有化学。
如果大家平常多关注新闻,可以看到许多与化学有关的问题。
阅读下面一段新闻,思考你从中发现或想到什么化学问题?网上信息摘录:若干神秘“水雷”惊现珠江。
2020年7月7日,在珠江石溪附近,前前后后共飘着七个白色的来历不明的金属桶。
突然,从飘在水面上的一个金属桶内冒起一股白烟,窜起亮黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起,这个铁桶接着又连续爆炸了多次,爆炸腾起的白色烟雾有近十米高,还有许多未燃尽的白烟飘进旁边的公司内,这些灰白色的物体一遇到水就不停地冒泡,有时甚至还突然着火。
据悉,其中另有一铁桶被过往船只发现,并将其打捞上船,打算清洗后使用,但当船员把盖子打开后,桶内冒起浓浓白烟,一接触桶内物质,双手立即感到剧烈地疼痛,于是他们又将其推入江里,一遇水,这个桶就又爆炸了。
所幸该船只迅速逃离,伤亡不大。
珠江水面上尚有五个一触即发的“水雷”漂浮着,消防队员、民警及广州化工集团的化学品专家赶来凑在一起,紧张地调查爆炸物的性质及研究“水雷”的处置对策。
/news/getInfo.asp?id=17681[问题讨论]:1。
引起爆炸的物质是什么?2。
为什么会发生爆炸(金属桶为什么会成为水雷)?3。
如何防止爆炸(另五个没有爆炸的金属桶如何处理)?4。
事故的启示是什么?生1:引起爆炸的物质可能是钠,因信息中“窜起亮黄色火苗”是钠元素的特征焰色反应。
发生爆炸是因为钠与水发生了反应。
生2:发生爆炸应该是钠与水反应生成了大量的气体,气体膨胀就产生了爆炸。
生3:也有可能钠是爆炸物。
生4:也有可能钠与水反应的生成产物是爆炸物。
……师:非常好,同学们提出很多的想法。
钠是怎么样的物质?它能与水反应吗?若反应又生成什么呢?让我们通过实验来说明吧。
●活动2:实验演示,科学探究[实验](投影)取出一块钠,用滤纸吸干表面的煤油,再用小刀切成一小块钠,投入盛有滴入几滴酚酞试液的水的玻璃皿中。

金属钠的性质与应用一、教材分析本节课是苏教版高一《化学·必修1》专题二——《从海水中获得的化学物质》的第二单元教学内容中的一部分,第一课时《金属钠的性质与应用》的学习。
通过对“钠”这种代表性元素的学习,旨在向学生介绍金属元素的学习方法,在高中化学中占有重要位置,也是高考重要的考点之一,钠和水反应探究实验具有重要意义。
本节内容通过钠和水反应实验,进一步加深和提高其元素化合物的物理性质、化学性质、保存方法及其用途。
二、教学目标1、知识与技能:(1)描述钠与水、氧气反应现象(2)理解钠与水、氧气反应实质(3)使学生知道化学反应是可以通过改变反应条件而发生不同变化的2.过程与方法(1)通过实验探究认识钠的有关性质;学会科学、合理地运用观察方法,体会实验方法在化学研究中的重要用。
(2)鼓励学生大胆预测,给学生一些开放性的问题。
利用实验现象引导学生发现问题、解决问题。
(3)通过对实验现象的观察和分析,培养学生对实验现象的分析并形成结论的能力。
3.情感态度与价值观(1)通过实验探究培养学生严谨、认真的科学方法观;(2)通过学习,认识化学知识在处理公共危险事故中的重要作用。
(3)对学生进行素质教育,激发学生学习化学的兴趣,培养学生的探究能力。
三、学情分析在初中阶段,学生已学过燃烧的三要素,通过上节对金属活动顺序和氧化还原反应的学习,学生普遍具有研究的热情、学生对实验探究有着浓厚的兴趣、。
钠是一种性质活泼的金属,大部分金属在一定条件下可以跟氧气反应。
通过学习第一章,学生已掌握了一些实验操作基本技能,学生已经知道了学习元素单质及其化合物知识的一般方法和思路,具有一定的实际动手和分析问题的能力。
所以本节课中,我将多设疑问和探索性实验,引导和激发学生动起手来。
四、教学重点、难点金属钠的化学性质;对实验现象的观察和分析五、教学过程【魔术】教师表演化学小魔术:“滴水生火”(课前在酒精灯灯芯里暗藏一小块钠,实验时用胶头滴管在灯芯内滴一滴水)。


专题二从海水中获得的化学物质第二单元钠、镁及其化合物钠的物理性质:银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。
钠的化学性质:1.钠与水反应加盖玻璃片。
观察到的现象及由现象得出的结论有:(1)钠浮在水面上(钠的密度比水小)(2)钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低)(3)钠在水面上四处游动(有气体生成)(4)发出嘶嘶的响声(生成了气体,反应剧烈)(5)事先滴有酚酞试液的水变红(有碱生成)反应方程式:2Na+2H2O=2NaOH+H2↑2.钠与氧气反应在常温时:4Na+O2=2Na2O (白色粉末)在点燃时:2Na+O2=△=Na2O2 (淡黄色粉末)3.钠与钛、锆、铌等金属氯化物反应4Na+TiCl4==熔融==4NaCl+Ti(条件为高温且需要氩气做保护气)补充4.与酸溶液反应钠与水反应本质是和水中氢离子的反应,所以钠与盐酸反应,不是先和水反应,钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应:2Na+2HCl=2NaCl+H2↑ 如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应。
5.与盐溶液反应将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。
如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓钠的制取:电解熔融氯化钠2NaCl(熔融)=电解=2Na+Cl2↑钠的化合物1.碳酸钠与碳酸氢钠的性质比较2.区分碳酸钠与碳酸氢钠的方法⑴加热固体。
产生能使石灰水变浑浊的无色气体的是碳酸氢钠。
2NaHCO3 = Na2CO3 + H2O + CO2⑵溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓⑶在固体中加入相同浓度的盐酸,反应剧烈的是碳酸氢钠。
侯氏制碱法反应原理NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl2NaHCO3△Na2CO3+H2O+CO2↑离子反应强电解质:强酸(硫酸、盐酸、硝酸)、强碱(氢氧化钠、氢氧化钾)、大多数盐在水溶液中完全电离的一类电解质。
第二章海水中的重要元素——钠和氯第一节钠及其化合物教师:海洋是一个巨大的化学资源宝库,含有80多种元素。
钠是其中含量较高的元素,也是典型的金属元素。
(展示图片)教师:钠元素在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等,钠的单质可以通过化学反应式制得。
(展示图片)教师提问:钠有哪些性质呢?(展示图教师利用多媒体设备向学生投影出下面思考讨论:实验室中,通常把钠保存在石蜡油或煤油中,以隔绝空气。
(展示被保存的钠的图片)教师提出疑问:为什么要把钠保存在石蜡油或煤油中呢?教师:从钠的原子结构来看,它的原子的最外层电子层上只有一个电子,该电子很容易在化学反应中丢失。
教师总结:钠的化学性质非常活泼表现出很强的还原性。
思考讨论:教师:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
(展示图片并向同学们演示该过程)教师:这里要注意,不要用手直接接触钠,而要用镊子夹取。
新课讲解:钠的物理性质:①质软,能用刀切割②具有银白色金属光泽③熔点:℃④沸点:883℃⑤密度:3新课讲解:钠的化学性质:钠和氧气反应教师:用新切开的钠的光亮的表面很快变暗了,这是因为钠与氧气发生反应,在钠的表面生成了一薄层氧化物,这种氧化物是氧化钠。
(展示图片中的反应方程)思考讨论:教师:裸露在空气中的钠就能直接和氧气反应,钠的化学性质十分活泼。
如果将钠加热,又会发生什么变化呢?思考讨论:教师:将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。
(边讲解边演示该操作)思考讨论:教师:继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
注:不要近距离俯视坩埚(边讲解边演示该操作)。
新课讲解:钠的化学性质:钠和氧气反应教师:钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体。
这种淡黄色固体是过氧化钠(Na2O2)。
(边讲解边演示该操作)。


专题2 从海水中获得的化学物质第二单元钠第一课时【中图分类号】g633.8 【文献标识码】a 【文章编号】2095-3089(2012)07-0189-02
1.设计思想:
利用自然界和生产生活的背景进行元素化合物知识的教学,体现从“生活走进化学,从化学走向社会”,以此激发学生发现问题、提出问题、分析问题和解决问题的兴趣,从而培养创新意识和创造能力。
实验探究教学是以实验为中心的探究教学,把实验作为提出问题、探究问题的重要途径和手段。
2.教材分析:
《课程标准》的要求:根据生产生活中的应用实例或通过实验探究,了解钠等金属及其重要化合物的主要性质。
本节课内容主要从2 个方面: 钠的物理性质、钠的化学性质,并安排了钠的有关性质的探究实验,也使学生感受到化学物质的丰富多彩。
3.学情分析:
在前面学生已学习了氧化还原反应理论、钠原子的结构示意图,为理解钠的化学性质,认识钠的活泼性奠定了理论基础;通过对本节钠与水的反应实验合理的探究,能对产生现象的原因进行合理解释。
4.教学目标:
知识目标:了解钠的物理性质;理解和掌握钠的化学性质;了解钠的存在和用途。
能力目标:1.通过学习和实验,培养学生动手能力及观察分析问题的能力;2.培养学生分析原有知识、归纳类比的能力。
思想情感:通过实验培养学生学习化学的兴趣,培养学生严谨求实的科学态度。
科学方法:科学的观察法、实事求是的实验态度。
5.重点、难点:钠的化学性质。
6.教学方法:实验探究法、情境设计、启发思维、分析、归纳
7.教学软件环境:powerpoint2003、windowsxp操作系统
实验用品:钠、酚酞、小刀、镊子、滤纸、烧杯、玻璃试管、大头针、玻片、三脚架、泥三角、坩埚、坩埚钳、石棉网、酒精灯、火柴等
8.教学过程设计:
9.教学反思:
本节课主要是通过对钠的性质的课堂教学,让学生掌握钠与水、盐溶液的反应。
教学中一开始以滴水点灯实验引入新课,以创设学习情景,把学生思路带入探究的内容中,激发学生学习和探究的兴趣。
然后探究钠与水的反应,主要是通过学生假设→设计方案→实验→获得结论,在问题的思考中提高学生的思维能力,在实验中同时培养学生动手能力;通过这一学习过程的体验,让学生感悟所学知识。
从过程中引导学生发现问题,激发他们解决问题的强烈愿望,来调动学生的学习积极性;在问题解决过程中让学生感受科学探究的一般方法。
在一次探究中出现与原有知识矛盾时,再引入对新问题的探讨。
通过学生的提问,用产生的学习新矛盾引入新的学习探究领域,再通过分析、设计、实验由学生得出结论。
通过对比实验,从实验教学来挖掘学生认知内驱力,让学生共同通过层层推进,使学生获得新知。
最后通过课后的探究思考,将探究活动延伸到课外,有利于学生思考。
与学生多交流是取得信息反馈成功的关键,学生在学习本课遇到的困难和问题:
(1)学生观察能力尚有不足,对实验现象的观察不全面。
(2)表达能力不足,对实验现象的描述和现象的解释可能会辞不达意。
板书:第二单元钠
一、钠的物理性质
1.色、态:银白色光泽、固体;
2. 硬度:较小;
3.密度:比水小,比煤油大;
4.熔、沸点:较低;
5.导热、导电性:良好。
二、钠的化学性质
1.与非金属单质反应
(1)与硫反应2na+s = na2s(研磨可能爆炸)
(2)与氧气反应
常温下:4na + o2 = 2na2o(白色)
加热或点燃:2na + o2 na2o2(淡黄色)
2.与水反应 2na + 2h2o 2naoh + h2↑
三、钠的用途
课后作业:课本57页1、5题。