氯气的性质
- 格式:doc
- 大小:167.50 KB
- 文档页数:3



氯气的化学性质氯气(Cl2)是一种常见的卤素元素,具有一系列特殊的化学性质。
在本文中,将详细介绍氯气的化学性质。
1. 氯气的物理性质氯气是一种黄绿色的气体,具有刺激性气味。
它的密度比空气大约2.5倍,可溶于水,与大多数有机物和无机物反应。
氯气有较高的沸点和凝固点,沸点为-34.04℃,凝固点为-101.5℃。
2. 氯气的燃烧性质氯气具有较强的氧化性,可与许多物质发生燃烧反应。
当氯气与可燃物质接触时,常常会引发剧烈的反应。
例如,当氯气与石油、木材、纸张等可燃材料接触时,会迅速燃烧产生火焰。
3. 氯气的反应性氯气是一种非常活泼的元素,与大多数金属和非金属元素反应产生化合物。
与金属反应时,氯气会接替金属原子中的电子,从而形成金属离子和氯离子。
与非金属反应时,氯气会直接与非金属原子共享电子,形成共价键化合物。
4. 氯气与水的反应氯气与水反应时,会形成盐酸(HCl)。
这是一种强酸,可与许多金属和碱发生反应。
由于盐酸的腐蚀性强,使用氯气时需要注意安全,避免与水接触导致酸性溶液的形成。
5. 氯气的氧化性氯气的氧化性强,可以氧化许多物质。
例如,与一些金属反应时,氯气会将金属氧化为金属离子。
与某些有机物反应时,氯气可以氧化有机物中的羟基(-OH)为酮基(C=O)。
6. 氯气的漂白性氯气是一种强力漂白剂,可以将许多有色物质漂白。
当氯气与有机染料等物质接触时,它会使有色物质分解或失去吸收特定波长光线的能力,从而导致褪色或变白现象。
7. 氯气的水处理应用氯气广泛应用于水处理领域。
在水处理过程中,氯气可以消除水中的细菌、病毒和其他微生物,达到杀菌消毒的作用。
然而,由于氯气的致癌性和对环境的负面影响,近年来逐渐被其他更环保、更安全的水处理方法所取代。
总结:氯气具有很多独特的化学性质,包括燃烧性质、反应性、氧化性、漂白性等。
它可以与许多物质发生反应,产生新的化合物。
在水处理领域,氯气曾广泛应用于杀菌消毒,但由于其有害性和环境影响,目前正逐渐被其他替代方法所取代。
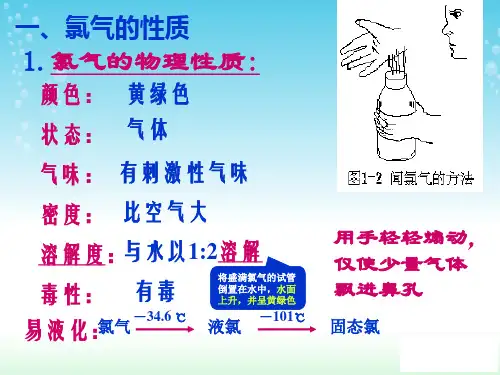


氯气的性质一.物理性质在通常情况下,氯气是一种、有气味的气体;密度比空气,溶于水(),但难溶于饱和食盐水;易液化(液氯)。
二.化学性质氯原子最外层有个电子,易得电子,化学性质。
★1、与金属反应与铁反应:现象:。
注意:反应只生成FeCl3,常温下,干燥的Cl2不与Fe反应,液氯可用钢瓶贮存。
与铜反应:现象:[归纳]2、与非金属反应与氢气反应:现象:注意:烟与雾的区别:燃烧:3、与水反应(1)氯水的性质实验(2)验证新制氯水中的微粒:Cl2:Cl-:H+:HClO:(3)新制氯水、久置氯水、液氯比较(4)次氯酸(HClO)的性质:a.强氧化性:★注意:b.弱酸性:c.不稳定性:4、与碱反应(1)与NaOH的反应:(用于实验中尾气的吸收)(2)与石灰乳的反应:(工业上制取漂白粉)漂白粉的主要成分为:有效成分为:漂白粉的漂白原理:漂白粉的失效原理:漂白粉的保存:5、与还原性物质反应三、氯气的用途1、制氯化物2、制漂白剂:氯水、漂白粉、二氧化氯3、冶炼金属4、制药物、染料5、制塑料:聚氯乙烯、氯丁橡胶例题:1.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3 ()2. 检验氯化氢气体中是否有氯气,可采用的方法是()A.用湿润的淀粉碘化钾试纸B.用干燥有色布条C.将气体通入硝酸银溶液D.用干燥的蓝色石蕊试纸3. 除去Cl2中混有的少量HCl气体,可将气体通入()A.饱和NaH CO3溶液B. NaOH溶液C.饱和NaCl溶液D. 澄清石灰水4. 自来水一般是用少量的氯气消毒。
下列哪些药品不能用自来水配制。
A、Na2SO4B、NaClC、AgNO3D、K2CO3 ()。


氯气的性质及应用氯气是一种黄绿色的有毒气体,具有刺激性气味。
下面将详细介绍氯气的性质及其应用。
1. 氯气的性质:氯气的化学式为Cl2,是一种非常活泼的元素。
它在常温下是一种气体,密度较空气大,稍微溶于水。
在高温下,氯气可以与金属直接反应,生成金属氯化物。
氯气有毒,长时间接触或高浓度吸入氯气会对人体、植物和动物造成伤害。
此外,氯气也是一种强氧化剂,它能与许多有机物反应。
2. 氯气的应用:2.1 消毒剂和漂白剂:由于氯气具有杀菌和漂白的作用,它被广泛应用于消毒剂和漂白剂的生产。
氯气可以杀死细菌、病毒和其他有害微生物,因此被用于水处理、游泳池消毒和医疗卫生等方面。
同时,氯气也可以将物体上的颜色去除,使其变得洁白。
2.2 合成化学品的制造:氯气在合成化学品的生产中发挥着重要的作用。
它可以与其他物质反应,产生许多重要的化学品,例如氢氯酸、氯化铝、氯乙烯。
这些化学品被广泛用于塑料、橡胶、药品、农药和合成纤维等行业。
2.3 金属提取:氯气可以与金属直接反应,提取出一些金属。
例如,氯气可以与铁反应,生成铁(Ⅲ)氯化物和铁(Ⅱ)氯化物。
这种反应被用于铁的冶炼和处理,以及其他一些金属的提取。
2.4 食品加工:氯气在食品加工和制造中也有应用。
例如,在饮用水处理中,氯气可以杀死水中的细菌和病毒,保证水的安全。
此外,氯气还可以用于食品加工中对食品进行消毒和保鲜处理。
2.5 制冷剂:氯气也是一种常用的制冷剂。
在冷冻和空调系统中,氯气可以通过压缩和膨胀循环,吸收和释放热量,从而实现空间的制冷效果。
2.6 化学分析:氯气可以用于化学分析中的一些实验。
例如,氯气可以用于检测水中的溶解氧含量,以及一些有机化合物的定量分析。
3. 对环境和人体的影响:由于氯气具有毒性,长时间接触或高浓度吸入氯气会对人体和环境造成伤害。
人体吸入氯气后会引起呼吸系统和眼睛的刺激,高浓度氯气还会损害肺部和中枢神经系统。
此外,氯气也会对大气和水源造成污染,对生态系统产生负面影响。

氯气的物理化学性质氯气(Cl2)是一种黄绿色的气体,具有独特的物理化学性质。
本文将重点介绍氯气的物理性质和化学性质,并探讨其在实际应用中的一些特点。
一、物理性质1. 外观:氯气是一种黄绿色的气体,具有刺激性气味。
它可以溶于水,形成氯水溶液。
在低温下,氯气会变成液体或固体形态。
2. 密度:氯气的密度比空气大约2.5倍,这使其能够在空气中较高的位置扩散。
氯气的密度较大也使其在液化和运输过程中需要特殊的处理方法。
3. 熔点和沸点:氯气的熔点约为-101摄氏度,沸点约为-34摄氏度。
这使得氯气在常温下能够以气体的形态存在,方便了其使用和储存。
4. 可燃性:氯气本身是不可燃的物质。
然而,氯气具有较强的氧化性,可以与其他可燃物质反应,加剧燃烧过程,甚至引发爆炸。
二、化学性质1. 强氧化性:氯气是一种强氧化剂,可以与许多物质发生氧化反应。
例如,氯气可以与金属反应,形成相应的金属氯化物。
它还可以与有机物反应,引发发色、分解或燃烧等化学变化。
2. 漂白性:由于氯气的强氧化性,它被广泛用作漂白剂。
氯气可以去除物体表面的颜色,从而使其变得更加洁白。
然而,由于其刺激性和毒性,氯气在工业生产中的使用受到了严格的监管。
3. 反应活性:氯气具有较高的反应活性,容易与其他物质反应。
它可以与氢气反应,形成氯化氢。
此外,氯气还可以与水反应,生成盐酸和次氯酸等物质。
三、实际应用1. 漂白剂:由于氯气具有强大的漂白性质,它被广泛用于纺织、造纸和食品加工等行业中。
氯气可以去除色素和杂质,提高产品的质量。
2. 消毒剂:氯气的高氧化性使其成为一种有效的消毒剂。
氯气可以杀灭细菌、病毒和其他微生物,用于水处理、医疗卫生和食品加工等领域。
3. 化学反应:由于氯气的活泼性,它可用于金属冶炼、有机合成和制药等领域。
例如,氯气可以与铝反应,生成氯化铝,用作催化剂。
此外,氯气还被用于制造氯化橡胶和消防泡沫等特殊化学产品。
综上所述,氯气作为一种重要的化学物质,具有独特的物理化学性质。

氯气Chlorine的理化性质氯气(Chlorine)是一种化学元素,其化学符号为Cl,原子序数为17,属于卤族元素。
它是一种黄绿色的气体,在标准状态下是一种二原子分子,具有强烈的刺激性气味。
在自然界中,氯气主要以盐酸形式存在于海水和地球上的盐矿中。
下面将介绍氯气的理化性质。
1.物理性质:氯气是一种无色、刺鼻的气体,臭氧的味道。
它的沸点为-34℃,密度为3.214 g/L,相对分子质量为70.91。
在常温常压下,氯气几乎不溶于水,但在低温下会与水反应生成氢氧化氯(HClO)和盐酸(HCl)等物质。
氯气的熔点为-101℃,主要形成液态。
2.化学性质:氯气是一种高度活泼的元素,在大部分数种环境下都会与其他元素发生化学反应。
以下是它的一些主要化学性质:(1) 氧化性氯气具有强烈的氧化能力。
它与金属、非金属元素或化合物发生反应,释放出氯分子或离子,同时让其他原子或分子氧化。
例如当氯气与锌发生反应时,就能生成锌氯化物。
(2) 还原性氯气在化学反应中也具有还原性。
当氯气与其他化合物作用时,会将一部分电子传递给其他原子或分子,促使它们达成化学平衡。
(3) 性质进一步当氯气与水反应时,生成的氯离子可形成一系列氧化态,如HClO、HClO2、HClO3和HClO4。
这些化合物在中和、氧化和消毒方面很有用。
3.毒性:氯气具有强烈的毒性。
它是二次世界大战中首次使用的化学武器之一,也被广泛应用于消毒、漂白和水处理等领域。
但是,与氯气接触的人会出现眼睛、喉咙、呼吸系统和肺部等部位感到刺痛的现象,严重时会导致肺水肿和窒息。
因此,氯气应谨慎使用,并应采取必要的防护措施。
氯气作为一种化学元素,具有强烈的化学反应性和毒性。
它的化学性质是它在实际应用中被广泛应用的原因之一。
但是,由于其强烈的毒性和损坏作用,必须在使用时采取特殊的防护措施。
氯气的化学性质氯是一种无色、有强烈腐蚀性的气体。
它是无色、无味、无色的气体,具有极强的氧化性、吸湿性和腐蚀性。
氯与氧化剂和还原剂都能发生反应而产生氯气和臭氧的混合物。
氯具有强烈的腐蚀性,在使用氯气时要注意防护避免吸入性损伤。
1.氯的氧化性氯气是一种强氧化剂,有极强的氧化能力。
氯能与大多数金属离子发生反应。
氯还能与其他金属发生化学反应,生成剧毒的金属镉或强腐蚀性试剂等。
在水中溶解度很小。
在弱酸中有溶解的特性。
氯的氧化性与它的吸湿性有关。
在酸性条件下能将有机酸氧化成无色或淡黄色液体;在碱性条件下能变为褐色或黄绿色等碱性物质生成氯气。
氯能溶于水,在碱性条件下也能分解生成氯酸。
所以氯具有很强的氧化性。
当氯气遇到氧气或其他气体时即生成臭氧。
2.氯气对金属的腐蚀性氯气具有强烈的腐蚀性,金属的最大允许腐蚀浓度为2.3%,最大允许腐蚀浓度为0.1%.氯化物的最大允许腐蚀性浓度为2.3%。
氯气与金属发生作用,会使金属氧化物被氧化而使金属表面产生腐蚀产物。
如金属与氯气发生反应形成的盐类腐蚀也是比较严重的。
氯气可腐蚀金属制品:如铜合金铝镁合金(含钛)和镁合金(含铝)等。
3.氯的吸湿性氯气与水反应,生成氯和水;与氢、氧反应,生成氯气和氧气;与水反应形成氯气和水化合物、碳酸氢根、碳酸根离子等;氯气与氯化氢分子作用,生成氢气和水。
另外还可发生强氧化剂作用而生成氯气和臭氧。
氯气能与氧化剂发生氧化还原反应而生成臭氧和二氧化碳。
氯气与水中的盐类离子结合生成氯化物和氯盐化合物。
4.氯有吸湿作用氯与空气的氧化性不同,它不吸湿。
氯能使水中的盐酸分解放出氯化氢。
当氯化物浓度为5%时,由于氯气能与空气中的水分发生化学转化而变成气体且不溶于水并且溶解度很小而几乎没有。
因此,氯是很好地吸湿性极强的。
5.氯具有极强腐蚀性用氯气洗涤衣服或物体时,先用洗涤剂将衣物、地面冲洗干净或用干布吸干后进行洗涤。
然后再用清水洗净;用含氯的肥皂水洗涤(或用清水)2-3次后用清水洗净。
氯气的性质1.物理性质通常情况下氯气是呈黄绿色的气体,有刺激性气味,有毒,能溶于水2.化学性质氯气是一种化学性质很活泼的非金属单质,能与多种金属和非金属直接化合,还能跟许多化合物发生反应,潮湿的氯气还具有漂白性。
(1)Cl2与金属反应2Fe+3Cl22FeCl3铁丝在氯气中燃烧,产生棕褐色烟,烟为FeCl3固体,由此可见Cl2的氧化性很强,将Fe氧化成+3价。
但在常温下,干燥的Cl2不与铁反应,故可用钢瓶贮存、运输液氯。
Cl2还可以与活泼金属钠及不活泼金属铜等大多数金属反应。
(2)Cl2与非金属反应Cl2+H22HCl说明:①纯净的H2在Cl2中可以安静的燃烧,发出苍白色火焰,在瓶口处有白雾生成。
②H2和Cl2混合后光照或点燃都会爆炸。
③工业上制取HCl就是利用H2在Cl2中燃烧来制取的。
(3)氯气与水反应①氯气溶于水后可得到氯水Cl2+H2O HCl+HClO新制的氯水中存在Cl2、H2O、HClO、HCl,主要以Cl2分子形式存在。
说明:Ⅰ.氯水显酸性,放置一段时间后酸性增强,其原因是Cl2+H2O HCl+HClO2HClO2HCl+O2↑使氯气转化为盐酸,氢离子深度增大。
新制的氯水与久置的氯水有区别:(1)颜色变浅至无色(2)酸性变大②HClO HClO具有强氧化性,不稳定性,漂白性和弱酸性。
Ⅰ.HClO不稳定,见光或受热易分解。
2HClO+2HCl+O2↑Ⅱ.次氯酸具有强氧化性,可使有机色质氧化成无色物质,具有漂白性。
Ⅲ.次氯酸具有强氧化性,所以可用氯气对自来水进行消毒。
Cl2+H2O HCl+HClO HClO能杀死水中的病毒、病菌。
Ⅳ.次氯酸具有弱酸性,酸性化碳酸酸性弱。
说明:①次氯酸具有强氧化性可使有机色质(如品红、石蕊等)氧化为无色物质,但不能使碳素等黑色物质氧化。
②氯水久置后失去氧化能力,是因为HClO不稳定,受热、光照易分解。
③氯水要现用现配,不易久置,暂时性保存要避光、密封。