辽宁师范大学无机化学专业考研
- 格式:doc
- 大小:21.00 KB
- 文档页数:2

一、单选题 第2章 热化学1、在下列反应中,Q p =Q v 的反应为( )(A )CaCO 3(s) →CaO(s)+CO 2(g) (B )N 2(g)+3H 2(g) →2NH 3(g)(C )C(s)+O 2(g) →CO 2(g) (D )2H 2(g)+O 2(g) →2H 2O (l )2、下列各反应的(298)值中,恰为化合物标准摩尔生成焓的是( ) (A )2H(g)+ O 2(g)→H 2O (l ) (B )2H 2(g)+O 2(g)→2H 2O (l )(C )N 2(g)+3H 2(g)→2NH 3(g) (D )N 2(g) +H 2(g)→NH 3(g)3、由下列数据确定CH 4(g)的为( ) C(石墨)+O 2(g)=CO 2(g) =-393.5kJ·mol -1H 2(g)+ O 2(g)=H 2O (l) =-285.8kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (l ) =-890.3kJ·mol -1(A )211 kJ·mol -1; (B )-74.8kJ·mol -1;(C )890.3 kJ·mol -1; (D )缺条件,无法算。
4、已知:(1)C(s)+O 2(g)→CO(g), (1)= -110.5k J·mol -1(2)C(s)+O 2(g)→CO 2(g),(2)= -393.5k J·mol -1 则在标准状态下25℃时,1000L 的CO 的发热量是( )(A )504 k J·mol -1 (B )383 k J·mol -1 (C )22500 k J·mol -1 (D )1.16×104 k J·mol -15、某系统由A 态沿途径Ⅰ到B 态放热100J ,同时得到50J 的功;当系统由A 态沿途径Ⅱ到B 态做功80J 时,Q 为 ( )(A ) 70J (B ) 30J (C )-30J (D )-70J6、环境对系统作10kJ 的功,而系统失去5kJ 的热量给环境,则系统的内能变化为 ( )(A )-15kJ (B ) 5kJ (C ) -5kJ (D ) 15kJ7、表示CO 2生成热的反应是( )(A )CO (g )+ 1/2O 2(g )=CO 2(g )ΔrHmθ=-238.0kJ.mol-1(B )C (金刚石)+ O 2(g )=CO 2(g )ΔrHmθ=-395.4kJ.mol-1(C )2C (金刚石)+ 2O 2(g )=2CO 2(g )ΔrHmθ=-787.0kJ.mol-1(D )C (石墨)+ O 2(g )=CO 2(g )ΔrHmθ=-393.5kJ.mol-1二、填空题1、25℃下在恒容量热计中测得:1mol 液态C 6H 6完全燃烧生成液态H 2O 和气态CO 2时,放热3263.9kJ ,则△U 为-3263.9,若在恒压条件下,1mol 液态C 6H 6完全燃烧时的热效应为-3267.6。
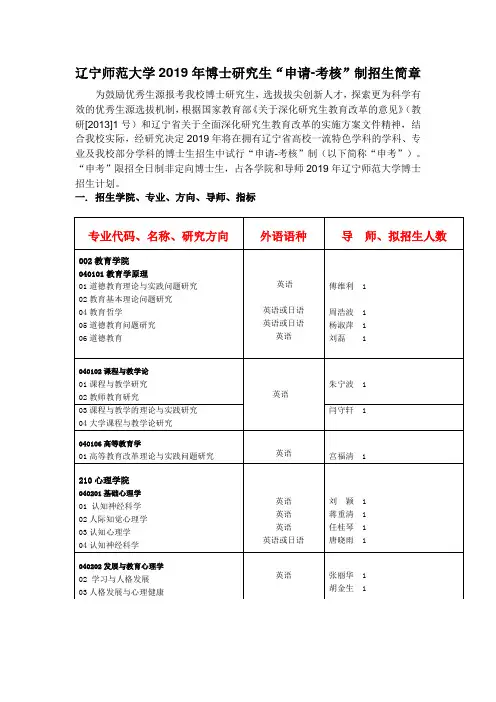
辽宁师范大学2019年博士研究生“申请-考核”制招生简章为鼓励优秀生源报考我校博士研究生,选拔拔尖创新人才,探索更为科学有效的优秀生源选拔机制,根据国家教育部《关于深化研究生教育改革的意见》(教研[2013]1号)和辽宁省关于全面深化研究生教育改革的实施方案文件精神,结合我校实际,经研究决定2019年将在拥有辽宁省高校一流特色学科的学科、专业及我校部分学科的博士生招生中试行“申请-考核”制(以下简称“申考”)。
“申考”限招全日制非定向博士生,占各学院和导师2019年辽宁师范大学博士招生计划。
一. 招生学院、专业、方向、导师、指标二.报名条件1.拥护中国共产党的领导,品德良好,遵纪守法,勤奋学习,愿意为祖国社会主义现代化建设服务。
2.申请者须为全日制硕士应届毕业生,且在博士入学前取得硕士学位。
3.身体健康状况符合规定的体检标准。
4.录取后须保证在读期间以全日制(非定向)方式在校学习,以人事档案关系转入我校为准。
5.本科或研究生所学专业与所报考的专业应隶属于同一个一级学科;6.科研要求:文科在SSCI或B类(见辽宁师范大学科研处“学术期刊目录”)或CSSCI(正刊)期刊及以上;理科在SCI或B类期刊及以上,以第一作者或通讯作者,或导师为第一作者、本人为第二作者至少发表一篇与所报学科、专业相关或相近研究领域的论文。
7.外语须满足下列条件之一英语:(1)大学外语考试六级≥425分;(2)专业英语四级/八级≥60分;(3)雅思≥6或托福≥80/550或GRE≥260/1300;(4)在英语为母语的国家留学一年以上(须提供留学证明)小语种:日语过国家四级或国际二级、俄语过国家四级。
8.申请人学习成绩要求:申请人硕士研究生阶段学习成绩优良。
三. 网上报名1.网上报名:申请人于2018年12 月13 日至2018年12 月29 日,自行登陆中国研究生招生信息网(/bsbm/)如实填报相关信息,逾期不予补报。
考试方式选择“申请考核”。

化学专业最好的20所大学化学专业最好的20所大学名单1、浙江大学2、厦门大学3、中国科学技术大学4、南京大学5、北京大学6、吉林大学7、清华大学8、南开大学9、四川大学10、复旦大学11、湖南大学12、兰州大学13、山东大学14、北京师范大学15、武汉大学16、华东理工大学17、中山大学18、郑州大学19、华东师范大学20、福州大学化学专业介绍化学专业培养具备化学的基础知识、基本理论和基本技能,能在化学及与化学相关的科学技术和其它领域从事科研、教学技术及相关管理工作的高级专门人才。
化学专业学生主要学习化学方面的基本知识、基本理论和基本技能与方法,受到科学思维和科学实验的训练,具有一定的科学研究、应用研究及科技管理的能力。
化学专业为学生提供化学知识方面的职业才能,同时,还开设包括数学、物理和生物在内的辅助性的课程。
除了使学生掌握具体科学基础知识外,该专业还培养学生具有判断力的思维、试验技术、解释观察以及清晰表达思维等能力。
化学专业方向化学、应用化学、化学生物学、分子科学与工程、化学工程与工艺、材料化学化学专业课程无机化学、分析化学(含仪器分析)、有机化学、物理化学(含结构化学)、化学工程基础等。
化学专业怎么样?(学长学姐评价)山东师范大学:在大学化学很好学,即使是毫无兴趣的人也能学好。
譬如说我,上高中时最讨厌滑雪,其次是生物,但各种原因,选择化学。
我是师范生,所以化学主要是高中内容的延伸。
不过,如果上师范建议别学化学了,学三大主科和生物吧。
吉林师范大学:我个人认为适合对科学感兴趣的人,并且对金钱没有特别向往的人学习。
因为学习化学之后很难赚到大钱。
我现在即使读了研究生也一样,没有钱可赚。
要学好化学就一定要有兴趣。
没兴趣不要学,化学这个专业很广泛,分为化学工程工艺和化学教育,前者多一些应用和理论前沿的创新。
或者注重的为人师表和教书育人的方式方法而后者在现在来说是个好职业。
稳定的职业,也是适合养老的职业。

要考物化和分析的学校:1、南京大学{985、211、考试科目:①物化②仪器分析}2、东北大学{985、211、考试科目:①物化②分析}3、南昌大学{211、考试科目:①物化②分析}4、河北大学{考试科目:①物化②分析}5、中南民族大学{考试科目:①物化②分析}6、沈阳药科大学{考试科目:①物化②分析}要考物化和无机的学校:1、厦门大学{985、211、考试科目:①物化②基础化学}2、南京大学{985、211、考试科目:①物化②大学化学}3、南京航空航天大学{211、考试科目:①物化②无机}4、南京师范大学{211、考试科目:①物化②无机}5、南昌大学{211、考试科目:①物化②无机}6、华南师范大学{211、考试科目:①物化②无机}7、中南民族大学{考试科目:①物化②无机}8、云南师范大学{考试科目:①物化②无机}注意:由于基础化学和大学化学和无机化学的内容几乎一样,故把基础化学和大学化学归为无机化学!!!要考物化和综合化学的学校:1、复旦大学{985、211、考试科目:①物化(含结构化学)②无机和分析}2、华中科技大学{985、211、考试科目:①物化②无机及分析}3、安徽大学{211、考试科目:①物化②综合化学}4、西北大学{211、考试科目:①物化②普通大学(无机和化学分析)}5、宁夏大学{211、考试科目:①物化②综合化学(有机、《无机化学与化学分析》)}6、河南大学{考试科目:①物化②无机和有机}7、浙江师范大学{考试科目:①物化②普通化学(有机、分析、仪器分析)}8、烟台大学{考试科目:①物化②化学综合(分析、无机、有机)}9、黑龙江大学{考试科目:①物化②综合化学(无机、有机、分析)}注意:《无机化学与化学分析》为参考书。
要考有机和分析的学校:1、南京大学{985、211、考试科目:①有机②仪器分析}2、华东理工大学{211、考试科目:①有机②分析}3、暨南大学{211、考试科目:①有机②分析(含仪器分析)}4、南昌大学{211、考试科目:①有机②分析}5、贵州大学{211、考试科目:①有机②分析}6、河南科技大学{考试科目:①有机②仪器分析}7、河南工业大学{考试科目:①有机②分析}8、浙江工业大学{考试科目:①有机②分析(含仪器分析)}8、中南民族大学{考试科目:①有机②分析}9、云南民族大学{考试科目:①有机②分析(含仪器分析)}要考有机和无机的学校:1、中南大学{985、211、考试科目:①有机②无机}2、南京大学{985、211、考试科目:①有机②大学化学}3、华东理工大学{211、考试科目:①有机②无机}4、华东师范大学{211、考试科目:①有机②普通化学原理}5、郑州大学{211、考试科目:①有机②大学化学}6、东北师范大学{211、考试科目:①有机②无机}7、南京航空航天大学{211、考试科目:①有机②无机} 8、福州大学{211、考试科目:①有机②化学原理}9、南昌大学{211、考试科目:①有机②无机} 10、辽宁大学{211、考试科目:①有机②无机}11、河南师范大学{考试科目:①有机②无机} 12、长沙理工大学{考试科目:①有机②无机}13、哈尔滨师范大学{考试科目:①有机②无机} 14、广西师范大学{考试科目:①有机②无机}15、海南师范大学{考试科目:①有机②无机} 16、渤海大学{考试科目:①有机②无机}17、华侨大学{考试科目:①有机②无机} 18、长春工业大学{考试科目:①有机②无机}19、聊城大学{考试科目:①有机②无机} 20、辽宁师范大学{考试科目:①有机②无机}21、山东师范大学{考试科目:①有机②无机} 22、四川师范大学{考试科目:①有机②无机}23、天津师范大学{考试科目:①有机②无机} 24、沈阳药科大学{考试科目:①有机②无机}25、中南民族大学{考试科目:①有机②无机} 26、徐州师范大学{考试科目:①有机②无机}27、内蒙古民族大学{考试科目:①有机②无机}注意:普通化学原理、大学化学以及化学原理与无机化学内容几乎一样,故归为无机化学。


《无机化学》考试大纲《无机化学》是化学、应用化学等专业的专业基础课。
它既是化学专业知识结构中重要的一环,又要为后继化学相关课程准备必需的无机化学基础理论和知识。
要求考生通过本课程的学习,掌握无机化学的基本理论和原理,熟悉常见元素及其化合物的性质。
掌握化学平衡理论、化学热力学和物质结构初步知识等在元素化学部分的应用,初步从微观和宏观相结合来阐述元素及其化合物的性质,并能灵活运用所学知识解决综合问题。
一、考试方法闭卷、笔试试卷满分:100分考试时间:3小时。
二、考试内容及要求以下按无机化学原理、元素化学和综合共三部分列出考试内容及要求。
基本要求按深入程度分为了解、理解(或明了)和掌握或熟悉(或会用)三个层次。
(一)无机化学原理部分1、化学基础知识了解理想气体和实际气体的基本性质;熟悉理想气体状态方程、分压定律及应用。
掌握溶液浓度的表示方法;了解非电解质稀溶液的依数性及应用。
2、化学热力学基础熟悉、理解热力学的基本概念。
掌握热力学能U、焓H、熵S和吉布斯自由能G等热力学函数的概念和物理意义,熟悉状态函数的特点;掌握盖斯定律和热力学第一定律、第二定律和第三定律。
能够熟练计算过程或反应的焓变、熵变和吉布斯自由能变,运用吉布斯自由能变判断化学反应的方向和限度;理解范特霍夫等温式并学会计算非标准态下的吉布斯自由能变;掌握利用吉布斯-赫姆霍兹公式的计算、理解△G 、△H 、△S之间的关系;学会估算热力学分解温度和反应温度等。
3、化学反应速率和化学平衡了解化学反应速率的基本概念及反应速率的实验测定;了解质量作用定律和反应级数的概念。
掌握浓度、温度及催化剂对反应速度的影响;掌握化学平衡的基本概念和平衡常数表达式;熟练掌化学平衡的有关计算;掌握化学平衡移动原理和应用。
4、原子结构与元素周期律了解原子能级、原于轨道(波函数)和电子云等概念。
熟悉四个量子数的物理意义和取值及对核外电子运动状态的描述。
了解屏蔽效应和钻穿效应的概念,熟练掌握鲍林原子轨道能级图、原子核外电子排布和元素在周期表中的位置。

无机化学一、专业介绍1、概述:无机化学是化学下属的二级学科,是以实验为基础的一门基础性学科,是研究无机物质的组成、性质、结构和反应的科学,是化学中最古老的分支学科。
近年来,无机化学的研究与发展越来越受到化学界的重视,现已从最早的理论性研究逐步地进入到人类社会的现代化建设中。
无机化学是我国最早设置的化学专业之一。
2、研究方向:无机化学的研究方向主要有01无机合成化学02能源材料化学03无机纳米材料04化学电源05功能性配合物化学06生物无机化学(注:各大院校的研究方向有所不同,以南开大学为例)3、培养目标:本专业硕士学位获得者应具有较深厚的近代无机化学和结构化学等基础理论知识;熟悉并掌握近代无机合成技术以及对化合物进行表征的常用近代物理研究方法、现代化学实验技术;了解相关领域在国内外的现状和发展趋势,能够适应我国经济、科技、教育发展需要;具有较好的实验技能和总结归纳分析问题的能力,能独立进行科研工作;有严谨的学风;至少掌握一门外国语,具有较熟练的阅读能力以及一定的写作和听说能力。
毕业后可胜任高校、科研院所和企业单位的教育、科研和应用开发或管理工作。
4、研究生入学考试科目:①101思想政治理论②201英语一③708综合化学④820无机化学(注:各大院校的考试科目有所不同,以南开大学为例)5、相关专业与无机化学专业相关的二级学科有:分析化学、有机化学、物理化学、高分子化学与物理二、专业素质要求及就业无机化学是化学科学中发展最早的一个分支学科。
它承担着研究所有元素的单质和化合物(碳氢化合物及衍生物除外)的组成、结构、性质和反应的重大任务。
当前无机化学的发展有两个明显趋势,即在广度上的拓宽和深度上的推进。
它与现代文明的三大支柱:能源、信息和材料紧密相联。
随着各学科的相互渗透及其自身的新成就,无机化学学科已发展到一个新阶段,在新材料的制备及应用上,已具有了相当重要的战略地位,具有广阔的发展前景,同步于材料科学、生命科学以及信息、能源的发展,是各类交叉学科的源始学科,特别是材料科学的发展强烈地依赖于无机化学。

目 录2014年沈阳师范大学858无机化学考研真题2013年沈阳师范大学860无机化学考研真题2012年沈阳师范大学858无机化学考研真题2014年沈阳师范大学858无机化学考研真题2014年招收攻读硕士学位研究生入学考试试卷科目代码: 858 科目名称:无机化学 适用专业名称:分析化学考生注意:请将答案写在答题纸上,写在本题签及草纸上无效。
考试后本题签同答题纸一并交回。
一、单选题(每题2分,共20分)1.[Al(F-)6]3-配离子中Al3+的杂化轨道类型为( )A.sp;B.sp3;C.d2sp2; D.sp3 d2;E.sp22.为防止SnCl2溶液在使用前被还原,在配置溶液时常加入( )A.Sn粒; B.大量H2O; C.HCl;D.Cl23.冬季人们很重视室内一氧化碳的含量, 因为它是( ). A.吸收紫外线;B.消毒; C.温室效应气体; D.有毒4.下列物质中哪个属于离子晶体( ).A.食盐; B.金刚石; C.干冰(固体CO2);D.金属铁;5.Fe3+离子中具有的成单电子数为( )A.0; B.4; C.5; D.66.在[Fe3+-EDTA]螯合物中,中心离子的配位数是( )A.2; B.3; C.4; D.67.下列电子的微观状态中,合理者为( ). A.3,2,1; B.3, 1,2;C.2,3,0; D.3,0,18.在下列物质中,分子的偶极矩不为零者为( ) A.BCl3; B.NO ; C.CCl4; D.CO29.下列离子或分子中属于两性物质的为 ( ) A.H2SO4;B.NO3-; C.H2O; D.HPO3-10.AgCl在下列哪一溶液中的溶解度最大 ( )A.Na2S2O3;B.H2O; C.NaNO3;D.HNO3二、简答题(每题5分,共25分)1.写出CO可能的的等电子体?2.由分子轨道理论说明He-H+分子离子能够稳定存在?3.由杂化轨道理论说明BCl3为非极性分子,而NH3为极性分子?4.由分子轨道理论说明O2+具有顺磁性。
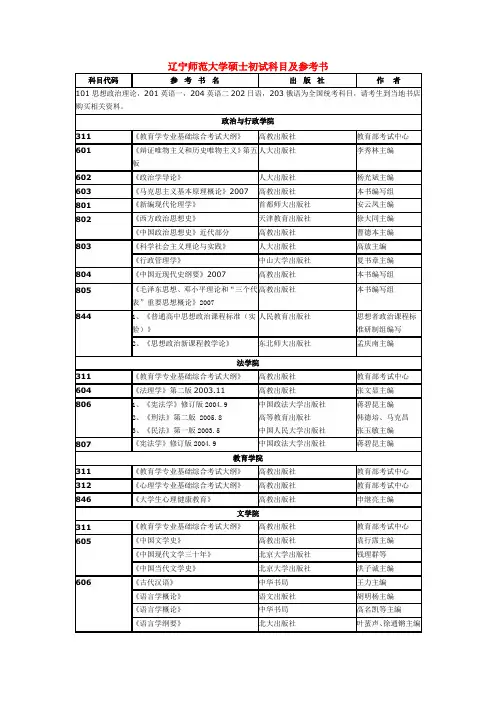

无机化学考研资料一、无机及分析化学考查目标该门学科在考查要求考生比较系统地理解和掌握无机化学、分析化学的基础知识、基本理论、基本方法和基本技能,能够分析、判断和解决有关理论和实际问题。
二、无机及分析化学考点解析大纲中明确的考试内容主要包括化学反应的一般原理、近代物质的结构理论、溶液化学平衡、电化学等的基础知识;分析误差和数据处理的基本概念,滴定分析、分光光度分析和电势分析等常用的分析方法。
要求考生掌握无机及分析化学的基础知识和基础理论,具有独立分析和解决有关化学问题的能力。
本学科知识体系分为十一个章节,对大纲中各章节内容考点的总结归纳为七项,解析如下:1、溶液和胶体考试内容:溶液浓度的表示方法、稀溶液的通性、胶体溶液。
考点解析及复习建议:该部分内容属于基础概念,要求掌握物质的量浓度等基本内容,考查多以概念性描述的选择题为主,要求准确理解和描述。
2、化学热力学基础考试内容:热力学基本概念、热化学及化学反应热的计算、化学反应方向的判断。
考试考点解析及复习建议:对热化学及化学反应热的计算,反应方向判断等是每年必考内容,也是重点,是化学平衡分析的基础。
该部分要求了解热力学能等名词概念,学会根据热力学定律分析化学反应过程中的热变化,及根据热变化分析化学反应方向等。
3、化学反应速率和化学平衡考试内容:化学反应速率基本概念及速率方程式、反应速率理论、化学平衡及移动。
考试考点解析及复习建议:在名词概念理解的基础上,强调掌握计算、分析和判断。
分析计算题中要求正确书写化学反应速率方程式和化学平衡常数,判断浓度、温度等对化学平衡的影响,侧重分析,在单选、填空、计算题中均会出现。
4、物质结构考试内容:核外电子运动状态、多电子原子核外电子排布、元素周期律及元素性质的周期性变化、离子键和共价键理论、杂化轨道理论、分子间力。
考试考点解析及复习建议:该部分内容概念性较强,较多,易混淆。
多以了解、理解为主,考查时以单选和填空为主,对此部分内容要求对名词概念的内容正确了解、理解物质组合结构规律,并根据规律学会分析判断杂化轨道、分子极性。
辽宁师范大学无机化学专业考研
无机化学教研室现有教工7人,实验技术人员1人,教授2人,副教授5人,讲师1人,其中博士1人,博士后2人。
无机化学学科为校重点学科,具有硕士学位点,正在积极申请博士点。
本学科三个研究方向:1、功能配合物化学(学科带头人:牛淑云教授),2、固体无机化学(学科带头人:由万胜教授),3、物理无机化学。
三年来,共发表论文近百篇,被SCI收录30余篇,该学科教学、科研实力雄厚,梯队完整。
辽宁师范大学信息与计算科学(非师范)
专业考研
培养目标:本专业培养具有良好的数学基础,掌握信息科学和计算科学的基本理论与
方法,受到科学研究的初步训练,能运用科学知识和计算机技能解决某些实际问题,能在科技、教育和经济部门从事研究教学、应用开发和管理工作的高级专门人才,也适宜继续攻读本专业或相关学科的硕士学位。
培养规格:本专业学生主要学习数学基础课程,学习信息科学和计算机科学的基本理论、基础知识和基本方法,受到比较扎实的计算机训练,系统掌握计算机科学和技术的基本理论,掌握计算机硬件、软件应用的基本理论,熟练掌握数据库技术、网络技术。
掌握利用计算机科学与技术进行信息处理。
初步具备在信息科学与计算科学领域从事科学研究、解决实际问题,既设计开发有关软件的能力,同时也可以进一步攻读信息科学、计算机科学技术,以及在信息技术与其它学科领域结合的方向上的硕士学位。
主要课程:数学分析、高等代数与解析几何、常微分方程、复变函数计算机语言程序
设计、计算方法、数值代数、信息科学基础、软件工程、数据库、编译原理、数学模型、计算机网络及其应用、计算机图形学、计算机基本原理、数字信号处理、信息与编码等。
主要实践性教学环节:劳动、科研实践和毕业设计等。
小提示:目前本科生就业市场竞争激烈,就业主体是研究生,在如今考研竞争日渐激烈的情况下,我们想要不在考研大军中变成分母,我们需要:早开始+好计划+正确的复习思路+好的辅导班(如果经济条件允许的情况下)。
2017考研开始准备复习啦,早起的鸟儿有虫吃,一分耕耘一分收获。
加油!。