罗氏安维汀FDA听证
- 格式:doc
- 大小:31.00 KB
- 文档页数:2



国家药监局关于修订盐酸西替利嗪口服制剂说明书的公告EMA警示氯喹和羟氯喹的精神障碍风险为进一步保障公众用药安全,国家药品监督管理局决定对盐酸西替利嗪口服制剂说明书【不良反应】、【禁忌】等项进行修订。
现将有关事项公告如下。
【不良反应】项下应包含:偶有报告患者有轻微和短暂不良反应。
如头痛、头晕、嗜睡、激动不安、口干、腹部不适。
在测定精神运动功能的客观试验中,本品的镇静作用和安慰剂相似。
罕有报道过敏反应。
【禁忌】项下应包含:①对本品成份、羟嗪或任何其他哌嗪衍生物过敏者禁用。
②严重肾功能损害(肌酐清除率低于10 ml/min )患者禁用。
【注意事项】项下应包含:①癫痫患者以及有惊厥风险的患者应慎用。
②因西替利嗪有可能增加尿潴留的风险,有尿潴留易感因素(例如脊髓损害、前列腺肥大)的患者慎用。
③抗组胺药物会降低皮肤过敏测试结果的灵敏度,所以接受这类测试前应停药3 d 。
临床医师、药师应当仔细阅读盐酸西替利嗪口服制剂说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
近日,欧洲药品监督管理局(EMA )发布消息,药物警戒风险评估委员会(PRAC )在审查了所有可用数据后,确认氯喹或羟氯喹的使用与精神障碍和自杀行为风险之间存在关联,建议更新所有含氯喹或羟氯喹药品的产品信息。
EMA 在收到西班牙药品管理局(AEMPS )就使用羟氯喹治疗COVID-19的患者中发生6例精神疾病的通报后,于2020年5月启动了此次审查,AEMPS 通报患者服用的羟氯喹剂量高于批准剂量。
氯喹和羟氯喹在欧盟被批准用于治疗某些自身免疫性疾病(如类风湿关节炎和狼疮),以及疟疾的预防和治疗。
这两种药物都没有被授权用于COVID-19治疗,但都超适应证用于COVID-19患者的治疗。
然而,大规模随机临床试验显示,氯喹和羟氯喹在治疗COVID-19方面并没有显示出任何有益作用。
鉴于氯喹和羟氯喹在COVID-19大流行期间的使用情况,EMA 曾于2020年4月和5月提醒医务人员此类药物的风险。

分子靶向药物类首页上一页1下一页尾页页次:1/1页100篇文章/页找了一下之前孙燕院士的靶向治疗文章中对靶向药物的总结:1、信号转导: TK酶抑制剂—吉非替尼、厄洛替尼、伊马替尼、达沙替尼、尼罗替尼、索拉非尼、舒尼替尼、凡德他尼、埃克替尼2、新生血管: 小分子化合物—恩度;单克隆抗体—贝伐单抗3、调控基因: 曲妥珠单抗4、EGFR受体: 小分子化合物—TKIs;单克隆抗体—西妥昔单抗、尼妥珠单抗、帕尼单抗5、表面受体: 利妥昔单抗因为这个是2010年总结的药物,过了1年多,所以里面肯定不全,先将这些慢慢的进行整理,后面再逐步添加新的。
吉非替尼商品名:易瑞沙英文名:Gefitinib Tablet 、Iressa、ZD1839结构式:适应症及作用机制:吉非替尼( gefitinib)是第一个批准用于治疗晚期非小细胞肺癌的分子靶向药物,通过竞争性结合到酪氨酸激酶的ATP结合区,抑制EGFR 酪氨酸激酶的活化,并能抑制EGFR的磷酸化作用和下游区的信号转导通路。
规格:250mg x 10 片/盒用法用量:推荐剂量为250mg(1片)每日1次,空腹或与食物同服。
不推荐用于儿童或青少年,对于这一患者群的安全性和疗效尚未进行研究。
不良反应:最常见的药物不良反应( ADRs )为腹泻、皮疹、瘙痒、皮肤干燥和痤疮,发生率20%以上,一般见于服药后一个月内,通常是可逆性的。
更多阅读分子靶向药物易瑞沙Iressa 吉非替尼治疗晚期或转移性非小细胞肺癌吉非替尼治疗晚期NSCLC2012-03-12 回复阳光明媚3楼厄洛替尼商品名:特罗凯英文名:Erlotinib Hydrochloride Tablets, Tarceva结构式:适应症及作用机制:可试用于两个或两个以上化疗方案失败的局部晚期或转移的非小细胞肺癌的三线治疗。
厄洛替尼(erlotinib) 可与ATP 结合区可逆性结合,并且完全抑制EGFR 酪氨酸激酶的自主磷酸化作用,从而阻断下游区EGFR 信号通路,引起细胞周期停滞,以及抑制血管生成。
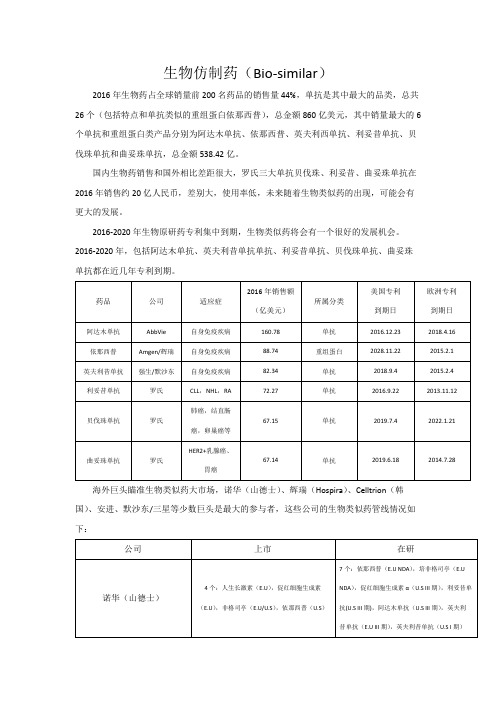
生物仿制药(Bio-similar)
2016年生物药占全球销量前200名药品的销售量44%,单抗是其中最大的品类,总共26个(包括特点和单抗类似的重组蛋白依那西普),总金额860亿美元,其中销量最大的6个单抗和重组蛋白类产品分别为阿达木单抗、依那西普、英夫利西单抗、利妥昔单抗、贝伐珠单抗和曲妥珠单抗,总金额538.42亿。
国内生物药销售和国外相比差距很大,罗氏三大单抗贝伐珠、利妥昔、曲妥珠单抗在2016年销售约20亿人民币,差别大,使用率低,未来随着生物类似药的出现,可能会有更大的发展。
2016-2020年生物原研药专利集中到期,生物类似药将会有一个很好的发展机会。
2016-2020年,包括阿达木单抗、英夫利昔单抗单抗、利妥昔单抗、贝伐珠单抗、曲妥珠单抗都在近几年专利到期。
海外巨头瞄准生物类似药大市场,诺华(山德士)、辉瑞(Hospira)、Celltrion(韩国)、安进、默沙东/三星等少数巨头是最大的参与者,这些公司的生物类似药管线情况如下:
国内的情况从2015年开始,生物类似药法规健全,生物类似药不再以新药申报,而是以类似药申报,可能会与原研进行头对头的比对,使得研发费用大幅提升,行业进入的门槛提高。
而且目前主流单抗药物进入医保谈判目录,类似药批后有望直接受益支付方式改变。
国内单抗集中在利妥昔单抗,曲妥珠单抗,贝伐珠单抗等6大类产品,按生物类似药申报少,按新药申报多。
大类仿制药情况如下:
从上面可以看到,目前6大单抗的国内主要研发企业研发进度如下表所示,信达生物3个品种处于临床Ⅲ期,复星医药和齐鲁制药各2个品种,其余1个品种的包括嘉和生物、康宁杰瑞、神州细胞、海正药业和安科生物。
上市公司中复星医药2个大品种进入Ⅲ期临床,数量和进度靠前。

安维汀(Ava stin)【药品名称】通用名称:贝伐珠单抗注射液商品名称:安维汀曾用名:阿瓦斯汀化学上分子结构名:贝伐珠单抗【性状】剂型:注射液剂量:100mg/4ml 400mg/16ml【保质期】3年【生产厂家】瑞士罗氏制药公司【临床药理学作用机制】安维汀是一种重组的人类单克隆IgG1抗体,通过抑制人类血管内皮生长因子的生物学活性而起作用。
也就是说贝伐珠单抗可结合VEGF并防止其与内皮细胞表面的受体(Flt-1和KDR)结合。
在体外血管生成模型上,VEGF与其相应的受体结合可导致内皮细胞增殖和新生血管形成。
在接种了结肠癌的裸(无胸腺)鼠模型上,使用贝伐珠单抗可减少微血管生成并抑制转移病灶进展。
【特殊人群】人口统计分析数据提示:无需因为患者的年龄或性别做剂量调整。
肾功能受损患者:目前还没有贝伐珠单抗在肾损害患者中的药代动力学研究。
肝功不全患者:目前还没有贝伐珠单抗在肝功不全患者中的药代动力学研究。
【临床研究】有两个随机的临床研究用于评价贝伐珠单抗联合以5-Fu为基础的化疗在治疗转移性结直肠癌的疗效和安全性。
贝伐珠单抗联合IFL方案静脉推注。
研究1是一个双盲、随机的临床研究,用于评价贝伐珠单抗做为转移性结直肠癌的一线治疗。
病人随机分配到三个组:第1组为IFL静推+安慰剂(伊利替康125 mg/m2静推,5-氟脲嘧啶500 mg/m2静推,四氢叶酸钙20 mg/m2静推,每周1次,连用4周,6周为1周期);第2组为IFL静推+贝伐珠单抗(5 mg/kg每2周1次);第3组为5-FU/LV+贝伐珠单抗(5 mg/kg每2周1次)。
预先决定,当IFL静推+贝伐珠单抗方案的毒性被评价为可以接受时,第3组的入组即中止。
813名患者被随机分配到第1组和第2组,中位年龄是60岁,40%为女性,79%是高加索人,57%的患者ECOG评分为0分,21%原发于直肠,28%接受过辅助化疗,56%患者的主要病变部位位于腹外,38%患者的主要病变部位在肝脏。
2011年全球制药公司50强排名作者: 药道人(站内联系TA)收录: 2011-10-20 发布: 2011-10-131. Pfizer President and CEO Jeff Kindler retired, succeeded by Ian C. Read. George Lorch elected Non-Executive Chairman of the Board. Sutent approved in EU for treatment of pancreatic neuro-endocrine tumors. Launched Prevnar 13, a vaccine against 13 strains of pneumococcal diseases in infants and young children. Also has 118 products in the R&D pipeline and had 1,300 clinical trials in 2010.2. Novartis Completed purchase of Alcon from Nestlé for $38.5 billion. Jonathan Symonds promoted to CFO. David Epstein replaced CEO Joe Jimenez as Division Head, Pharmaceuticals. Thirteen major pharmaceutical approvals in the US, Europe, and Japan, with 147 products in development. Tasigna was approved in the US, the EU, Japan, and Switzerland for patients with newly diagnosed Philadelphia chromosome-positive chronic myeloid leukemia (Ph+ CML), a form of blood cancer. Menveo (vaccine against meningococcal disease) launched in the US, EU, and parts of Latin America and Asia. Sandoz launched generic enoxaparin, its most successful launch to date, and acquired Oriel Therapeutics.3. Sanofi-Aventis Initiated acquisition of Genzyme for $16.6 billion (completed in April) and finished acquisition of OTC company Chattem. Began collaboration programs with Harvard and Columbia Universities and a research alliance with Scripps Genomic Medicine. Jevtana approved in US for second-line treatment of metastatic hormone-refractory prostate cancer.4. Merck Elected Kenneth Frazier CEO. Bought Inspire for $430 million. Rotateq vaccine awarded top honor at Prix Galien USA 2010. Merck BioVentures entered into an alliance with Parexel for biosimilar development. Signed commercialization agreement with Lundbeck for Sycrest and a letter of mutual intent with China's Sinopharm. Pipeline has more than 20 late-stage candidates. Licensed oral mTOR inhibitor for multiple cancers from Ariad. Oral hepatitis C protease inhibitor Boceprevir granted Priority Review status by FDA.5. Roche Rituxan approved in US as first-line treatment for chronic lymphocytic leukemia (CLL) and relapsed/refractory CLL. Tarceva approved in US and EU for first-line treatment of non-small-cell lung cancer after chemotherapy. FDA rejected use of Avastin as a treatment for metastatic breast cancer; Roche has requested a hearing to appeal this decision. Daniel O'Day appointed COO of the Pharmaceuticals division. Alan Hippe named CFO. Jean-Jacques Garaud appointed Head of Roche Pharma Research and Early Development.6. GlaxoSmithKline Benlysta (belimumab, the first new lupus treatment in 60 years) approved by FDA in March. Six products in total approved by US and EU; seven more filed with regulators. Malaria vaccine in Phase III trials in Africa, with 30 other late-stageassets. Julian Heslop retired as CFO, succeeded by Simon Dingemans. Patents for active ingredients in Seretide/Advair expired.7. AstraZeneca Crestor substance patent upheld in US court. Approvals include Vimovo (naproxen/esomeprazole magnesium) in US and EU and Brilique (atherothrombotic event prevention) in EU. Kombiglyze XR, the only once-daily dose of DPP4/metformin, developed with Bristol-Myers Squibb, also approved in US. Nine molecules in Phase III trials or submitted for regulatory approval, with another 92 projects in development. Completed deal with Rigel for development of fostamatinib (rheumatoid arthritis).8. Johnson & Johnson Completed tender offer for Crucell N.V. in February 2011; acquired 98.93 percent of shares. Products under regulatory review include: Rivaroxoban for stroke prevention in patients with atrial fibrillation (US), Telaprevir for hepatitis C (US and EU), Abiraterone acetate for metastatic advanced prostate (US and EU), and rilpivirine for HIV. Eight more candidates planned for regulatory submission from 2011 to 2013.9. Eli Lilly Completed acquisition of Alnara and Avid Radiopharmaceuticals. Launched statin Livalo in the US with partner Kowa. Has 68 molecules in development. Several monoclonal antibodies for cancer in late-stage development. Phase III candidates include Necitumumab for non-small-cell lung cancer and Ramucirumab for metastatic breast and gastric cancers. Signed commercialization deal with Acrux for newly approved experimental testosterone solution Axiron.10. Abbott The year was marked by acquisitions, including the pharmaceutical business of Solvay for $6.1 billion plus milestones, and Piramal Healthcare's Healthcare Solutions business, a leader in the Indian branded generics market, for $2.2 billion in cash, plus $1.6 billion in annual payments through 2014. Additional acquisitions included Advanced Medical Optics, STARLIMS Technologies (informatics), and the remaining shares of Facet Biotech.辉瑞公司总裁兼首席执行官杰夫·金德勒退休,由伊恩·里德继任。
目录VEGF拮抗剂——规模超三百亿的大市场 (4)VEGF——在肿瘤生成和眼底病变中扮演重要角色 (5)VEGF是最重要的促血管生成因子,在肿瘤生成过程中扮演重要角色 (5)VEGF在黄斑变性(AMD)等眼底疾病中也起重要作用 (5)原研药安维汀年销售额接近70亿美元,结直肠癌为主要市场 (6)罗氏多年TOP3畅销药物,专利即将到期 (6)中国获批适应症范围远小于国外,市场规模受限制 (6)2017年通过谈判降价62%纳入国家医保 (7)结直肠癌在我国发病率排第五,每年新增发病人数37.6万 (7)贝伐珠单抗是转移性结直肠癌患者的一二线治疗药物 (7)肺癌发病率居我国恶性肿瘤之首 (8)贝伐珠单抗联合治疗是晚期、转移性或复发性非小细胞肺癌的一线治疗方案 (9)VEGF靶点眼底病变市场增长迅速 (10)年龄相关黄斑变性(AMD)是老人致盲的首要疾病之一 (10)VEGF抑制剂:逆转视力,AMD治疗的里程碑药物 (10)Lucentis(雷珠单抗)vs. Elyea(阿柏西普),两个年销售额近40亿美元的重磅炸弹 (10)康柏西普(朗沐):中国原创,潜力巨大 (12)雷珠单抗与康柏西普通过谈判纳入医保,放量在即 (13)未来中国VEGF靶点药物市场规模有望达362亿人民币 (14)未来VEGF药物在国内结直肠癌市场规模约为30.8亿人民币 (14)肺癌市场:若罗氏四联疗法成功,有望在PD-1/PD-L1带动下渗透率迎来较大幅度上升 (15)其他肿瘤末线治疗 (16)眼底病变领域——增长动力十足的大市场 (17)国内多家药企进行VEGF靶点相关药物研发 (18)图表图表1: 未来中国市场VEGF靶点药物市场预测 (4)图表2: VEGF/VEGFR通路作用机理 (5)图表3: 安维汀全球销售额 (6)图表4: 安维汀在中国重点医院销售情况 (6)图表5: 安维汀在中国和国际获批适应症情况对比 (7)图表6: 安维汀在中国的适应症和治疗方案 (7)图表7: 2017年安维汀通过谈判纳入国家医保 (7)图表8: 复发/转移性结直肠癌化疗方案 (8)图表9: BO20696试验结果—结直肠癌 (8)图表10: YO25404研究的疗效结果—非小细胞肺癌 (9)图表11: 包含Avastin的PD-1/PD-L1联合疗法目前已在多个癌种开展临床研究(部分展示) (9)图表12: 初期黄斑变性情况 (10)图表13: 湿性黄斑变性情况 (10)图表14: 雷珠单抗(Lucentis)全球销售情况 (11)图表15: 雷珠单抗(Lucentis)国内样本医院销售情况 (11)图表16: Elyea(阿柏西普)全球销售情况 (11)图表17: 雷珠单抗、阿柏西普、康柏西普情况比较 (12)图表18: 朗沐(康柏西普)销售额 (12)图表19: 康柏西普与雷珠单抗进入医保乙类情况 (13)图表20: 安维汀一年治疗费用&渗透率—结直肠癌 (14)图表21: VEGF药物未来在结直肠癌的市场规模 (15)图表22: VEGF药物未来在肺癌的市场规模 (16)图表23: VEGF药物未来在其他癌种的市场规模 (16)图表24: VEGF药物未来在眼底病变的目标人群 (17)图表25: VEGF药物未来在眼底病变的目标人群 (18)图表26: VEGF药物未来在我国的总市场空间测算 (18)图表27: 国内VEGF靶点药物研发情况-肿瘤科用药 (19)VEGF拮抗剂——规模超三百亿的大市场血管内皮生长因子(vascular endothelial growth factor,VEGF)是最重要的促血管生成因子,可在体内诱导血管的新生。
2015年上半年FDA批准新药简析柯维鑫刘振亚(西南大学药学院,重庆,400715)摘要:2015 年上半年美国食品药品监督管理局( FDA) 共批准了14种新药,其中批准新分子实体药10种,新生物制品4种。
新药批准数量较2014年上半年批准17种有所下降[1],与2013年上半年批准新药数量13种相当[2]。
按照药物作用分类,抗肿瘤药物4个(28.57%),抗感染药物3个(21.43%),心血管药物2个(14.29%),神经系统药物,内分泌药物各一个(7.14%),其他药物3个(21.43%),详见表1。
[关键词]:新分子实体;新生物制品;FDA美国是新药研发强国,在药物研发方面居世界主导地位,美国在新药研发投入上是世界上最多的国家,2010 年全球在新药研发上投入排名前10 名的制药公司中有5 家为美国的制药公司[3]。
同时,美国药物研发企业数量近年来一直占据全球新药研发企业数量的第1 位,2013 年占比为49%[4]。
美国新药研发动向对世界各国的新药研发都会产生一定的影响,加深对美国新药研发情况的掌握至关重要。
通过对美国食品管理局(FDA)网站发布的批准新药数据进行对比[5],并查阅相关参考文献,将2015 年上半年美国FDA 新药批准情况简要分析如下。
1. 新药批准数量保持相对稳定从图1,2005 -2014 年FDA 新药数量批准情况趋势来看,近10年间新药批准数量基本保持稳定。
历年批准的新药基本在26 ~28 个上下浮动,保持相对稳定,个别年份出现特例,如,2007 年出现一个低点18 个,2014年出现一个高点42 个。
2015年上半年新药批准数量14件,较近10年上半年峰值2014年(17件)减少3件,减少17.65%,与2013年上半年批准新药数量(13件)基本相当。
根据近10年FDA在上半年和下半年批准的数量比较,可预测,2015年新药批准的数量较前10年而言将会相对稳定,将达30件左右,新药批准数量呈现基本稳定形势,表明企业药物研发形势依然保持相对活跃。
【药物名】Bevacizumab【商品名】Avastin(阿瓦斯汀)【最初上市时间】2004【类别】单克隆抗体【分子量】149kDa【靶点】VEGF【生产公司】Roche Pharma(Schweiz)Ltd 罗氏制药公司【购买地】美国【剂型和规格】注射液:单个100 mg包装:含有一瓶4ml的Bevacizumab。
(25 mg/ml)。
NDC 50242-060-01 606单个400 mg包装:含有一瓶16ml的Bevacizumab。
(25 mg/ml)。
NDC 50242-060-02 608【概述】阿瓦斯汀(Bevacizumab,Avastin)是重组的人源化单克隆抗体。
2004年2月26日获得FDA的批准,是美国第一个获得批准上市的抑制肿瘤血管生成的药。
通过体内、体外检测系统证实IgG1抗体能与人血管内皮生长因子(VEGF)结合并阻断其生物活性。
而阿瓦斯汀包含了人源抗体的结构区和可结合VEGF的鼠源单抗的互补决定区。
阿瓦斯汀是通过中国仓鼠卵巢细胞表达系统生产的,分子量大约为149,000道尔顿。
阿瓦斯汀为无色透明、浅乳白色或灰棕色、pH值6.2的无菌液体。
阿瓦斯汀有100mg和400mg两种规格,对应的体积为4ml和16ml(25mg/ml),不含防腐剂。
阿瓦斯汀被FDA撤销用于乳腺癌治疗的许可。
阿瓦斯汀是2008年2月22日被美国食品药品监督管理局批准的用于治疗一系列癌症的药物,由于罗氏公司未能提供其安全性的评估数据,且未能明显改善癌症患者的生存时间,于2011年11月18日被FDA撤销其用于乳腺癌治疗的许可,但仍用可于结肠癌、肺癌、肾癌和脑癌的治疗。
中国正式的商品名:安维汀注射液化学上分子结构名:贝伐珠单抗【药理作用】通过抑制人类血管内皮生长因子的生物学活性而起作用。
【毒理研究】目前还没有关于阿瓦斯汀对人和动物致癌性的数据。
阿瓦斯汀可能损害生育能力。
【药代动力学】静脉给药后,平均清除半衰期为20天(范围11~50天),预测达到稳态的时间为100天。
罗氏提供有关安维汀®治疗转移性乳腺癌的FDA听证会更新信息
FDA专员将在晚些时候做出最终决定
罗氏(SIX: RO, ROG; OTCQX: RHHBY)于今日公布,在星期三召开的美国食品药品监督管理局(FDA)听证会上,FDA肿瘤药物顾问委员会(ODAC)建议FDA撤销安维汀®(贝伐单抗)联合紫杉醇方案用于治疗既往未经治疗(一线)的HER2阴性转移性乳腺癌的批准。
该撤销建议并不是最终决定,安维汀®加紫杉醇目前仍被FDA批准用于HER2阴性转移性乳腺癌女性患者治疗。
FDA专员将就安维汀®是否仍被批准用于治疗转移性乳腺癌做出最终决定。
FDA目前尚未公布FDA专员将何时做出最终决定。
“我们对该委员会的建议感到十分失望。
HER2阴性转移性乳腺癌是不能治愈的,这些女性患者的治疗选择本来就很少。
希望FDA专员不会决定去除治疗这一疾病的重要药物”全球产品开发部首席医疗官兼总监Hal Barron医学博士说。
“我们已准备好随时与FDA协作,找出最佳解决方案,以保障需要安维汀®的患者的最佳利益。
”
这些公报和ODAC建议不会影响安维汀®在美国用于其他类型癌症的批准或其他国家安维汀®治疗转移性乳腺癌的使用。
在欧洲,安维汀®联合紫杉醇以及从昨天起联合希罗达(卡培他滨)是已获批准用于治疗转移性乳腺癌女性患者的一线化疗方案。
欧盟委员会扩展安维汀药品适应征的最新决定为不适于接受其他化疗(包括紫杉烷类或蒽环类)的女性患者提供了额外的一线治疗选择。
关于安维汀®:逾5年转变癌症治疗
随着2004年在美国首次被批准用于晚期结直肠癌,安维汀®成为第一种可广泛用于治疗晚期癌症患者的抗血管生成药物。
目前,安维汀®以在多种肿瘤中证明的生存益处(总体生存期和/或无进展生存期)继续转变肿瘤治疗。
安维汀®在美国和欧洲被批准用于治疗晚期阶段的结直肠癌、乳腺癌、非小细胞肺癌和肾癌,在美国和其他32个国家安维汀®还可用于治疗成胶质细胞瘤(一种脑癌)患者。
安维汀®是唯一可用于治疗这些各种晚期癌症类型的抗血管生成治疗药物,这些癌症每年共导致超过250万人死亡。
安维汀®使抗血管生成治疗成为目前癌症治疗的基本支柱—到目前为止超过100万的患者接受过安维汀治疗。
一项由超过500项正在进行的临床试验组成的综合临床项目正研究安维汀®在50多种不同类型肿
瘤(包括结直肠癌、乳腺癌、非小细胞肺癌、脑癌、胃癌、卵巢癌等)及不同疾病状况(晚期或早期疾病)中的使用。
关于安维汀®:作用方式
安维汀®是一种特异性地与VEGF(血管内皮生长因子)结合并阻断其生物效应的抗体。
VEGF是肿瘤血管生成的关键驱动因素,肿瘤血管生成是肿瘤生长和扩散(转移)至身体其他部位所需的基本过程。
安维汀®的作用机制明确,使其可与各种化疗和其他抗癌治疗有效地联合使用。
安维汀®有助于控制肿瘤生长并延长生存期,而对化疗的副作用仅有很小的影响。