高二化学物质结构
- 格式:pdf
- 大小:1.38 MB
- 文档页数:8

把握构造原理书写电子排布式江苏倪洪海根据构造原理,书写1~36号元素原子的核外电子排布式是本节的重点内容之一,同学们需要熟练掌握。
现就核外电子排布式的书写方法作如下介绍,供同学们学习参考。
一、构造原理基态原子中的电子排布遵循构造原理以使整个原子的能量处于最低状态,简称能量最低原理。
基态原子核外电子排布时总是尽可能排在能量最低的轨道(从1s开始),当能量低的轨道占满后,电子再依次进入能量较高的轨道。
核外电子在原子轨道上的排布顺序是:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s……,称为构造原理。
二、核外电子排布的书写用来表示原子核外电子排布的式子称为电子排布式。
在电子排布式中,将K、L、M、N各能层分别用数字1、2、3、4表示;用s、p、d、f等符号表示各能层中不同的能级,并在这些符号的右上角用数字表示各能级上电子的数目。
书写时,用数字与符号按能层(在同一能层中,从左到右依次为s、p、d)顺序表示出每一能级的电子数,如Na:1s22s22p63s1,也可以把钠的电子排布式简化为:[Ne]3s1。
“[ ]”中为该元素上一周期的稀有气体元素符号,“[ ]”内的电子排布与相应稀有气体元素原子的电子排布相同。
根据构造原理,我们知道了原子的原子序数(或核外电子数、核外电子数),就可以写出几乎所有元素原子的电子排布式。
方法如下:电子从1s能级开始排布排布,根据构造原理依次排布在轨道上,每一个能级上最多能够排布的电子数为:s能级2个,p能级6个,d能级10个(泡利原理)。
当在同一能级的不同轨道中同时出现成单电子时,其自旋方向应该相同(洪特规则)。
例如,氯原子核外有17个电子,第一层1s轨道上有2个电子,第二层2s、2p两个能级四个轨道上共有8个电子,余下的5个电子将填在第三层,在3s轨道排2个电子,3p 轨道填5个电子。
因此氯原子的核外电子排布式为1s22s22p63s23p5或[Ne] 3s23p5。




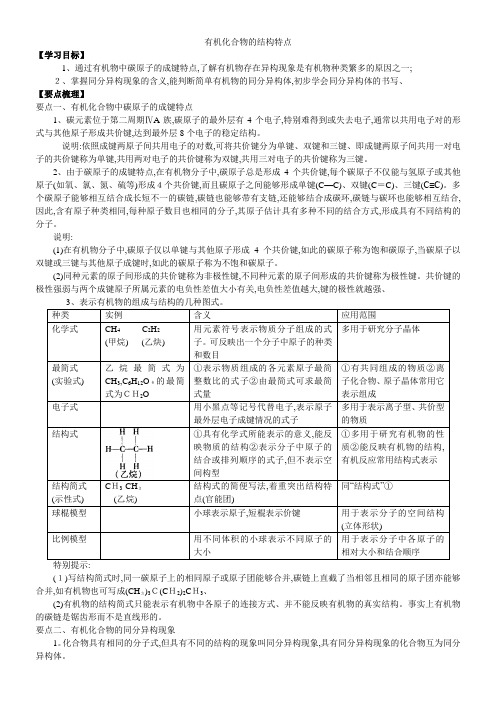
有机化合物的结构特点【学习目标】1、通过有机物中碳原子的成键特点,了解有机物存在异构现象是有机物种类繁多的原因之一;2、掌握同分异构现象的含义,能判断简单有机物的同分异构体,初步学会同分异构体的书写、【要点梳理】要点一、有机化合物中碳原子的成键特点1、碳元素位于第二周期ⅣA族,碳原子的最外层有4个电子,特别难得到或失去电子,通常以共用电子对的形式与其他原子形成共价键,达到最外层8个电子的稳定结构。
说明:依照成键两原子间共用电子的对数,可将共价键分为单键、双键和三键、即成键两原子间共用一对电子的共价键称为单键,共用两对电子的共价键称为双键,共用三对电子的共价键称为三键。
2、由于碳原子的成键特点,在有机物分子中,碳原子总是形成4个共价键,每个碳原子不仅能与氢原子或其他原子(如氧、氯、氮、硫等)形成4个共价键,而且碳原子之间能够形成单键(C—C)、双键(C=C)、三键(C≡C)。
多个碳原子能够相互结合成长短不一的碳链,碳链也能够带有支链,还能够结合成碳环,碳链与碳环也能够相互结合,因此,含有原子种类相同,每种原子数目也相同的分子,其原子估计具有多种不同的结合方式,形成具有不同结构的分子。
说明:(1)在有机物分子中,碳原子仅以单键与其他原子形成4个共价键,如此的碳原子称为饱和碳原子,当碳原子以双键或三键与其他原子成键时,如此的碳原子称为不饱和碳原子。
(2)同种元素的原子间形成的共价键称为非极性键,不同种元素的原子间形成的共价键称为极性键。
共价键的极性强弱与两个成键原子所属元素的电负性差值大小有关,电负性差值越大,键的极性就越强、3、表示有机物的组成与结构的几种图式。
种类实例含义应用范围化学式CH4C2H2(甲烷) (乙炔) 用元素符号表示物质分子组成的式子。
可反映出一个分子中原子的种类和数目多用于研究分子晶体最简式(实验式) 乙烷最简式为CH3,C6H12O6的最简式为CH2O①表示物质组成的各元素原子最简整数比的式子②由最简式可求最简式量①有共同组成的物质②离子化合物、原子晶体常用它表示组成电子式用小黑点等记号代替电子,表示原子最外层电子成键情况的式子多用于表示离子型、共价型的物质结构式①具有化学式所能表示的意义,能反映物质的结构②表示分子中原子的结合或排列顺序的式子,但不表示空间构型①多用于研究有机物的性质②能反映有机物的结构,有机反应常用结构式表示结构简式(示性式) CH3-CH3(乙烷)结构式的简便写法,着重突出结构特点(官能团)同“结构式”①球棍模型小球表示原子,短棍表示价键用于表示分子的空间结构(立体形状)比例模型用不同体积的小球表示不同原子的大小用于表示分子中各原子的相对大小和结合顺序特别提示:(1)写结构简式时,同一碳原子上的相同原子或原子团能够合并,碳链上直截了当相邻且相同的原子团亦能够合并,如有机物也可写成(CH3)3C(CH2)2CH3、(2)有机物的结构简式只能表示有机物中各原子的连接方式、并不能反映有机物的真实结构。
人教版高二化学物质的结构与性质一、引言在化学学科的学习中,我们需要深入理解不同物质的结构与性质之间的关系。
本文将从分子的层面出发,讨论人教版高二化学教材中关于物质结构与性质的相关内容,旨在帮助学生更好地理解和掌握这一重要知识点。
二、物质的结构与性质1. 分子和离子的结构与性质化学物质的基本组成单位有分子和离子两类。
分子是由原子通过化学键连接而成,而离子则是通过电荷吸引而形成的。
2. 共价键物质的结构与性质共价键物质是指由共用电子对连接的原子所构成的物质,如水、氨等。
这类物质的结构与性质受到中心原子电子对的排列方式和配位数的影响。
3. 离子晶体的结构与性质离子晶体是由正、负离子通过离子键结合而成的晶体,如氯化钠、碳酸钙等。
它们的结构与性质主要受到离子的电荷和尺寸之间的相互作用影响。
4. 金属晶体的结构与性质金属晶体是由金属离子和自由电子共同组成的晶体,如铁、铜等。
金属晶体的结构与性质受到金属离子的排列方式和自由电子对热导、电导等性质的贡献。
5. 分子间力的结构与性质除了共价键和离子键外,物质中还存在分子间力,如氢键、范德华力等。
这些力对物质的相态、溶解性、沸点等性质产生重要影响。
三、化学平衡中的物质结构与性质化学平衡是指反应物与生成物浓度保持一定比例的动态平衡态。
在平衡态下,反应物与生成物分子的结构与性质扮演着重要角色。
1. Le Chatelier原理的结构与性质解释Le Chatelier原理指出,当系统平衡受到扰动时,系统会通过向相反方向移动以抵消这种扰动。
这种移动涉及到物质结构与性质的变化,进而影响平衡位置的改变。
2. 平衡常数与物质结构的关系平衡常数是描述化学平衡位置的参数,与反应物与生成物分子的结构与性质密切相关。
相同的反应式在不同温度和压力下,平衡常数的值可能会有所不同。
四、通过实验了解物质结构与性质的关系在化学实验中,可以通过一系列的操作和观察来研究物质结构与性质之间的关系。
1. 分子模型实验通过使用分子模型,可以直观地展示各类物质中原子和键的结构,使学生更好地理解分子与性质之间的关联。
引言概述:在高中化学学习中,电子式结构式是化学反应和物质性质研究的基础。
本文将总结一些高二化学中常见物质的电子式结构式,旨在帮助高中化学学习者更好地理解和应用电子式结构式。
正文内容:一、羟基酸及其酐类1.羟基酸的电子式结构式:羟基酸是一类含有羟基(OH)的有机化合物。
其电子式结构式可用一般有机酸(COOH)的结构式框架,将羟基表示为OH即可。
2.酐类的电子式结构式:酐是由羧酸分子脱去一个水分子形成的。
其电子式结构式可用酸酐的结构式框架,将羧基表示为COO即可。
二、醛与脂肪族醇1.醛的电子式结构式:醛是由亲电性化合物与亲核性化合物反应制备而成,其中亲电性化合物通常是卤代烷,亲核性化合物通常是氢氧根离子和亚碳酰根离子。
其电子式结构式可用RCHO表示,其中R代表一个有机基团。
2.脂肪族醇的电子式结构式:脂肪族醇是一类饱和脂肪醇,其电子式结构式可用ROH表示,其中R代表一个有机基团。
三、酮与脂肪酸1.酮的电子式结构式:酮是由亲电性化合物与亲核性化合物反应制备而成,其中亲电性化合物通常是醇,亲核性化合物通常是羰基根离子。
其电子式结构式可用R₁COR₂表示,其中R₁和R₂代表有机基团。
2.脂肪酸的电子式结构式:脂肪酸是一类由羧酸和脂肪醇通过酯化反应得到的化合物。
其电子式结构式可用RCOOH表示,其中R 代表一个有机基团。
四、羧酸与胺1.羧酸的电子式结构式:羧酸是一类含有羧基(COOH)的有机化合物。
其电子式结构式可用RCOOH表示,其中R代表一个有机基团。
2.胺的电子式结构式:胺是一类含有氨基(NH₂)的有机化合物。
其电子式结构式可用RNH₂表示,其中R代表一个有机基团。
五、醚与酯1.醚的电子式结构式:醚是由两个有机基团通过氧原子相连的化合物。
其电子式结构式可用ROR'表示,其中R和R'分别代表两个有机基团。
2.酯的电子式结构式:酯是由醇和羧酸通过酯化反应得到的化合物。
其电子式结构式可用RCOOR'表示,其中R和R'分别代表一个有机基团。