深圳中学高考化学二轮高考题型分析及解题指导专题专题九、常见元素及其化合物
- 格式:pptx
- 大小:3.62 MB
- 文档页数:79




专题能力提升训练(九)一、选择题(本题共16小题,每小题只有一个选项符合题意)1.(2022·洛阳模拟)化学与生活密切相关。
下列说法正确的是( B )A.河南烩面中的淀粉(C6H10O5)n是纯净物B.酒泉夜光杯所采用的祁连山玉是一种无机非金属材料C.杜康酒的酿造过程中无氧化还原反应发生D.黄河鲤鱼肉中蛋白质的最终水解产物为二氧化碳、水和尿素【解析】淀粉(C6H10O5)n中n值不同,就是不同的分子,故其是混合物,A错误;玉石一般为硅酸盐材料,属于无机非金属材料,B正确;酒的酿造过程中发生反应C6H12O6(葡萄糖)→2CH3CH2OH+2CO2↑,碳元素化合价发生变化,有电子转移,C错误;蛋白质的最终水解产物为氨基酸,D错误。
2.(2022·南宁模拟)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚(C2H5OC2H5)、75%乙醇、含氯消毒剂过氧乙酸(CH3COOOH)、氯仿(CHCl3)等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是( B )A.氯仿与水互不相溶B.乙醇与乙醚互为同分异构体C.NaClO比HClO稳定D.过氧乙酸主要通过氧化灭活病毒【解析】氯仿属于氯代烃,不溶于水,与水互不相溶,故A正确;乙醇与乙醚的分子式不同,不可能互为同分异构体,故B错误;次氯酸钠遇光不易发生分解反应,次氯酸遇光易发生分解反应,所以次氯酸钠比次氯酸稳定,故C正确;过氧乙酸中含有过氧键,主要通过氧化灭活病毒,故D正确。
3.(2022·遵义模拟)下列有关有机物的说法中,正确的是( D )A.聚乙烯(CH2—CH2)是纯净物B.四苯乙烯(如上图)中所有原子不可能共面C.我国科学家用CO2合成了淀粉,此淀粉是天然高分子化合物D.C4H10O有7种同分异构体【解析】聚合物都是混合物,A选项错误;四个苯环连接在碳碳双键的碳原子上,有可能所有原子共面,B选项错误;CO2合成淀粉属于人工合成高分子,C选项错误;C4H10O中属于醇的有CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、(CH3)2CHCH2OH、C(CH3)3OH等共4种,醚有CH3OCH2CH2CH3、CH3OCH(CH3)2、CH3CH2OCH2CH3等共3种,共有7种同分异构体,D选项正确。


2020-2021深圳高考化学铁及其化合物推断题(大题培优易错难题)一、铁及其化合物1.X、Y、Z、W 为四种常见元素,其中 X、Y、Z 为短周期元素。
ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,W原子的最外层电子数小于4且W 的常见化合价有+3、+2,WX3的稀溶液呈黄色,回答下列问题:(1)X在元素周期表的位置________________,其简单阴离子的结构示意图为____________________,用电子式表示X的氢化物的形成过程______________________________。
(2)Z的氧化物在通讯领域用来作_______________。
锗与Z是同一主族元素,它可用来制造半导体晶体管。
研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH溶液反应但在有H2O2存在时可与NaOH溶液反应生成锗酸盐,反应的化学方程式为:_______________________________(3)W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:____________________________________,若灼烧W(OH)2固体得到___________。
【答案】第三周期ⅦA族光导纤维 Ge + 2H2O2 +2NaOH = Na2GeO3 + 3H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Fe2O3【解析】【分析】根据元素的性质及用途等信息分析元素的种类;根据核外电子排布情况确定在元素周期表中的位置;根据物质的性质及反应的现象书写反应方程式,及用相关化学用语表示物质的组成和结构。
【详解】Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,则Z为硅;ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,则X 为氯;Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,则Y为铝;W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3的稀溶液呈黄色,则W为铁;(1)X为氯元素,在元素周期表的位置为:第三周期ⅦA族;氯离子的结构示意图为:;用电子式表示HCl的形成过程:;(2)Z为硅,二氧化硅在通讯领域用作光导纤维;根据题干信息知锗NaOH溶液在有H2O2存在时反应生成锗酸盐,反应的化学方程式为:Ge + 2H2O2 + 2NaOH = Na2GeO3 + 3H2O;(3)反应现象知该反应为氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,Fe(OH)3不稳定,灼烧分解得到固体Fe2O3。
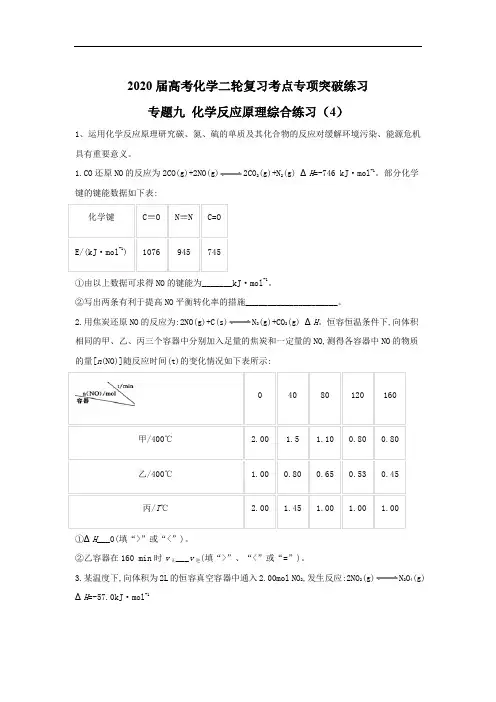
2020届高考化学二轮复习考点专项突破练习专题九化学反应原理综合练习(4)1、运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
1.CO还原NO的反应为2CO(g)+2NO(g)2CO 2(g)+N2(g) ΔH=-746 kJ·mol-1。
部分化学键的键能数据如下表:①由以上数据可求得NO的键能为_______kJ·mol-1。
②写出两条有利于提高NO平衡转化率的措施_____________________。
2.用焦炭还原NO的反应为:2NO(g)+C(s)N 2(g)+CO2(g) ΔH。
恒容恒温条件下,向体积相同的甲、乙、丙三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量[n(NO)]随反应时间(t)的变化情况如下表所示:①ΔH___0(填“>”或“<”)。
②乙容器在160 min时v正___v逆(填“>”、“<”或“=”)。
3.某温度下,向体积为2L的恒容真空容器中通入2.00mol NO 2,发生反应:2NO2(g)N2O4(g) ΔH=-57.0kJ·mol-1已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:①的数值为___________。
②已知速率常数k随温度升高而增大,则升高温度后k1增大的倍数______k2增大的倍数(填“>”、“<”或“=”)。
4.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_________________。
反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为_________L。
2、近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。


专题九常见元素及其化合物真题试做1.(2012高考广东理综卷,10)下列应用不涉及氧化还原反应的是( )A.Na2O2用作呼吸面具的供氧剂B.工业上电解熔融状态Al2O3制备AlC.工业上利用合成氨实现人工固氮D.实验室用NH4Cl和Ca(OH)2制备NH32.(2012( )3.(2011确且能达到目的的是( )A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体4.(2009高考广东化学卷)广东正在建设海洋强省。
下列说法不正确...的是( ) A.从海带中提取碘单质的过程涉及氧化还原反应B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属5.(2010高考广东理综卷,32)碳酸锂广泛应用于陶瓷和医药等领域。
以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是______________________。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO2-4,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入________(填“石灰石”“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。

高考真题分析—元素及化合物8、(2006重庆,8)能正确表示下列反应的化学方程式是A.黄铁矿煅炼:2FeS2+5O2FeO+4SO2B.石英与石灰石共熔:SiO2+CaO CaSiO3C.氨的催化氧化:4NH3+5O24NO+6H2OD.氯气与石灰乳反应:2Cl2+2Ca(OH) 2=CaCl2+CaClO2+2H2O解析:A中尽管原子个数守恒,但电子得失数不守恒;B中的石灰石是碳酸钙而不是氧化钙;D中氯原子个数和电子得失数均不守恒。
故A、B、D均不正确。
答案:C命题立意:本题主要考查对常见化学反应方程式书写的熟练程度。
侧重考查对化学方程式的书写中质量守恒、电子得失守恒原则的理解。
28.(2006北京,28)有X、Y、Z三种元素,已知:①X2-、Y—-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:(1)Y的最高价氧化物对应水化物的化学式是。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是,此液体具有的性质是(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”b.插入电极通过直流电后,有一极附近液体颜色加深c.向该液体中加入硝酸银溶液,无沉淀产生d.将该液体加热、蒸干、灼烧后,有氧化物生成(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0KJ。
若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反映,可生成一种强酸和一种氧化物,若1.5×6.02×1023个电子转移时,该反应的化学方程式是。
解析:因X 2-、Y —-均与Y 的气态氢化物分子具有相同的电子数,说明X 、Y 位于同周期,又根据Z 与Y 可组成化合物ZY 3,ZY 3溶液遇苯酚呈紫色,推知ZY 3为三氯化铁,即X 、Y 、Z 分别是硫、氯、铁元素,然后回答有关问题。

深圳高考化学卤素及其化合物(大题培优易错难题)一、卤素及其化合物练习题(含详细答案解析)1.A、B、D、E、G 是原子序数依次增大的五种短周期元素,A与E同主族,A、B和E的原子最外层电子数之和为19,B与G 的单质都能与 H2反应生成“HX”(X代表B或G)型氢化物,D 为同周期主族元素中原子半径最大的元素。
(1)B 在元素周期表中的位置是______。
(2)D 的两种常见氧化物中均含有____________(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为____________。
(4)D 的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为___________。
(5)用原子结构解释“B、G 单质都能与H2反应生成HX型氢化物”的原因:________。
【答案】第2周期第VIIA族离子键 2H2SO4(浓)+C CO2↑+2SO2↑+2H2O Cl2+2OH﹣═ClO﹣+Cl﹣+H2O 氟和氯同在VIIA族,其原子最外层电子数均为7,均可与氢原子共用一对电子形成共价键【解析】【分析】A、B、D、E、G 是原子序数依次增大的五种短周期元素,其中B与G同主族,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B为F元素,G为Cl元素.D为同周期主族元素中原子半径最大的元素,原子序数大于F而小于Cl,则D为Na元素.A与E 同主族,A、B和E的原子最外层电子数之和为19,可知A与E的最外层电子数都为6,则A为O元素,E为S元素,结合对应单质、化合物的性质以及元素周期律知识的解答。
【详解】A、B、D、E、G 是原子序数依次增大的五种短周期元素,其中B与G同主族,B 与G 的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,则B为F元素,G为Cl元素.D为同周期主族元素中原子半径最大的元素,原子序数大于F而小于Cl,则D为Na元素.A与E 同主族,A、B和E的原子最外层电子数之和为19,可知A与E的最外层电子数都为6,则A为O元素,E为S元素;(1)B为F元素,位于周期表第2周期第VIIA族;(2)D为Na元素,其两种常见氧化物为氧化钠、过氧化钠,二者均含有离子键;(3)E的最高价氧化物对应水化物的浓溶液为浓硫酸,具有强氧化性,和木炭共热反应化学方程式为2H2SO4(浓)+C CO2↑+2SO2↑+2H2O;(4)氯气和氢氧化钠反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H2O;(5)氟和氯同在VIIA族,其原子最外层电子数均为7,均可与氢原子共用一对电子形成共价键,单质都能与H2反应生成HX 型氢化物。