绘制配位滴定曲线概要
- 格式:doc
- 大小:318.00 KB
- 文档页数:6



配位滴定曲线的名词解释配位滴定曲线,也称为配位滴定曲线分析,是化学分析中常用的一种方法。
它通过量化样品中特定化合物与滴定试剂之间的配位反应,来确定样品中所含物质的组成和浓度。
配位滴定曲线以滴定剂的体积为横坐标,反应的指标(例如溶液的pH值或溶液中反应物的浓度变化)为纵坐标,画出的曲线可以提供有关滴定反应的定量信息。
在配位滴定曲线分析中,常用的滴定剂包括酸碱、络合剂和氧化还原剂。
滴定剂经过稀释以一定速率滴定到待测溶液中,滴定过程中记录滴定剂的体积和反应指标的变化。
在滴定剂体积逐渐增加的过程中,滴定反应会发生,反应的指标会发生明显的变化。
当滴定反应达到了终点时,反应指标的变化会急剧改变,称为滴定终点。
配位滴定曲线的形状和特点与滴定反应的性质和滴定剂的性质有关。
因此,不同的滴定剂和滴定反应对应着不同类型的配位滴定曲线。
常见的配位滴定曲线类型包括酸碱滴定曲线、络合滴定曲线和氧化还原滴定曲线。
酸碱滴定曲线通常以酸碱指示剂的颜色变化作为反应指标。
酸滴定曲线一般呈现S型,如硫酸与氢氧化钠的滴定反应,当滴定剂的体积较小时,pH值变化不明显,然后在一定体积范围内pH值迅速改变,最后再次趋于变化较小。
而碱滴定曲线则相反,呈倒S型。
络合滴定曲线是用络合试剂滴定金属离子的化学反应得到的。
络合滴定曲线的特点是在某一维度上的数值波动较大,而其他维度上基本保持平稳,如铁离子与亚硫酸钠络合反应。
氧化还原滴定曲线以电位作为反应指标。
它可以通过记录滴定过程中氧化还原电位的变化来确定待测溶液中所含物质的浓度,例如硼氢化钠滴定碘酸钾溶液。
配位滴定曲线分析在实际应用中具有广泛的用途。
通过绘制与滴定剂体积和反应指标变化相关的曲线,可以确定待测溶液中所含物质的浓度。
此外,配位滴定曲线还可以用于确定滴定过程中出现的滴定误差,并根据曲线的形状和特征进行定量判断和分析。
需要注意的是,在进行配位滴定曲线分析时,应根据具体的实验条件和需求选择合适的滴定剂和反应指标,并严格控制实验过程中的操作技术和条件,以确保测试结果的准确性和可靠性。

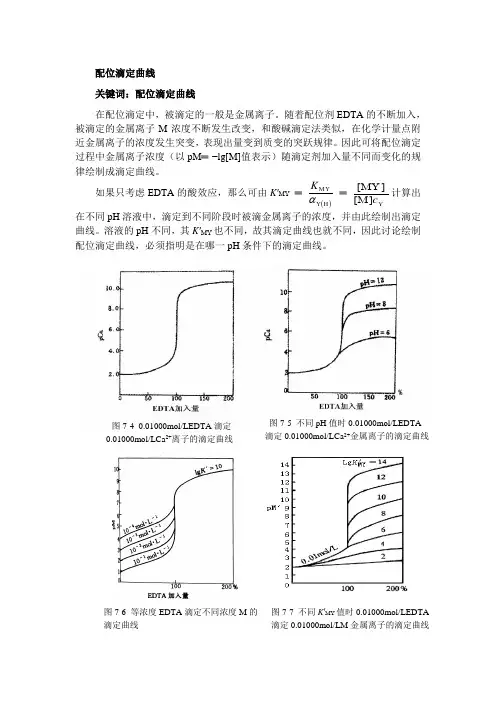
配位滴定曲线关键词:配位滴定曲线在配位滴定中,被滴定的一般是金属离子。
随着配位剂EDTA 的不断加入,被滴定的金属离子M 浓度不断发生改变,和酸碱滴定法类似,在化学计量点附近金属离子的浓度发生突变,表现出量变到质变的突跃规律。
因此可将配位滴定过程中金属离子浓度(以pM ═ −lg[M]值表示)随滴定剂加入量不同而变化的规律绘制成滴定曲线。
如果只考虑EDTA 的酸效应,那么可由K ′MY ═ ()H Y MY αK ═ ][][Y M MY c 计算出在不同pH 溶液中,滴定到不同阶段时被滴金属离子的浓度,并由此绘制出滴定曲线。
溶液的pH 不同,其K ′MY 也不同,故其滴定曲线也就不同,因此讨论绘制配位滴定曲线,必须指明是在哪一pH 条件下的滴定曲线。
图7-4 0.01000mol/LEDTA 滴定0.01000mol/LCa 2+离子的滴定曲线 图7-5 不同pH 值时0.01000mol/LEDTA 滴定0.01000mol/LCa 2+金属离子的滴定曲线 图7-6 等浓度EDTA 滴定不同浓度M 的 滴定曲线图7-7 不同K ′MY 值时0.01000mol/LEDTA滴定0.01000mol/LM 金属离子的滴定曲线图7-4是pH═12时,用0.01000mol/L EDTA标准滴定溶液滴定20.00mL 0.01000mol/L Ca2+溶液的滴定曲线。
0.01000 mol/L EDTA在不同pH时滴定0.01000 mol/L Ca2+的滴定曲线如图7-5所示。
对于等浓度的EDTA标准滴定溶液滴定不同浓度的金属离子M的滴定曲线如图7-6所示。
当条件一定时,MY配合物的K′MY值不同,滴定突跃也不同,如图7-7所示。
由滴定曲线可以看出,用EDTA滴定某离子M(如Ca2+)时,配合物的条件稳定常数和被滴金属离子的浓度是影响配位滴定pM突跃的主要因素:①对同一金属离子,在滴定允许的酸度范围内,pH值越大,配合物的条件稳定常数K′MY越大,化学计量点附近滴定的pM突跃越大(图7-5)。






情境四配位滴定任务二绘制配位滴定曲线一、基础知识夯实1.在配位滴定中,直接滴定法的条件包括(A)lgCK‘mY≤8 (B)溶液中无干扰离子(C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行2. 某溶液主要含有Ca2+、Mg2+及少量Al3+、Fe3+,今在pH=10时加入三乙醇胺后,用EDTA滴定,用铬黑T为指示剂,则测出的是(A)Mg2+的含量(B)Ca2+、Mg2+含量(C)Al3+、Fe3+的含量(D)Ca2+、Mg2+、Al3+、Fe3的含量3. EDTA滴定金属离子M,MY 的绝对稳定常数为KMY,当金属离子M的浓度为0.01 mol •L-1时,下列lgαY(H)对应的PH值是滴定金属离子M的最高允许酸度的是(A)lgαY(H)≥lgKMY – 8 (B)lgαY(H)= lgKMY - 8(C)lgαY(H)≥lgKMY - 6 (D)lgαY(H)≤lgKMY – 34. 在Fe3+、Al3+、Ca2+、Mg2+ 混合溶液中,用EDTA测定Fe3+、Al3+ 的含量时,为了消除Ca2+、Mg2+ 的干扰,最简便的方法是.(A)沉淀分离法; (B)控制酸度法; (C)配位掩蔽法; (D)溶剂萃取法.二、应用能力巩固1. 以EDTA滴定同浓度的溶液,若pH=5.5 ,计算滴定突跃,选用二甲酚橙为指示剂是否合适?答案:E t= ±0.1%lg αY(H) = 5.5 (pH=5.5)lg K CdY = lg K CdY - lgαY(H)= 16.5 - 5.5 = 11.0lg cK= -2 + 11.0 = 9.0查图:ΔpM = ±1.5pM sp = (p c + lg K)/2= (2+11.0)/2= 6.5滴定突跃为pCd = 6.5±1.5(5.0-8.0)查二甲酚橙 :pCd t = 5.0 答:选用二甲酚橙是合适的。
2. 计算lg αCd(NH3)、lg αCd(OH)和lg αCd 值(Cd 2+-OH -络合物的lg β1~lg β4分别是4.3,7.7,10.3,12.0)。
情境四配位滴定任务二绘制配位滴定曲线一、基础知识夯实1.在配位滴定中,直接滴定法的条件包括(A)lgCK‘mY≤8 (B)溶液中无干扰离子(C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行2. 某溶液主要含有Ca2+、Mg2+及少量Al3+、Fe3+,今在pH=10时加入三乙醇胺后,用EDTA滴定,用铬黑T为指示剂,则测出的是(A)Mg2+的含量(B)Ca2+、Mg2+含量(C)Al3+、Fe3+的含量(D)Ca2+、Mg2+、Al3+、Fe3的含量3. EDTA滴定金属离子M,MY 的绝对稳定常数为KMY,当金属离子M的浓度为0.01 mol •L-1时,下列lgαY(H)对应的PH值是滴定金属离子M的最高允许酸度的是(A)lgαY(H)≥lgKMY – 8 (B)lgαY(H)= lgKMY - 8(C)lgαY(H)≥lgKMY - 6 (D)lgαY(H)≤lgKMY – 34. 在Fe3+、Al3+、Ca2+、Mg2+ 混合溶液中,用EDTA测定Fe3+、Al3+ 的含量时,为了消除Ca2+、Mg2+ 的干扰,最简便的方法是.(A)沉淀分离法; (B)控制酸度法; (C)配位掩蔽法; (D)溶剂萃取法.二、应用能力巩固1. 以EDTA滴定同浓度的溶液,若pH=5.5 ,计算滴定突跃,选用二甲酚橙为指示剂是否合适?答案:E t= ±0.1%lg αY(H) = 5.5 (pH=5.5)lg K CdY = lg K CdY - lgαY(H)= 16.5 - 5.5 = 11.0lg cK= -2 + 11.0 = 9.0查图:ΔpM = ±1.5pM sp = (p c + lg K)/2= (2+11.0)/2= 6.5滴定突跃为pCd = 6.5±1.5(5.0-8.0)查二甲酚橙 :pCd t = 5.0 答:选用二甲酚橙是合适的。
2. 计算lg αCd(NH3)、lg αCd(OH)和lg αCd 值(Cd2+-OH -络合物的lg β1~lg β4分别是4.3,7.7,10.3,12.0)。
(1)含镉溶液中[NH 3]=[NH 4+]=0.1;(2)加入少量NaOH 于(1)液中至pH 为10.0。
答案:查得Cd 2+—NH 3络合物的lg β1~lg β6分别为:2.60,4.65,6.04,6.92,6.6,4.9Cd 2+-OH -的lg β1~lg β4:4.30,7.7,10.3,12.0(1)0.1][NH ][NH 43==+mol/L -14.631b [OH ]10molgL ,pH 9.37K ---∴===326Cd(NH )3132362.0 4.653.0 6.044.0 6.923.41[NH ][NH ][NH ]10101010αβββ-+-+-+=+++⋅⋅⋅+=++=4.3lg )Cd(N H 3=α23-4Cd(OH)12344.6 4.30.21[OH ][OH ][OH ][OH ] 110 10αββββ----+=++++=+=4.3lg Cd =α(2)pH=10.09.370.81a 310.09.37a 0.210[NH ]01610(mol L )[H ]1010cK K ---+--⨯====++. 或:3H 10.09.370.13NH (H)43(NH )1[H ](NH )11010[NH ]c K α++-+==+=+=8.01.0)(H NH3310102.0)NH (]NH [3-===∴αc计算得:0.4lg )Cd(N H 3=α,5.0lg )Cd(O H =α,0.4lg Cd =α 3. 计算下面两种情况下的lg K ′(NiY)值。
(1)pH=9.0,c (NH 3)=0.2mol ·L -1;(2)pH=9.0,c (NH 3)=0.2mol ·L -1,[CN -]=0.01mol ·L -1。
答案:(1)查得6.18)NiY (lg =K ;Ni —NH 3络合物的lg β1~lg β6分别为:2.75,4.95,6.64,7.79,8.50,8.49; pH=9.0时,5.0lg (H )N H 3=α,1.0lg N i(O H )=α,Y(H)lg 1.4α=3 1.2130.53NH(H)(NH )0.2[NH ]100.06(molgL )10c α--====326Ni(NH )3132362.4 4.953.6 6.644.87.79 6.08.503.41[NH ][NH ][NH ] 10101010 10αβββ-+-+-+-+=+++⋅⋅⋅+=+++= 8.134.14.36.18 lg lg )NiY (lg )NiY (lg Y(H)=--=--='ααNi K K(2)0.01][CN =- -N i C N -的3.31lg 4=β3.23Ni(OH)Ni(CN))Ni(NH N 3.233.3140.244Ni 10 210101]CN [1)(CN 3=-++==+=+=+⨯--ααααβαi 1.64.13.236.18 lg lg )NiY (lg )NiY (lg Y(H)N -=--=--='ααi K K4. 今欲配制pH=5.0、pCa=3.8的溶液,所需EDTA 与Ca 2+物质的量之比,即n (EDTA):n (Ca)为多少? 答案:3.06.67.108.3[CaY]]Y [lg [CaY]]Y [lglg CaY)(lg pCa Y(H)-=+-=''+-=αK2:1[CaY]:]Y [=' 即:(EDTA):(Ca)3:2n n =5. 15mL 0.020 mol ·L -1 EDTA 与10mL 0.020 mol ·L -1 Zn 2+溶液相混合,若pH 为4.0,计算[Zn 2+];若欲控制[Zn 2+]为10-7.0 mol ·L -1,问溶液pH 应控制在多大? 答案:5.16)ZnY (lg =K ,H lg (ZnHY) 3.0K =0.4pH =时,6.8lg Y (H )=α,0.0lg )Zn(O H =α04.00.30.4H ZnY (H )10101(ZnHY)]K [H 1=+=+=+-+αZn(OH)Y(H)ZnY(H)lg (ZnY)lg (ZnY)lg lg lg 16.50.08.60.04 7.9K K ααα'=--+=--+=混合后, 0040.01010150.020100.02015]Y [40.2==+⨯-⨯='-6.72.407.9 2.102.1001101010]Y (ZnY)[]Y [Zn [Zn]0.008010250.02010]Y Zn [----=⨯='''===⨯='K若控制[Zn]=10-7.0则 3.72.407.02.10011010]Y [Zn][]Y [Zn (ZnY)==''='---K2.93.75.16(ZnY)lg (ZnY)lg lg )Y (H =-='-=K K α由Y(H)lg ~pH α曲线,查得pH ≈3.86. 在一定条件下,用0.010 mol ·L -1 EDTA 滴定20.00mL 同浓度金属离子M 。
已知该条件下反应是完全的,在加入19.98~20.02mL EDTA 时pM 值改变1单位,计算K ′(MY)。
答案:据题意,E t =±0.1%,ΔpM=0.51sp (M)0.010/20.0050mol L c -==⋅()()pM pM 0.50.5t 11'22101010100.1%0.0050E K cK ∆-∆---===' 解得, 2.410='K-0.1% 30.5%)1.00050.0lg(M p =⨯-=' +0.1% 13.53lg M p '+=-='K3.9lg ='∴K7. 铬蓝黑R 的酸离解常数K a1=10-7.3,K a2=10-13.5,它与镁的络合物稳定常数K (MgIn)=107.6。
计算pH10.0时(pMg)t 值;若以它为指示剂,在pH 10.0时以2×10-2 mol ·L -1 EDTA 滴定同浓度的Mg 2+,终点误差多大? 答案:铬蓝黑R 的17.3a 10K -=,213.5a 10K -=5.13110=K ,3.7210=K5.13110=β,8.20210=β6.710)(MgIn =K(1)pH=10.0时210..013.520.020.8 3.5In(H)12t In(H)1[H ][H ]1101010(pMg)lg (MgIn )lg (MgIn)lg 7.6 3.5 4.1K K αββα++-+-+=++=++='==-=-=(2)7.8)MgY (lg =K ,pH=10.0时,5.0lg Y (H )=αY(H)lg (MgY )lg (MgY)lg 8.70.58.2K K α'=-=-=()()sp 11pMg lg (MgY )p (Mg)(8.2 2.0) 5.122sp K c '=+=+= 0.11.51.4pMg -=-=∆,sp lg (Mg)(MgY ) 6.2c K '⋅=查误差图得,0.8%t -=E 亦可用E t 公式计算:()()pM pM1.0 1.0t 112.08.222sp10101010100%100%10(Mg)(MgY )0.8%E cK ∆-∆--+--=⨯=⨯'⋅=-三、综合能力提升2+。
请根据表中数据,完成填空:提示:(1). 化学计量点前后0.1%的pM 值相对于化学计量点有对称关系。
(2).K '相同的体系,浓度增大10倍时,突跃增大1个pM 单位;sp 后0.1%的pM 值相同。
答案:2. 在pH 为10.0的氨性缓冲溶液中,以2×10-2mol ·L -1 EDTA 滴定同浓度的Pb 2+溶液。
若滴定开始时酒石酸的分析浓度为0.2 mol ·L -1,计算化学计量点时的lg K ′(PbY)、[Pb ′]和酒石酸铅络合物的浓度。
(酒石酸铅络合物的lg K 为3.8)答案:酒石酸以H 2L 表示,1a p 2.9K =, 4.1p 2a =K0.18)PbY (lg =K ,8.3)PbL (lg =K0.10pH =时,Y(H)lg 0.5α=,7.2lg Pb(O H )=α1sp 2(H L)[L]0.1mol L c -==⋅1.0 3.82.8Pb(L) 2.8 2.73.1Pb Pb(L)Pb(OH)Pb Y(H)1[L](PbL)1101011010110lg (PbY)lg (PbY)lg lg 18.0 3.10.514.4K K K αααααα-+=+=+==+-=+-='=--=--=()()sp sp 11(pPb )lg (PbY)p (Pb)14.4 2.08.222K c ''=+=+= 8.2sp11.3sp 3.1Pb[Pb ]10[Pb]1010α--'=== 又sp sp2.8Pb(L)sp[PbL][Pb]10[Pb]α+==5.83.113.118.2sp 101010PbL][---=-=∴或: sp sp sp[PbL](PbL)[Pb][L]K =8.5sp sp sp 10[L][Pb](PbL)[PbL]-=⋅=∴K。