部编版2020年高考化学一轮复习 酸碱中和滴定曲线大全 专题08 导电能力曲线练习
- 格式:doc
- 大小:1.42 MB
- 文档页数:11

人教部编版高中化学酸碱中和滴定曲线知识点总结在历年高考命题中,通过图象考查弱电解质电离平衡、pH与起始浓度的关系、有关混合溶液pH的计算、离子浓度的大小比较、盐类水解、守恒关系的应用以及沉淀溶解平衡等知识的题目是必考题,具有一定难度和区分度。
酸碱中和滴定曲线类试题是近几年高考的热点和难点,试题通常以酸碱滴定过程为基础,涉及电解质水溶液中离子浓度的等量关系、大小关系以及水的电离程度等知识和规律,综合性强,难度较大。
一、解题方法:1.要仔细分析所给图象,确定图象各点的成分和溶液酸碱性,充分挖掘图象信息中的隐含条件,如图示中的最高点、最低点、交汇点、突变点都是提供解题信息的关键点。
2.用守恒法、不等式(先主次、后大小)等方法解决问题。
(1)三大守恒:①电荷守恒,②物料守恒,③质子守恒。
(2)一个不等式:主要微粒>次要微粒。
①强酸、强碱、大多数盐(含水解和不水解)溶液主要以电离产生的离子形式存在于溶液中。
②弱酸、弱碱主要以弱电解质的分子形式存在于溶液中。
③可水解的盐溶液中可水解的离子的水解程度极小、弱电解质分子的电离程度极小。
④强碱弱酸的酸式盐溶液,需要讨论酸式酸根水解和电离程度的相对大小。
3.对于混合溶液的离子平衡图象题,解题思维必须触及:混合溶液有无反应、反应物是否过量、电离与水解何者强、溶液体积变化有无影响定性分析或定量计算等。
若不发生反应的混合溶液,则同时考虑电离和水解。
若恰好完全反应的混合溶液,生成的是酸或碱则考虑电离,生成的是盐则考虑水解。
若反应物过量,则根据过量程度考虑电离或水解。
若有定量计算,则要考虑混合溶液的体积变化。
4.一定要理解透坐标用对数表示的含义。
结合平衡移动原理确定变化量到底是增大了还是减小了。
5.选择题中的曲线图通常有以下几种:(1)弱电解质的电离平衡图象。
该类试题中,图象中一般会同时涉及强电解质和弱电解质。
(2)酸碱混合液的pH与离子浓度大小之间的关系图象。
(3)沉淀溶解平衡图象。



专题04 碱滴定酸的曲线1.常温下,用0.1mol/L NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。
下列结论正确的是A. 水解常数:X->Y-B. a、b两点溶液混合后:c(HX) +c(HY) +c(H+)=c(OH-)C. pH=7时,c(Y-)>c(X-)D. 10.00mlL时,有c(Na+)>c(HX)>c(X-)>c(H+)【答案】B【解析】分析:用浓度为0.1mol/L的NaOH溶液分别逐滴加入到20.00mL0.1mol/L的HX、HY溶液中,酸越弱,初始时刻pH值越大,根据图象可判断,酸性强弱为HY<HX;当NaOH 反应了10.00mL时,溶液中分别存在HX-NaX和HY-NaY,且物质的量之比分别为1:1;当NaOH反应了20.00mL时,溶液中分别恰好存在NaX和NaY,二者均会发生水解使溶液呈碱性,根据图象和溶液中的守恒关系解答。
2.常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。
下列说法不正确的是A. 在反应过程中,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)B. pH=5时,c(CH3COO-)> c(Na+)> c(H+)> c(OH-)C. pH=6时,c(Na+)+ c(H+)-c(OH-)+ c(CH3COOH)=0.1000 mol·Lˉ1D. pH=7时,消耗NaOH溶液的体积小于20.00mL【答案】C【解析】A、根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;B、pH=5时,溶液呈酸性,以醋酸电离为主,所以离子浓度的大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;C、根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),两者混合pH=6,则氢氧化钠溶液的体积小于20.00mL,物料守恒可知:c(CH3COO-)+c(CH3COOH)>0.05mol/L,所以c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.05 mol/L,故C错误;D、如果消耗NaOH溶液的体积为20.00mL,两者恰好完全反应生成醋酸钠,溶液水解呈碱性,而溶液呈中性,所以消耗NaOH 溶液的体积小于20.00mL,故D正确;故选C。


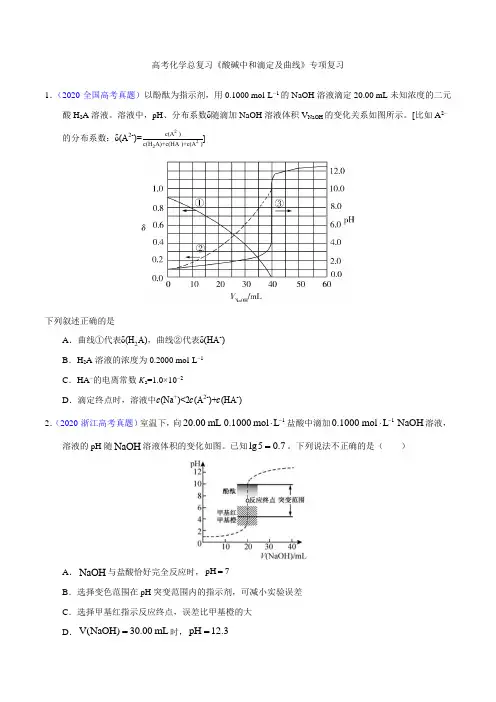
高考化学总复习《酸碱中和滴定及曲线》专项复习1.(2020·全国高考真题)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积V NaOH 的变化关系如图所示。
[比如A 2−的分布系数:δ(A 2-)=c(A 2-)c(H 2A)+c(HA -)+c(A 2-)]下列叙述正确的是A .曲线①代表δ(H 2A),曲线②代表δ(HA -)B .H 2A 溶液的浓度为0.2000 mol·L −1C .HA −的电离常数K a =1.0×10−2D .滴定终点时,溶液中c (Na +)<2c (A 2-)+c (HA -)2.(2020·浙江高考真题)室温下,向120.00mL 0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg50.7=。
下列说法不正确的是( )A .NaOH 与盐酸恰好完全反应时,pH 7=B .选择变色范围在pH 突变范围内的指示剂,可减小实验误差C .选择甲基红指示反应终点,误差比甲基橙的大D .V(NaOH)30.00mL =时,pH 12.3=3.(2020·山东高考真题)25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COO c c -= B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大4.(2019·全国高考真题)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。


专题08 导电能力曲线1.已知电导率越大导电能力越强。
常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A. 曲线①代表滴定盐酸的曲线B. 滴定醋酸的过程应该选择甲基橙作为指示剂C. a、b、c三点溶液中水的电离程度:c>a>bD. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)【答案】D【解析】醋酸是弱酸、盐酸是强酸。
同浓度的盐酸、醋酸溶液,盐酸的导电能力强,所以曲线①代表醋酸、曲线②代表盐酸,故A错误;氢氧化钠滴定醋酸,终点时溶液呈碱性,所以应该用酚酞作为指示剂,故B错误;a点表示醋酸钠溶液、c点表示氯化钠溶液、b点表示氢氧化钠与醋酸钠的混合液, b点水电离受到氢氧化钠的抑制,a点水电离受到醋酸钠的促进,c点氯化钠对水电离无影响,所以a、b、c三点溶液中水的电离程度:a>c>b,故C错误;b点表示等浓度的氢氧化钠与醋酸钠的混合液,根据电荷守恒c(Na+)+ c(H+)= c(OH-)+c(CH3COO-);根据物料守恒c(Na+)= 2c(CH3COO-)+2c(CH3COOH);所以c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH),D正确。
2.电解质溶液电导率越大导电能力越强。
常温下用0.100 mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法错误的是A. a、d、e三点的溶液中,水的电离程度最大的是d点B. 溶液温度c点高于d点C. b点溶液中:c[(CH3)2NH2+] +c[(CH3)2NH·H2O]=2c(Cl-)D. d点溶液中: c(H+) + c[(CH3)2NH·H2O]=c(OH-)【答案】D3.已知K b(NH3·H2O)=1.7×10-5,K a(CH3COOH)=1.7×10-5。

基于“教、学、评一体化 ”的高中化学大单元教学 水溶液中的离子反应与平衡酸碱中和滴定及滴定曲线2025届高三化学一轮复习课件知识点一 酸碱中和滴定的原理与操作1、概念及原理:(1)用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定碱(或酸)的浓度。
知识点一 酸碱中和滴定的原理与操作2、仪器及用品:(1)仪器:____________滴定管(如图A)、____________滴定管(如图B)、滴定管夹、铁架台、____________。
知识点一 酸碱中和滴定的原理与操作2、仪器及用品:(2)试剂:标准液、待测液、指示剂、蒸馏水。
(3)滴定管的使用试剂性质滴定管原因酸性、氧化性________滴定管氧化性物质易腐蚀橡胶管碱性________滴定管碱性物质易腐蚀玻璃,致使玻璃活塞无法打开3、实验步骤:(1)滴定前的准备以标准盐酸滴定待测NaOH溶液为例3、实验步骤:(2)滴定操作3、实验步骤:(3)终点判断等到滴入最后半滴标准液,溶液由红色变为无色,且在半分钟内________原来的颜色,视为滴定终点并记录标准液的体积。
如何滴加半滴溶液______________________________________________________________________________________________________________________。
将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁3、实验步骤:4.数据处理5.误差分析注意1:读数注意2:终点判断当滴入最后半滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。
注意3:滴定曲线与误差分析(P172)(2)实例(以标准盐酸滴定待测NaOH溶液为例,分析实验误差)步骤操作c(NaOH)洗涤未用标准溶液润洗酸式滴定管偏高锥形瓶用待测溶液润洗偏高未用待测溶液润洗取用待测液的滴定管偏低锥形瓶洗净后瓶内还残留少量蒸馏水无影响取液取碱液的滴定管尖嘴部分有气泡且取液结束前气泡消失偏低滴定滴定完毕后立即读数,半分钟后颜色又变红偏低滴定前滴定管尖嘴部分有气泡,滴定后消失偏高滴定过程中振荡时有液滴溅出偏低滴定过程中,向锥形瓶内加少量蒸馏水无影响滴定前仰视读数或滴定后俯视读数偏低1.用酚酞作指示剂,以0.100 0 mol·L-1的NaOH溶液测定装在锥形瓶中的一定体积的盐酸溶液的物质的量浓度。
专题10 酸滴定碱的曲线1.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。
下列叙述错误的是A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=lgK)B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)C. N2H5Cl溶液中c(H+)>c(OH-)D. K b1(N2H4)=10-6【答案】A2.某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。
向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是A. 交点a处对应加入的盐酸溶液的体积为5mLB. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B (OH)+)>c(H+)>c(OH-)>c(B2+)C. 交点b处c(OH)=6.4×10-5D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),【答案】C【解析】图中曲线①B(OH)2,②为B(OH)+③为B2+;交点a处对应加入的盐酸溶液的体积为5mL时,反应生成等浓度的B(OH)Cl和B(OH)2混合液,由于两种溶质水解电离能力不同,所以B(OH)2、B(OH)+浓度分数δ不相等,A错误;当加入的盐酸溶液的体积为10mL时,溶液为B(OH)Cl,溶液显酸性,根据B(OH)2(K1=5.9×10-2、K2=6.4×10-5)可知,c(Cl-)>c(B(OH)+)>c(H+)> c(B2+)>c(OH-),B错误;交点b处时,c(B(OH)+)= c(B2+),根据B(OH)+ B2++ OH-,K 2= c(OH-)=6.4×10-5, C正确;当加入的盐酸溶液的体积为15mL时,生成等体积等浓度B(OH)Cl和BCl2的混合液,存在电荷守恒为c(Cl-)+c(OH-)= 2c(B2+)+c(B(OH)+)+ c(H+),D错误;正确选项C。
专题06 对数曲线1.若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是A. pH=4时,c(HAˉ)<c(A2-)B. c(H2A)+c(HAˉ)+c(A2-)是定值C. 该酸的电离常数K a1=10-1.3D. 常温下,NaHA的水溶液呈碱性【答案】C2.已知:pOH=-lgc(OH-)。
常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。
下列说法正确的是A. 溶液加水稀释,先增大后不变B. 在NaHXO3溶液中:>1C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)D. 实线M表示pOH与的变化关系【答案】B【解析】分析:A. 溶液加水稀释,c(H+)×c(XO32-)/c(HXO3-)的值不变;B. 在NaHXO3溶液中,= [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=K h/K a1,结合pOH=2计算;C.根据溶液中电荷守恒及中性溶液中c(H+)=c(OH-)进行分析;D.已知pOH=-lgc(OH-),则pOH越大,c(OH-)越小,当pOH较大时,溶液中的氢离子较多,则c(H2XO3)较大,所以实线M表示pOH与的变化关系;根据以上分析解答。
详解:Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,Kw不变,因此c(H+)增大,Na2XO3溶液加水稀释,一直增大,A错误;= [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=K h/K a1,根据图像当=0时,溶液的pOH=4,水解大于电离,溶液显碱性,所以K h/K a1>1,即在NaHXO3溶液中:>1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时:溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3为强碱弱酸盐,水解显碱性,分两步水解:XO32-+H2O= HXO3-+ OH-, HXO3-+ H2O= H2XO3+ OH-;水解的第一步程度较大,因此c(HXO3-)/c(XO32-)比值较大,当c(HXO3-)/c(XO32-)=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,c(H2XO3)/c(HXO3-)比值较小,当c(HXO3-)/c(XO32-)=10-9时,溶液的碱性最强,pOH=0;所以实线M表示pOH与的变化关系,D错误;正确选项B。
专题09 强碱滴定三元酸曲线1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)【答案】B【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;B.根据H3AsO4的电离平衡常数计算;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;B.H3AsO4的K a2=,pH=7时c(HAsO42-)=c(H2AsO4-),K a2=c(H+)=10-7,pK a2=7,B错误;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。
2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H 3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度【答案】C3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
专题05 物质的量分数曲线1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)【答案】B【解析】分析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B. 根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)【答案】C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。
专题08 导电能力曲线1.已知电导率越大导电能力越强。
常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A. 曲线①代表滴定盐酸的曲线B. 滴定醋酸的过程应该选择甲基橙作为指示剂C. a、b、c三点溶液中水的电离程度:c>a>bD. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)【答案】D【解析】醋酸是弱酸、盐酸是强酸。
同浓度的盐酸、醋酸溶液,盐酸的导电能力强,所以曲线①代表醋酸、曲线②代表盐酸,故A错误;氢氧化钠滴定醋酸,终点时溶液呈碱性,所以应该用酚酞作为指示剂,故B错误;a点表示醋酸钠溶液、c点表示氯化钠溶液、b点表示氢氧化钠与醋酸钠的混合液, b点水电离受到氢氧化钠的抑制,a点水电离受到醋酸钠的促进,c点氯化钠对水电离无影响,所以a、b、c三点溶液中水的电离程度:a>c>b,故C错误;b点表示等浓度的氢氧化钠与醋酸钠的混合液,根据电荷守恒c(Na+)+ c(H+)= c(OH-)+c(CH3COO-);根据物料守恒c(Na+)= 2c(CH3COO-)+2c(CH3COOH);所以c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH),D正确。
2.电解质溶液电导率越大导电能力越强。
常温下用0.100 mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法错误的是A. a、d、e三点的溶液中,水的电离程度最大的是d点B. 溶液温度c点高于d点C. b点溶液中:c[(CH3)2NH2+] +c[(CH3)2NH·H2O]=2c(Cl-)D. d点溶液中: c(H+) + c[(CH3)2NH·H2O]=c(OH-)【答案】D3.已知K b(NH3·H2O)=1.7×10-5,K a(CH3COOH)=1.7×10-5。
25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是A. a点溶液中,c(CH3COO-)数量级约为10-5B. b点溶液中,c(NH4+) > c(CH3COOH)C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)D. c点水的电离程度小于d点【答案】D【解析】分析:氨水逐滴滴入盐酸和醋酸的混合液中,依次发生的反应为:HCl+NH3·H2O=NH4Cl、CH3COOH+NH3·H2O=CH3COONH4+H2O;盐酸为强酸,随着氨水的滴入,溶液的体积变大,溶液中离子浓度变小,溶液的电导率逐渐变小,当盐酸恰好完全反应时电导率最小,b点为等浓度的NH4Cl和CH3COOH的混合液;继续滴加氨水,弱酸醋酸与氨水反应生成强电解质CH3COONH4,溶液中离子浓度变大,溶液的电导率又逐渐变大,c点为等浓度的NH4Cl和CH3COONH4的混合液;醋酸恰好完全反应后,继续滴加氨水,氨水属于弱碱水溶液,溶液中离子浓度又变小,溶液的导电率又变小。
A项,由CH3COOH的电离平衡常数、盐酸和醋酸的浓度计算;B项,b点为等浓度的NH4Cl和CH3COOH的混合液,根据NH3·H2O的K b计算NH4+的水解平衡常数,比较NH4+的水解平衡常数与CH3COOH的K a;C项,c点为等浓度的NH4Cl和CH3COONH4的混合液,根据物料守恒判断;D项,分析c点和d点溶液的组成,根据酸、碱、盐对水的电离平衡的影响判断。
4.电解质溶液电导率越大导电能力越强。
常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和二甲胺[(CH3)2NH]溶液,利用传感器测得滴定过程中溶液的电导率如图所示(已知常温下二甲胺的电离常数K b=1.6×10-4)。
下列说法正确的是A. 曲线①代表滴定二甲胺溶液的曲线,pH=7时所消耗的V[HCl(aq)]大于10 mLB. 在a、b、c 三点溶液中,水电离出的c(H+):a<c<bC. 曲线中c点电导率最小,原因是c点溶液中导电微粒的数目最少D. d 点溶液呈酸性,且有3c(H+)=c(Cl-)+3c(OH-)【答案】D【解析】A. 曲线①代表滴定二甲胺溶液的曲线,二甲胺与盐酸反应生成的是强酸弱碱盐,根据题意要使pH=7,所消耗的V[HCl(aq)]小于10 mL,故A错;B. 在a点二甲胺与盐酸恰好反应,生成强酸弱碱盐,会发生水解,促进水的电离;在b点为酸过量,抑制水的电离;c点时NaOH和盐酸恰好完全反应,生成NaCl为强酸强碱盐,不水解,溶液显中性,所以a、b、c三点溶液中,水电离出的c(H+):b<c<a,故B错误;C. 曲线中c点NaOH和盐酸恰好完全反应,生成NaCl属于强电解质,完全电离,导电率大于a点,故C错误; D. 因为HCl+NaOH=NaCl+H2O,0.100 mol·L-1盐酸15mL与10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液混合,酸过量,所以溶液显酸性,溶液中存在下列电离H2O H++OH- NaCl=Na++ Cl-HCl= H++ Cl- 根据物料守和电荷守恒可得3c(H+)=c(Cl-)+3c(OH-),故D正确。
5.电解质溶液导电能力越强,电导率越大。
常温下用0.1000 mol/L 盐酸分别滴定10.00 mL 浓度均为0.1000 mol/L的NaOH溶液和二甲胺[ (CH3)2NH]溶液( 二甲胺在水中电离与氨相似,已知在常温下K b[(CH3)2NH·H2O] =1.6×10-4),利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A. 盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小B. d点溶液中:c(H+)<c(OH-)+c [(CH3)2NH2+]C. a 点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+]<c[(CH3)2NH·H2O]D. b、c、e.三点的溶液中,水的电离程度最大的是e点【答案】B【解析】假设图中最上方的曲线为②,下方曲线为①;加入盐酸前,浓度均为的和二甲胺[]溶液,是强碱,完全电离,溶液导电能力较强,则曲线①代表滴定溶液的曲线,曲线②代表滴定溶液的曲线。
盐酸滴定二甲胺所得溶液为强酸弱碱盐,溶液水解显酸性,甲基橙的变色范围为pH:3.1~4.4之间,酚酞的变色范围:pH:8.2~10之间,因此使用甲基橙误差更小,A错误;d点溶液中,溶质为,,d点溶液中,存在质子守恒,即:,所以:c(H+)<c(OH-)+c[(CH3)2NH2+],B正确;a 点溶液溶液为氢氧化钠和氯化钠混合液(各为0.0005mol), d点的溶液为,其量为0.001 mol,两溶液混合后,溶质变为和氯化钠的混合液,溶液显酸性,所以c[(CH3)2NH2+]>c[(CH3)2NH·H2O],C错误;由分析可以知道,曲线②为的变化曲线,b点溶液中溶质为和,电离出氢氧根离子抑制水的电离,c点溶质为NaCl对水的电离无影响,d点为,水解促进水的电离,溶液e点的溶液中溶质为和HCl,HCl抑制水的电离,所以b、c、e.三点的溶液中,水的电离程度最大的是c点;D错误;正确选项B。
6.利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.lmol/L 盐酸过程中的电导率曲线。
下列说法错误的是A. 电导率传感器能用于判断酸碱中和滴定的终点B. a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>cC. d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+)D. C点电导率最小是因为此时溶液中导电微粒数目最少【答案】D【解析】A.HCl和NaOH反应方程式为HCl+NaOH=NaCl+H2O,根据图象知,从0-10mL之间,随着反应的进行,溶液中c(H+)浓度逐渐减小,溶液的电导率逐渐降低,加入溶液体积大于15mL时,溶液中氢氧根离子浓度逐渐增大,溶液的电导率增大,根据图知当恰好中和时电导率最小,所以可以电导率传感器能用于酸碱中和滴定终点的判断,选项A正确;B.电导率与导电性成正比,根据图知该点电导率最大,所以其导电性最强,离子浓度由大到小顺序为a>b>c,选项B正确;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(Na+),选项C正确;D.溶液电导率与离子浓度成正比,c点电导率低是因为离子浓度小,而不是导电微粒数目最少,选项D错误。
答案选D。
7.电解质溶液电导率越大导电能力越强。
常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L 的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法不正确的是A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>BB. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数K b约为10-4C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+] >c(H+)>c(OH-)D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+] +2c[(CH3)2NH·H2O]【答案】C8.常温下,向10mL0.1mol·的HA溶液中逐滴滴入0.1mol·的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是A. ROH在溶液中的电离方程式为B. c点由电离出的浓度最小C. b点存在:D. 若升高温度,a、d两点pH增大【答案】C9.298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。