复发性卵巢癌迎来新靶向药Rubraca
- 格式:docx
- 大小:13.87 KB
- 文档页数:1

最新:粕敏感复发性卵巢癌诊治中国专家共识2023卵巢癌发病率居女性生殖道恶性肿瘤第3位,而病死率则高居首位。
新诊断卵巢上皮性癌的标准治疗方式包括规范化手术、粕类药物为基础的联合化疗及有指征的维持治疗。
基于此,中国医师协会微无创医学专业委员会妇科肿瘤学组、中国抗癌协会中西整合卵巢癌专业委员会组织专家讨论并制定《粕敏感复发性卵巢癌治疗中国专家共识(2023年版)》,旨在进一步规范和指导PSR卵巢癌的治疗与全程化管理,以期尽可能地延长PSR卵巢癌患者的PFI,提高生存质量,改善预后。
20多年来,伴随手术水平的提高以及以紫杉醇/卡粕为基础的化疗和维持治疗的规范化应用,卵巢癌患者的预后得以明显改善,但晚期患者的5年生存率仍然不足30%;超过70%的晚期患者在完成标准的初始治疗后仍会出现疾病的复发。
初期手术联合以铀类为基础的化疗达到临床缓解,在停粕化疗后6个月以上的复发性卵巢癌称为粕敏感复发性PSR卵巢癌。
绝大部分卵巢癌患者会经历反复复发或疾病进展,随着无粕间期(PFI)不断缩短,最终演进为粕耐药复发,临床治疗非常棘手。
本共识推荐级别及其代表意义见表1。
表1本共识推荐级别及其代表意义推荐级别代表意义-基于T级别临床研究证据.专家意见高度•致2A类基广高级别证据,专家意见基本•致;或基J:低级别临床研究证据,专家意见高度•致2B类基「•低级别临床研究证据,专家意见基本•致3类不论基「•何种级别临床证据,专家意见明显分歧一、定义根据复发时间与末次使用含钳化疗的时间间隔即PFL将复发性卵巢癌分为粕敏感性和钳耐药性。
PFI被广泛用于预测患者对后续化疗药物的反应、患者的生存预后及临床研究入组的筛选标准等。
实际上,PFI可能更多地反映卵巢癌的肿瘤生物学行为,用以预测肿瘤的临床特征和对化疗的反应,并非作为判断粕敏感的惟一特定指标。
PFI特指适宜于首次及2次复发人群。
而2次以上复发者,PFI是否仍可作为可靠的化疗疗效预测因子,尚缺乏足够的证据。

香港治疗卵巢癌新方法:有无BRCA基因突变均可使用的靶向疗法展开全文卵巢癌是女性常见癌症之一,香港临床肿瘤科专科李医生表示,早期卵巢癌病征不明显,不少患者发现时已经是晚期,治疗后有机会于半年内甚至数月内复发。
近年,医学界研发了针对带BRCA基因突变卵巢癌的标靶药物-PARP抑制剂,近期更有研究发现,这类药物同样可用于非基因突变患者身上,大大减低复发率,为患者带来希望。
未生育女性患卵巢癌风险较高李医生表示,相较于其他癌症,早期卵巢癌征状不怎么明显,因此不少患者延至晚期才发现患病,在发病初期,患者只出现腹胀、盆腔疼痛等症状;直至晚期,部分患者会出现腹水、腹部异常窿起等,才感觉到不对劲马上求医。
可惜研究显示,晚期卵巢癌患者的5年生存率仅约20%。
他续指,晚期患者容易复发,主要因为晚期癌症已由卵巢扩散至腹膜,医生虽然会在手术中尽量切除干净,再安排患者接受化疗,但他坦言由于太多肿瘤,影响范围太广,难以百分百清除,所以不少个案病情稳定后数月至半年,又再复发。
李医生续称,较早发育、从未生育、从未哺乳和不育的女士,其一生中卵巢的排卵次数相对较多,因此患卵巢癌的风险较高;而年过50岁和家人曾患乳癌、肠癌、子宫癌等的女性,也属于高危一族;另外,早年的研究显示,卵巢癌亦与遗传基因BRCA突变有关。
他解释,正如家居损毁需要不时维修一样,细胞中的DNA 也有受损的时候,此时便需“工具”进行修补工作,BRCA和PARP正担当这个角色。
对于BRCA基因突变的患者来说,BRCA的缺陷除了增加患卵巢癌的机会,癌细胞亦因同样存在BRCA缺陷,故特别依赖PARP来修补缺损的DNA。
因此,PARP抑制剂就能有效防止癌细胞进行DNA修复的工作,继而使其存在过多缺损的DNA而死亡,治疗癌症;最近更有研究发现,此药用于非BRCA基因突变患者同样见效。
用药无恶化存活期长近四倍李医生引述近期一项大型研究指出,PARP抑制剂对减低患者复发风险有显著成效,研究比较在手术切除肿瘤和化疗后,有用药和无用药的BRCA基因突变复发性卵巢癌患者,结果发现,有用药的无恶化存活期中位数达约19个月,比无用药的约5个月长近四倍;复发率更大减70%,有小部分患者6年后仍未复发,显示药物有效延长癌细胞受控时间,效果理想。

卵巢癌是一种女性常见的恶性肿瘤之一。
发病率仅次于宫颈癌和子宫内膜癌。
虽然卵巢癌的发病率位于第三位,但是卵巢的死亡率却是女性的恶性肿瘤中的首位。
当卵巢癌到了晚期时,很容易出现其他脏器组织的扩散转移,手术切除的可能性很小,因此药物治疗成了重要的治疗方法,如靶向药,那卵巢癌晚期病人吃靶向药有用吗?对于一些晚期病人来说,吃靶向药是有一定作用的,有助于减轻患者痛苦,抑制肿瘤生长,控制病情发展。
需要提醒大家的是,靶向药虽然对卵巢癌治疗有效,但靶向药至今仍无法摆脱耐药难题,且随着靶向治疗次数的增加,患者往往会产生耐药性。
另外,靶向药也有其特定使用人群,使用靶向药前需要进行基因检测,有相应的“驱动基因”突变才能使用相应的靶向药,不可盲目使用。
袁希福老中医曾用过一个形象的比喻:“靶向药物的原理不同于传统化疗药好坏细胞都杀,而是找到致癌突变基因后进行‘精确攻击’,这就像打鸟一样,你想打鸟,首先得知道鸟的位置,瞄准鸟。
假如你连树上有没有鸟都不知道,想着先凭运气盲打两枪试试,真把鸟打下来的概率自然是非常低的!”“不做基因检测,不知道有没有基因突变就吃靶向药说白了也就是盲吃!用药的时候药物副作用、耐药性,都是应该考虑到的问题,没有经过基因检测就吃靶向药,万一没有靶点,药在身体内怎么可能不影响病人身体呢?”当然,对于那些不能进行靶向药治疗的患者来说,可以选择其他方式的治疗,比如中医治疗。
中医治疗卵巢癌已经有几千年的历史,积累了不少成功经验和宝贵案例。
在中医看来,卵巢癌是一种全身性的疾病,需从整体观念出发,实施辨证论治。
中医治疗卵巢癌讲究辩证论治,注重整体治疗,一方面有助于抑杀癌细胞,控制病情发展,另一方面有助于调理患者机体,增强患者免疫力。
除此之外,还有助于提高整体治疗疗效,改善患者生存质量,延长患者生存期。
袁希福出身于中医世家,祖上从清朝乾隆年间开始行医,到嘉庆年间已经远近闻名。
同治十年、光绪元年,皇帝先后颁发圣旨,诏封袁希福祖上名医袁积德为“奉直大夫”。

2024卵巢癌靶向治疗应用及进展要点(全文)卵巢上皮癌(简称卵巢癌)的死亡率在女性总癌症中居第5位,且在女性生殖系统恶性肿瘤中居首位。
在中国,2022年预计有近5.7万的卵巢癌新发病例和3.9万的死亡病例[1],且呈上升趋势。
由于起病较为隐匿,早期患者缺乏特异性症状及特征,约70%的患者诊断时即为晚期,5年生存率为30%~40%。
对晚期患者来说,肿瘤细胞减灭术及铂类为基础的联合化疗是卵巢癌治疗的基石,多数患者一线治疗后可获得缓解,但70%左右的患者仍会在2~3年内复发,并接受补救治疗,且无治疗间期不断缩短,最终导致死亡。
探索新的治疗模式是近年来卵巢癌研究的热点和难点。
靶向治疗(targeted therapy)是指应用某些特定的单克隆抗体或小分子药物对肿瘤发生、发展过程中的靶点进行干扰以达到抗肿瘤的目的。
目前卵巢癌靶向治疗主要包括抗血管生成药物、聚腺苷二磷酸核糖聚合酶(poly adenosine diphosphate ribose polymerase,PARP)抑制剂以及其他类药物等,下面将对靶向治疗相关药物进行系统阐述,以期将繁杂的循证医学证据归类汇总,梳理临床和分子特征助力临床决策和个体化诊疗的脉路。
一、抗血管生成药物1.卵巢癌一线维持治疗:抗血管生成药物贝伐珠单抗是第一个被美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于卵巢癌一线维持治疗的药物,相关的临床研究包括GOG-0218和ICON7,结果显示出明显的无进展生存期(progression-free survival,PFS)获益,但无总生存(overall survival,OS)获益[2-3]。
从2019年得到的GOG-0218的最终OS数据结果[4]看,经过中位随访102.9个月、剔除了组间交叉及化疗组二线应用贝伐珠单抗等数据后,三组之间的总生存仍未见明显差异。
只有探索性分析结果显示,Ⅳ期患者在贝伐维持组的总生存可能优于对照组(42.8个月vs.32.6个月;HR=0.75,95%CI:0.59~0.95)。

4大靶向药物方案:有效防止卵巢癌复发在过去的3年中,靶向治疗在卵巢癌中的发展迅速,FDA批准了一线治疗中的4种新策略,这些策略可使女性无病进展的时间比以前的标准治疗更长。
在此之前,将标准治疗从环磷酰胺更改为紫杉醇已有近20年的时间。
贝伐单抗贝伐单抗联合化疗于2014年头次在复发性铂耐药的卵巢癌中获得FDA批准。
根据来自GOG-0218 3期试验(NCT00262847)的数据,FDA于2018年6月批准贝伐单抗联合卡铂和紫杉醇,随后单药贝伐单抗维持治疗用于初次手术切除后的III或IV期上皮性卵巢癌,输卵管或原发性腹膜癌的患者。
奥拉帕尼2018年12月,FDA批准了PARP抑制剂olaparib作为维持治疗,用于具有有害或疑似BRCA突变的晚期上皮性卵巢癌,输卵管癌或原发性腹膜癌的成年人患者。
该疗法基于SOLO-1第3期试验(NCT01844986)的数据。
BRCA突变既可以是种系突变也可以是体细胞突变,尽管这些患者中的大多数确实具有种系突变。
在SOLO-1中,患者被随机分配接受每日两次300 mg的olaparib(n = 260)或安慰剂(n = 131)的维持治疗。
Olaparib使进展或死亡的风险降低70%,平均随访时间为41个月。
在大多数患者停止治疗的一年后,奥拉帕尼组60%的患者3年后无进展,而安慰剂治疗3年后无进展的患者为26.9%。
2020年10月欧洲医学肿瘤学会提交的五年随访数据显示,奥拉帕尼的益处在治疗结束后仍将持续。
奥拉帕尼维持组观察到的中位PFS为56.0个月,而安慰剂组为13.8个月。
尼拉帕利2020年4月,FDA根据第三阶段PRIMA试验数据(NCT02655016),将尼拉帕利(naraparib)用作对一线铂类化学疗法完全或部分应答的晚期上皮性卵巢癌,输卵管或原发性腹膜癌成人的维持疗法。
与SOLO-1试验不同,所有生物标志物人群均包括在研究中,并且50.9%的患者患有HRD阳性肿瘤。

一、引言卵巢癌是一种常见的妇科恶性肿瘤,发病率位居女性恶性肿瘤的第五位。
由于卵巢癌早期症状不明显,常常被误诊或漏诊,导致患者确诊时已处于晚期,预后较差。
近年来,随着分子生物学、免疫学等领域的不断发展,卵巢癌的治疗策略也在不断创新。
本文将介绍一种基于创新药物治疗的卵巢癌治疗方案。
二、治疗方案概述卵巢癌创新药治疗方案主要包括以下几个方面:1. 免疫检查点抑制剂治疗免疫检查点抑制剂是一种新型免疫治疗药物,通过阻断肿瘤细胞与免疫细胞之间的相互作用,激活免疫系统攻击肿瘤细胞。
目前,针对卵巢癌的免疫检查点抑制剂主要包括:(1)PD-1抑制剂:如帕博利珠单抗(Pembrolizumab)、尼伏单抗(Nivolumab)等。
(2)CTLA-4抑制剂:如伊匹单抗(Ipilimumab)等。
2. 靶向治疗药物靶向治疗药物针对肿瘤细胞特异性信号通路,抑制肿瘤细胞的生长和增殖。
针对卵巢癌的靶向治疗药物主要包括:(1)PARP抑制剂:如奥拉帕利(Olaparib)、尼拉帕利(Niraparib)等。
(2)VEGF抑制剂:如贝伐珠单抗(Bevacizumab)、瑞戈非尼(Regorafenib)等。
3. 联合治疗方案针对卵巢癌患者,可根据病情和个体差异,采用免疫检查点抑制剂、靶向治疗药物或两者的联合治疗方案。
三、治疗方案实施步骤1. 评估病情在开始治疗前,对患者进行全面评估,包括肿瘤分期、病理类型、患者年龄、身体状况等。
2. 制定治疗方案根据患者病情和个体差异,制定个性化的治疗方案。
可参考以下步骤:(1)评估肿瘤负荷:肿瘤负荷较大的患者,优先考虑免疫检查点抑制剂治疗。
(2)评估肿瘤组织类型:针对BRCA突变阳性的卵巢癌患者,优先考虑PARP抑制剂治疗。
(3)评估患者身体状况:根据患者年龄、身体状况等,选择合适的治疗方案。
3. 治疗实施(1)免疫检查点抑制剂治疗:按照医嘱,定期注射PD-1抑制剂或CTLA-4抑制剂。
(2)靶向治疗药物:按照医嘱,定期口服PARP抑制剂或VEGF抑制剂。

妇科癌症的新疗法靶向治疗和免疫疗法的突破妇科癌症的新疗法:靶向治疗和免疫疗法的突破近年来,妇科癌症的治疗领域取得了令人瞩目的进展,尤其是靶向治疗和免疫疗法的应用。
这些新疗法的引入为妇科癌症患者带来了希望,有效地改变了传统治疗无法满足的局面。
本文将重点探讨妇科癌症的靶向治疗和免疫疗法的突破。
一、靶向治疗在妇科癌症治疗中的应用靶向治疗是指通过针对癌细胞表面的特定分子进行干预,从而阻止细胞增殖、抑制肿瘤生长。
在妇科癌症领域,靶向治疗已经成为重要的研究方向和临床应用手段。
1. 子宫内膜癌的靶向治疗子宫内膜癌是一种常见的妇科癌症类型,过去主要依靠手术切除和放疗进行治疗。
然而,由于肿瘤异质性以及药物耐药性的存在,传统治疗手段的效果有限。
靶向治疗因此成为改善治疗效果的重要策略之一。
针对子宫内膜癌的靶向治疗主要集中在PI3K-AKT-mTOR信号通路上。
目前,针对PI3K通路的抑制剂已经进入临床试验阶段,取得了一定的疗效。
例如,针对子宫内膜癌患者中的PIK3CA基因突变进行靶向治疗,可以显著提高患者的生存率和质量。
2. 卵巢癌的靶向治疗卵巢癌是一种妇科恶性肿瘤,具有高度侵袭性和易复发性的特点。
传统治疗方法包括手术和化疗,但该疾病的预后仍然不理想。
因此,寻找新的治疗方法势在必行。
在卵巢癌的靶向治疗中,PARP抑制剂是一类新型药物的代表。
PARP是DNA修复途径中的一个重要酶,PARP抑制剂能够阻断癌细胞的DNA修复通路,进而导致癌细胞的死亡。
临床实验证实,PARP 抑制剂在卵巢癌患者中显示出优异的疗效和良好的耐受性。
二、免疫疗法在妇科癌症治疗中的突破免疫疗法是一种通过激活患者自身的免疫系统来攻击癌细胞的新型治疗方法。
近年来,免疫疗法在妇科癌症治疗中的研究得到了长足的发展。
1. 子宫颈癌的免疫疗法子宫颈癌是世界范围内令人担忧的恶性肿瘤之一,特别是在发展中国家。
传统治疗方法包括手术、放疗和化疗,但疗效有限。
在子宫颈癌的免疫疗法中,PD-1/PD-L1抑制剂是目前的研究热点。

显著延长PFS!奥拉帕利+贝伐珠单抗一线维持治疗晚期卵巢癌PAOLA-1研究到达主要终点8月14日,阿斯利康/默沙东宣布Lynparza(奥拉帕利)在晚期卵巢癌患者(有或无BRCA突变)中开展的III期PAOLA-1 研究取得阳性结果。
PAOLA-1 研究比较了奥拉帕利+贝伐珠单抗作为一线维持治疗相比贝伐珠单抗单独使用的差异,不管患者BRCA突变情况如何。
结果显示,在意向治疗人群中,奥拉帕利+贝伐珠单抗作为一线维持疗法使患者的PFS得到了具有临床意义和统计学意义的显著改善,相比单独使用贝伐珠单抗延长了患者发生疾病进展或死亡的时间。
PAOLA-1 研究是Lynparza在一线治疗晚期卵巢癌患者中取得的第2项积极III期结果,详细数据将在不久后召开的医学会议上公布。
Lynparza在2018/12/19被FDA批准用于铂类药物化疗后产生应答的BRCA+晚期卵巢癌的一线维持治疗。
PAOLA-1 研究的意义则是有望将Lynparza的一线维持治疗范围扩大到BRCA野生型的人群。
卵巢癌是常见的妇科肿瘤之一,全球每年新增卵巢癌病例接近30万,死亡人数超过15万。
手术和化疗是卵巢癌的常见治疗手段,初始患者通常都能够获得临床缓解,但是70%以上的初治患者会在3年内复发,这也是卵巢癌比较难治的主要原因之一。
因此,在一线治疗产生应答后,通过维持治疗降低复发时间对提高卵巢癌患者的临床结局有重要意义。
奥拉帕利最近好消息不断。
今天6月的ASCO大会上,阿斯利康公布奥拉帕利多项研究结果,包括针对既往已经接受过二线以上疗法的BRCA突变的复发卵巢癌患者的SOLO-3研究最新结果。
数据显示,使用奥拉帕利组单药治疗(n=151)相比单药化疗显著提高了ORR (72.2% vs 51.4%),显著延长了PFS(13.4 vs 9.2个月)。
SOLO-3研究证明了奥拉帕利是首个能够为多次复发卵巢癌患者带来比化疗更大获益的药物。
8月7日,阿斯利康/默沙东刚宣布奥拉帕利在转移去势抵抗前列腺癌(mCRPC)患者中开展的一项代号为PROfound的III期研究的积极结果。

泰索帝治疗晚期复发性卵巢癌研究现状肿瘤防治杂志 2000年第1期第17卷综述与讲座作者:李斌刘丽影章文华单位:李斌刘丽影章文华(北京市中国医学科学院肿瘤医院妇科肿瘤科100021)关键词:卵巢肿瘤/治疗;化学药物治疗;泰索帝中图分类号:R737.31;R730.53 文献标识码:A文章编号:1009-4571(2000)01-0080-031 化学结构、作用机制及药代动力学泰索帝(taxotere, TXT,化学名 docetaxel)是半合成紫杉类化合物,其合成原料(10-deacetylbaccatin Ⅲ)提取于欧洲紫杉的针叶,为一种可再生的自然资源。
泰索帝的化学结构与紫杉醇的区别在于其碳10和碳13上侧链基团较小,以烷氧基取代碳13上的苯甲酰胺苯基,以羟基取代碳10上的乙酰基,其经验分子式C43H53N14·3H2O,分子量807.9 kD。
泰索帝抗肿瘤作用机制是通过促进微管蛋白聚合,形成稳定的非功能性微管,并抑制其解聚,导致自由的微管蛋白明显减少,从而破坏细胞的微管系统,抑制肿瘤细胞的有丝分裂,并最终导致细胞死亡[1]。
泰索帝的细胞毒作用机理与紫杉醇基本相同,但多项临床前期药理学研究表明,泰索帝促进微管蛋白聚合抑制其解聚的潜力及对微管结合部位亲和力均为紫杉醇的2倍[2]。
体外抗肿瘤活性研究显示,泰索帝与紫杉醇比较,其抗瘤谱更广,抗瘤活性更强,与长春新碱、顺铂、足叶乙甙耐药的肿瘤细胞株无交叉耐药性[3],对部分紫杉醇耐药的肿瘤细胞株也具有活性。
体内抗肿瘤试验进一步提示泰索帝无一定作用程序,与多种化疗药物,如足叶乙甙、环磷酰胺、氟脲嘧啶等有协同作用[4,5]。
泰索帝的药代动力学呈线性,符合三室模型,血清蛋白结合率93%~94%,平均终末消除相半衰期11.1 h,主要经胆道排泄,经尿排泄仅占5%~7%。
2 Ⅰ期临床研究及基本用药方案大量的Ⅰ期临床研究在美国和欧洲进行。
入组病例234例,包括卵巢癌、肺癌、乳腺癌等多种实体瘤,用药共790周期,评价泰索帝剂量范围5~115 mg/m2及其相关的7种给药方案,结果显示泰索帝单药最大耐受量为115 mg/m2,在此剂量范围内,血中性粒细胞降低为主要的剂量限制因素。
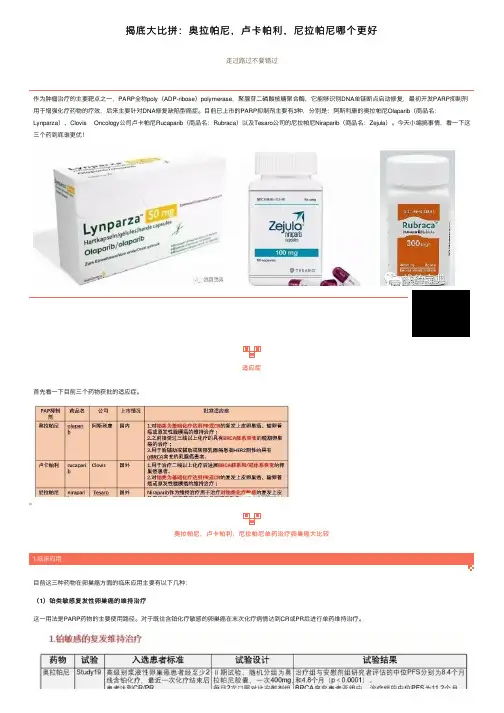
奥拉帕尼,卢卡帕利,尼拉帕尼单药治疗卵巢癌⼤⽐较简要对⽐⼀下:三种药物在具有BRCA突变(gBRCA是胚系突变,tBRCA包含体系和胚系突变)的患者维持治疗PFS差不多,总体在20个⽉左右,尼拉帕尼更优。
在所有铂类化疗敏感⼈群中,尼拉帕尼和卢卡帕利的PFS数值更漂亮。
(2)具有胚系BRCA突变卵巢癌复发后的解救治疗在解救治疗上,⽬前只有奥拉帕尼和卢卡帕利获得了初期结果。
从有效率上看,卢卡帕利的ORR50%,更⾼。
等待奥拉帕尼的SOLO3的数据结果。
(3)发展⽅向除了以上常见的临床应⽤外,⽬前三种药物都在向更⼴阔的的药物⽅向发展。
2.药物基础属性(1)其实PARP家族共有17种PARP抑制剂,⽽⽬前这三种药物的各⾃能覆盖的靶点不⼀。
其中卢卡帕利的靶点最⼴。
这种靶点不⼀的情况其实对于后续耐药处理提供了思路。
(2)药理数据:在2017ECCO上,Tesaro公司展⽰了⼀张三种药物的药理学数据,尼拉帕尼在很多指标上处于优势地位。
3.尼拉帕尼联合PD1已拔得头筹其中PARP抑制剂使⽤起来限制重重,但是现实⽣活中很多患者都是铂类耐药及难治的。
此类患者被直接排除。
⽽⽬前⽕爆的PD1在卵巢癌的数据也较为有限。
那如果将⼆者联合起来能否获得较好的临床疗效呢。
在2018SGO上,就报道了⼀项尼拉帕尼联合K药治疗铂难治耐药的卵巢癌的临床数据。
结果喜⼈,更贴近临床应⽤。
4.PARP抑制剂耐药任何靶药都会有耐药出现。
⼩编前⽇拜读了⼀篇PARP耐药原因的⽂章,描述原因很多如BRCA的继发突变导致活性恢复、其他修复通路的活化等。
⽽其中⼀种耐药机理提到其他PARP酶的异常导致在服靶药耐药。
⽽在此情况下,采⽤靶点更多的PARP抑制剂或与PARP结合⼒更强的靶药如卢卡帕利及尼拉帕尼也是其中⼀条解决通路。
虽然有待临床验证,但是提供了解决思路。
通过以上的各⾓度⽐拼,希望⼤家对这是三种药物有了更为清晰的认知。
尼拉帕尼和卢卡帕利虽然上市晚些,但有⾃⼰的独特优势。

重磅丨首款靶向药奥拉帕利国内获批,卵巢癌迈入精准治疗时代近日,阿斯利康(中国)与默沙东(中国)联合宣布,国家药监局已批准奥拉帕利片剂(Olaparib,商品名:利普卓)在国内上市,用于铂类敏感复发性卵巢癌的维持治疗,无论患者是否携带BRCA1/2突变。
这意味着,国内卵巢癌治疗方案中终于有了第一款靶向新药!作为死亡率最高的妇科肿瘤,每年全球卵巢癌新发病例22.5万,死亡人数14万。
而在我国每年新发卵巢癌病例约5.2万例,死亡约2.3万例。
主要原因在于,卵巢癌起病隐匿,难以早期发现,多数患者确诊时已是中晚期,错过了最佳治疗时机,5年生存率很低。
过去几十年,我国晚期卵巢癌治疗一直缺乏有效药物。
而奥拉帕利的引入,将很大程度上改善这一困境。
奥拉帕利美国上市年份:2014年作用靶点:PARP-2, PARP-3, PARP1FDA批准的三大适应症:♦治疗既往接受过三线以上化疗的BRCA突变晚期卵巢癌。
♦用于对铂类药物化疗有应答的成人复发性上皮性卵巢癌、输卵管或原发性腹膜癌的二线维持治疗。
♦治疗具有BRCA突变、HER2阴性,且既往接受过化疗或内分泌治疗的转移性乳腺癌患者。
作为全球首个获批的PARP抑制剂,奥拉帕利能够抑制PARP蛋白活性。
PARP蛋白(多聚腺苷二磷酸酯核糖聚合酶)通过碱基切除修复途径对DNA复制过程出现的单链损伤进行切除修复,参与DNA的复制与转录并维持基因组稳定性。
许多癌细胞相比于正常健康细胞更依赖PARP蛋白。
而PARP抑制剂正是通过阻断肿瘤细胞DNA修复路径来优先杀死癌细胞。
值得一提的是,PARP抑制剂对于BRCA1/2突变的乳腺癌及卵巢癌细胞有明显抑制作用,能杀死携带这两个突变的癌细胞。
而在所有卵巢癌患者当中,大约15%-20% 携带BRCA基因突变。
不过这次批准的卵巢癌适应症,并不要求患者有BRCA1/2突变。
临床疗效——无进展生存期翻倍临床研究数据显示,对于至少完成了二线含铂化疗并获得缓解的卵巢癌患者而言,在第二次化疗缓解后,使用奥拉帕利维持治疗,与安慰剂相比,无进展生存期(PFS)延长了近2倍(8.4个月vs 4.8个月),疾病进展或死亡风险下降了65%。
最新盘点 | 卵巢癌的上市靶向药物卵巢癌的死亡率在女性生殖系统肿瘤中位居第一,发病率仅次于子宫颈癌、子宫内膜癌。
由于临床症状不明显,大多数患者确诊时已处于癌症晚期,并已出现转移。
国际肿瘤研究机构数据表明,卵巢癌的5年生存率为46%。
近20年来,卵巢癌5年内的复发率高达80%,且复发时间主要集中在治疗期的3年内。
本期汇总整理了全球最新最全的治疗卵巢癌的靶向药物及其可及性信息,如若药物价格太昂贵或是难以买到,您也可以参考我们汇总的国内最新临床试验信息,考虑参与临床试验。
01卵巢癌治疗现状对于卵巢癌患者,手术和化疗仍是主要的治疗方式,和大部分癌症治疗领域的突飞猛进、新药迭出相比,卵巢癌已近三十年,始终没有新的一线用药出现。
但随着科学家发现,卵巢癌的发病和BRCA基因突变密切相关,一种名为PARP抑制剂的靶向药物的出现,使得卵巢癌患者可以最大限度地维持治疗效果,延迟复发时间。
2018年08月23日,首个卵巢癌靶向药物PARP抑制剂奥拉帕利(利普卓)获CFDA批准,成为在我国国内上市的首款PARP抑制剂,填补了国内卵巢癌靶向治疗领域近30年的空白,从此中国卵巢癌治疗进入PARP抑制剂时代。
02卵巢癌可用药物VEGFA❆贝伐珠单抗(安维汀®):2010年2月中国获批上市,目前已纳入国家乙类医保目录。
贝伐珠单抗与化疗药物(卡铂和紫杉醇)联合用于治疗对铂类敏感的复发性上皮性卵巢癌,输卵管癌或原发性腹膜癌的患者与单纯用化疗药物治疗相比,中位总生存期:42.6个月 vs 37.3个月;中位无进展生存期:13.8个月 vs 10.4个月;总缓解率:78% vs 56%。
PARP❆奥拉帕利(利普卓®):2018年8月23日,阿斯利康中国与默沙东中国联合宣布,CFDA已批准首个PARP抑制剂利普卓(奥拉帕利片)正式上市,利普卓可用于铂敏感复发性卵巢癌维持治疗,无论BRCA突变与否,奥拉帕利可以“靶向阻断”肿瘤细胞DNA修复路径,从“源上”杀死癌细胞。
复发性卵巢癌化疗联合靶向治疗的效果观察摘要:目的:探析复发性卵巢癌采用化疗联合靶向治疗的效果。
方法:筛选出28例复发性卵巢癌患者,视不同治疗方案将其分成观察组A和观察组B,两组都是14例,观察组A给予紫杉醇+铂类化疗,观察组B给予化疗加用贝伐单抗治疗,对比其疗效。
结果:观察组A治疗的有效率与控制率依次是28.6%、64.3%,观察组B治疗的有效率与控制率依次是42.9%、85.7%,观察组B均高于观察组A,对比差异显著(P<0.05);两组患者的不良反应诱发率均为28.6%,对比差异不显著(P>0.05)。
结论:复发性卵巢癌采用化疗联合靶向治疗的效果满意,毒副反应可控,有望成为复发性卵巢癌的有效、安全的候选治疗方案。
关键词:复发性卵巢癌;靶向治疗;贝伐单抗卵巢癌的病死率居妇科恶性肿瘤之首,其5年生存率仅为35%,多数患者确诊时已为晚期【1】。
近几年,随着人们生活方式与行为习惯的不断变化,卵巢癌的发病率不断增加,在中国,2015年约有52100例新发卵巢癌,约22500例死于卵巢癌【2】。
目前卵巢癌的标准治疗是手术联合化疗,但多数患者于术后2-3年内复发,且部分表现为化疗耐药【3】。
基于此,本研究为了进一步探析复发性卵巢癌采用化疗联合靶向治疗的效果,筛选出本院2016年7月到2017年7月28例患者的病历资料进行研究,并对比化疗以及化疗联合靶向治疗的临床效果,见下述总结汇报。
1资料与方法1.1一般资料筛选出28例复发性卵巢癌患者,视不同治疗方案将其分成观察组A和观察组B,两组都是14例。
观察组A:年龄28~62岁,平均(47.4±4.3)岁;婚史中,已婚14例,未婚0例;生育史中,有生育史14例,无生育史0例;肿瘤类型中,浆液性乳头状腺癌9例,浆液性囊腺癌3例,移行细胞癌1例,子宫内膜炎癌1例;病变部位中,单侧卵巢癌12例,双侧卵巢癌2例;肿瘤分期中,Ⅲ期2例,Ⅱ期9例,Ⅰ期3例。
观察组B:年龄28~62岁,平均(47.7±4.2)岁;婚史中,已婚13例,未婚1例;生育史中,有生育史13例,无生育史1例;肿瘤类型中,浆液性乳头状腺癌9例,浆液性囊腺癌3例,移行细胞癌1例,子宫内膜炎癌1例;病变部位中,单侧卵巢癌12例,双侧卵巢癌2例;肿瘤分期中,Ⅲ期2例,Ⅱ期10例,Ⅰ期2例。
抗癌捷报:奥拉帕尼逆天数据,无进展生存时间延长25个月!奥拉帕尼奥拉帕尼是目前上市的首个口服类的ADP核糖聚合酶(PARP)类抑制剂,可以抑制DNA的修复,对于同样具有DNA修复障碍的如BRCA基因突变的肿瘤细胞具有双重抑制效应,在细胞及临床水平都表现出对BRCA突变患者的有效抑制!近日召开的2017年妇瘤年会上阿斯利康惊喜报道了奥拉帕尼治疗复发卵巢癌的III期临床试验SOLO-2近期结果,奥拉帕尼维持治疗既往铂类化疗失败的复发的BRCA胚系突变的卵巢癌患者,PFS达到30.2月(长达2年半),相比安慰剂(PFS只有5.5个月),整整延长了两年多!患者进展及死亡风险下调70%!在此次III期SOLO-2试验中,294例BRCA1/2突变复发卵巢癌患者被纳入其中,这些患者都是之前至少接受过至少两次含铂类的全身化疗后出现复发,最近对含铂方案有疗效,以2:1的比例随机分配到奥拉帕尼维持治疗组(300mg,bid)及安慰剂组,最终主要研究目标PFS(无进展生存时间≈耐药时间)经独立调查(BICR)评估,奥拉帕尼治疗组:安慰剂组是30.2个月:5.5个月。
(HR 0.25; 95% CI 0.18-0.35; P<0.0001)。
另一种评价方法调查者评估分析显示虽然结果有些出入,奥拉帕尼组达到19.1个月,但也明显高于安慰剂组的5.5个月。
另外,试验还统计了两组患者进行下一次治疗的时间及治疗后二次进展时间(PFS2),前者奥拉帕尼组达到27.9个月,而安慰剂组只维持了7.9个月患者就需要接受进一步治疗。
而在接受继续治疗的患者中,二次进展时间(PFS2)奥拉帕尼组还未达到,安慰剂组是18.4个月,风险比下降50%,奥拉帕尼仍然保持了极大的生存优势。
目前整体生存时间还未得到。
这些后续的分析数据进一步奠定了奥拉帕尼在BRCA突变的复发卵巢癌患者中绝对的维持治疗地位!在安全性方面,奥拉帕尼主要表现出血液学毒性,两组≥3 级的不良反应分别是36.9%和18.2%,最常见的包括贫血(19.5% vs 2.0%)、中性粒减少(5.1% vs 4.0%)及血小板减少(1.0%两组)。
复发性卵巢癌迎来新靶向药Rubraca
近日,美国FDA正式批准PARP抑制剂Rubraca(rucaparib)片剂,用于复发性卵巢上皮癌、输卵管癌或原发性腹膜癌患者的维持治疗(无论BRCA状态如何),这些患者在接受铂类化疗后完全或部分缓解。
FDA还同时批准了补充诊断测试FoundationFocus CDx BRCA LOH,用于确定肿瘤样本的同源重组缺陷(HRD)状态。
作为女性生殖系统最常见的恶性肿瘤之一,卵巢癌严重威胁着女性健康。
据美国癌症学会数据显示,仅有20%的卵巢癌患者在早期被诊断出来。
而1期卵巢癌患者接受治疗后五年生存率高达90%,4期患者仅为17%左右。
目前恶性卵巢癌的标准疗法为手术和化疗,但很多患者都会复发。
据统计,全球每年有超过22万女性确诊卵巢癌,死亡率高达60%。
而在所有卵巢癌患者中,约15-20%携带BRCA 基因突变。
BRCA基因主要参与修复损伤的DNA,通常以此机制来防止肿瘤进一步发展。
然而,这些基因突变也可直接导致包括卵巢癌在内的某些癌症。
Rubraca是一类称为PARP抑制剂的药物,可阻断参与修复受损DNA的PARP酶活性。
当PARP的功能得到抑制,那些同时具有受损BRCA基因的癌细胞的DNA不太可能得到修复,导致癌细胞死亡,并可能减缓或停止肿瘤生长。
今年2月底,Rubraca已被纳入美国国家综合癌症网络(NCCN)卵巢癌临床实践指南,作为铂类敏感卵巢上皮癌、输卵管癌和原发性腹膜癌患者的维持疗法(在接受至少两次铂类化疗后有完全或部分缓解)。
苏珊·罗斯是Rubraca的受益者之一。
2007年她被诊断出卵巢癌,此后接受了4次手术和3周期的化疗。
2015年12月,卵巢癌复发,而这次她没有选择手术治疗,而是加入了Rubraca的临床试验。
经过一年多的治疗,她的肿瘤完全收缩,她仍在继续接受Rubraca治疗。
“自2007年诊断出卵巢癌以来,我的状态从没有这么好过!我感觉自己重生了!”她说。
“FDA批准Rubraca作为维持治疗,对于复发性卵巢癌患者来说是一个重要的里程碑。
它提供了更大的灵活性来使用这种新型PARP抑制剂,该抑制剂已显示出显著的临床疗效并在实践中被广泛接受。
”此项研究的首席研究员、肿瘤学教授兼UCL癌症研究所临床主任Jonathan Ledermann教授说,“这将使更多罹患铂敏感复发性卵巢癌患者受益。
”另外,在开具Rubraca处方时,无须进行生物标志物检测。
此次Rubraca的获批,是基于临床试验ARIEL3的结果。
这是一项随机、双盲、安慰剂对照的研究。
该研究显示,在所有患者中,由研究者评估的中位无进展生存期(PFS),Rubraca 组相较安慰剂组显示出显著的统计学改善。