热分析动力学
- 格式:ppt
- 大小:3.78 MB
- 文档页数:85



热分析动力学一、 基本方程对于常见的固相反应来说,其反应方程可以表示为)(C )(B )(A g s s +→ (1)其反应速度可以用两种不同形式的方程表示:微分形式 )(d d ααf k t= (2) 和积分形式t k G =)(α (3)式中:α――t 时物质A 已反应的分数;t ――时间;k ――反应速率常数;f (α)—反应机理函数的微分形式; G(α)――反应机理函数的积分形式。
由于f (α)和G (α)分别为机理函数的微分形式和积分形式,它们之间的关系为:ααααd /)]([d 1)('1)(G G f == (4)k 与反应温度T (绝对温度)之间的关系可用著名的Arrhenius 方程表示:)/exp(RT E A k -= (5)式中:A ――表观指前因子; E ――表观活化能; R ――通用气体常数。
方程(2)~(5)是在等温条件下出来的,将这些方程应用于非等温条件时,有如下关系式:t T T β0+= (6)即:β/=t d dT式中:T 0――DSC 曲线偏离基线的始点温度(K ); β――加热速率(K ·min -1)。
于是可以分别得到:非均相体系在等温与非等温条件下的两个常用动力学方程式:)E/RT)f(A t d d αexp(/-=α (等温) (7))/exp()(βd d RT E f AT -=αα (非等温) (8)动力学研究的目的就在于求解出能描述某反应的上述方程中的“动力学三因子” E 、A 和f(α)对于反应过程的DSC 曲线如图所示。
在DSC 分析中,α值等于H t /H 0,这里H t 为物质A ′在某时刻的反应热,相当于DSC 曲线下的部分面积,H 0为反应完成后物质A ′的总放热量,相当于DSC 曲线下的总面积。
二、 微分法2.1 Achar 、Brindley 和Sharp 法:对方程)/exp()(βd d RT E f AT -=αα进行变换得方程:)/exp(d d )(βRT E A Tf -=αα (9)对该两边直接取对数有:RTEA T f -=ln d d )(βln αα (10)由式(11)可以看出,方程两边成线性关系。
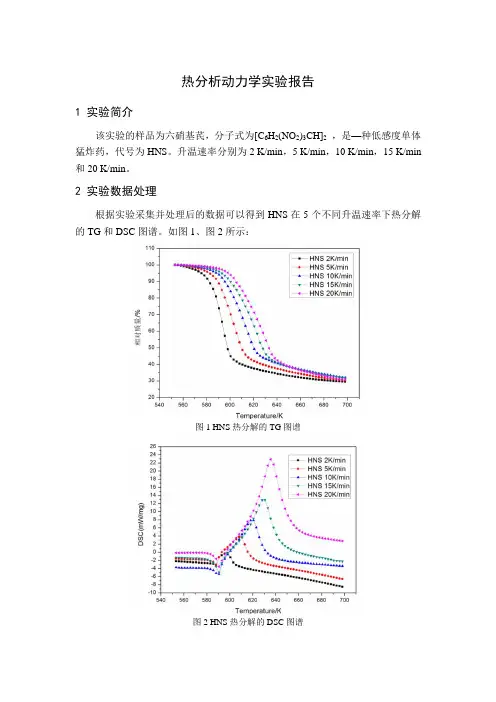
热分析动力学实验报告1 实验简介该实验的样品为六硝基芪,分子式为[C6H2(NO2)3CH]2,是—种低感度单体猛炸药,代号为HNS。
升温速率分别为2 K/min,5 K/min,10 K/min,15 K/min 和20 K/min。
2 实验数据处理根据实验采集并处理后的数据可以得到HNS在5个不同升温速率下热分解的TG和DSC图谱。
如图1、图2所示:图1 HNS热分解的TG图谱图2 HNS热分解的DSC图谱根据图1的TG 图谱,可得到5个升温速率下HNS 的相对失重量,起始温度和终止温度,具体如表1所示:表1 HNS 的TG 图谱解析表升温速率β 相对失重量/%起始温度/K 终止温度/K2 K/min 70.56 553.15 698.155 K/min 69.69 10 K/min 68.05 15 K/min 68.15 20 K/min 69.34根据图2中的DSC 图谱,可得到5个不同升温速率下HNS 热分解的峰值温度T p ,如表2所示:表2 峰值温度T p升温速率β 峰值温度T p /K2 K/min 598.15 5 K/min 608.15 10 K/min 620.65 15 K/min 630.65 20 K/min635.65根据实验采集并处理后的数据,可以得到HNS 分别在5个升温速率的条件下转化率随温度变化而变化的曲线,如图3所示:图3 HNS 转化率曲线根据图3的转化率曲线可以得到在不同升温速率下,转化率为10%,20%,30%,40%,50%,60%,70%,80%和90%对应的温度,如表3-表7所示:表3 升温速率为2 K/min转化率/% 10 20 30 40 50 60 70 80 90 温度/K579585589591593595598602626表4 升温速率为5 K/min转化率/% 10 20 30 40 50 60 70 80 90 温度/K586592596600603606609616641表5 升温速率为10 K/min转化率/% 10 20 30 40 50 60 70 80 90 温度/K592599604608612615619625650表6 升温速率为15 K/min转化率/% 10 20 30 40 50 60 70 80 90 温度/K596604610615619623626631650表7 升温速率为20 K/min转化率/% 10 20 30 40 50 60 70 80 90 温度/K6026096156206246286326376553 活化能计算3.1 Ozawa 法已知Ozawa 法的方程为lg lg(/()) 2.3050.4567/AE RG E RT βα=--将lg β与1/T 作图,然后经过线性拟合可得该拟合直线的斜率,如图4所示,得到的斜率值即为-0.4567E/R 的值。



热分析动力学一、 基本方程对于常见的固相反应来说,其反应方程可以表示为)(C )(B )(A g s s +→ (1)其反应速度可以用两种不同形式的方程表示:微分形式 )(d d ααf k t= (2) 和积分形式t k G =)(α (3)式中:α――t 时物质A 已反应的分数;t ――时间;k ――反应速率常数;f (α)—反应机理函数的微分形式; G(α)――反应机理函数的积分形式。
由于f (α)和G (α)分别为机理函数的微分形式和积分形式,它们之间的关系为:ααααd /)]([d 1)('1)(G G f == (4)k 与反应温度T (绝对温度)之间的关系可用著名的Arrhenius 方程表示:)/exp(RT E A k -= (5)式中:A ――表观指前因子; E ――表观活化能; R ――通用气体常数。
方程(2)~(5)是在等温条件下出来的,将这些方程应用于非等温条件时,有如下关系式:t T T β0+= (6)即:β/=t d dT式中:T 0――DSC 曲线偏离基线的始点温度(K ); β――加热速率(K ·min -1)。
于是可以分别得到:非均相体系在等温与非等温条件下的两个常用动力学方程式:)E/RT)f(A t d d αexp(/-=α (等温) (7))/exp()(βd d RT E f AT -=αα (非等温) (8)动力学研究的目的就在于求解出能描述某反应的上述方程中的“动力学三因子” E 、A 和f(α)对于反应过程的DSC 曲线如图所示。
在DSC 分析中,α值等于H t /H 0,这里H t 为物质A ′在某时刻的反应热,相当于DSC 曲线下的部分面积,H 0为反应完成后物质A ′的总放热量,相当于DSC 曲线下的总面积。
二、 微分法2.1 Achar 、Brindley 和Sharp 法:对方程)/exp()(βd d RT E f AT -=αα进行变换得方程:)/exp(d d )(βRT E A Tf -=αα (9)对该两边直接取对数有:RTEA T f -=ln d d )(βln αα (10)由式(11)可以看出,方程两边成线性关系。


热分析动力学汇总热分析动力学是指研究物质在升温或降温过程中的热物性变化规律及其与化学反应动力学之间的关系。
它通过测量热量或温度随时间的变化,结合热学或动力学理论,从而揭示了化学反应的机理和动力学参数。
本文将对热分析动力学的概念、基本原理、应用领域及研究方法等方面进行详细阐述。
一、热分析动力学的概念和基本原理热分析动力学的实验方法主要有热量计法、差示扫描量热法(DSC)和热重法(TG)。
其中,热量计法通过测量材料的热量变化,得到热分解反应的热效应曲线,从而确定反应的速率等动力学参数。
差示扫描量热法是比较常用的实验方法,它通过比较样品和参比样品的热量变化,得到样品的热效应曲线,从而确定热分解反应的动力学参数。
热重法是通过测量材料在升温或降温时的质量变化,得到热分解反应的质量曲线,从而探索反应的动力学参数。
二、热分析动力学的应用领域热分析动力学在材料科学、化学工程、药学和环境科学等领域都有重要应用。
在材料科学中,热分析动力学可以用于研究材料的热性质、热稳定性和热分解反应等方面,从而指导材料的合成和加工。
在化学工程中,热分析动力学可以用于优化工艺参数、预测反应过程和评估化学工艺的安全性。
在药学中,热分析动力学可以用于研究药物的热性质和稳定性,从而指导药物的贮存和运输。
在环境科学中,热分析动力学可以用于研究污染物在环境中的分解和转化过程,从而指导环境监测和治理。
三、热分析动力学的研究方法热分析动力学的研究方法包括实验方法和理论方法。
实验方法主要是通过实验测定材料的热效应曲线或质量曲线,从而确定反应的动力学参数。
理论方法主要是通过热学和动力学理论进行模拟和计算,以预测热效应曲线或质量曲线,从而确定反应的动力学参数。
在实验方法方面,热分析动力学主要使用差示扫描量热法和热重法。
差示扫描量热法通过比较样品和参比样品的热量变化,得到样品的热效应曲线,从而确定反应的速率等动力学参数。
热重法通过测量材料在升温或降温时的质量变化,得到热分解反应的质量曲线,从而探索反应的动力学参数。


热分析动力学在不同领域应用的研究热分析动力学是研究物质在加热过程中的结构变化、相变、化学反应和能量转化的一种技术手段。
它通过对物质在不同温度下吸收或释放的热量进行分析,来揭示物质的热力学和动力学性质。
这项技术在不同领域的应用非常广泛,下面将重点介绍其中几个领域的研究。
首先是材料科学领域。
热分析动力学可以用来研究材料的稳定性和热稳定性。
通过对材料在不同温度下的热分解行为进行监测和分析,可以确定材料的热稳定性,并且可以推导出材料的热分解动力学参数,如活化能、反应级数等。
这对于材料的设计和制备具有重要的指导意义。
热分析动力学也可以用来研究催化剂的性能。
催化剂是很多化学反应过程中的关键组成部分,了解催化剂的性质对于提高反应效率和选择性具有重要意义。
热分析动力学可以帮助我们揭示催化剂中催化活性材料的热稳定性、表面变化和活性中心的失活机制等,为催化剂的设计和优化提供了重要的依据。
热分析动力学还可以应用于生物医学研究。
生物分子、药物和制剂在不同温度下的热分解行为和相互作用可以通过热分析动力学来研究。
这对于药物的稳定性和药物释放的控制具有重要意义。
通过研究蛋白质和核酸的热解过程,可以了解它们的结构和功能。
这对于揭示生物大分子的折叠和解离机制具有重要的意义。
热分析动力学还可以应用于环境科学和能源领域。
在固体废物处理过程中,通过热分析动力学可以揭示废物的热解行为和生成物的析出机制,有助于寻找高效的废物处理方法。
热分析动力学还可以用来研究能源材料的热分解行为,为能源的存储和转换提供重要信息。
火灾学课程热分析动力学(Thermal Analysis Kinetics)定义¾热分析动力学:用热分析技术研究某种物理变化或化学反应(以下统称反应)的动力学热分析技术的定量化方法热分析动力学的目的 理论上:探讨物理变化或化学反应的机理(尤其是非均相、不等温)生产上:提供反应器设计参数应用上:建立过程进度、时间和温度之间的关系,可用于预测材料的使用寿命和产品的保质稳定期,评估含能材料的危险性,从而提供储存条件。
可估计造成环境污染物质的分解情况…发展历史化学动力学源于19世纪末-20世纪初热分析动力学始于20世纪30年代、盛于50年代(评估高分子材料在航空航天应用中的稳定性和使用寿命研究的需要))动力学模式(机理)函数均相反应: f ( c)= ( 1 -c)n非均相反应:根据控制反应速率的“瓶颈”气体扩散相界面反应成核和生长常见固态反应的机理函数(理想化)1. Acceleratory(The shape of a ~T curve) Symbol f(a)g(a)n(α)1-1/n α 1/nPnα lnαE12. Sigmoidm(1−α)[−ln(1−α)]1−1/m[-ln(1-a)]1/m Amα(1−α) ln[α/(1−α)] B1(1/2)(1−α)[−ln(1−α)]−1 [−ln(1−α)]2 B2(1/3)(1−α)[−ln(1−α)]−2[−ln(1−α)]3 B3(1/4)(1−α)[−ln(1−α)]−3 [−ln(1−α)]4 B43. Deceleratory2(1−α)1/21−(1−α)1/2R23(1−α)2/31−(1−α)1/3R31/2α α2D1[−ln(1−α)]−1(1−α)ln(1−α)+α D2D(3/2)(1−α)2/3[1−(1−α)2/3]−1[1−(1−α)1/3]2 3(3/2)[(1−α)−1/3−1]−11−2α/3−(1−α)2/3 D4D(−3/2)(1−α)2/3[(1−α)1/3−1]−1[(1−α)1/3−1]2 5D(3/2)(1−α)4/3[(1−α)−1/3−1]−1 [(1−α)−1/3−1]2 6F* 1−α −1n(1−α) 1(1-α) 21/(1-α) F2(1-α) 3/2(1/1−α) 2 F32(1−α) 3/2(1−α) −1/2 F(3/2)(2/3)(1−α) 5/2(1−α) −3/2 F(5/2)*F1 is the same as A1Sestak-Berggren empirical function(1971)f (α ) = αm (1−α) n2. 热分析动力学方法按动力学方程形式:微商法积分法按加热速率方式:单个扫描速率法(single scanning method)多重扫描速率法(multiple scanning method) (等转化率法,iso-conversional)Kissinger-Akahira-Sunose equationAnal. Chem., 29(1957)1702作多重加热速率β下的测定,选择TA 曲线峰值对应的温度T p由线性方程斜率——E ,然后由截矩——A 注:1. Kissinger(1956): 在最大速率处,适于n 级反应2.Akahira-Sunose(1969): 指定α处亦可3. Ozawa: 不限于n 级反应ppRT E E AR T /)/ln()/ln(2−=β非等温实验:特征点法举例:CaCO3热解动力学分析Friedman equation (modelfree )J. Polym. Sci. Part C, 6(1964)183作多重加热速率β下的测定,选择等α处斜率——E ;截矩——若则:斜率——E ; 截矩——ART E Af dT d /)](ln[)]/(ln[−=ααβnf )1()(αα−=)1ln(ln )](ln[αα−+=n A Af )](ln[αAf温度积分的近似表达式¾Doyle 近似式(J. Appl. Polym. Sci.,6(1962)639 )¾Schlomlich 展开级数(Doyle , Nature, 207(1965)290 )¾经验公式(Zsaco , J. Thermal Anal. 8(1975)593))1()1()3)(2(2211[)1()(−+⋅⋅⋅−+⋅⋅⋅−++++−+=−n x n x x x x x e x p n x )2)(/()(−−≈−x d x e x p x )844/(162+−=x x d xx p 4567.0315.2)(lg −−≈)6020(≤≤x2u u 2222(1)(1)u E RT e ART RT e u u EE β−−−=−2[1]}RT E E RT −−ADN的不等温热分解反应动力学参数模式 E / kJ mol-1lnA/ min-1γP4 24.5 3.9 0.9783 P3 35.1 6.9 0.9813 P2 56.2 12.7 0.9837 P2/3 182.9 46.2 0.9862 D1 246.2 62.8 0.9865 F1 139.4 35.70.9928 A4 29.5 5.3 0.9903 A3 41.7 9.0 0.9913 A2 66.1 15.9 0.9921 D3 269.1 67.4 0.9928 R3 131.0 32.0 0.9924 R2 127.6 31.3 0.9910Flynn-Wall-Ozawa equation (model free )Bull. Chem. Soc. Jpn.,38(1965)1881取不同β下曲线的等α处之温度T作lg β~1/T 图,由斜率——E注:Ozawa (1965): 在最大转化速率处Flynn-Wall (1966): 指定α处亦可RT E Rg AE /4567.0315.2)(lg lg −−=αβ参考书籍胡荣祖等. 《热分析动力学》(第二版) . 北京科学出版社, 2008.。
LiFePO 4的合成及其热分析动力学阮艳莉1,*唐致远2(1天津工业大学材料科学与化学工程学院,天津300160;2天津大学化工学院,天津300072)摘要:在惰性气氛下,以Li 2CO 3、FeC 2O 4·2H 2O 和NH 4H 2PO 4为原料,用高温固相方法合成了橄榄石型LiFePO 4材料.利用不同升温速率的热重及差热分析研究了固相合成LiFePO 4的反应动力学.研究表明,LiFePO 4的高温固相合成过程可分为三个步骤,利用Doyle ⁃Ozawa 法和Kissinger 法分别计算了各个反应阶段的表观活化能.用Kissinger 法确定每个反应阶段的反应级数和频率因子,并给出了各个阶段的动力学方程.根据动力学研究的结果,采用优化的固相分段法合成了碳包覆改性的LiFePO 4正极材料.利用X 射线衍射、扫描电镜及恒流充放电对材料进行了物性表征及性能测试.结果表明,该材料具有单一的橄榄石结构,颗粒尺寸细小均匀,0.1C 倍率放电时表现出良好的电化学性能.关键词:LiFePO 4;差热分析;固相合成;动力学方程中图分类号:O643;TM 912Synthesis of LiFePO 4and Thermal Dynamics of the PrecursorRUAN Yan ⁃Li 1,*TANG Zhi ⁃Yuan 2(1School of Material Science and Chemical Engineering,Tianjin Polytechnic University,Tianjin300160,P.R.China;2School of Chemical Engineering and Technology,Tianjin University,Tianjin300072,P.R.China )Abstract:Olivine LiFePO 4cathode materials were synthesized by a solid state method in an inert atmosphere.Thethermal decomposition processes taking place in the solid state mixture of Li 2CO 3,FeC 2O 4·2H 2O,and NH 4H 2PO 4were investigated using TG ⁃DTA and XRD techniques.The dynamic study of the precursor was also investigated using TG ⁃DTA at different heating rates.The decomposition proceeded through three well ⁃defined steps while TG curves closely corresponded to the theoretical mass loss.The apparent activation energy of each stage was calculated using the Doyle ⁃Ozawa and Kissinger methods.The calculated results were 134.3,122.2,173.2kJ ·mol -1for Ozawa method and 102.4,128.1,145.3kJ ·mol -1for Kissinger method.The coefficients of reaction order,frequency factor,and dynamic equations were also determined.Based on the results of the dynamic study,the cathode material LiFePO 4was synthesized by optimized step ⁃sintering method.The crystal structure and the electrochemical performance were characterized by X ⁃ray powder diffraction (XRD),scan electron microscopy (SEM),and galvanostatical charge ⁃discharge testing.The results showed that the material had a single crystal olivine structure with homogeneous grain sizes,and exhibited excellent electrochemical performance at 0.1C rate.Key Words:LiFePO 4;Differential thermal analysis;Solid state synthesis;Dynamic equation[Article]物理化学学报(Wuli Huaxue Xuebao )Acta Phys.鄄Chim.Sin .,2008,24(5):873-879Received:October 16,2007;Revised:February 27,2008;Published on Web:March 24,2008.∗Corresponding author.Email:ylruan@;Tel:+8622⁃24568055.国家自然科学基金(20273047)资助项目ⒸEditorial office of Acta Physico ⁃Chimica Sinica固体之间能否进行反应、反应完成的程度、反应过程的控制步骤等直接影响材料的显微结构,并最终决定材料的性质.因此,研究固体之间反应的机理及动力学规律,对材料的合成有重要的意义[1].利用TG ⁃DTA 技术研究材料的固相合成动力学,不仅可以为材料的制备提供一定的理论依据,动力学研究的结果还可以作为工业生产中最佳工艺条件评定的重要指标[2].因此,该技术已广泛应用于材料的固相May 873Acta Phys.鄄Chim.Sin.,2008Vol.24合成研究[3-5].LiFePO4是一种新型的锂离子电池正极材料,与常见的过渡金属氧化物正极材料相比有其独特的优势,特别是价格低廉、热稳定性好以及对环境无污染等优点,更使其成为最具潜力的正极材料之一[6-14].然而关于LiFePO4正极材料的研究起步较晚,利用TG⁃DTA技术研究LiFePO4合成的动力学参数,至今未见报道,但已有不少关于草酸前驱体分解的动力学研究值得借鉴[5,15-20].本文采用TG⁃DTA技术研究了LiFePO4合成的动力学过程.为克服试样的温度在产生热效应期间与程序温度间的偏离、试样内部存在温度梯度等缺点,采用四种不同的升温速率分别测试样品的DTA曲线(差热曲线).运用Doyle⁃Ozawa法和Kissinger法计算合成过程中各个反应阶段的表观活化能、反应级数、频率因子等动力学参数,并给出各个反应阶段的速率方程,为进一步优化LiFePO4的性能提供了理论依据.1实验部分1.1原料以Li2CO3(分析纯,含量99%)、FeC2O4·2H2O(分析纯,含量99%)和NH4H2PO4(分析纯,含量99%)为原料.按照摩尔比为0.5∶1∶1混和,加入丙酮研磨1h,干燥后备用.1.2热分析及物性表征取上述备用试样置于铂金坩埚中.实验在氮气流量100mL·min-1的动态气氛中进行.测试温度范围为室温至1073K.仪器为美国Perkin⁃Elmer公司的Pyris TG⁃DTA联用仪.XRD表征在日本理学D/Max⁃2500自动X射线衍射仪上进行.Cu Kα辐射(λ=0.154056nm),石墨单色器,40kV,100mA.扫描范围0-80°.SEM测试在荷兰PHILIPS XL30ESEM环境扫描电子显微镜上进行.加速电压20kV.1.3电化学性能测试以自制的材料作为正极活性物质,乙炔黑为导电剂,60%的PTFE乳液为粘结剂,按照质量比为80∶15∶5混合.用无水乙醇作分散剂,超声波振荡15 min,使之混合均匀.制成面积约1cm2,厚度≤200μm的圆片压在集流体铝箔上构成正极,393K真空干燥12h.以金属锂片作为负极,隔膜为进口聚丙烯微孔膜(Celgard2300),以1mol·L-1LiPF6/碳酸乙烯酯(EC)+碳酸二乙酯(DEC)+碳酸二甲酯(DMC)(体积比1∶1∶1)的混合溶液为电解液.在充氩气的手套箱中装成2032型扣式电池.用电池程控测试仪(PCBT⁃138⁃32D)在室温下以0.1C倍率进行充放电测试.2数据处理方法化学反应动力学研究化学反应速率随时间、浓度、温度的变化关系,最终建立动力学方程.在利用热分析的数据进行动力学研究的过程中常常用到以下几个基本的关系式.质量作用定律:dα/d t=k(1-α)n(1)式中,k为反应速率常数,α为反应的变化率,t为时间,n为反应级数.Arrhenius公式:k=A exp(-E/RT)(2)式中,E为活化能,A为频率因子,R为气体常数,T 为温度.将式(2)代入式(1),得dα/d t=A e-E/RT(1-α)n(3)升温速率β=d T/d t,将d t=d T/β带入式(3)得式(4) dα/d T=Aβ-1e-E/RT(1-α)n(4)依据上述4个公式,用Doyle⁃Ozawa法和Kissinger法分别计算动力学参数.2.1Doyle鄄Ozawa法lgβ=lg(AE/RF(α))-2.315-0.4567E/RT(5)式(5)即为Ozawa公式.该式解法为,在不同的βi下,选择相同的α,则此时不管反应级数n是多少,F(α)总是常数,按lgβi-1/T作图应为直线关系,其斜率为-0.4567E/R,通过斜率可以求得活化能E.当α是常数时,式(5)变为lgβ1+0.4567E/RT1=lgβ2+0.4567E/RT2=…=常数(6)Doyle⁃Ozawa法是热分解法的积分法,Ozawa 法避开了反应机理函数的选择而直接求出E值.与其它方法相比,它避免了因反应机理函数的假设不同而可能带来的误差.这是Ozawa法的一个突出的优点.2.2Kissinger法Kissinger法是热分解法的微分法,对反应速率方程即式(3)求导后经数学处理可得,d[ln(β/T2m)]/d(T-1m)=-E/R(7)式中,T m为峰值温度.由式(7)可知ln(β/T2m)与1/T m呈874No.5阮艳莉等:LiFePO 4的合成及其热分析动力学直线关系.通过直线的斜率(-E /R )可以求得反应的活化能,与反应级数无关.Kissinger 指出,反应级数n 可以由峰形的形状因子I 求得.I 值是根据DTA曲线每个峰具体的峰形作图得来的.n =1.26I 1/2或I =0.63n 2(8)为了得到准确的动力学数据,本文用上述两种方法分别计算每个峰的反应活化能E 和反应级数n .有了准确的E 和n 值,可以利用式(9)求出频率因子A .E RT 2m=A 茁exp -ERT m ()(9)3结果与讨论3.1LiFePO 4固相合成动力学样品的TG ⁃DTA 测定所采用的升温速率分别为5、10、15和20K ·min -1,实验均在N 2流量为100mL ·min -1的动态气氛中进行.当测试温度超过873K 后,样品的TG ⁃DTA 曲线上不再有质量及热量变化,故本文选择273-873K 范围内的TG ⁃DTA 曲线进行分析,如图1所示.由图可知,加热开始直至443K 的范围内一直存在失重,这主要源于原料中的水份挥发及部分结晶水的析出.473K 失重速率加大,并且在差热(DTA)曲线上出现一个吸热峰,这主要对应原料中FeC 2O 4的无氧分解:FeC 2O 4=FeO+CO ↑+CO 2↑473-623K 的区间内有较大的失重,并且对应DTA 曲线上的吸热峰,而在673K 后的温度区间内,基本上不再出现失重,因此在473-623K 温度区间内主要发生了NH 4H 2PO 4的熔融及与其它物质的反应:NH 4H 2PO 4+Li 2CO 3→Li 3PO 4+NH 3↑+CO 2↑+H 2O ↑FeO+NH 4H 2PO 4→Fe 3(PO 4)2+H 2O ↑+NH 3↑673K 后的温度区间内尽管没有失重出现,但却存在热量上的变化.这说明随着温度的升高,发生了新的固相反应以及反应产物不断的进行晶型转化或完成晶格规整.Li 3PO 4+Fe 3(PO 4)2→3LiFePO 4上述反应是根据热分析的结果推测而得的,但是由于高温固相反应本就是极为复杂的复相反应,因此并不排除有其它反应发生的可能性.图2将不同升温速率下的DTA 曲线综合起来.从图中可以看出,四次DTA 测量中,曲线上都出现图1不同升温速率下合成LiFePO 4的TG ⁃DTA 曲线Fig.1TG ⁃DTA curves of LiFePO 4synthesized at different heatingrates875Acta Phys.鄄Chim.Sin.,2008Vol.24了3个吸热峰.根据样品的TG ⁃DTA 测试结果,利用Doyle ⁃Ozawa 法和Kissinger 法分别计算了合成LiFePO 4反应的表观活化能.根据Doyle ⁃Ozawa 法,在一定的反应转化率α下,由lg β=-0.4567E /RT +…作每个峰的lg β-1/T 图.通过各直线的斜率-0.4567E /R 计算各个反应阶段的表观活化能.表1是上述三个吸热峰在不同升温速率下相同反应转化率所对应的温度情况.转化率是通过TG 测试中实测的失重质量的数据作图后得到的.图3是利用Doyle ⁃Ozawa 法分别对上述三个吸热峰求活化能时的lg β-1/T 图.图中的点由表1中数据计算而得,分别对其进行拟合得到图中的直线.表2是由图3中各直线斜率求得的不同反应转化率下的活化能及其相关系数.由表2可以看出,各个吸热峰随反应转化率的不同,其表观活化能不同,取其平均值,三个吸热峰的表观活化能分别为134.3、122.2和173.2kJ ·mol -1.根据Kissinger 法,以ln(β/T 2m)对1/T m 作图,通过斜率(-E /R )求反应的活化能.图4为各吸热峰的ln(β/T 2m)-1/T m 图,回归直线方程,给出相关系数.由图4中三个图的直线斜率分别计算三个吸热峰的表现活化能;依据Kissinger 关于峰型因子的定义求得不同升温速率下的形状因子;用式(8)求得反应级数n ,并用式(9)计算频率因子A ,计算结果见表3.图2不同升温速率下合成LiFePO 4的DTA 曲线Fig.2DTA curves of LiFePO 4synthesized atdifferent heatingrates图3Doyle ⁃Ozawa 法求吸热峰的活化能的lg β-1/T 图Fig.3lg β-1/T plots for E of the endothermic peak using Doyle ⁃Ozawa methodα(%):a)10,b)20,c)30,d)40,e)50,f)60,g)70,h)80,i)90,j)100表1三个吸热峰对应不同升温速率及不同反应转化率下的温度Table 1Temperatures of the three endothermic peaks at various conversions and different heating ratesα(%)β/(K ·min )5101520T /KIII III I II III I II III I II III 10442.6494.6634.4447.6502.2648.8450.9509.1646.9454.1513.2654.320446.8501.1639.3451.9510.7652.4458.5517.0652.4461.3520.8659.930448.8506.2642.7455.1516.9656.6460.7522.9660.7464.8526.7664.240452.1511.5646.5457.9522.1663.5464.0530.4663.1468.6533.3669.650454.0517.8652.0460.3526.9667.7467.0536.1670.9471.9540.2674.560456.2523.9655.9462.7531.6671.0469.7543.3675.0475.0546.5680.370458.5529.6663.2465.3538.4673.1472.5550.9679.8478.3556.1687.680463.6535.2669.3469.8547.4675.6475.9559.9684.5482.9565.5693.990473.8541.1676.9479.5556.7679.9484.3570.3690.4492.8576.7698.1100481.7547.4685.9488.5570.4681.2495.3582.6695.6501.8588.1704.0876No.5阮艳莉等:LiFePO 4的合成及其热分析动力学分别利用Doyle ⁃Ozawa 法和Kissinger 法计算每个峰的表观活化能,取平均值,可得每个峰的平均表观活化能,如表4所示.按非等温过程求取动力学参数后,进一步判断反应机制.假设在无限小的时间间隔内,非等温过程看成是等温过程,则等温过程的通式表示反应速率.根据质量作用定律、Arrhenius 公式和表4,三个峰的速率方程分别为d α/d T =1.85×1011e-1.184×105/RT(1-α)0.787d α/d T =4.40×1012e -1.252×105/RT (1-α)1.060d α/d T =1.20×1011e -1.592×105/RT (1-α)1.224TG ⁃DTA 测试结果(图2)表明,在437-501K 、485-588K 和630-704K 温度范围分别存在3个吸表4由Doyle ⁃Oawa 法和Kissinger 法计算每个峰的表观活化能Table 4Activation energies calculated using Doyle ⁃Ozawa method and Kissinger methodThe unit of E is kJ ·mol -1,K is the line slope,and r is linear correlation coefficient.表3不同加热速率下的峰值温度T m 、峰型指数I 、活化能E 、反应级数(n )及频率因子(A )Table 3Peak maximum temperature (T m ),peak shape index (I ),activation energy (E ),reaction order (n ),andfrequency factor (A )at different heating rates表2每个峰不同转化率α对应的活化能E 及相关系数rTable 2Activation energies E and linear related coefficients (r )of the endothermic peaks at differentconversions (α)of each peak图4各个吸热峰在不同升温速率下的ln(β/T 2m )-1/T m 图Fig.4Relationship for ln(β/T 2m )-1/T m at different heating rates of everypeakα(%)E 1/(kJ ·mol )r 1E 2/(kJ ·mol )r 2E 3/(kJ ·mol )r 310151.10.997147.00.996208.60.98320148.20.986143.60.999202.00.99830143.40.995141.90.999186.40.99740138.00.988131.90.997174.00.99150129.50.986131.80.994173.60.99160123.80.988127.80.981168.90.99470119.70.987114.80.984164.10.99380126.40.979105.80.994156.20.99290132.00.96093.60.997152.00.993100130.80.98484.00.985146.30.986average134.3122.2173.2β/(K ·min -1)Peak numberNo.1No.2No.3T m /K I n 10-11AT m -12Am /K I n 10-105454.50.3150.707 1.75504.80.3400.735 4.40650.1 1.170 1.3639.7110463.20.3850.781 2.04516.50.876 1.180 4.24662.10.944 1.22411.515472.20.4290.825 1.77521.70.826 1.145 4.63671.10.647 1.01317.320476.40.4380.833 1.84527.60.878 1.181 4.34683.11.055 1.2949.61average0.3920.7871.850.7301.0604.400.9541.2241.20E =102.4,K =-13.32,r =0.992E =128.1,K =-15.41,r =0.998E =145.3,K =-17.47,r =0.981Method E 1/(kJ ·mol -1)E 2/(kJ ·mol -1)E 3/(kJ ·mol -1)Doyle ⁃Ozawa 134.3122.2173.2Kissinger 102.4128.1145.3average118.4125.2159.2877Acta Phys.鄄Chim.Sin.,2008Vol.24热峰.由此初步可以判断固相合成LiFePO 4的过程主要分为三个阶段:FeC 2O 4·2H 2O 的脱水及分解过程;NH 4H 2PO 4的熔融及反应过程以及生成LiFePO 4的过程.平均表观活化能在一定程度上反映了各阶段反应的难易程度.由此可知,LiFePO 4的最终合成反应(第三峰)相对地较难发生.因此,应适当延长该阶段的反应时间.我们根据上述动力学分析结果和理论计算及XRD 衍射表征确定了合成LiFePO 4的高温固相分段合成工艺,即在573K 保温12h,使FeC 2O 4·2H 2O 及NH 4H 2PO 4分解完全,然后在1023K 保温24h,确保LiFePO 4的合成反应充分进行.并用该法合成了碳包覆的LiFePO 4,该产品具有良好的电化学性能[14].3.2样品物性表征图5-7分别给出了利用分段固相法合成的碳包覆LiFePO 4样品的XRD 、SEM 表征以及该样品在室温及0.1C 倍率下的首次充放电曲线和循环性能图.从图5可以看出,样品吸收峰的峰形尖锐且强度较高,表明该样品结晶良好.经过与LiFePO 4标准谱图(PDF No.40鄄1499)对照,发现图中表征物相的衍射峰基本与LiFePO 4标准谱图的衍射峰吻合,这说明该样品具有纯净单一的橄榄石结构.图6是产物SEM 照片.从图中不难发现,样品的形貌比较规则,颗粒基本成球形,表面比较光滑,并且颗粒之间存在明显的边界,说明在高温烧结过程中,产物未发生明显团聚.图7是LiFePO 4的首次充放电及循环性能曲线.由图可知,LiFePO 4的首次放电比容量为142.5mAh ·g -1,首次充放电效率达到92.8%.该材料具有良好的充放电循环可逆性,在起始的几次循环中存在材料的活化过程,即随着循环次数的增加,可逆容量不断提高.电池的放电比容量在第3次循环时达到最大值144.7mAh ·g -1.循环30次后,电池的容量下降约2.9%.上述电化学性能表明,该工艺下制备的LiFePO 4正极材料具有较高的充放比容量及优良的循环性能,同时也充分验证了动力学研究结果对于合成工艺具有较好的指导性.4结论在惰性气氛下,采用不同的升温速率对LiFePO 4的合成过程进行了差热分析.四次DTA 测图6LiFePO 4的扫描电镜图Fig.6SEM image of LiFePO4图5LiFePO 4的X 射线衍射图Fig.5XRD pattern of LiFePO 4图7LiFePO 4的首次充放电曲线及循环性能图Fig.7The first charge/discharge curves and thecycling performance of LiFePO4878No.5阮艳莉等:LiFePO4的合成及其热分析动力学量中,曲线上都出现了3个吸热峰.由此将合成LiFePO4的过程分为三个主要阶段.利用Doyle⁃Ozawa法和Kissinger法分别计算了各个反应阶段的平均表观活化能,分别为118.4、125.2及159.2 kJ·mol-1.根据差热分析的结果,按照高温固相分段焙烧法合成的LiFePO4材料具有单一的橄榄石型结构,规则的球形外观,并具有良好的电化学性能.这充分证明了工艺的可行性,同时也验证了差热分析结果对于合成工艺具有较好的指导性. References1Hu,R.Z.;Shi,Q.Z.Thermal analysis kinetics.1st ed.Beijing:Science Press,2001:1-7[胡荣祖,史启祯.热分析动力学.第一版.北京:科学出版社,2001:1-7]2Ren,N.;Zhang,J.J.Progress in Chemistry,2006,18:410[任宁,张建军.化学进展,2006,18:410]3Zhao,M.S.;Zhai,Y.C.;Tian,Y.W.Acta Phys.⁃Chim.Sin.,2002,18(2):188[赵铭姝,翟玉春,田彦文.物理化学学报,2002,18(2):188]4Li,Z.M.;Qiu,W.H.;Hu,H.Y.J.Inorg.Mater.,2004,19:342[李智敏,仇卫华,胡环宇.无机材料学报,2004,19:342]5Tang,W.J.;Chen,D.H.Acta Phys.⁃Chim.Sin.,2007,23:605[唐万军,陈栋华.物理化学学报,2007,23:605]6Padhi,A.K.;Nanjundaswamy,K.S.;Goodenough,J.B.J.Electrochem.Soc.,1997,144:11887Liao,X.Z.;Ma,Z.F.;Wang,L.;Zhang,X.M.;Jiang,Y.;He,Y.S.Electrochem.Solid⁃State Lett.,2004,7:A5228Kalaiselvi,N.;Doh,C.H.;Park,C.W.;Moon,S.I.;Yun,M.S.mun.,2004,6:11109Huang,H.;Yin,S.C.;Nazar,L.F.Electrochem.Solid⁃State Lett., 2001,4:A17010Takahashi,M.;Tobishima,S.;Takei,K.;Sakurai,Y.Solid State Ionics,2002,148:28311Prosini,P.P.;Lisi,M.;Zane,D.;Pasquali,M.Solid State Ionics, 2002,148:4512Chen,Z.H.;Dahn,J.R.J.Electrochem.Soc.,2002,149:A1184 13Thuckeray,M.Nat.Mater.,2002,2:8114Ruan,Y.L.Ph.D.Dissertation.Tianjin:Tianjin University,2007 [阮艳莉.博士学位论文.天津:天津大学,2007]15Lin,C.M.;Chen,D.H.;Tang,W.J.;Peng,Y.H.J.Anal.Appl.Pyrolysis,2006,75:24016Vlaev,L.;Nedelchev,N.;Gyurova,K.;Zagorcheva,M.J.Anal.Appl.Pyrolysis,2008,81:25317Zhan,D.;Cong,C.J.;Diakite,K.;Tao,Y.T.;Zhang,K.L.Thermochimica Acta,2005,430:10118Gabal,M.A.J.Anal.Appl.Pyrolysis,2003,64:137519El⁃Diefallah,H.M.;Mousa,M.A.;El⁃Bellihi,A.A.;El⁃Mossalamy,E.H.;El⁃Sayed.G.A.;Gabal,M.A.J.Anal.Appl.Pyrolysis,2002,62:20520Małecka,B.;Małecki,A.;Drozdz⁃Ciesla,E.;Tortet,L.;Llewellyn, P.;Rouquerol,F.Thermochimica Acta,2007,466:57̇̇′879。
摘 要 本文概述了两类典型光电聚合物材料的发展现状介绍了热分析动力学研究非等温固相热分解反应的数学处理方法使计算数据更为准确在一定程度上拓宽了热分析动力学在该领域的应用已渐渐的被研究者所淘汰然而经典的等转化率法在求算中大多都引入了积分近似并且所得结果不涉及可能的机理函数用迭代法求算出较为准确的活化能并用其制约经典的积微分法所得的结果进而判断出反应动力学的模型实验证明该法合理可行并具有一定的广普性根据不同温度速率下转化率利用SPSS软件测试证明S形函数是其较为理想的拟合函数Y拟合所得线性回归的相关系数更为理想3. 利用热分析技术研究了含不同间隔基的卟啉聚合物和聚(4-乙烯基吡啶)与木质素共混薄膜的两个系列光电聚合物的具有特色的热行为及其热分解过程关键词热分析动力学热行为ABSTRACTIn this paper the present situation of the two typical photoelectric polymers and the application of the thermal analysis technique in the study of the nonlinear optical polymers were introduced. The mathematical method of studying non-isothermal decomposition reaction with thermal analysis kinetics was described and we wrote and improved the computer program of computation for computing the kinetic triplets to get the reliable results. The thermal behavior and decomposition kinetic of two series of photoelectric polymers were studied by using the comparative method we proposed.1. The conventional single scan method, which cannot detect the complex nature of the solid state reaction, has been replaced by multiple scan method or iso-conversional method. But the most classical iso-conversional methods are based on the assumption concerning the temperature integral, which will bring the homologous error and cannot detect the complex nature of the solid state reaction. We described a comparative method to investigate the reliable kinetic triplets. The kinetic triplets can be evaluated from the results obtained by differential and integral equations at only one heating rate with the constraint of the activation energy calculated by iterative method. The calcium oxalate monohydrate and ammonium oxalate monohydrate wereselected to be studied by the proposed method. Results show that this method is feasible, conventional with good reproducibility and can be used broadly.2. We have written the computer program of the thermal analysis kinetic. The plot of the conversion á for differential temperatures with the corresponding temperatures T was a S shape. The function of this S shape was tested by using SPSS software that it was a better fitting function YPVP第一章 两类光电聚合物材料的研究历史及应用 第一节 高性能二阶非线性光学聚合物材料的研究进展 非线性光学也就是强光光学介质中束缚较弱的价电子为强光电场所极化介质的电极化强度p与入射光的光强E有以下关系(1)E0(3)E*E*E0为真空介电常数(1)为线性极化率(2)(3)(n)分别为二阶对于普通光源而在激光作用下非线性不能忽略称为非线性光学效应(2)项不为零时所表现出来的效应便称之为二阶非线性光学效应 70年代末极化聚合物概念的提出开辟了二阶非线性光学材料研究的全新领域将具有大的微观一阶超极化率的有机分子 (又称生色团)通过掺杂或化学键合在聚合物之中并加以强直流电场实现非中心对称经此处理后的聚合物称为极化聚合物极化聚合物体系从首例报道距今已经十年多了从化学组成上看主要有聚酰亚胺类聚氨酯类从结构特点来看又可大致分为主侧链型交联型四类通过将非线性光学系数较高的有机分子和聚合物进行混合由于有机分子含量相对较少 最早的掺杂体系是1982年文献报道的染料DANS和液晶共聚物(2)为 31992年Valley等人[3]制备以了聚酰亚胺LQ2200为主体此后利用掺杂型PI制得了第一个全PI的Mach Zehnder干涉仪 文献[5]报道了利用介电松弛光谱来研究铁电侧链液晶高聚物(FLCP)与NLO染料的主客体混合物体系的介电松弛行为利用差示扫描量热法X射线衍射法测定了这些主客体物质的液晶相2. 侧链型 为了克服主客体型聚合物材料的缺点这种体系的优点较明显可以实现高浓度非线性光学基团接枝相分离和在聚合物中形成浓度梯度含有相同浓度的生色基团的侧链型聚合物体系Tg明显高于主客体体系如何将高非线性光学特性的NLO生色分子键接到Tg的聚合物骨架上 2.1 聚酰亚胺类IBM公司采用先合成非线性光学生色团功能化了的二胺单体制出了可承受数小时350大大改善了聚合物非线性光学特性的稳定性[6]DR1用旋涂法制备出了高聚物薄膜并用电晕技术使其在200极化后其非线性光学系数d33接近60pm/V发现改性聚酰亚胺在100中国科学院感光化学研究所和南开大学化学系合作报道了八种含偶氮类非线性光学活性侧基的聚酰亚胺材料的合成与表征聚合物中的发色团含量最高接近100﹪[8]用UV-Vis可见吸收光谱法测定了该体系的取向稳定性并用一维刚性取向气体模型估算了二阶非线性光学系数结果表明该极化聚合物具有较好的高温取向稳定性 48150后变化仅为 12% 文献[10]报道了有关侧链型含有DR1或NPP基团的聚酰亚胺(PI-DR1和PI-NPP)的合成与表征一般的Tg如以4,46FDA-二(3-氨基-4-羟基-苯基)六氟丙烷为含氟单体的羟基聚酰亚胺通过发色团上的共价键与聚酰亚胺主链相连[11]m处测定)南京大学成功地合成出了一种侧链含非线性光学单元的主侧链型共聚酯将刚性介晶基元引入高分子主链以提高Tg以期改善NLO单元的取向和提高取向的稳定性[12]所合成的含偶氮基团与介晶基团的聚酯型高分子均为结晶性无规共聚物而熔融温度则随聚合物中偶氮含量的增加而降低各聚合物均具有很好的热稳定性谢洪泉等人[14]合成了含不同分子超级化率的偶氮发色团作为侧链的四种聚氨酯NLO发色团的极化PU的且发色团的不同其玻璃化转变温度不同Ki Hong Park等人[15]成功的合成了含有一个该单体作为非线性光学发色团具有很好的热稳定性这些聚氨酯的热稳定性通过热重分析和IR光谱分析进行表征并与其他含有一般悬吊的含氮发色团的聚氨酯进行比较 2.4 侧链液晶聚合物并与甲基丙烯酸甲酯共聚谌东中等人[17]用熔融缩聚法合成了含非线性光学活性硝基偶氮苯液晶基元的聚丙二酸酯侧链液晶聚合物NMR对其结构进行了表征该聚合物为近晶型液晶聚合物-二羟基联苯二溴己烷氯代乙醇为原料合成了两种单体完成了单体的聚合和共聚对其结构进行了表征3. 主链型 如果将发色团引入聚合物主链中从而提高取向极化的稳定性发色团的转动需要牵动大链段用柔性链连接起来的发色团有更好的柔顺性和良好的力学性能中山大学高分子研究所合成了一类含双羟基的偶氮染料PURa Y S等人[20]在分散红DR19的硝基邻位引入一个羟甲基的偶极单体DRTO将氰基亚撑-2-甲基-5-(4-二甲基氨基苯乙烯基)-4H-吡喃(DCM)单元引入到刚性聚氨脂后 对于功能化的二阶非线性光学聚酰亚胺的研究的范围在205-224 文献[23]报道了含有用氰基磺酰基功能化了的偶氮发色团的聚酰亚胺(PI-SOT)的制备以及在非线性光学中的应用DSCTGA其玻璃化转变温度T为186时开始发生降解150 pm/V28pm/V该值在150 4. 交联型 关于交联型的极化聚合物目前在国内外已有很多的报道生成多羟基低聚物生成相应的交联型二阶 NLO聚合物发现从硝基联苯胺出发的低聚物和聚合物Tg 相对较高 对于聚氨酯与分散红19的交联体系的光极化极化后样品的诱导磁化率d33为46pm/V实验证实据报道羟基的甲基丙烯酸酯共聚物Ki Hong Park等人制备了[27]一类新型的自交联非线性光学共聚物(PGBz)并将这些共聚物的热性能与含1,2-二苯乙烯发色团的共聚物 (PGSt) 作了比较 范围内在热处理后PGBz共聚物的热稳定性有所提高交联的PGBz的热稳定性比交联的PGSt好 利用差示扫描量热法和热重分析法测定发现一些新型发色团用双马来酰亚胺联苯甲烷进行热处理后可以提供一系列交联的并具有改性发色团的双马来酰亚胺树脂即使升温到300将互穿网络BMI树脂两端的反应基团与发色团相连可提高物质的热稳定性[28]在二阶非线性光学极化聚合物实用化方面提高NLO材料的热稳定性是目前人们大量研究工作的目的具有高Tg温度的高分子材料所构成的电光器件将有较高的取向稳定性第二节 导电高分子在光电材料领域中的研究进展 传统的有机化合物由于分子间的相互作用弱因而过去一直只注重高分子材料的力学性能和化学性能聚乙炔 (PA)化学掺杂后电导率急剧增加这一研究成果为有机高分子材料的应用开辟了一个全新的领域一个新型多学科交叉的领域并成为20世纪后期材料科学领域的研究热点[29]使其由绝缘体转变为导体的一类高分子的统称它们具有导电性同时还具有一系列光学性能电致变色性因此[30]如光信号处理电致荧光显示等1. 高分子材料导电机理 根据能带理论形成分子轨道最高占有能带与最低占有能带之间的能量空间被称为能带间隙EEg是价带与g导带之间的能量差异导带层没有电子但通过掺杂可大大提高其导电能力从而产生空穴阳离子自由基其能量介于价带层和导带层之间一个极化子的自旋为1/2但若这个第二个电子是从极化子上夺取的 极化子和双极化子可通过双键迁移沿共轭链传递就产生越多的极化子或双极化子高浓度掺杂物可以促进极化子的移动能力同时可以增加载流子的数目从而使材料导电[31]有机非线性光学材料作为电光器件的新材料得到迅速发展优良的器件制备性质而且因为品种类别众多快速响应和高的三阶非线性光学系数(3)目前2.1 聚乙炔及其衍生物类 众所周知而且是一种典型的NLO共轭聚合物但近年来有关PA非线性光学性能的报道也趋增多m的激光测定了厚度为100nm 的无规反式PA的三次谐波(THG)(3)比PDA还大随后他们对全反式和全顺式PA在一较宽的频率范围内 (0.5(3)至少比顺式高 1个数量级[33]1.5e V之间的THG测定结果,在0.91e V处观察到了双光子吸收峰并观察到-9esu(共振值)了在0.65eV处整个测定范围内最大的1 0 实验证明PA的其二阶分子超级化率 (且同时他们还发现导电高分子的聚合度大于25后(3)将不再增加[35]在光电子技术中光学双稳态光计算和光纤通讯等方面引起人们极大的兴趣聚噻吩10-9esu)用Maker条纹的方法测得在1.907(3)为3.5而利用Kerr效应法研究发现PTh齐聚物的三阶非线性光学效应最大值可达到4.3除此之外采用四波混频法技术对PTh衍生物聚异硫茚 (PITN)的NLO性能进行研究) 最近聚叔丁基异硫茚 (PTBITN)其具有很高的文献[40]采用三次谐波技术结果发现(3)值提高的幅度并不大因此应设法改善共轭高分子的主链结构(3)值达到4 由聚(3-[2-((S)-2-甲基丁氧基)乙基]噻吩)和硬脂酸以不同分子比率构成的混合单层制备而成的手性HT-P(S)MBET/ SALB膜的电导率为10-4 ̄10-5S当谐波波长在吸收范围内时(3)值会快速的提高10-7esu(3)值要大的多[42]PANI理论研究表明聚苯胺具有较大的三阶非线性光学系数[43]优异的物理化学性能热稳定性,且价格低廉使之成为最有希望在实际中应用的共轭高分子材料(3))的影响在入射光波长为1.86PEMB10-11esu(3)的关系可以看出其文献[45]报道了PAn溶液及其在硅胶基质中的10-11esu和4.8国内研究人员用四波混频法系统地研究了PANI在NMP溶剂中的三阶非线性效应与溶液浓度掺杂程度及掺杂剂的性质等的依赖关系PANI链上醌环上的光激发是PANI/NMP溶液三阶非线性光学效应的主要原因[46]窄分布高取向且性能稳定的PPV聚合物其三阶非线性光学性能实验证明PPV沿着拉伸方向可得到相当高的10-10esu)垂直于拉伸方向时(3)值最小人们还发现当在苯环上引入一个甲氧基(3)值为79高于PPV增加了利用Wessling前聚物法合成的含有非线性光学发色团甲氧基亚硝基菧的PPV衍生物(3)值为1.7利用了锍聚合电解质法合成的分子结构为PPV溴4BrPPVClPPV(3)值10-10esu10-10esu10-10esu[49]MEH-PPVDO-PPV(聚-10-(2,5-二辛氧基-1,4-聚对苯乙烯撑))在非共振条件下的10-10和4.1这些PPV的衍生物都具有很好的NLO性能PPV的三阶非线性光学性质来自于PPV的相对较短的因此对进一步开发和优化有光学应用价值的PPV材料国内有关专家合成出了两种长链三苯环OPVs基团通过将长链基团连接到PPV上可以大大提高PPV的溶解性有望成为新的环保型材料[51]信息虽然无机的发光理论及制备工艺较成熟高驱动电压稳定性较差以及难以解决短波长 (蓝光)发光材料等诸多问题1990年聚苯撑乙炔作为高分子(有机)发光二极管的发光[52]材料在电场的作用下发出了亮丽的黄绿光与无机半导体电致发光器体相比,高分子电致发光材料具有价廉启动电压较低效率较高绿这些突出的优点无疑使高分子聚合物将成为最具有商业化前景的电致发光首选材料电子传输层下面分别介绍比较典型导电高分子在EL中的应用对于电子传输能力强的发光材料制备的器件需引入空穴传输(HTL)光稳定性和较好的成膜能力以外PPV及其衍生物是目前导电高分子电发光研究的重点因而在EL装置中又可充当空穴运输层以 PPV为空穴传输层制成了双层LEDs而采用单层装置 利用新的n-型的导电高聚物聚(p-吡啶乙撑基)(PPyV)和PPV作为电致发光装置中的空穴传输层 3.2 电子传输材料 常用的高分子材料的空穴迁移率远大于电子迁移率人们不断设计并合成出新的高分子电子传输材料其量子效率为0.25%[55](1) 400(2)具有较高的电导率(4)材料稳定 聚对苯炔 (PPV)是第一个被用作发光层的聚合物电致发光及三阶非线性光电性能剑桥大学用聚对苯乙炔 (PPV)作发光层实现了红绿多色发光显示[57]以Mg制备了发红橙光的LEDs随着烷基链长的增加实验发现在反向电压下他们以P3OT为发光层正向启动电压为3V研究人员以PCHTPTOPT等噻吩的衍生物为电致发光材料获得了蓝光橙光和红光器件[60] 图1-1 几种噻吩的衍生物材料的结构图 二甲锡烷基噻吩与其二溴苯取代的衍生物在钯催化的发生下发生缩合反应生成噻吩基通过旋涂法在铟锡氧化物(ITO)上形成均匀的薄膜LED发出橙红色的光且具有很高的电流整流率103 Fujii等人[62]对PPV和含有甲氧基取代基的可溶性PPV乙烯撑)(OOPPV)和聚(2,5-二壬氧基-p-苯乙烯撑)(NOPPV)进行了研究3.4 导电高分子正负极材料 1992年其结果表明电致发光器件的性能提高了许多50%30%开发了PAn在发光材料中的应用新前景并研究了导电高聚物厚度对(EL)装置的开启电压4. 发光聚合物 自从发现聚对苯撑乙烯具有电致发光特性并制备出聚合物发光二极管[65]以来发光聚合物材料和聚合物电致发光器件受到了广泛的重视它的掺杂态具有导电性因此也属于导电聚合物材料的一种已制备出多种具有不同结构特征的发光聚合物材料这些发光聚合物中最具代表性的有PPV及其多种可溶性衍生物PTh红光PPP蓝光PFO绿光到蓝光发出蓝-绿色光且强于用聚(二甲氧基-p-苯乙烯撑)(ROPPV)和蒽形成的共聚物构成同类装置发出的光5. 展望 尽管导电高分子研究仅有20余年的历史掺杂和导电机理加工性和稳定性以及在技术上的应用探索等方面均已取得了长足的进展然而导电高分子面临着在应用基础和技术应用方面纳米化和实用化的挑战必将成为21世纪材料科学的研究前沿测量物质的物理性质与温度关系的一种技术相态变化和吸附等)和化学变化 (脱水氧化和还原等)分析和选择随着信息时代的到来光处理和光计算机等领域取得了飞速发展同时也提出了更高的要求这种弛豫与决定聚合物链运动的玻璃化转变温度Tg直接关联的[68]而且Tg也是高聚物作为结构材料的一个最基本的参数随之极化温度也必然要高生色团必须具有更高的分解温度Td人们采用各种方法来获得更大的非线性光学系数和提高生色基团极化取向的热稳定性1提高聚合物的玻璃化转变温度热分析手段具有简单精确等特点热稳定性与液晶极化聚合物相转变行为研究中的应用1. 热分析法在提高聚合物物材料Tg以及热稳定性方面的应用 Rong-Ho Lee等人[69]将非线性光学的活性三-氧化磷和三-氧化磷发色团分别与聚羟基苯乙烯掺杂(PSOH)组成具有二阶非线性光学性能的体系这些NLO活性氨基氧化膦和高聚物基体在400nm下都具有光透性以及良好的热稳定性 (T 345由于发色团良好的热稳定性使其在不断升温的极化过程中不易发生分解以引入较大刚性单体为发色团来提高聚合物的Tg使聚合物薄膜在玻璃化转变温度附近被电场极化该聚合物兼具PU溶解性和成膜性能好以及 PI玻璃化转变温度较高 [71]选取了一种综合性能 (包括热稳定性透明性)相对较隋郁等人优的三嗪环类发色团分子作为二胺单体研究了其热稳定性及发色团分子含量对材料性能的影响它们的 5%热失重温度 (T5)都比相应聚合物的Tg高出100K以上 谌东中等人[72]将刚性介晶基元引入高分子主链以提高Tg并创造各向异性介质环境合成了一种侧链含非线性光学单元的主侧链型共聚酯4-氨基苯基NSTDAPI利用DSC测定了该聚合物的T达到304生色团单体与聚合物主链的连接不含柔性链段的提高TGA其有利于TTGA曲线证明了聚酰亚胺骨架上含有多芳结构噻吩环使聚合物具有较好的热性能从DSC曲线来看186这主要源于NLO发色团和进一步发生的功能化作用说明了所有的高聚物都是无定形的TGA测定结果发现由于偶氮基团的裂解使得高聚物在温度为190间开始发生降解时这是因为高聚物结构中有高芳香性的环利用热重分析和差示扫描量热法对NLO聚酰亚胺的热稳定性进行了测定一般在161之间/min的条件下测定的处失重是由于NLO生色团的分解所引起的以上这类聚合物的热化学稳定性是利用TGA手段来检测的其失重5%时的温度大大的超过了300Hwan Kyu Kim [77]将通过缩聚法制成了聚酰胺酰亚胺的非线性光学活性发色团TGADSC其Tg范围在142之间以上仍具有相当的热稳定性以上才发生分解该聚合物在升温过程中仅能在两吸热峰间观察到结晶性高聚物典型的岩粒状织构样品熔化并成为各向同性液体而无液晶相存在而高温吸热峰则是由样品结晶熔融吸热引起的而结晶熔融温度则随偶氮基团含量的增加而降低随着聚合物中偶氮基团含量的增加聚合物链刚性增强另一方面且随着聚合物中偶氮基团含量的增加因而引起结晶熔融温度随偶氮基团含量的增加而降低NLO染料的掺杂程度低于10wt﹪时没有相的变化吸热峰或放热峰峰尖处对应的就是热转化随着样品中NLO染料量的增多 梁旭霞等人[80]研究了光引发共聚合然后再分别与4-硝基-4制备了两种侧链含偶氮苯生色团的液晶聚合物TGA对聚合物介晶相转变温度结果表明液晶相转变温度较低聚合物热稳定性较好以上-甲氧基联苯-4-氧基)戊基]酯 (M5 MPP)并完成了单体的聚合和共聚利用DSC法研究了M5MPP结果表明PMMEANB属于非晶性高分子并证实了分子间吸电子与给电子基团相互作用有利于提高液晶高分子热稳定性3. 热分析法在高聚物交联体系中的应用 山东大学孟凡青等人[82]合成了双芪唑盐的衍生物作为生色团与2 ,4-二异氰酸酯甲苯及三乙醇胺反应并生成了交联的聚氨酯体系说明生色团参与聚合反应形成了无定形的聚合物这是因为分子的交联抑制了链段运动高温下体系只会受热分解将这些共聚物的热性能与含1,2-二苯乙烯发色团的共聚物 (PGSt) 作了比较 范围内高聚物中苯并唑发色团的增加这种现象可以解释为如果反应活性高的甲基丙烯酸缩水甘油酯单体含量减少从热重分析的结果来看这是因为在热处理过程中发生了交联高聚物的互穿网络Luo Jingdong 等人[84]合成出了一些在分子一端或两端连接烯炳基的含氮发色团,并利用DSC和TG法测定发现这些发色团用双马来酰亚胺联苯甲烷进行热处理后可以生成一系列交联的并具有改性的发色团的双马来酰亚胺树脂该树脂也不会发生分解. Xie Hong-Quan 等人[85]研究了含偶氮苯并噻唑发色团的两种非线性光学交联高聚物的热性能第四节 选题思想 近年来因为它们具有良好的电光特性低廉的价格易于发展新的器件和产品材料的热稳定性和其他热性能也是相当重要的参数热分析方法以其精确简易的特点扮演了重要的角色测量物质的物理性质与温度关系的一种技术相态变化和吸附等)和化学变化 (脱水氧化和还原等)分析和选择热稳定性以及该类聚合物相转变行为的研究热分析动力学是通过对物质热分解反应动力学进行分析从而得到相应的动力学和热力学参数热稳定等热性能提供有用的参考数据它们热性能和热行为对其性能的判定有着重要的意义得到热焓H等热力学参数和活化能n来推断键的性质和键的相对强弱从而对材料的进一步应用提供有价值的数据探讨了一种新的合理该方法最主要的特点是1因而尽可能的减小了积分法中因为引入积分近似而带来的误差值与迭代法2应用传统的积分法和微分法计算出的E或KAS法求出的值最接近用这种新的方法对经典样品草酸钙的脱水反应的动力学进行了求取因而可以说这种方法是可行的由实验得出热分析数据从而为该聚合物的热性能键能等提供有用的信息参考文献 [1] 罗敬东等.极化聚合物电光材料研究进展[J].高分子通报, 2000,1:9 [2] Meredith ,et al. Synthesis and Optical characterization of Liquid Crystalline Polymers for Electro-optical Applications[J]. Polymer Preprints, 1982 , 2 (23):149 [3] Valley J F, et al. Thermoplasticity and parallel-plate poling of electro-optic polyimide host thin films[J]. Appl Phy Lett, 1992 , 2 (60):160 [4] Hua Shu Wu, et al. Real time poling vapor co-deposition of dye doped second order nonlinear optical polymer thin films[J]. Macromolecules, 1997, 30 :4410 [5] Ging-Ho Hsiue, Rong-Ho Lee, Ru-Jong Jeng et al. Dielectric study of a ferroelectric side-chain liquid crystalline polysiloxane with a broad temperature range of the chiral smectic C phase: 2. Doping effect of a non-linear optically active dye[J].Polymer,1997, 38 (4): 887-895 [6] Verbiest T, burland D M, Cjurich M, et al. Exceptionally thermally stable polyimides for second-order nonlinear optical applications[J]. Science, 1995, 268:1604 ̄1606 [7] Marestin C, Mercier R, Sillion B et al. High glass transition temperature electro-optic side-chain polymers[J]. Synthetic Metal,1996,81: 14-146 [8] 麻洪张志谦甘湘萍高分子材料科学与工程.2000, 16 (4): 36et al. Nonlinear optical polymers with novel benzoxazole chromophores II. Synthesis of polyurethanes with good thermal stability[J]. Reative & Functional Polymers,1996,30: 375-383 [16] 胡权芳蔡兴贤. 侧链液晶丙烯酸酯聚合物的合成与表征[J]. 四川大学学报姜旭卫赵晓光740-743 [20] Ra Y S, Mao S S H, Dalton L R D, et al. Thermoset second-order NLO material from a rifunctionalized chromophore[J]. Polymer Preprints, 1997,38(1): 926 [21] Chong-Bok Yoon, Byung-Jun Jung, Hong-Ku Shim. Synthesis and second-harmonic generation study of DCM-containing polyurethane[J]. Synthetic Metals, 2001,117:233-235 [22] Elke Gubbelmans, Thierry Verbiest, Marcel Van Beylen, et al. Chromophore-functionalised polyimides with high-poling stabilities of the nonlinear optical effect at elevated temperature[J]. Polymer, 2002, 43:1581-1585. [23] Tae-Dong Kima, Kwang-Sup Leea, Youn Hong Jeong et al. Nonlinear optical properties of a processable polyimide having azo-dye functionalized with cyanosulfonyl group[J]. Synthetic Metals, 2001, 117: 307-309 [24] 王全伏王化滨等. 从多羟基低聚物出发合成交联型二阶非线性光学聚合物[J].Chinese Journal of Applied Chemistry, 1997, 6(14): 54-56 [25] Gang Xu, Jinhai Si, Xuchun Liu, et al. Permanent optical poling in polyurethane via thermal crosslinking[J]. Optics Communications , 1998 ,153 :95-98 [26] 张灵志于清水等. 功能化甲基丙烯酸甲酯共聚物合成及其交联膜的二阶非线性光学性能[J]. 高分子材料科学与工程, 2000, 2(16): 55-58 [27] Ki Hong Park, Mi Gyung Kwak, Woong Sang Jahng et al. Nonlinear optical polymers with novel benzoxazole chromophores- III. Synthesis and characterization of self-crosslinkable glycidyl methacrylate copolymers [J]. Reactive & Functional Polymers, 1999, 40: 41-49 [28] Jingdong Luo Caimao Zhan Jingui Qin et al. Bismaleimide resins modified by bi-or tri-allyl-functionalized azo chromophores for second-order optical nonlinearity [J]. Reactive & Functional Polymers, 2000, 44: 219-225 [29] 祝伟.导电高分子材料研究进展[J]. 黎明化工, 1997, (5):31-33 [30] 石高全梁映秋. 高性能导电高分子材料[J]. 大学化学, 19989-12 [31] 裴坚. 导体和有机光电信息材料2000年诺贝尔化学奖简介[J]. 大学化学, 2001, 16 (2): 101-103 [32] Heeger A J, Moses D, Sinclair M. Nonlinear excitations and nonlinear phenomena in conductive polymers[J]. Synth Met, 1987, 17(1-3):343-348 [33] Sinclair M, Moses D. Anisotropy of the third-order nonlinear-optical susceptibility in a degenerate ground-state conjugated polymer: trans-polyacetylene[J]. Phys Rev, 1988, 38(15):107 24-107 33 [34] Kajzar F, Etemal S, Baker G J. 。