无菌检验原始记录
- 格式:doc
- 大小:105.00 KB
- 文档页数:2
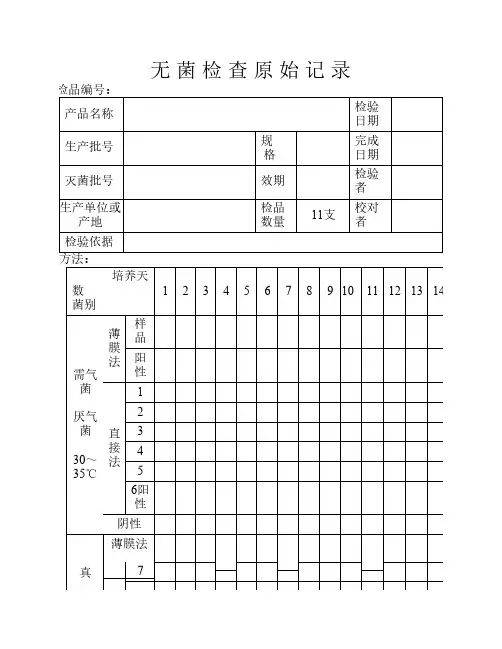
培养天
数
菌别
1234567891011121314
需气菌
厌气菌
30~35℃薄
膜
法
样
品
阳
性
直
接
法
1
2
3
4
5
6阳
性阴性
真薄膜法
7
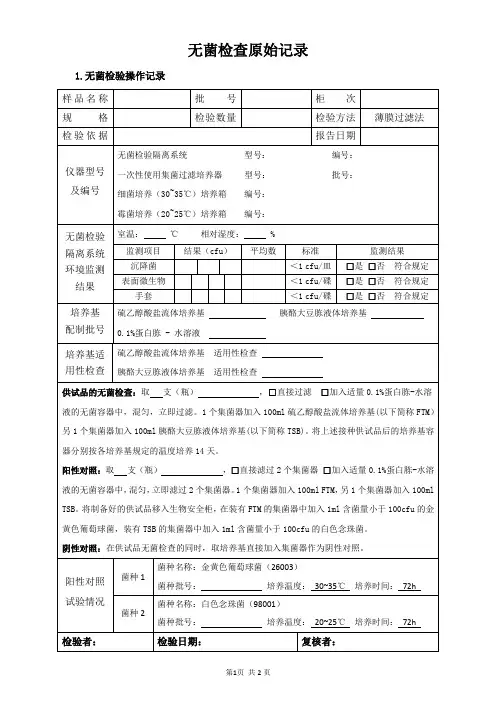
无菌检查原始记录
检品编号:
产品名称检验日期
生产批号规
格
完成
日期
灭菌批号效期检验者
生产单位或
产地检品
数量
11支
校对
者
检验依据方法:
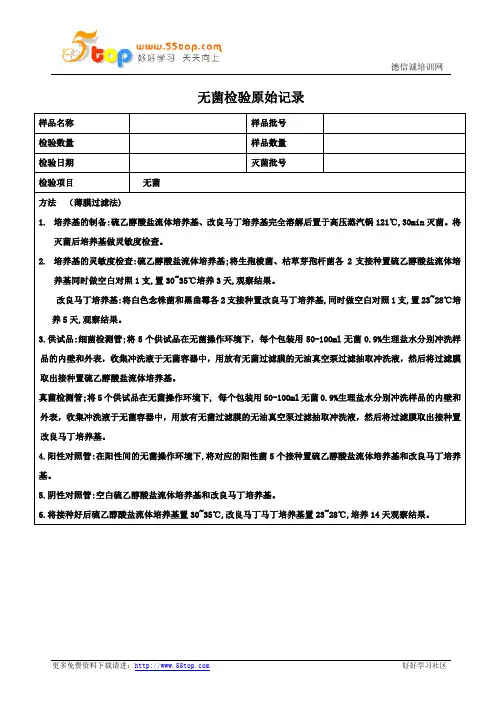
菌 23~28℃
直接法8 9 10 11
阴性
培养基: 硫乙醇酸盐流体培养基 配制批号:
改良马丁培养基 配制批号:
稀释液、冲洗液:□ 0.1%蛋白胨水溶液 □ PH7.0氯化钠-蛋白胨缓冲液 □ 0.9%无菌氯化钠溶液
配制批号:
对照菌:
取上述对照菌新鲜培养物1ml ,用9ml0.9%无菌氯化钠溶液10倍系列稀
释,取稀释液1ml 作为对照用菌液。
第 代培养物,稀释级别 计数结果
CFU/ml
设备编号: 隔水式恒温培养箱: 霉菌培养箱: 集菌仪:
无菌室菌落培养(30~35℃)
碟号时间123(应≤1CFU/平板)24小时菌落
数 结果:
符合 □
不符合 □
48小时菌落
数 平均菌落数
检验结果
无菌检查结果判断:□符合规定□不符合规定。

无菌检验原始记录资料1. 引言无菌检验是医药行业中一项非常重要的检测项目,用于评估药品或医疗器械是否符合无菌要求。
本文档将记录无菌检验的原始数据,包括实验设计、样品准备、实验过程、结果分析等内容。
2. 实验设计在进行无菌检验前,需要制定合理的实验设计,明确实验目的、方法和操作流程。
以下是本次无菌检验的实验设计:•实验目的:评估药品A的无菌性能,判断是否达到临床使用的要求。
•样品准备:从批次A中随机抽取10个单位作为样品。
•实验方法:采用膜过滤法进行无菌检验。
•实验流程:样品制备、膜过滤、培养基接种、培养、读取结果。
3. 样品准备样品准备是无菌检验中的重要环节,确保样品的真实性和可再现性。
在本次无菌检验中,我们从药品A批次中随机抽取了10个单位作为样品。
样品准备步骤如下:1.检查药品A批次的包装是否完好。
2.选择10个单位的药品,注意不要接触到外部环境。
3.将药品放入灭菌环境中,准备进行后续的膜过滤操作。
4. 实验过程本次无菌检验采用膜过滤法进行。
实验过程如下:1.准备所需材料和设备:膜过滤器、采样器、移液器、灭菌培养基等。
2.将膜过滤器装入采样器,并进行预灭菌处理。
3.使用移液器将样品精确地转移至采样器中。
4.将采样器连接至真空泵,启动泵抽取样品。
5.将膜过滤器转移到灭菌培养基板上,确保膜迅速接触到培养基。
6.将培养基板置于恒温培养箱中,设定合适的温度和时间。
7.培养结束后,观察培养基板上是否有细菌生长。
5. 结果分析根据观察结果,我们对实验结果进行分析和解读。
以下是对本次无菌检验结果的分析:•样品1-10:观察结果显示,所有样品在培养基板上均未发现细菌生长。
•正、负对照:正对照(已知含有细菌)显示细菌生长,而负对照(未接触到样品)未发现细菌生长。
•结论:根据实验结果,可以得出结论,药品A批次显示出良好的无菌性能,符合临床使用的要求。
6. 总结本文档记录了一次无菌检验的原始数据,包括实验设计、样品准备、实验过程、结果分析等内容。

《无菌检验原始记录》
日期:YYYY年MM月DD日
实验目的:通过进行无菌检验,检测样品是否受到外源性微生物污染。
实验材料:
1.无菌培养基
2.无菌试管
3.无菌匀液棒
4.无菌平板
5.微生物荧光灯
6.净化工作台
实验步骤:
1.将样品取出,在净化工作台上进行操作。
2.取一支无菌试管,将培养基倒入试管中约1/4满。
3. 用无菌匀液棒沾取样品约0.1ml,并迅速划线于无菌培养基上。
4.取另一支无菌试管,使用同样的方法将培养基倒入试管中,作为对
照组。
5.将培养基涂布在无菌平板上,旋转均匀。
6.将培养基固化后,将平板放置于微生物荧光灯下观察,并记录菌落
的出现情况。
7.对照组同样进行观察,用于比对差异结果。
实验结果:
对照组观察结果:未观察到任何菌落的生长。
样品观察结果:观察到部分菌落的生长。
实验分析与讨论:
根据实验结果,对照组未观察到任何菌落的生长,说明实验的无菌操作得到了有效执行。
而样品中观察到了部分菌落的生长,表明样品中存在微生物的外源性污染。
实验结论:
根据实验结果,样品中观察到了部分菌落的生长,表明样品受到了外源性微生物污染。
为了确保样品的质量和安全性,在进一步的研究中,需要采取相应措施降低污染源,并加强无菌操作的执行。


无菌检验原始记录资料1. 引言本文档为《无菌检验原始记录》资料的详细记录和分析。
无菌检验是指在无菌条件下对物品进行检验,以确定其中是否存在细菌或其他微生物的方法。
本次无菌检验涉及的物品包括药品、医疗器械、食品等。
本文档将提供检验过程的详细记录,并分析结果以评估物品的无菌性能。
2. 检验对象及目的2.1 检验对象本次无菌检验的对象为医疗器械A。
2.2 检验目的检验医疗器械A是否符合无菌要求,以评估其无菌性能。
3. 检验方法3.1 前期准备•清洁工作台:使用消毒剂对工作台进行彻底清洁,并进行适当灭菌处理。
•检验器具:收集所需的各种无菌器具,如培养皿、无菌填料等。
•培养基:准备适当的培养基。
3.2 检验步骤1.将医疗器械A放置在清洁工作台上,检查其外部是否有明显污染。
2.使用消毒液对医疗器械A进行清洁,消毒时间为10分钟。
3.将清洁后的医疗器械A放入无菌培养皿中。
4.将培养皿密封并标记,以便后续分析。
5.将培养皿放入适当的培养基中,培养时间为24小时。
6.培养结束后,观察培养皿中是否有细菌生长。
7.根据细菌生长情况,评估医疗器械A的无菌性能。
4. 实验结果经过24小时的培养,观察到培养皿中无任何细菌生长。
因此,医疗器械A符合无菌要求,具有较好的无菌性能。
5. 结论和建议根据本次无菌检验的结果,可以得出以下结论和建议:1.医疗器械A通过了无菌检验,满足无菌要求。
2.建议继续保持对医疗器械A的无菌条件管理,并进行定期检验,以确保其无菌性能。
6. 参考文献1.无菌检验技术规范,国家药典委员会、中国食品与药品监督管理局。
2.WHO《无菌技术指南》。
本文档详细记录了《无菌检验原始记录》的实验步骤、检验结果以及结论和建议。
通过本次检验,我们可以对医疗器械A的无菌性能进行初步评估,并提出后续管理建议,以确保其安全使用。
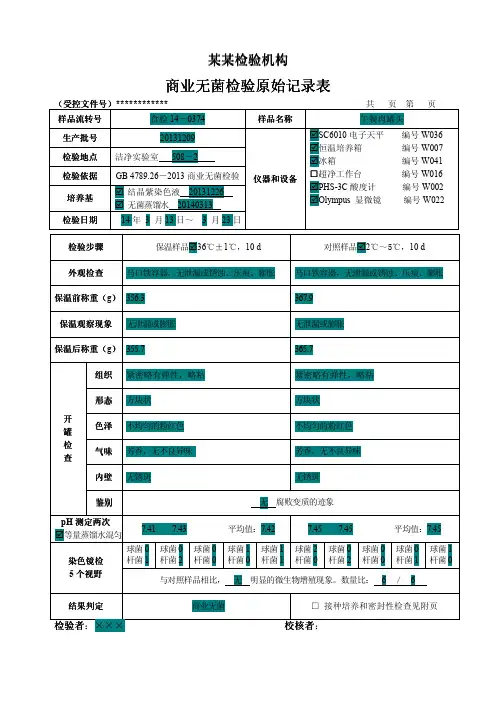
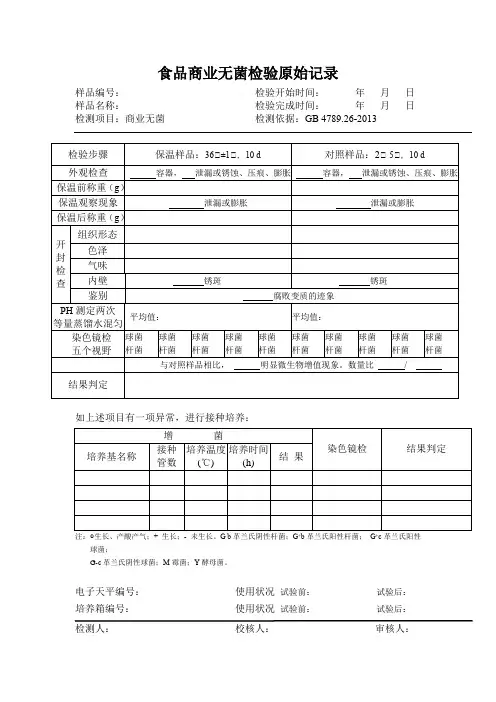
注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:洁净室动态测定∑= CFU/皿(规定100级∑≤1 CFU/皿)符合规定室温℃相对湿度 %细菌培养箱:真菌培养箱:压力蒸汽灭菌器:培养基名称:硫乙醇酸盐流体培养基(1)硫乙醇酸盐流体培养基(2)改良马丁培养基阳性对照菌:金黄色葡萄球菌 [CMCC(B)26 003] 生孢梭菌 [CMCC(B)64 941] 白色念珠菌[CMCC(F)98 001] 大肠埃希菌 [CMCC(B)44 102]注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:基本信息【药品名称】通用名称:头孢呋肟商品名称:西力欣、明可欣、达力新英文名称:汉语拼音:xilixin【成份】头孢呋辛酯化学名称为:(6R,7R)-7-[2-呋喃基(甲氧亚氨基)乙酰氨基]-3-氨基甲酰氧甲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸,1-乙酰氧基乙酯【性状】本品为白色胶囊形薄膜衣片。
【作用类别】【规格】 250mg/片 125mg/片适应症头孢呋辛酯适用于敏感细菌造成的感染的治疗。
- 下呼吸道感染:如急性支气管炎及慢性支气管炎急性发作和肺炎。
- 上呼吸道感染:包括耳、鼻、咽喉感染,如中耳炎、鼻窦炎、扁桃体炎及咽炎。
- 生殖泌尿道感染:如肾盂肾炎,膀胱炎和尿道炎。
- 皮肤及软组织感染:如疖病,脓皮病和脓疱病。
治疗成人和12岁以上儿童的早期莱姆病,以及其后对晚期莱姆病的预防。
无菌检查记录一、任务描述根据要求,编写一份无菌检查记录的标准格式文本。
二、无菌检查记录表日期:2022年10月15日检查人员:张三检查地点:XX医院手术室序号项目名称结果备注1 消毒操作合格无异常2 空气质量合格 PM2.5浓度符合标准3 器械包装合格无破损、湿润等异常4 器械包装合格无破损、湿润等异常5 操作人员合格穿戴无菌手套和口罩6 操作环境合格温度、湿度符合要求7 操作时间合格手术开始前完成无菌检查8 检查结果合格无菌指标符合要求备注:本次无菌检查记录表共检查8项,检查结果全部合格。
三、解析和说明1. 消毒操作:检查消毒操作是否符合要求,包括消毒剂的使用方法、浓度和时间等。
2. 空气质量:检查手术室空气中PM2.5浓度是否符合标准,确保手术环境无污染。
3. 器械包装:检查手术器械包装是否完好无损,无湿润、破损等异常情况。
4. 操作人员:检查手术人员是否穿戴无菌手套和口罩,确保操作人员不会引入细菌。
5. 操作环境:检查手术室的温度和湿度是否符合要求,保证手术环境适宜。
6. 操作时间:检查无菌检查是否在手术开始前完成,确保手术过程中的无菌状态。
7. 检查结果:综合以上各项检查结果,判断整体的无菌指标是否符合要求。
四、参考数据1. 消毒操作:消毒剂浓度为1:100,消毒时间为30分钟。
2. 空气质量:PM2.5浓度应低于35μg/m³。
3. 器械包装:器械包装应完好无损,无湿润、破损等异常情况。
4. 操作人员:手术人员应穿戴无菌手套和口罩。
5. 操作环境:手术室温度应控制在20-25摄氏度,湿度应控制在40%-60%。
六、总结本次无菌检查记录表详细记录了无菌检查的各项指标,包括消毒操作、空气质量、器械包装、操作人员、操作环境、操作时间等。
通过对以上指标的检查,确认手术室的无菌状态符合要求。
无菌检查记录的编写和记录对于手术室的无菌操作和术后感染的预防具有重要意义,保证了手术的安全性和患者的健康。
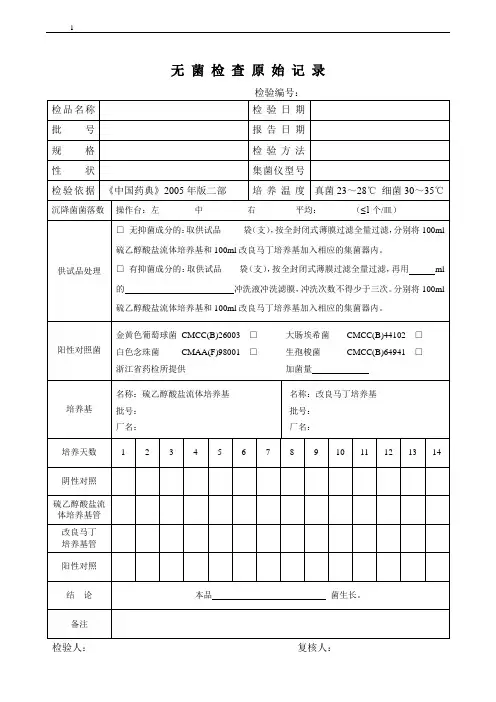
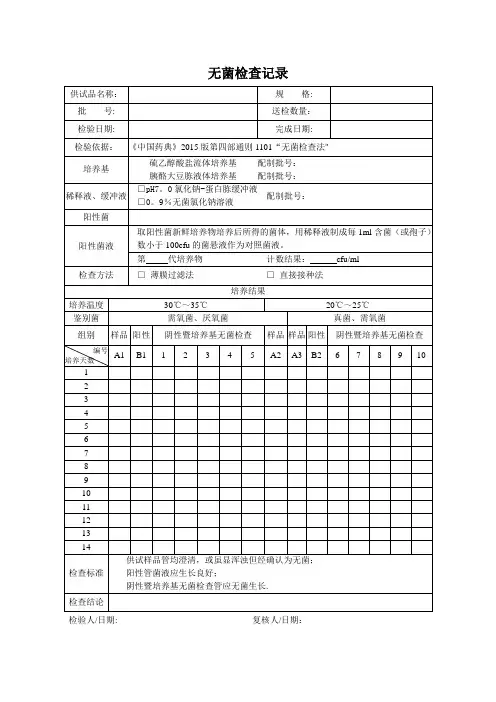
无菌检查记录
供试品名称:批号:检验日期:规格:送检数目:完成日期:
检验依照:《中国药典》 2015 版第四部公则 1101“无菌检查法”
培育基硫乙醇酸盐流体培育基配制批号:胰酪大豆胨液体培育基配制批号:
稀释液、缓冲液□氯化钠 - 蛋白胨缓冲液
配制批号:□ %无菌氯化钠溶液
阳性菌
取阳性菌新鲜培育物培育后所得的菌体,用稀释液制成每1ml 含菌(或孢子)
阳性菌液数小于 100cfu 的菌悬液作为比较菌液。
第代培育物计数结果:cfu/ml
检查方法□ 薄膜过滤法□ 直接接种法
培育结果
培育温度30℃~ 35℃20℃~ 25℃
鉴别菌需氧菌、厌氧菌真菌、需氧菌
组别样品阳性阴性暨培育基无菌检查样品样品阳性阴性暨培育基无菌检查编号
A1 B1 1 2 3 4 5 A2 A3 B2 6 7 8 9 10 培育天数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
供试样品管均澄清,或虽显浑浊但经确以为无菌;
检查标准阳性管菌液应生长优异;
阴性暨培育基无菌检查管应无菌生长。
检查结论
检验人 / 日期:复核人 / 日期:。