脑神经胶质瘤
- 格式:doc
- 大小:173.50 KB
- 文档页数:11
脑胶质瘤的早期症状有哪些?脑胶质瘤的早期症状有哪些?本指文旨在帮助患者及其亲属更好地了解胶质瘤的性质,并根据胶质瘤的亚型选择更佳的治疗方案。
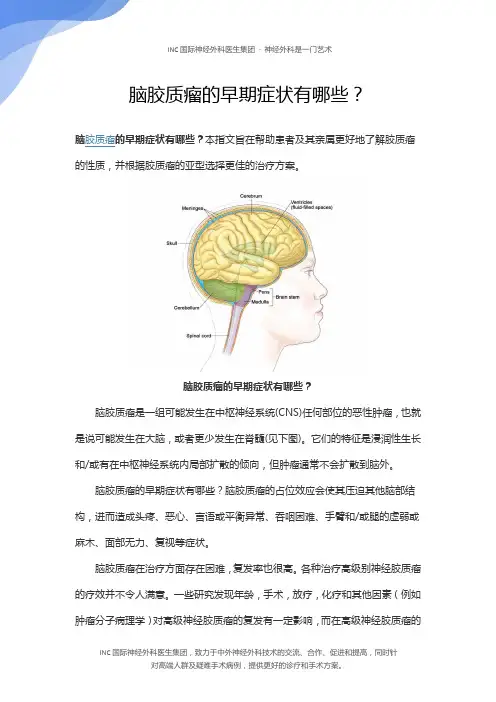
脑胶质瘤的早期症状有哪些?脑胶质瘤是一组可能发生在中枢神经系统(CNS)任何部位的恶性肿瘤,也就是说可能发生在大脑,或者更少发生在脊髓(见下图)。
它们的特征是浸润性生长和/或有在中枢神经系统内局部扩散的倾向,但肿瘤通常不会扩散到脑外。
脑胶质瘤的早期症状有哪些?脑胶质瘤的占位效应会使其压迫其他脑部结构,进而造成头疼、恶心、言语或平衡异常、吞咽困难、手臂和/或腿的虚弱或麻木、面部无力、复视等症状。
脑胶质瘤在治疗方面存在困难,复发率也很高。
各种治疗高级别神经胶质瘤的疗效并不令人满意。
一些研究发现年龄,手术,放疗,化疗和其他因素(例如肿瘤分子病理学)对高级神经胶质瘤的复发有一定影响,而在高级神经胶质瘤的研究中普遍关注的是单药治疗往往疗效低下。
但是,随着分子生物学的发展,人们对这些肿瘤的发病机理有了更深入的了解,分子靶向治疗引起了人们的广泛关注。
复发性高级神经胶质瘤的治疗也更加丰富,治疗选择比以前多样化。
溶瘤病毒疗法,干细胞疗法,免疫疗法和电场疗法等新兴疗法有望改善复发性高级别神经胶质瘤的治疗前景。
但需要指出的是,手术切除仍是胶质瘤的一线治疗手段,因其可以从根本上提高生存率、改善预后,手术全切可以极大程度上避免肿瘤复发。
对于一些低级别胶质瘤患者而言,手术全切甚至有可能达到治愈效果;高级别胶质瘤患者手术切除后再辅以放化疗,也可有效延长生存期,患者切勿舍本逐末,一味追求新的药物与疗法,延误治疗时间。
若对自身病情有所疑虑,不知能否手术,或希望接受新型疗法,均可预约INC国际专家远程咨询,在听取一位或多位专家的第二诊疗意见后再做决策。

中药治愈脑胶质瘤案例脑胶质瘤是一种常见的神经系统恶性肿瘤,常常对患者的生活和健康造成严重威胁。
然而,传统中药在治疗脑胶质瘤方面也展现出了一定的疗效。
以下是一例中药治愈脑胶质瘤的案例,展示了中药的潜力和独特的治疗效果。
患者李先生,男性,60岁,被诊断出患有脑胶质瘤。
根据病情的严重程度,医生建议进行手术治疗。
然而,李先生担心手术带来的风险和后遗症,决定寻求中药治疗的选择。
李先生开始接受中药治疗后,每天服用由中药师根据他的病情和体质定制的中药方剂。
这个方剂的主要成分包括夏枯草、蜂蜜、桑椹和当归等。
夏枯草被广泛用于中医传统治疗中,据说具有清热解毒、消肿止痛的功效。
蜂蜜具有养阴润燥、清热解毒的作用。
桑椹和当归也被认为具有抗肿瘤的功效。
这个中药方剂的目标是抑制肿瘤生长、增强免疫力、改善李先生的整体身体状况。
经过几个月的中药治疗,李先生的病情开始出现积极的变化。
他的脑胶质瘤的生长速度减缓了,并且他的头痛和恶心的症状也有所缓解。
他的身体状况和精神状态也明显改善。
进一步的检查显示,他的肿瘤大小在逐渐减小,肿瘤细胞的活跃度也降低了。
这个案例说明了中药治疗在脑胶质瘤患者中的潜力。
中药方剂中的草药成分被认为具有多种抗肿瘤的作用机制。
首先,一些中草药的成分具有抑制肿瘤细胞生长的能力。
其次,中草药可以增强机体的免疫力,提高机体对抗肿瘤的能力。
此外,中草药还具有调节体内微环境和减轻化疗药物副作用的作用。
尽管中药治疗在治疗脑胶质瘤方面具有一定的疗效,但仍然需要与西医治疗相结合,并在专业医生的指导下进行。
中药治疗的效果可能因人而异,因此在选择中药方剂时应根据个体的病情和体质进行调整。
总结起来,中药治疗在脑胶质瘤患者中展现出了一定的疗效。
在这个案例中,中药方剂成功地抑制了肿瘤的生长,减轻了患者的症状,并改善了他的整体身体状况。
然而,中药治疗仍然需要进一步的研究和证据来支持其在脑胶质瘤治疗中的应用。
对于脑胶质瘤患者,综合治疗方案和个体化的治疗方案可能会带来更好的治疗效果。

胶质瘤病理诊断标准1. 引言1.1 背景胶质瘤是一种常见的颅内恶性肿瘤,占颅脑肿瘤的一大部分。
它起源于神经胶质细胞,主要发生在中枢神经系统中,包括大脑、小脑、脑干和脊髓等部位。
随着医学技术的发展和人们对肿瘤的认识不断深入,胶质瘤的病理诊断标准也得到了不断完善和更新。
胶质瘤的病理诊断一直是临床医生和病理学家面临的难题之一,因为其病理特征复杂多样,而且易于与其他类型的肿瘤混淆。
制定科学合理的病理诊断标准对于确诊胶质瘤、制定治疗方案和预后评估至关重要。
随着分子生物学和遗传学研究的进展,胶质瘤的病理诊断标准也在不断更新和完善。
有了准确可靠的病理诊断标准,医生可以更加准确地评估患者的病情,制定个体化的肿瘤治疗方案。
深入了解胶质瘤病理诊断标准的重要性,对于提高胶质瘤的诊治水平,提高患者的生存率具有重要意义。
1.2 目的胶质瘤是一种常见的中枢神经系统肿瘤,其治疗和预后严重依赖于病理诊断结果。
建立准确、可靠的胶质瘤病理诊断标准对于指导治疗和预后评估至关重要。
本文的目的旨在系统总结当前胶质瘤病理诊断标准的最新进展,以及对比不同标准的优缺点,为临床医生提供参考和指导。
具体而言,我们将重点介绍胶质瘤的定义、分类、病理特征以及最新的病理诊断标准,比较不同标准之间的差异和争议。
通过本文的深入探讨,我们希望可以为临床医生提供更准确、更客观的胶质瘤病理诊断依据,提高病理诊断的准确性和一致性。
本文还将讨论胶质瘤病理诊断的意义,探讨其在临床实践中的实际应用和未来发展方向,为胶质瘤治疗和研究提供新的思路和策略。
2. 正文2.1 胶质瘤的定义一般来说,胶质瘤是指起源于神经胶质细胞的一种良性或恶性肿瘤。
胶质瘤通常发生在中枢神经系统,包括大脑和脊髓。
它们是最常见的原发性颅内肿瘤之一,约占所有颅内肿瘤的四分之一。
胶质瘤可以发生在任何年龄,但多见于成年人,特别是中老年人。
胶质瘤的形成主要是由于神经胶质细胞的异常增殖和失控。
在正常情况下,神经胶质细胞负责提供支持和营养,维持神经元的正常功能。
ONE KEEP VIEW 脑胶质瘤ppt参考课件目录CATALOGUE•引言•脑胶质瘤基本概念•临床表现与诊断•影像学检查在脑胶质瘤诊断中应用•治疗方案及适应证选择•并发症预防与处理策略•康复期管理与生活调整建议•总结回顾与展望未来进展方向PART01引言目的和背景提高对脑胶质瘤的认识和理解01通过本次课件的讲解,使听众能够更深入地了解脑胶质瘤的发病原因、病理机制、临床表现、诊断方法和治疗方案等方面的知识。
探讨脑胶质瘤的研究进展和未来方向02介绍当前脑胶质瘤领域的研究热点和最新成果,展望未来的发展趋势和可能的研究方向。
为临床医生和研究者提供参考03通过分享典型的病例、诊断经验和治疗技巧等内容,为临床医生和研究者提供有益的参考和借鉴。
脑胶质瘤的基本概念介绍脑胶质瘤的定义、分类、发病部位和流行病学特点等基础知识。
详细阐述脑胶质瘤的病理机制,包括遗传因素、环境因素、细胞信号传导异常等方面的内容。
介绍脑胶质瘤的临床症状、体征和影像学表现,帮助听众更好地了解和识别脑胶质瘤。
系统介绍脑胶质瘤的诊断方法和治疗方案,包括手术切除、放疗、化疗和免疫治疗等多种手段,同时探讨各种治疗方法的优缺点和适用范围。
通过分享典型的病例,介绍脑胶质瘤的诊断和治疗过程,引导听众进行深入的思考和讨论。
脑胶质瘤的病理机制脑胶质瘤的诊断和治疗典型病例分享和讨论脑胶质瘤的临床表现课件内容概述PART02脑胶质瘤基本概念脑胶质瘤是起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤之一。
它属于神经上皮组织肿瘤的一种,主要发生在脑和脊髓的胶质细胞中。
根据不同的细胞类型,脑胶质瘤可分为星形细胞瘤、少突胶质细胞瘤、室管膜瘤等。
脑胶质瘤定义遗传因素环境因素病毒感染其他因素发病原因及危险因素01020304部分脑胶质瘤具有家族聚集性,可能与遗传基因有关。
长期接触电离辐射、化学物质等有害物质可能增加患病风险。
某些病毒感染,如巨细胞病毒感染,可能与脑胶质瘤的发生有关。


早期脑胶质瘤有哪些征兆近些年,随人们生存结构的变化,脑瘤的患病率在全球范围内均呈现上升的趋势。
而胶质瘤是最为常见的一种,是一种大脑中枢神经系统的原发性肿瘤,多属于恶性。
那么,出现哪些信号需警惕脑胶质瘤呢?早期脑胶质瘤有哪些征兆呢?1、头痛:头痛常是早期脑胶质瘤症状之一,初期常为间歇性、搏动性钝痛及胀痛,以后随着肿瘤增大,头痛加剧,时间延长,可以变成持续性。
头痛可以是局限性或全头痛,常发生于清晨或起床后空腹时,白天逐渐缓解,严重时可伴有恶心、呕吐,呕吐后头痛可减轻。
任何引起颅内压增高的因素,如咳嗽、喷嚏、大便等均可使头痛加重。
当肿瘤囊性变、肿瘤内出血或蛛网膜下腔出血时,可使头痛加剧,当患者头痛突然加剧、坐卧不安、大声呼痛或两手抱头,甚至叩击头部,伴有喷射性呕吐,继之昏迷,这是急性颅内压增高危象的先兆信号,必须采取紧急处理措施。
2、呕吐:呕吐也经常是首发胶质瘤症状,多发生在清晨空腹时,呕吐前可有或无恶心,且常伴有剧烈的头痛、头晕。
有时呈喷射性,多因颅内压增高刺激呕吐中枢引起。
小儿颅后窝肿瘤出现呕吐较早且频繁,常为唯一的早期症状,易误诊为胃肠道疾病,故小儿出现频繁呕吐时,应做详细的神经系统检查,以防漏诊。
3、癫痫:癫痫发作多由于肿瘤的直接刺激或压迫引起,发生率约30%。
一般生长缓慢的低级别胶质瘤如星形细胞瘤和少突胶质瘤以癫痫为首发或主要症状,生长快的恶性胶质母细胞瘤癫痫发生率低。
4、由于肿瘤刺激、压迫或破坏周围脑组织或颅神经引起的神经系统定位症状,如额叶胶质瘤可引起运动区损害、书写及运动语言中枢损害等,顶叶肿瘤胶质瘤引起皮质感觉障碍、失用症、失读症和计算力障碍等。
颞叶胶质瘤可引起耳鸣和幻听、感觉性或命名性失语、眩晕等。
以上是关于“早期脑胶质瘤有哪些征兆?”的相关介绍,相信您应该有所了解。
如果您还有任何的疑问,建议你可以先咨询在线医生。
原文链接:/410njzl/2015/0817/229288.html。

脑胶质瘤的全身和局部症状脑胶质瘤是常见的的疾病,其症状主要有两方面的表现。
一是颅内压增高和其他一般症状,如头痛、呕吐、视力减退、复视、癫痫发作和精神症状等。
另一是脑组织受肿瘤的压迫、浸润、破坏所产生的局部症状,造成神经功能缺失。
脑胶质瘤的全身症状:1、脑胶质瘤引发的头痛:大多由于颅内压增高所致,肿瘤增长颅内压逐渐增高,压迫、牵扯颅内疼痛敏感结构如血管、硬膜和某些颅神经而产生头痛。
大多为跳痛、胀痛,部位多在额颞部或枕部,一侧大脑半球浅在的肿瘤,头痛可主要在患侧、头痛开始为间歇性,多发生于清晨、随着肿瘤的发展,头痛逐渐加重,持续时间延长。
2、胶质瘤患者呕吐:系由于延髓呕吐中枢或迷走神经受刺激所致,可先无恶心,是喷射性。
在儿童可由于颅缝分离头痛不显着,且因后颅窝肿瘤多见,故呕吐较突出。
3、颅内压增高可产生视乳头水肿,且久致视神经继发萎缩,视力下降。
肿瘤压迫视神经者产生原发性视神经萎缩,亦致视力下降。
外展神经易受压挤牵扯,常致麻痹,产生复视。
4、一部分肿瘤病人有癫痫症状,并可为早期症状。
癫痫始于成年后者一般为症状性,大多为脑瘤所致。
药物不易控制或发作性质有改变者,都应考虑有脑瘤存在。
肿瘤邻近皮层者易发生癫痫,深在者则少见。
局限性癫痫有定位意义。
5、有些肿瘤特别是位于额叶者可逐渐出现精神症状,如性格改变、淡漠、言语及活动减少,注意力不集中,记忆力减退,对事物不关心,不知整洁等。
脑胶质瘤的局部症状:依肿瘤所在部位产生相应的症状,进行性加重。
特别是恶性胶质瘤,生长较快,对脑组织浸润破坏,周围脑水肿亦显着,局部症状较明显,发展亦快。
在脑室内肿瘤或位于静区的肿瘤早期可无局部症状。
而在脑干等重要功能部位的肿瘤早期即出现局部症状,经过相当长时间才出现颅内压增高症状。
某些发展较慢的肿瘤,由于代偿作用,亦常至晚期才出现颅内压增高症状。
海军总医院的“P-RM分子消融基因渗透疗法”,以中西医结合为突破口,注重发挥中医优势,以放疗结合中医的综合治疗手段治疗癌症。

1神经胶质瘤的研究意义神经胶质瘤( Glioma)是最常见的颅内肿瘤,约占所有颅内肿瘤的50%左右。
目前临床上 IV 型神经胶质瘤是恶性程度最高的脑部肿瘤,至今无法治愈[1]。
多形性胶质母细胞瘤(Glioblastoma Multiforme, G BM) 起源于脑部神经胶质细胞,成年脑癌患者中约 80%为浸润性的星形细胞瘤。
由于该肿瘤是浸润性生长物,其和正常脑组织没有明显的界限,因此难以被完全切除或根本不能手术。
血脑屏障的存在,又使得化学药物和一般抗肿瘤的中药难以发挥疗效。
该肿瘤细胞对放疗亦不甚敏感,非常容易复发。
因此脑胶质瘤至今仍是全身肿瘤中预后最差的肿瘤之一。
据文献报道神经胶质瘤的中位生存时间和无进展生存时间分别为 14.6个月和 6.9个月, 5 年生存率为 9.8%2。
近年来,原发性恶性脑肿瘤发生率逐年递增,年增长率达到每 100,000人口中有 5.26 个人,而且每年有 17000人被最新诊断出患有该致死性疾病[3, 4]。
因此,积极研究神经胶质瘤的发病原因、寻找恶性胶质瘤治疗切实有效的治疗手段已成为目前亟待解决的关键问题。
和(或)抑癌基因改变的细胞;肿瘤的发展(包括由分化较好的肿瘤2 上皮 -间质转化与神经胶质瘤发生发展的关系人脑胶质瘤发生、发展过程中,多种癌基因、抑癌基因的异常改变牵涉其中。
肿瘤的形成和发展与基因改变间的关系是近年来肿瘤学研究的核心问题之一。
多种基因的改变都参与到肿瘤细胞生长过程中,肿瘤细胞生长是肿瘤最基本的生物学行为,生长异常是肿瘤恶性行为的基础。
大量的研究证实,肿瘤的形成起源于单个获得了癌基因转变成分化差的肿瘤,局部浸润和远处转移)则是更多癌基因和抑癌基因受累后作用叠加,肿瘤细胞克隆选择和扩增的最终结果3 4 5 6。
在胶质瘤发生发展的大量研究中,人端粒酶逆转录酶( hTERT)[6]、内皮生长因子受体( EGFR)7、热休克蛋白( HSP)8 9 10等分子以及 PKA、PKC、ERK[9, 10]等关键信号转导分子均在神经胶质瘤的发生发展过程中发挥重要作用。

脑胶质瘤WHO中枢神经系统肿瘤分类(第五版)分析_附60例报告脑胶质瘤WHO中枢神经系统肿瘤分类(第五版)分析:附60例报告摘要:脑胶质瘤是指发生在中枢神经系统中的恶性肿瘤。
根据WHO的分类标准,该病被分为四个等级,即Ⅰ级到Ⅳ级。
本文通过对60例脑胶质瘤患者的病理报告进行分析,以探讨它们的病理特征和分类情况,并对其临床表现和治疗进行讨论。
引言:脑胶质瘤是中枢神经系统中最常见的恶性肿瘤之一,其发病率逐年上升。
病因目前尚不明确,但遗传、环境及个体因素等均被认为与其发生有关。
脑胶质瘤的分类对于其治疗和预后的评估至关重要,因此,根据WHO的分类标准进行分析和研究是必要的。
方法:本研究共收集了60例脑胶质瘤患者的病理报告,包括病理类型、组织学分级、病灶位置、分布情况等信息。
对这些信息进行统计分析,并将其与WHO中枢神经系统肿瘤分类(第五版)进行对比和讨论。
结果:通过对这60例病例的病理报告进行分析,我们发现其中48例属于WHO分类的Ⅳ级,9例属于Ⅲ级,2例属于Ⅱ级,只有1例属于Ⅰ级。
脑胶质瘤的病灶位置多发生在大脑半球,尤以额叶、颞叶为多。
此外,我们还观察到脑胶质瘤的分布不均匀,其中前额叶最多见,次为颞叶和顶叶。
讨论:根据本研究的结果和分析,可以得出以下结论:脑胶质瘤的分级与其临床表现和预后密切相关,Ⅳ级脑胶质瘤通常具有高度恶性和侵袭性的特征,治疗难度较大;Ⅱ级和Ⅲ级脑胶质瘤相对较为良性,但仍需密切监测和及时治疗。
此外,脑胶质瘤的病灶位置对其治疗和预后也有一定影响。
结论:脑胶质瘤的分类对其治疗和预后起到重要作用。
根据本研究的结果,可以更好地了解脑胶质瘤的病理特征和分类情况,为临床医生提供参考依据,指导患者的治疗和监测。
然而,本研究仍然存在一些限制,例如样本数量有限,且没有进行长期随访观察。
因此,在以后的研究中,应该进一步扩大样本量,并进行更长期的随访,以便更全面地了解脑胶质瘤的特点和分类。
根据对60例脑胶质瘤病例的病理报告分析,本研究发现大多数病例属于WHO分类的Ⅳ级,表明这些瘤体具有高度恶性和侵袭性的特征,治疗难度较大。

得了脑胶质瘤该怎么治?脑胶质瘤亦称神经胶质瘤,是发生于神经外胚叶组织的肿瘤。
在我国,脑胶质瘤占颅内肿瘤的33.3%~58.9%,平均43.5%。
其治疗难度较大,目前脑胶质瘤无法根治,但是随着医学技术的飞速发展,相信我们离攻克脑胶质瘤的那一天也不会太远了。
脑胶质瘤高增殖和侵袭行为是当今的治疗难点,以至有人比喻它能有效地“逃避”外科手术、放疗、化疗、免疫治疗等方案,导致病人最终的不可治和死亡。
目前脑胶质瘤的治疗手段主要包括以下几种:手术治疗目前,手术治疗是脑胶质瘤相对最有效的治疗方法。
但是由于肿瘤生长于脑部这种重要部位,即使能进行手术治疗也并不保证能完全切除肿瘤。
因此手术治疗的目的是明确诊断,改善症状,减轻肿瘤负荷,为进一步治疗创造条件。
随着显微手术及激光、导航系统等高新技术的应用,手术治疗也在不断完善中,以往一些认为不能手术的肿瘤,也能进行手术切除了,而且相关新技术不仅提高了手术的全切率还降低了手术的风险。
放射治疗放疗是综合治疗脑胶质瘤的重要组成部分。
近年来放射治疗,主要进展集中于放射剂量、放射野、时间间隔的改进以及在放射增敏剂的应用和选择上。
化学治疗化疗是脑胶质瘤治疗的重要环节,手术和放疗使部分脑胶质瘤取得了较好的疗效,然而,大多数肿瘤还难免复发。
化疗对进一步杀灭残留肿瘤细胞起到很重要的作用。
脑胶质瘤的化疗主要是用药还是以亚硝脲类为主体的单一或联合用药。
影响胶质瘤化疗疗效的原因至少有2个方面:①血脑屏障(blood brain barrier,BBB)的存在影响抗瘤药物进人脑内;②相当一部分肿瘤对抗癌药物的具有耐药性。
另外值得一提的是,化疗和放疗疗法在杀灭癌细胞的同时,也会伤害人体正常细胞,因此放化疗过程中通常会伴有一些副作用,产生恶心、呕吐、骨髓抑制等症状。
临床上通常搭配中药如人参皂苷Rh2等护理,缓解放化疗副反应。
现代中药人参皂苷Rh2治疗脑胶质瘤优势脑胶质瘤作为危害人体健康的一大疾病,脑胶质瘤的治疗一直是中医抗癌研究的一个重要课题。

胶质瘤简介胶质瘤会诊中心脑胶质瘤(神经胶质瘤)约占颅内肿瘤的46%,世界卫生组织1998年公布按死亡率顺序排位,恶性胶质瘤是34岁以下肿瘤患者的第2位死亡原因,是35~54岁患者的第3位死亡原因。
在全球,每年恶性脑胶质瘤无情地夺去18~60万中青年人的宝贵生命。
病因脑胶质瘤的病因至今都没有查出来。
可能与遗传、损伤、放射性、化学毒物、病毒等因素有关。
症状星形细胞瘤一般症状为颅内压增高表现,头痛、呕吐、视神经乳头水肿、视力视野改变、癫痫、复视、颅扩大(儿童期)和生命体征改变等。
局部症状依肿瘤生长位置不同而异①大脑半球星形细胞瘤:约1/3患者以癫痫为首发症状约60%患者发生癫痫。
②小脑星形细胞瘤:患侧肢体共济失调,动作笨拙,持物不稳,肌张力和腱反射低下等。
③丘脑星形细胞瘤:病变对侧肢体轻瘫,感觉障碍及半身自发性疼痛,患侧肢体共济运动失调、舞蹈样运动,亦可表现为精神障碍,内分泌障碍,健侧同向偏盲,上视障碍及听力障碍等。
④视神经星形细胞瘤:主要表现为视力损害和眼球位置异常。
⑤第三脑室星形细胞瘤:因梗阻性脑积水患者常表现为剧烈的发作性头痛,并可出现突然的意识丧失,精神障碍,记忆力减退等。
⑥脑干星形细胞瘤:中枢肿瘤常表现为眼球运动障碍,桥脑肿瘤多表现为眼球外展受限,面神经及三叉神经受累,延髓肿瘤常表现为吞咽障碍及生命体证改变。
胶质母细胞瘤:肿瘤高度恶性生长快,病程短,自出现症状至就诊多数在3个月之内,高颅内压症状明显,33%患者有癫痫发作,20%患者表现淡漠、痴呆、智力减退等精神症状,(患者)可出现不同程度的偏瘫,偏身感觉障碍、失语和偏盲等。
少枝胶质细胞瘤及间变(恶性)少枝胶质细胞瘤:癫痫常为首发症状,精神症状以情感异常和痴呆为主,侵犯运动、感觉区可产生偏瘫,偏身感觉障碍及失语等,高颅压症状出现较晚。
髓母细胞瘤①肿瘤生长快,高颅压症状明显②小脑功能损害表现为步态蹒跚,走路不稳等。
③复视、面瘫、头颅增大(儿童)、呛咳等。
脑胶质瘤是起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤。
根据世界卫生组织(WHO)中枢神经系统肿瘤分类,脑胶质瘤分为Ⅰ-Ⅳ级,其中Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级别脑胶质瘤。
全球范围内,脑胶质瘤的发病率和病死率较高。
据统计,世界脑胶质瘤发病率为5.48/10万,我国脑胶质瘤发病率为7.00/10万,男性发病率略高于女性。
同时,世界恶性脑肿瘤年病死率为 4.37/10万,其中恶性程度最高的胶质母细胞瘤1年生存率为39.5%,5年生存率仅为5.4%,在我国,这一数据为9%。
高级别脑胶质瘤的复发率可超过70%。
脑胶质瘤的发病危险因素包括高剂量电离辐射、神经纤维瘤病(NF-1)综合征、胶质瘤息肉病综合征和利-弗劳梅尼综合征等。
此外,亚硝酸盐、病毒和细菌感染等致癌因素也可能参与脑胶质瘤的发生。
在治疗方面,脑胶质瘤的治疗原则和目标是根据不同的病理分级、肿瘤位置和患者身体状况来制定个性化的治疗方案。
手术是首选的治疗方式,对于低级别脑胶质瘤,通过手术切除肿瘤可以获得较好的生存期;而对于高级别脑胶质瘤,手术切除后需要辅助放疗和化疗等综合治疗手段。
此外,随着医学技术的不断发展,免疫治疗和基因治疗等新型治疗方式也逐渐应用于脑胶质瘤的治疗中。
总之,脑胶质瘤是一种严重威胁人类健康的疾病,需要加强对其发病机制、病理分型和治疗方案等方面的研究,以提高患者的生存期和生活质量。
脑胶质瘤的治疗方法脑胶质瘤是一种主要起源于神经胶质细胞的恶性肿瘤,常见于中枢神经系统。
它的治疗方法通常涉及手术切除、放射治疗和化学治疗等多种方法。
下面我将详细介绍脑胶质瘤的治疗方法。
1. 手术切除:手术切除是治疗脑胶质瘤的主要方法之一。
手术的目的是尽可能完整地切除肿瘤组织,减少肿瘤对健康脑组织的侵袭。
手术通常采用显微镜辅助技术进行,可以通过切除肿瘤组织来减轻症状,延长患者的生存期。
然而,脑胶质瘤通常有较高的复发率,因此手术往往需要与其他治疗方法联合应用。
2. 放射治疗:放射治疗是用高能射线照射肿瘤组织,破坏肿瘤细胞的生长和分裂,达到治疗目的的方法。
放射治疗可以用于术前辅助治疗,以减小肿瘤体积,提高手术切除的成功率;也可以用于术后辅助治疗,以杀死手术切除后残留的肿瘤细胞。
放射治疗有时也可以单独应用于无法手术切除的患者。
然而,放射治疗也会对正常脑组织产生一定的损伤,因此在剂量和治疗计划的确定上需要谨慎。
3. 化学治疗:化学治疗是使用化学药物抑制肿瘤细胞的生长和分裂的方法。
化学药物通过静脉注射或口服给药的方式进入全身循环,可以杀死远离肿瘤灶的转移细胞。
常用的化疗药物包括卡矽平、替莫唑胺、长春新碱等。
化学治疗通常与手术和/或放射治疗联合应用,以达到更好的治疗效果。
然而,脑胶质瘤对化疗药物的抵抗性较强,因此化疗的效果有限。
4. 靶向治疗:近年来,靶向治疗作为一种新兴的治疗方法,逐渐应用于脑胶质瘤的治疗中。
靶向治疗是基于研究发现脑胶质瘤细胞中存在特定的致病基因突变或异常表达的蛋白质,通过选择性地抑制这些致病基因或蛋白质的活性,从而达到治疗的目的。
目前,已经开发出一些针对脑胶质瘤的靶向治疗药物,例如透明质酸合成酶抑制剂(如贝伐珠单抗)和基因突变抑制剂(如特罗瑞必妥)。
靶向治疗的优势在于针对肿瘤细胞的特定靶点,具有较好的治疗效果和较少的毒副作用。
5. 免疫治疗:免疫治疗是利用身体的免疫系统来抑制肿瘤生长和扩散的一种治疗方法。
大脑胶质瘤病一概述大脑胶质瘤病(GC),又名弥漫性星形细胞瘤、脑弥漫性胶质瘤等,是一种临床少见的中枢神经系统肿瘤性疾病。
本病特征为:病变浸润性或多发性生长,涉及2个及以上脑叶。
2007年WHO中枢神经系统肿瘤的分类将其归属于神经上皮组织肿瘤中的星形细胞肿瘤,恶性程度为3级。
GC的临床表现不具特异性,一般为亚急性起病,进行性加重。
若出现进行性加重的头痛、偏瘫和癫痫发作,影像学上显示脑实质内多个脑叶受累的病变,应考虑本病。
目前该病尚无特殊有效的治疗方法,基本治疗包括手术、放疗和化疗。
二病因大脑胶质瘤病来源目前尚不清楚,有三种主要学说:脑神经胶质细胞胚胎发育障碍,导致瘤细胞样畸变,最终形成离心样弥漫分布的肿瘤;可能由单发肿瘤经内在广泛扩布或区域性转移扩散;肿瘤为多中心起源,瘤细胞经进一步离心扩散呈弥漫性浸润。
目前多认为它是在一定的内外因素作用下大范围的胶质细胞间变所致,同时瘤细胞沿着脑白质内的传导束向远处浸润扩散,而扩散的瘤细胞在适宜的部位和内外因素作用下又发展成为另一相对独立的瘤巢。
有人认为,脑胶质瘤可能来源于胚胎组织或为慢性炎症影响的结果,如脑梗死的亚急性期、多发性硬化、进行性多灶性白质脑病等,它们均可合并有明显胶质细胞增生。
胶质瘤病分子水平的研究很少,分子水平改变还是很大的未知领域。
ChristianM报道,在胶质瘤病中存在P53的改变,但这并不是病情恶化的必要条件。
三临床表现临床表现为进行性颅内压增高和癫痫反复发作,同时伴有不同程度的智力与精神障碍。
其常见的症状依次为:皮质脊髓束受累占58%,智能减退或痴呆占44%,头痛占39%,癫痫发作占38%,脑神经损害占37%,颅内压增高占34%,脑脊液受累占33%。
四检查影像学检查示病变弥散,侵犯大脑半球2个或2个以上脑叶。
CT平扫病灶可呈高密度、低密度或等密度,病变边界欠清楚,同一病例不同病灶密度也可不相同。
病灶可强化或不强化,瘤周多有不同程度水肿。
脑胶质瘤的手术治疗解析1. 简介脑胶质瘤是一种起源于脑胶质细胞的神经系统恶性肿瘤,约占脑肿瘤的40%-50%。
由于其位置深藏于大脑内部,手术治疗一直是脑胶质瘤治疗的重要手段。
本文将对脑胶质瘤的手术治疗进行详细解析。
2. 手术治疗的目标脑胶质瘤手术治疗的主要目标是尽可能完整地切除肿瘤组织,同时保留神经功能,降低复发率,延长患者生存期。
手术治疗还可以为后续的放疗、化疗等综合治疗提供基础。
3. 手术治疗方法3.1 传统开颅手术传统开颅手术是目前治疗脑胶质瘤最常见的方法。
手术过程中,医生会在患者头部切开一个切口,然后利用显微镜和手术器械尽可能地切除肿瘤组织。
传统开颅手术的优点是肿瘤切除程度高,手术视野清晰,但缺点是手术创伤大,术后恢复时间长。
3.2 微创手术微创手术是近年来发展起来的一种新型手术方法,包括内镜辅助手术和机器人辅助手术。
微创手术的优点是手术创伤小,术后恢复快,但肿瘤切除程度相对较低。
3.3 术中导航术中导航是一种利用影像学技术(如MRI、CT等)在手术过程中实时显示肿瘤位置的方法,有助于医生更准确地切除肿瘤组织,降低术后复发率。
3.4 术中荧光术中荧光是一种利用特定染料使肿瘤组织在手术过程中发出荧光的方法,有助于医生更清晰地识别肿瘤组织,提高肿瘤切除程度。
4. 手术治疗的优势与挑战4.1 优势- 肿瘤切除程度高:手术治疗可以尽可能地切除肿瘤组织,降低术后复发风险。
- 保留神经功能:手术过程中,医生会尽量保护周围正常神经组织,降低神经功能障碍的发生。
- 延长生存期:手术治疗可以为后续的放疗、化疗等综合治疗提供基础,从而延长患者生存期。
4.2 挑战- 手术创伤:传统开颅手术创伤较大,术后恢复时间长。
- 术后并发症:手术治疗可能引发术后出血、感染等并发症。
- 复发风险:脑胶质瘤具有较高的复发率,手术治疗后仍需密切监测和综合治疗。
5. 总结手术治疗是脑胶质瘤治疗的重要手段,具有肿瘤切除程度高、保留神经功能、延长生存期等优势。
中国胶质瘤指南
胶质瘤的定义和分类
胶质瘤是一种常见的中枢神经系统肿瘤,由胶质细胞形成。
根据WHO(世界卫生组织)的分类,胶质瘤被分为四个等级,其中一级和两级为良性肿瘤,三级和四级为恶性肿瘤。
胶质瘤的症状和诊断
胶质瘤的症状包括头痛、晕厥、恶心和呕吐、精神失常等。
诊断胶质瘤需要进行脑部影像学检查,头部CT或MRI可用于确定嗜铬细胞瘤的病变位置和大小。
胶质瘤的治疗
目前针对胶质瘤的治疗包括手术切除、放疗和化疗等多种方法。
手术切除是目前胶质瘤治疗的首要选择,但由于胶质瘤的位置和大小不同,手术切除并不能完全去除瘤体。
放疗和化疗是在手术切除后进行的辅助治疗。
胶质瘤治疗中的综合护理
在胶质瘤治疗的过程中,同时进行综合护理可以有效缓解患者的痛苦。
综合护理包括饮食调理、药物治疗和心理治疗等,可以提高患者的生活质量和治疗效果。
在药物治疗方面,目前已经出现了很多针对胶质瘤的靶向药物,这些药物对提高治疗效果有明显的作用。
胶质瘤的预后和复发
胶质瘤的预后和复发与治疗的效果有很大关系。
良性肿瘤的预后较好,恶性肿瘤的预后则较差。
胶质瘤的复发率相对较高,需要密切的随访和治疗。
作为一种常见的神经系统肿瘤,胶质瘤的治疗和管理是一个十分复杂的过程。
综合护理和治疗仍然存在很大的发展空间,加强科研和临床实践有助于提高胶质瘤治疗的效果和预后,为患者带来更多的福音。
脑胶质瘤是一种神经胶质恶性度较高的肿瘤,不仅生长较快,而且沿神经组织的生长不规则,生活中一经发现要及时治疗。
对于脑胶质瘤晚期患者来说,在确诊病情后都希望尽快采取合理有效的措施,控制病情,缓解症状,争取更长的生存时间,但患者出现的不良症状也会引起家属的担心,害怕患者活不长了,如有的患者吐黑水、消瘦等,那脑胶质瘤晚期吐黑水消瘦能延长生命吗?脑胶质瘤晚期患者吐黑水,多是由于消化道出血造成的,因为胃里面有胃酸,鲜红的血跟胃酸作用后产生的硫酸亚铁会出现铁锈色,跟黑水一样。
脑胶质瘤患者消化道出血多是由于胃肠受到肿瘤的侵害,以及恶病质衰竭、消化道粘膜损伤等所致,此时一定要引起足够的重视,及时采取措施治疗,以免导致出血量加大会危及患者生命。
除了控制消化道出血的情况外,患者还应积极进行抗肿瘤的治疗,控制病情发展,缓解临床症状,尽可能的延长生存时间。
对于脑胶质瘤晚期的治疗,手术切除的几率很小,放化疗虽然能控制病情,抑制扩散转移,但也会产生一系列的副作用,而对于吐黑水、消瘦的患者来说往往很难耐受,因此越来越多的患者把目光转向了安全、副作用小的中医上来。
中医药学包含着中华民族几千年的健康养生理念及其实践经验,是中华文明的一个瑰宝,凝聚着中国人民和中华民族的博大智慧。
目前中医越来越多的参与到恶性肿瘤的治疗中,其抗癌功效也被日益认可,更得到了大量临床案例的证实。
中医治疗讲究以人为本,从患者整体出发,强调巩固元气、扶正固本,始终将扶正元气,提升病人机体免疫力放在治癌之首,提高及巩固患者免疫机能、体质,稳定脑胶质瘤内因,调整紊乱的内环境,维持机体免疫功能与肿瘤的对抗平衡,一方面控制病情,抑制扩散转移,一方面缓解患者不适症状,改善患者的饮食、睡眠、精神状况,增强患者体能,提高生存质量,延长生存时间。
对于脑胶质瘤患者来说,在确诊病情后要及时将中医纳入治疗方案中,维护身体的元气,增强抵抗力,才有助于控制肿瘤的生长,预防病情的恶化,出身中医世家的袁希福在12岁时,就在祖父指导下开始熟读《药性总论》、《本草备要》、《汤头歌诀》等中医名著。
脑神经胶质瘤简介:恶性星形细胞瘤可扩散至邻近或远离原发灶的脑组织,手术很难将肿瘤组织彻底切除,术后放疗的作用已较明确,化疗及生物调节剂等治疗的疗效尚不能肯定。
在不明显增加并发症的条件下,适形放疗等提高局控率的方法与全脑放疗及化疗等可能控制非局部病灶方法的有效配合,可能是今后发展的主要方向。
低度恶性星形细胞瘤的儿童病例若肿瘤未全部切除,术后放疗及化疗的疗效较明确。
中文名称:脑神经胶质瘤外文名称:Brain glioma病理分级标准:约60%为神经胶质瘤神经胶质瘤的分类小脑半球胶质瘤病理分级标准在原发性脑肿瘤中,约60%为神经胶质瘤。
WHO1997年的病理分级标准为①Ⅰ级:纤维型星形细胞瘤,好发年龄为8-13岁;②Ⅱ级:低度恶性星形细胞瘤(LGA),占所有神经胶质瘤的25%,好发年龄为30-40岁;③Ⅲ级:退变型星形细胞瘤(AA),易转化为Ⅳ级;④Ⅳ级:多形性胶质母细胞瘤(GBM),好发年龄为45-60岁。
恶性星形细胞瘤(MA)主要包括AA及GBM,其中GBM占50%-80%。
分类胶质瘤的分类方法有很多种,有人将儿童小脑半球胶质瘤、视神经胶质瘤归为良性胶质瘤。
目前临床上胶质瘤分类系统常用的有两种,即WHO分类系统和Kernoban分类系统(如下表)。
这两种分类系统都能简单明了的理解胶质瘤的恶性程度高低,但根据这两种分类仍不能准确判断胶质瘤患者的预后,因此这两种分类已不适应目前的临床治疗。
但基于分子病理基础上的新的胶质瘤分类尚未制定,目前还只能参照这两种分类,指导胶质瘤的综合治疗,相信不久的将来会有分子水平的病理分级是胶质瘤的诊断及治疗个体化。
星形细胞瘤Ⅰ-Ⅳ级室管膜瘤Ⅰ-Ⅳ级少突胶质瘤Ⅰ-Ⅳ级神经元-星形细胞瘤Ⅰ-Ⅳ级髓母细胞瘤Ⅰ-Ⅳ级预后因素成人低恶度胶质瘤全切除后五年生存率达80%,而在部分切除后为50%;高恶度胶质瘤全切后病人生存期也明显长于近全切除和部分切除的,并且有助于神经功能障碍的恢复。
幕上低级别(分化良好)星形细胞肿瘤的预后较好。
临床观察发现,低级别星形细胞肿瘤总体上讲预后良好,但它的预后也受多种因素的影响,如病人年龄大于40岁,术前有癫痫、肿瘤的病理类型、手术全切肿瘤能明显的延长病人的生存期。
丘脑或脑室肿瘤、肿瘤直径≥5cm,病人的生存率较低。
分化不良的星形细胞肿瘤预后差,90%的病人于确诊后二年内死亡,临床上对此类肿瘤治疗困难。
恶性星形细胞瘤中位生存期(MST)分别为18个月(Ⅲ级)及12个月(Ⅳ级);年龄50岁、KPS<70及智力异常者的MST<5个月。
对于年龄<50岁、KPS≥70的病例,胼胝体受侵与否的2年生存率分别为35%及56%。
纯AA与含少突神经胶质细胞成分的AA相比,MST分别为3年及7.3年,是否含少突神经胶质细胞成分为一独立的预后因素。
Curran等于1993年据年龄、病理为AA或GBM及智力状倘8个因素,提出预后的Ⅰ-Ⅵ分级,分级越高生存率越低。
GBM的5年生存率为5%-20%。
多因素分析提示对于GBM病例,年龄<40岁、KPS评分高、肿瘤位于额部及行根治术的预后较好,其MST为17个月;术后残瘤灶体积≤5ml病例的5年生存率为37%。
低度恶性星形细胞瘤纤维型星形细胞瘤常呈现增强影,其他类型则少见增强影;少突神经胶质瘤的预后较好,饲肥星形细胞瘤的预后较差;非纤维型LGA的5年生存率分别为10%-35%(单纯手术)及45%-60%(手术加放疗)。
多因素分析提示预后不良因素包括年龄较大、行为能力较差、CT检查有增强影及智力异常等,其中年龄<20岁及20-49岁病例的MST分别为226个月及106个月;年龄20-49岁的病例,若具两条或两条以上上述预后不良因素,则MST为41个月,反之则为139个月;若有因肿瘤压迫造成的症状,则行肿瘤切除术病例的MST明显长于行活检术的病例。
在复发病例中,45%-71%的病例被证实已恶化为MA。
放疗加速超分割放疗目前希望通过立体放疗外科(SRS)、插植放疗及超分割外放疗等方法,提高肿瘤组织的剂量或敏感性,降低或不增加正常组织的损伤。
SRS或插植放疗的条件为:患者的KPS>70、CT或MRI检查示单个边界清楚的增强病灶、最大直径分别为5cm(插植放疗)及4cm(SRS)、先行常规外放疗60Gy。
符合上述条件的病例单纯外放疗即可获得较好疗效,SRS及插植放疗作为首程治疗方法之一的疗效尚不明确,治疗后患者的MST为11-22个月。
对于MA,采用放疗增敏剂未能取得明确疗效。
对于已行肿瘤全部切除的GBM病例,采用卡波金(95%O2+5%CO2)及烟酰胺并行加速超分割放疗(150cGy,每日2次×4周)取得了一定疗效。
外放疗对于低度恶性星形细胞瘤,若肿瘤已行全部切除,通常不须再行放疗,10年无瘤生存率为80%-100%。
⒈设野:①由于复发大多发生在原发灶或接近原发灶的部位,故设野多主张包括增强影周围2cm-3cm的区域(全疗程)或先包括增强影及其周围水肿区后针对增强影区加量;也有的主张设野应适当放宽。
②Rudoler等报道LGA病例放疗后复发均发生在野内,但所报道的病例中有26%为全脑放疗。
⒉剂量:①目前明确的是在常规分割的情况下,对于MA,剂量越高生存期越长,总剂量应达60Gy以上;对于LGA,放疗剂量达54Gy(50Gy-60Gy)较好。
②对于脑干神经胶质瘤,超分割放疗可减小晚期并发症,局部剂量≤72Gy(100cGy,每日2次)与72Gy相比,MST差别不明显;对儿童患者,50.4Gy(180Gy,每日2次,中间间隔8小时)治疗的并发症虽可耐受,但疗效不明显。
72Gy(120cGy,每日2次)治疗后的并发症与60Gy(常规分割)治疗的相近[17],疗效也相近,预示比较两种分割方式疗效的Ⅲ期临床研究可能得出阴性结果。
加速超分割放疗剂量达48Gy或54.4Gy,两种剂量的疗效相近。
③对预后较差、经费较困难的恶性神经胶质瘤病例可行5.5周51Gy/17f(中间休息2周)的放疗;对预后较好的病例,应考虑分次量≥300cGy的晚期损伤反应较大,应降低分次剂量。
④适形放疗高剂量(90Gy)与低剂量(<90Gy)相比,局部复发率分别为23%及76%,而室管膜下种植转移率分别为41%及4%,两种剂量治疗的生存率因病例数较少而差别不显著。
SRSSRS可通过大的分次剂量控制外放疗后对放疗耐受的肿瘤组织。
SRS对上述Ⅰ-Ⅵ分级中的Ⅰ及Ⅲ-Ⅴ级病例有效。
放射治疗肿瘤学组(PTOG)正在针对年龄≥18岁、KPS≥60、术后残瘤灶直径≤4cm的脑幕上MA病例,比较外放疗(60Gy)及卡氮芥治疗之前作或不作SRS(15Gy-21Gy)治疗的疗效。
化疗脑神经胶质瘤的化疗具有以下特点:①瘤细胞可沿脑白质通道扩散至远离原发灶的脑组织,也可有室管膜下种植转移,但很少转移到中枢神经系统之外的组织。
②由于血脑屏障的影响,CT或MRI不能显示肿瘤的真实大小,化疗的疗效较难判定,例如部分缓解(PR)的标准为CT增强影缩小50%及糖皮质激素用量稳定或减少。
化疗经历了由辅助性到新辅助性的探索过程,但对于成人患者目前尚无一个明确的治疗方案。
MA⒈辅助性治疗:放疗完成后再行化疗。
①对于AA,PCV(甲基苄肼+CCNU+长春新碱)方案及BCNU化疗的MST分别为39个月及20个月;目前虽然PCV方案多用于AA,BCNU多用于GBM,但该两种治疗方案的疗效尚不明确。
②常规放疗同时合并羟基脲治疗,放疗后行6?硫代鸟嘌呤及BCNU治疗,可延长AA患者的生存期,疗效与PCV方案相近。
③经动脉化疗或高剂量化疗配合自体骨髓移植的尝试均未取得明显疗效。
⒉新辅助性治疗:①由于是先化疗后放疗,化疗的疗效较易判定。
BCNU+顺铂方案的PR为42%,3年及5年生存率分别为12%及5%,关于该方案与BCNU辅助性治疗方案疗效比较的Ⅲ期临床研究,目前尚未报道结果。
②对GBM病例,大剂量的紫杉醇治疗尚未能取得较好疗效。
③对于年龄<3岁的MA术后病例,环磷酰胺+长春新碱化疗的有效率为60%,3年生存率也较先放疗后化疗方案的报道高。
LGA因对化疗的敏感性较低及血脑屏障较完好等因素,化疗对LGA的疗效较小。
对于儿童病例,可先通过化疗使病灶缩小或不长大,待脑组织发育到较好程度后再考虑放疗。
①放线菌素D+长春新碱可使70%病例的放疗时间平均延后40个月。
②卡铂+长春新碱?或PCV+甲二溴卫矛醇+6-硫代鸟嘌呤的疗效也较好,目前正在比较该两种方案对年龄<5岁病例的疗效。
③对儿童脑干神经胶质瘤,尤其是弥漫型桥脑神经胶质瘤,化疗的有效率几乎为零。
干扰素治疗由于MA患者细胞中染色体9p的丢失,50%患者体内的α-干扰素(α-INF)或β-INF成分有异常,而INF可能对阻止星形细胞瘤由低度恶性向高度恶性转化较为重要。
①Dillman等报道MA的α-INF治疗可与放疗同时进行,其中α-INF 的用法为300万单位,每周3次,第3周开始改为每次500万单位,放疗剂量为5940cGy/33次,6-7周,INF共用16周,疗效欠明确,估计与其中行活检术病例较多有一定关系。
②Yoshida等报道,MA术后行放疗、嘧啶亚硝脲(ACNU)及β-INF综合治疗的疗效较好。
并发症状态检查目前在对估计预后较好的病例作治疗前后的智力低下状态检查(mini?mental statusexam,MMSE)及ADLS(activity of daily living scale)测定,以了解治疗后患者的神经精神反应及生活质量,明确结果尚未得出。
除了通常的放、化疗反应之外,脑神经胶质瘤治疗后具有一些较特殊的反应。
外放疗①急性反应不常见,主要与放疗所致的水肿反应有关,使用皮质类激素后症状可很快缓解。
②亚急性反应发生在放疗完成后数周至数月内,主要为放疗前已有神经症状或体征的加重,CT或MRI可显示短暂的脱髓鞘,通常症状较易好转。
③慢性反应发生在放疗完成后数月至数年,主要为智力或下丘脑及垂体功能障碍,影像学检查可显示弥散性脑组织损伤或坏死(但目前尚不能明确区分脑坏死、肿瘤坏死或复发)。
④非全脑性常规分割放疗54Gy后脑组织发生坏死的可能性小于1%,超过60Gy后随着剂量的加大,脑组织坏死的发生率明显增大。
高剂量适形放疗90Gy 后11%的病例发生放疗性坏死反应。
SRS及插植放疗:急性反应不常见且较轻,对病灶直径>3cm的病例行SRS治疗,发生急性反应的可能性较大;晚期反应(治疗后1个月以后)主要为因靶区内脑组织坏死或颅神经损伤所致的头痛、呕吐或象限盲视等症,CT检查可表现为增强影及水肿区扩大。
大多数行SRS或插植放疗的患者须较长期服用皮质类激素以减轻由于肿瘤周围水肿造成的治疗反应;生存期超过1年曾行SRS或插植放疗的病例,分别有38%及54%的病例须行再次手术以控制因治疗后脑组织坏死或肿瘤复发造成的症状。