河北省定州中学2018届高三化学下学期第一次月考试题
- 格式:doc
- 大小:420.50 KB
- 文档页数:10
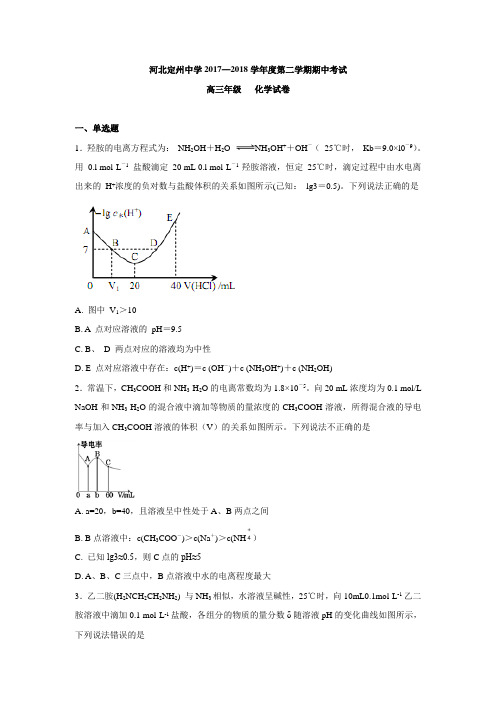
河北定州中学2017—2018学年度第二学期期中考试高三年级化学试卷一、单选题1.羟胺的电离方程式为:NH2OH+H2O NH3OH++OH-(25℃时,Kb=9.0×l0-9)。
用0.l mol·L-1盐酸滴定20 mL 0.l mol·L-1 羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。
下列说法正确的是A. 图中V1>10B. A 点对应溶液的pH=9.5C. B、D 两点对应的溶液均为中性D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)2.常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。
向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。
下列说法不正确的是A. a=20,b=40,且溶液呈中性处于A、B两点之间B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH)C. 已知lg3≈0.5,则C点的pH≈5D. A、B、C三点中,B点溶液中水的电离程度最大3.乙二胺(H2NCH2CH2NH2) 与NH3相似,水溶液呈碱性,25℃时,向10mL0.1mol·L-1乙二胺溶液中滴加0.1 mol·L-1盐酸,各组分的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是A. 混合溶液呈中性时,滴加盐酸的体积小于10mLB. K b2[H2NCH2CH2NH2] 的数量级为10-8C. a 点所处的溶液中:c(H+)+3c([H3NCH2CH2NH3]2+)=c(OH-) +(Cl-)D. 水的电离程度:a>b4.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg(OH-) 变化的关系如图所示。

河北定州中学2017—2018学年度第二学期期中考试高四年级化学试卷一、单选题1.下列实验操作和现象对应的结论错误的是选项实验操作和现象结论A向溶液X中滴加BaCl2溶液,有白色沉淀生成溶液X中可能含有SO32-B 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NOC 向1mL浓度均为0.05mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01mol·L-l AgNO3溶液,振荡,沉淀呈黄色Ksp(AgCl)<Ksp(AgI)D室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5HSO3-的电离程度大于其水解程度A. AB. BC. CD. D2.电动汽车在我国正迅猛发展,磷酸铁锂(LiFePO4)电池是电动汽车常用的一种电池,其工作原理如下图所示。
中间是聚合物的隔膜把正极与负极隔开,锂离子可以通过而电子不能通过。
该电池的总反应式是:LiFePO4+C6 Li1-x FePO4+ Li x C6 。
下列说法不正确...的是A. 放电时电子从A极通过导线流向B极B. 充电时Li+从A极区移向B极区C. 充电时B极电极反应式为:C6+xLi++xe-===Li x C6D. 放电时A极电极反应式为:Li1-x FePO4+ xLi++ xe-=== LiFePO43.下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确...的是实验①实验②实验③A. 实验①中生成的沉淀是BaCO3B. 实验①中有气体生成C. 实验②沉淀中可能含有BaSO4D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+4.A、 B、 C、 D 均为短周期主族元素,原子序数依次增大,其原子的最外层电子数之和为18, A 和C 同主族, B 原子的电子层数与最外层电子数相等,B、 C、 D 的单质均可与NaOH 溶液反应。

2018届高三化学下学期开学试卷(附答案河北定州中学)河北定州中学2017-2018学年第二学期高三化学开学考试一、单选题1.下列各组溶液中的各种溶质的物质的量浓度均为0.1mol/L。
①H2S溶液;②KHS溶液;③K2S溶液;④H2S 和KHS混合溶液。
下列说法正确的是A.溶液pH从大到小的顺序是:③②①④B.在KHS溶液中有:c(H+)+c(K+)=c(OH-)+c(HS-)+c(S2-)C.c(H2S)从大到小的顺序是:①④③②D.在H2S和KHS混合溶液中有:c(H2S)+c(HS-)+c(S2-)=2c(K+)2.下列实验设计或操作能达到实验目的的是A.除去乙酸乙酯中的乙酸:加入乙醇和浓硫酸,共热,使乙酸全部转化为乙酸乙酯B.液态溴乙烷中加入NaOH溶液共热几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验溴乙烷中含溴元素C.除去甲苯中的少量苯酚:加浓溴水,振荡、静置、过滤D.检验甲酸中是否混有乙醛:可向样品中加入足量稀NaOH溶液中和甲酸后,再做银镜反应实验3.已知H2X为二元弱酸,常温下,0.1mol/L的NaHX溶液中c(H+)c(OH-),下列关系中一定正确的是A.c(Na+)+c(H+)=c(HX-)+2c(X2-)B.c(H+)c(OH-)=10-14mol2L-2C.c(Na+)=c(X2-)+c(HX-)D.溶液中pH=14.“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。
其中没食子儿茶素(EGC)的结构如图所示。
关于EGC的下列说法中正确的是A.遇FeCl3溶液不发生显色反应B.1molEGC与4molNaOH恰好完全反应C.易发生氧化反应和取代反应,难发生加成反应D.分子中所有的原子共平面5.用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2molCuO,恰好恢复到电解前的浓度和pH。

河北省定州中学2018届高三化学下学期第一次月考试题(承智班)一、单选题1.中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2B. 电解池中质子从电极I向电极Ⅱ作定向移动C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-D. 每处理1 mol NO电解池质量减少16g2.25℃时,c mol·L—1CH3COOH 溶液加水稀释,溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。
下列说法不正确的是A. 由图可知,25℃时醋酸的 Ka=10-4.76B. c mol·L—1CH3COOH 溶液加水稀释中,α(CH3COOH)增大, c(CH3COOˉ)也一定增大C. 在pH=4.76 的溶液中通入HCl,α(CH3COOH)增大,α(CH3COOˉ)减小,α(CH3COOH)+α(CH3COOˉ)=1D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)3.肼(N2H4)和氧气的反应情况受温度影响。
某同学设计方案探究温度对产物影响的结果如图所示。
下列说法不正确的是A. 温度较低时,肼和氧气主要发生的反应N2H4+O2 = N2+2H2OB. 900℃时,能发生 N2+O2 = 2NOC. 900℃时, N2的产率与 NO 的产率之和可能小于 1D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验4.常温下,关于 pH 值相同的氨水和醋酸钠两种溶液,下列说法正确的是A. c(NH4+)=c(Na+)B. c(NH3·H2O)>c(CH3COONa)C. 两种溶液中水电离出的 c(H+)相等,且都大于 10ˉ7 mol·Lˉ1D. 该条件下,醋酸钠溶液的导电能力强于氨水5.将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。

河北省定州中学2018届高中化学毕业班上学期第一次调研试题(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(河北省定州中学2018届高中化学毕业班上学期第一次调研试题(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为河北省定州中学2018届高中化学毕业班上学期第一次调研试题(含解析)的全部内容。
高四第一学期第1次考试化学试题1. 某烃结构式如下:-C≡C-CH=CH-CH3,有关其结构说法正确的是:A。
所有原子可能在同一平面上 B. 所有原子可能在同一条直线上C. 所有碳原子可能在同一平面上 D。
所有氢原子可能在同一平面上【答案】C【解析】试题分析:具有苯环、乙烯的共面结构以及乙炔的共线结构,所以苯环的6个碳原子一定共面,具有乙烯结构的后4个碳原子一定共面,具有乙炔结构的两个碳原子一定共线,即所有的碳原子可以共面,但不共线。
答案选C。
【考点定位】本题主要是考查有机物共线共面问题判断【名师点晴】掌握常见有机物的结构是解答的关键,归纳如下:(1)甲烷,正四面体结构,碳原子居于正四面体的中心,分子中的5个原子中没有任何4个原子处于同一平面内。
其中任意三个原子在同一平面内,任意两个原子在同一直线上。
(2)乙烯,平面型结构,分子中的6个原子处于同一平面内,键角都约为120°。
(3)乙炔,直线型结构,分子中的4个原子处于同一直线上。
(4)苯,平面型结构,分子中的12个原子都处于同一平面.只要掌握好这些结构,借助碳碳单键可以旋转而碳碳双键和碳碳三键不能旋转的特点,以及立体几何知识,各种与此有关的题目均可迎刃而解。
2。

河北省定州中学2017-2018学年高一化学下学期第一次月考试题一、单选题1.下列叙述正确的是()A. O2分子间存在着非极性共价键B. CO2分子内存在着极性共价键C. SO2与H2O反应的产物是离子化合物D. 盐酸中含有H+和Cl-,故HCl为离子化合物2.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是()。
A. A>B>C>DB. D>B>A>CC. B>A>C>DD. C>A>B>D3.A、B、C、D、E均为周期表中的短周期元素,且原子序数依次增大。
A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。
已知A和C同主族,B和D同主族,C离子和B离子具有相同的电子层结构。
下列说法正确的是A. B离子半径小于C离子半径B. 五种元素中非金属性最强的是DC. 由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是ED. C的最高价氧化物的水化物中化学键类型为离子键和共价键4.X是VIA族元素,以下一些该元素组成的粒子的化学式中的n值不一定为2的是A. 阴离子:B. 氧化物: XO nC. 气态氢化物: HXD. 含氧酸HXO n 5.下列叙述中,正确的是A. 所有主族中都有非金属元素B. 同周期元素中,VIA族元素的原子半径最大C. 过渡元素都是金属元素D. VIA族元素的原子,其半径越大,越容易得到电子6.根据表中信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价A. 氢化物的稳定性为H2T<H2RB. 单质与稀盐酸反应的速率为L>QC. L与M 的最高价氧化物的水化物的碱性L<MD. L2+ 与R2-的核外电子数相等7.下列表达方式错误的是A. 碱性NaOH>Mg(OH)2>Al(OH)3B. 氟化钠的电子式C. 酸性HClO > H2SO4D. 碳-12原子126C8.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是A. 原子半径A>B>D>CB. 原子序数d>c>b>aC. 离子半径C>D>B>AD. 单质的还原性A>B>D>C9.短周期元素X、Y 在周期表中的相对位置如图所示,且己知Y基态原子的价电子层为ns n-1np n+1,下列说法不正确的是A. X元素的电负性大于Y的B. X元素的第一电离能大于Y的C. Y在周期表中位于第三周期第VIA族D. 原子半径:Mg<X10.长式周期表共有18 个纵行,从左到右排为1-18 列,即碱金属为第一列,稀有气体元素为第18列。
河北省定州中学2018届高三化学下学期第一次月考试题(承智班)一、单选题1.中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2B. 电解池中质子从电极I向电极Ⅱ作定向移动C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-D. 每处理1 mol NO电解池质量减少16g2.25℃时, c mol·L—1CH3COOH 溶液加水稀释,溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。
下列说法不正确的是A. 由图可知,25℃时醋酸的 Ka=10-4.76B. c mol·L—1CH3COOH 溶液加水稀释中,α(CH3COOH)增大, c(CH3COOˉ)也一定增大C. 在pH=4.76 的溶液中通入HCl,α(CH3COOH)增大,α(CH3COOˉ)减小,α(CH3COOH)+α(CH3COOˉ)=1D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)3.肼(N2H4)和氧气的反应情况受温度影响。
某同学设计方案探究温度对产物影响的结果如图所示。
下列说法不正确的是A. 温度较低时,肼和氧气主要发生的反应N2H4+O2 = N2+2H2OB. 900℃时,能发生 N2+O2 = 2NOC. 900℃时, N2的产率与 NO 的产率之和可能小于 1D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验4.常温下,关于 pH 值相同的氨水和醋酸钠两种溶液,下列说法正确的是A. c(NH4+)=c(Na+)B. c(NH3·H2O)>c(CH3COONa)C. 两种溶液中水电离出的 c(H+)相等,且都大于 10ˉ7 mol·Lˉ1D. 该条件下,醋酸钠溶液的导电能力强于氨水5.将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
定州中学2017-2018学年度高三承智班第一学期调研测试化学试卷1. 向含有下列离子的溶液中滴加NaCl 并通入足量SO 2气体后,溶液中还可能大量共存的离子组是( )A. K +、Fe 2+、SO 42--B. Ag +、H +、NO 3—C. NH 4+、Fe 3+、SO 42--D. Mg 2+、Ca 2+、HCO 3— 【答案】A【解析】 A. K +、Fe 2+、SO 42—与氯化钠以及SO 2等均不反应,可以大量共存,A 正确;B. Ag +与氯离子不能大量共存,H +、NO 3—与SO 2发生氧化还原反应,不能大量共存,B 错误;C. Fe 3+氧化SO 2不能大量共存,C 错误;D. HCO 3—与SO 2反应,不能大量共存,D 错误,答案选A 。
2. 下列解释实验过程或事实的反应方程式不正确的是A. 熔融烧碱时,不能使用普通石英坩埚:SiO 2+2NaOHNa 2SiO 3+H 2OB. 在海带灰的浸出液(含有I -)中滴加H 2O 2得到I 2:2I -+ H 2O 2+2H += I 2+O 2↑+2H 2OC. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H 2O(g)Fe 3O 4+4H 2D. “84消毒液”(有效成分NaClO )和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO -+ Cl -+ 2H += Cl 2↑+H 2O 【答案】B【解析】【详解】A. 熔融烧碱时,不能使用普通石英坩埚,因为二者反应:SiO 2+2NaOH Na 2SiO 3+H 2O ,A 正确; B. 在海带灰的浸出液(含有I -)中滴加H 2O 2得到I 2:2I -+H 2O 2+2H +=I 2 +2H 2O ,B 错误;C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层四氧化三铁:3Fe+4H 2OFe 3O 4 +4H 2,C 正确;D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用发生氧化还原反应放出氯气:ClO -+Cl -+2H +=Cl 2↑+H 2O ,D 正确;答案选B 。
河北定州中学2017-2018学年第二学期高三化学开学考试一、单选题1.某温度下,向一定体积0.1mol·的氨水中逐滴加入等浓度的盐酸,溶液中与pH的变化关系如下图所示。
下列说法不正确的是A. M点和N点溶液中的电离程度相同B. Q点溶液中,C. M点溶液的导电性小于Q点溶液的导电性D. N点溶液加水稀释,变小2.下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是选项离子组加入试剂加入试剂后发生反应的离子方程式A、、稀硫酸B、、氢氧化钠溶液C 、、氢氧化钠溶液D、、过量氢氧化钠溶液A. AB. BC. CD. D3.A 、B 、C 、D 、E 、F 、G 为七种短周期主族元素,原子序数依次增大。
已知:A 、F 的最外层电子数分别等于各自的电子层数,其中A 的单质在常温下为气体。
C 与B 、G 在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。
D 与F 同周期,且在该周期中D 元素的原子半径最大。
下列说法不正确的是()A. C 、D 、G 三种元素形成的盐,水溶液可能呈碱性B. A 、B 、C 三种元素间既能形成共价化合物,又能形成离子化合物C. B 、C 、G 的简单氢化物中C 的氢化物稳定性最强D. D 、E 、F 、G 形成的简单离子半径逐渐减小4.向体积均为10 mL 、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO 2,得到溶液甲和乙。
向甲、乙两溶液中分别滴加0.1mol/L 的盐酸,此时反应生成CO 2体积(标准状况)与所加盐酸体积的关系如图所示。
则下列叙述中不正确的是A. 原NaOH 溶液的物质的量浓度为0.5 mol/LB. 当0盐酸)<10 mL 时,甲溶液中发生反应的离子方程式为H ++CO 32-=HCO 3-C. 乙溶液中含有的溶质是Na 2CO 3、NaOHD. 向乙溶液中滴加过量盐酸后产生CO 2体积的最大值为224 mL 5.常温下,向10mL0.1mol ·-1L 的HA 溶液中逐滴滴入0.1mol ·-1L 的ROH 溶液,所得溶液pH 及导电能力的变化如图,下列判断正确的是A. ROH 在溶液中的电离方程式为ROH===R OH B. c 点由2H O 电离出的OH 浓度最小C. b 点存在:1R HA 0.05L c c mol。
河北省定州中学2018届高三化学下学期第一次月考试题一、单选题1.下列实验操作对应的实验现象及解释或结论不正确的是A. AB. BC. CD. D2.某离子反应中共有 H2O、ClO-、NH4 +、H+、N2、Cl-六种微粒。
其中 c(ClO-)随反应进行逐渐减小。
下列判断错误的是A. 该反应的还原剂是NH4+B. 反应后溶液酸性明显增强C. 若消耗 1 mol 氧化剂,可转移 2 mol e-D. 该反应中氧化剂与还原剂的物质的量之比是 2:33.常温下,下列溶液中的微粒浓度关系不正确...的是A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4) 4.网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。
在辛酸的同分异构体中,含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除外,还有A. 7种B. 11种C. 14种D. 17种5.位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁) > r(乙) > r(丙) > r(甲)。
四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。
据此推断,下述正确的是A. 丙的简单氢化物分子内存在氢键B. 由甲、乙两元素组成的化合物中,只含有极性键C. 由甲和丙两元素组成的分子不止一种D. 乙和丁两元素的最高价氧化物的水化物之间能发生反应6.设N A为阿伏加德罗常数,下列有关说法正确的是A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为N AB.标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3N AC. 过量铜与含0.4 mol HNO3的浓硝酸反应,电子转移数大于0.2N AD. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 N A7.实验室测定已部分变质的过氧化钠样品纯度的装置如图所示(Q为弹性良好的气球不与药品反应,取定量的样品放入其中)。
河北省定州中学2018届高三化学下学期第一次月考试题
一、单选题
1.下列实验操作对应的实验现象及解释或结论不正确的是
A. A
B. B
C. C
D. D
2.某离子反应中共有 H2O、ClO-、NH4 +、H+、N2、Cl-六种微粒。
其中 c(ClO-)随反应进行逐渐减小。
下列判断错误的是
A. 该反应的还原剂是NH4+
B. 反应后溶液酸性明显增强
C. 若消耗 1 mol 氧化剂,可转移 2 mol e-
D. 该反应中氧化剂与还原剂的物质的量之比是 2:3
3.常温下,下列溶液中的微粒浓度关系不正确
...的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)
=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4) 4.网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。
在辛酸的同分异构体中,含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除
外,还有
A. 7种
B. 11种
C. 14种
D. 17种
5.位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁) > r(乙) > r(丙) > r(甲)。
四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。
据此推断,下述正确的是
A. 丙的简单氢化物分子内存在氢键
B. 由甲、乙两元素组成的化合物中,只含有极性键
C. 由甲和丙两元素组成的分子不止一种
D. 乙和丁两元素的最高价氧化物的水化物之间能发生反应
6.设N A为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为N A
B.标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3N A
C. 过量铜与含0.4 mol HNO3的浓硝酸反应,电子转移数大于0.2N A
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 N A
7.实验室测定已部分变质的过氧化钠样品纯度的装置如图所示(Q为弹性良好的气球不与药品反应,取定量的样品放入其中)。
按图示安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。
下列说法中不正确的是。