常见的离子符号,化学式
- 格式:ppt
- 大小:157.00 KB
- 文档页数:9

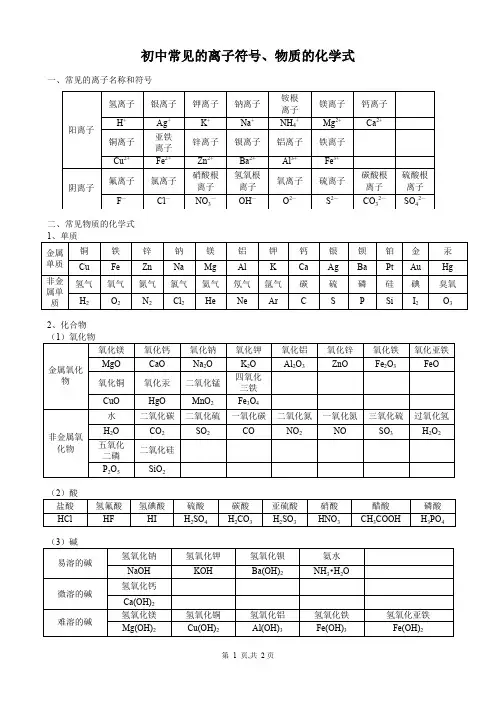
常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物1氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO 2酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 3碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:MgOH2氢氧化钙:CaOH2氢氧化铝:AlOH3氢氧化亚铁:FeOH2氢氧化铁:FeOH3氢氧化铜:CuOH24盐部分氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:AlNO33 硫酸铝:Al2SO43氯化亚铁:Fe Cl2硝酸亚铁:FeNO32 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:FeNO33 硫酸铁:Fe2SO43氯化镁:MgCl2 硝酸镁:MgNO32 硫酸镁:MgSO4 碳酸镁:MgCO3氯化钙:CaCl2 硝酸钙:CaNO32 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:ZnNO32硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:CuNO32 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:BaNO32 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:NH42SO4 碳酸铵:NH42CO3高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:1某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……2非金属气体单质:如H2、O2、N2、Cl2、O3 ……3稀有气体特殊的单原子分子:如He、Ne、Ar ……4酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:1金属单质:如Hg、Fe、Mg……2某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:1盐:如NaCl、KCl、MgCl2、CuSO4……2碱:如NaOH KOH ……。

五大原子团离子符号
五大原子团离子是指在化学中比较常见的由多个原子团组成的离子,它们分别是氨基离子(NH₂⁻)、碳酸根离子(CO₃²⁻)、硫酸根离子(SO₄²⁻)、磷酸根离子(PO₄³⁻)和氢氧根离子(OH⁻)。
氨基离子的化学式为NH₂⁻,由一个氮原子和两个氢原子组成。
它带有一个负电荷,在水中会与阳离子配对形成盐类。
碳酸根离子的化学式为CO₃²⁻,由一个碳原子和三个氧原子组成。
它带有两个负电荷,常见于碳酸盐类中,如钙碳酸、镁碳酸等。
硫酸根离子的化学式为SO₄²⁻,由一个硫原子和四个氧原子组成。
它带有两个负电荷,是一种广泛存在于矿物和生物体中的物质。
磷酸根离子的化学式为PO₄³⁻,由一个磷原子和四个氧原子组成。
它带有三个负电荷,在生物体中广泛存在,如骨骼、DNA、RNA等中。
氢氧根离子的化学式为OH⁻,由一个氧原子和一个氢原子组成。
它带有一个负电荷,在水中广泛存在,是碱性的化合物。
以上五大原子团离子在化学中都有着重要的应用,对于理解相关的物
理和化学现象具有至关重要的作用。
同时,它们也广泛应用于人类社
会中,如生产、医疗、环保等领域。
熟练掌握这些离子的性质和应用,是现代化学工作者的必备技能。


初中化学离子符号及化学用语的含义常见离子名称和符号:氢离子:H+;钠离子:Na+;钾离子:K+;银离子:Ag+;铵根离子:NH4+;镁离子:Mg2+;钙离子:Ca2+;铜离子:Cu2+;亚铁离子:Fe2+;钡离子:Ba2+;锌离子:Zn2+;铝离子:A13+;铁离子:Fe3+;氯离子:C1-;氟离子:F-;氢氧根离子:OH-;硝酸根离子:NO3-碳酸根离子:CO32-;硫酸根离子:SO42-;硫离子:S2-;氧离子:O2-化学用语的含义:一、元素符号、化学式、离子符号前面..的数字表示几个某原子或几个某分子或几个某离子:例:下列符号中“2”所表示的含义:2SO3:表示2个三氧化二硫分子2H:表示2个氢原子2.SO42-:表示2个硫酸根离子二、元素符号右下角...的数字表示一个某分子中含几个某原子:例:下列符号中“2”的含义:SO2:表示一个二氧化硫分子中含有2个氧原子H2:表示一个氢气分子中含有2个氢原子三、元素符号右上角...的数字表示某离子带几个单位正(负)电荷(数字先写,正负号后写,1可省略)如H-、NO3-:例:下列符号中“2”的含义:CO32-:表示碳酸根离子带2个单位负电荷Ca2+:表示钙离子带2个单位正电荷SO42-:表示硫酸根离子带2个单位负电荷四、元素符号正上方...的数字表示某物质中某元素的化合价(正负号先写,数字后写,1不能省略);+1 -2如: H2O; H2SO4;例:下列符号中“2”的含义:+2CuSO4:表示硫酸铜中铜元素的化合价为+2价-2CO:表示一氧化碳中氧元素的化合价为-2价+2BaCO3:表示碳酸钡中钡元素的化合价为+2价。

常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物(1)氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO (2)酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 (3)碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3氢氧化铜:Cu(OH)2(4)盐(部分)氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:Al(NO3)3 硫酸铝:Al2(SO4)3氯化亚铁:Fe Cl2硝酸亚铁:Fe(NO3)2 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:Fe(NO3)3 硫酸铁:Fe2(SO4)3氯化镁:MgCl2 硝酸镁:Mg(NO3)2 硫酸镁:MgSO4 碳酸镁:MgCO3 氯化钙:CaCl2 硝酸钙:Ca(NO3)2 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:Zn(NO3)2硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:Cu(NO3)2 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:Ba(NO3)2 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4 )2SO4 碳酸铵:(NH4)2CO3 高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:(1)某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……(2)非金属气体单质:如H2、O2、N2、Cl2、O3 ……(3)稀有气体(特殊的单原子分子):如He、Ne、Ar ……(4)酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:(1)金属单质:如Hg、Fe、Mg……(2)某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:(1)盐:如NaCl、KCl、MgCl2、CuSO4……(2)碱:如NaOH KOH ……。
![常见的离子符号,化学式[优质PPT]](https://uimg.taocdn.com/10046b52dd36a32d7275812a.webp)

初中常见离子符号、化学式和化学方程式(初二部分)常见的离子符号常见的金属离子:1、带一个单位正电荷的锂离子:Li+钾离子:K+钠离子:Na+银离子:Ag+亚铜离子:Cu+2、带两个单位正电荷的钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+锌离子:Zn2+亚铁离子:Fe2+铜离子:Cu2+3、带三个单位正电荷的铁离子:Fe3+ 铝离子:Al3+常见的非金属离子:1、带一个单位负电荷的氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—2、带两个单位负电荷的硫离子:S2—氧离子O2—3、带一个单位正电荷的氢离子:H+常见的原子团:(也叫酸根离子,NH4+除外)硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—锰酸根离子:MnO42—铵根离子:NH4+说明:带正电荷的叫阳离子(如金属离子)带负电荷的叫阴离子(如常见的非金属离子和常见的原子团。
H+和NH4+除外。
)1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S的化合价为—23、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是+的整体化合价是+1,这其组成元素所表现化合价的代数和。
例如,铵根离子NH4是由于其中N显—3价,H显+1价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
常见的化学式常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P+5O2 2P2O52、氢气在空气中燃烧生成水:2H2+O22H2O3、硫磺在空气(或氧气)中燃烧:S+O2SO24、镁条在空气(或氧气)中燃烧:2Mg+O22MgO5、铁丝在氧气中燃烧:3Fe+2O2Fe3O46、木炭在空气(或氧气)中完全燃烧:C+O2 CO27、木炭不充分燃烧:2C+O22CO8、一氧化碳燃烧:2CO+O2 2CO29、二氧化碳和水反应生成碳酸:CO2+H2O ==H2CO310、二氧化碳通过灼热的炭层:CO2+C 2CO 二、分解反应11、高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑12、氯酸钾制氧气:2KClO32KCl+3O2↑13、双氧水制氧气:2H2O22H2O + O2↑14、电解水:2H2O 2H2↑+ O2↑15、碳酸分解:H2CO3H2O+CO2↑16、高温煅烧石灰石:CaCO3 CaO +CO2↑三、其他反应类型17、石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl =CaCl2+H2O+CO2点燃点燃点燃点燃点燃点燃点燃高温点燃△MnO2△MnO2通电高温18、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓19、二氧化碳通入澄清石灰水中:CO2+Ca(OH)2== CaCO3↓+H2O20、氢氧化钠吸收二氧化碳:CO2+2NaOH=Na2CO3+H2O21、氢氧化钠溶液吸收二氧化硫:SO2+ 2NaOH==Na2SO3+H2O22、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O23、甲烷燃烧:CH4 + 2O2CO2+ 2H2O点燃点燃。

常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物(1)氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO (2)酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 (3)碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3氢氧化铜:Cu(OH)2(4)盐(部分)氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:Al(NO3)3 硫酸铝:Al2(SO4)3氯化亚铁:Fe Cl2硝酸亚铁:Fe(NO3)2 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:Fe(NO3)3 硫酸铁:Fe2(SO4)3氯化镁:MgCl2 硝酸镁:Mg(NO3)2 硫酸镁:MgSO4 碳酸镁:MgCO3 氯化钙:CaCl2 硝酸钙:Ca(NO3)2 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:Zn(NO3)2硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:Cu(NO3)2 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:Ba(NO3)2 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4 )2SO4 碳酸铵:(NH4)2CO3 高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:(1)某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……(2)非金属气体单质:如H2、O2、N2、Cl2、O3 ……(3)稀有气体(特殊的单原子分子):如He、Ne、Ar ……(4)酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:(1)金属单质:如Hg、Fe、Mg……(2)某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:(1)盐:如NaCl、KCl、MgCl2、CuSO4……(2)碱:如NaOH KOH ……。

初中罕见离子符号、化学式和化学方程式(初二部分)之袁州冬雪创作罕见的离子符号罕见的金属离子:1、带一个单位正电荷的锂离子:Li+钾离子:K+钠离子:Na+银离子:Ag+亚铜离子:Cu+2、带两个单位正电荷的钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+锌离子:Zn2+亚铁离子:Fe2+铜离子:Cu2+3、带三个单位正电荷的铁离子:Fe3+ 铝离子:Al3+罕见的非金属离子:1、带一个单位负电荷的氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—2、带两个单位负电荷的硫离子:S2—氧离子 O2—3、带一个单位正电荷的氢离子:H+罕见的原子团:(也叫酸根离子,NH4+除外)硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子 ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—锰酸根离子:MnO42—铵根离子:NH4+说明:带正电荷的叫阳离子(如金属离子)带负电荷的叫阴离子(如罕见的非金属离子和罕见的原子团.H+和NH4+除外.)1、离子不成单独存在,有阴离子存在必定有阳离子,由阴阳离子构成的物质是离子化合物.2、离子所带的电荷数与其在化合物中元素表示的化合价数值和正负均一致.例如,硫离子S2—中S的化合价为—23、离子团所带的电荷数与其整体表示化合价数值和正负一致,其整体化合价是其组成元素所表示化合价的代数和.例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决议的.常常使用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零.负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根.罕见的化学式一、罕见单质(可以参考讲义后面的元素周期表)二、化合物1、氧化物2、其他化合物3、罕见有机化合物➢罕见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P+5O 2 2P 2O 52、氢气在空气中燃烧生成水:2H 2+O 2 2H 2O点燃点燃点燃3、硫磺在空气(或氧气)中燃烧:S+O 2SO 24、镁条在空气(或氧气)中燃烧:2Mg+O 2 2MgO5、铁丝在氧气中燃烧:3Fe+2O 2Fe 3O 46、柴炭在空气(或氧气)中完全燃烧:C+O 2 CO 27、柴炭不充分燃烧:2C+O 22CO8、一氧化碳燃烧:2CO+O 2 2CO 29、二氧化碳和水反应生成碳酸:CO 2+H 2O ==H 2CO 310、二氧化碳通过灼热的炭层:CO 2+C 2CO 二、分解反应11、高锰酸钾制氧气:2KMnO 4K 2MnO 4+MnO 2+O 2↑12、氯酸钾制氧气:2KClO 32KCl+3O 2↑13、双氧水制氧气:2H 2O 2 2H 2O + O 2↑14、电解水:2H 2O 2H 2↑+ O 2↑ 15、碳酸分解:H 2CO 3 H 2O+CO 2↑16、高温煅烧石灰石:CaCO 3 CaO +CO 2↑ 三、其他反应类型17、石灰石与稀盐酸反应制取二氧化碳:CaCO 3+2HCl =CaCl 2+H 2O+CO 218、硫酸铜溶液和氢氧化钠溶液反应:CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓ 19、二氧化碳通入澄清石灰水中:CO 2+Ca(OH)2== CaCO 3↓+H 2O点燃点燃点燃点燃高温点燃△MnO 2△MnO 2通电高温20、氢氧化钠吸收二氧化碳:CO 2+2NaOH=Na 2CO 3+H 2O 21、氢氧化钠溶液吸收二氧化硫:SO 2+ 2NaOH==Na 2SO 3+H 2O22、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O23、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O点燃点燃。

常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物(1)氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO (2)酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 (3)碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3氢氧化铜:Cu(OH)2(4)盐(部分)氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:Al(NO3)3 硫酸铝:Al2(SO4)3氯化亚铁:Fe Cl2硝酸亚铁:Fe(NO3)2 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:Fe(NO3)3 硫酸铁:Fe2(SO4)3氯化镁:MgCl2 硝酸镁:Mg(NO3)2 硫酸镁:MgSO4 碳酸镁:MgCO3 氯化钙:CaCl2 硝酸钙:Ca(NO3)2 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:Zn(NO3)2硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:Cu(NO3)2 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:Ba(NO3)2 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4 )2SO4 碳酸铵:(NH4)2CO3 高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:(1)某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……(2)非金属气体单质:如H2、O2、N2、Cl2、O3 ……(3)稀有气体(特殊的单原子分子):如He、Ne、Ar ……(4)酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:(1)金属单质:如Hg、Fe、Mg……(2)某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:(1)盐:如NaCl、KCl、MgCl2、CuSO4……(2)碱:如NaOH KOH ……。
前20号离子符号的书写
离子是带电荷的原子或分子,它们通过失去或获得电子而带正或负电荷。
在化学中,我们通常用符号表示离子,其中正离子用带有正号的符号表示,负离子用带有负号的符号表示。
以下是前20个元素的一些常见离子的符号:
1.氢离子:H⁺
2.氦没有常见的离子形式。
3.锂离子:Li⁺
4.铍离子:Be²⁺
5.氮离子:B³⁺
6.碳没有常见的离子形式。
7.氮离子:N³⁻
8.氧离子:O²⁻
9.氟离子:F⁻
10.氖没有常见的离子形式。
11.钠离子:Na⁺
12.镁离子:Mg²⁺
13.铝离子:Al³⁺
14.硅没有常见的离子形式。
15.磷离子:P³⁻
16.硫离子:S²⁻
17.氯离子:Cl⁻
18.钾离子:K⁺
19.钙离子:Ca²⁺
20.钛没有常见的离子形式。
这些是前20个元素的一些典型离子。
请注意,这里仅列出了一些常见的离子形式,有些元素在常见情况下并不形成离子。
此外,元素的离子形式可能因化合物的不同而有所不同。
常见的元素符号:氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,H He Li Be B C N O F He Na Mg Al Si P硫氯氩钾钙, 锰铁铜锌银,钡铂金汞碘S Cl Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I常见元素的化合价:钾钠银氢+1价, 氟氯溴碘-1价, 钙镁钡锌汞+2价,正一亚铜,正二铜,正二亚铁,正三铁,+3铝来+4硅,单质零价永不变,氧硫负二要记住。
碳酸根、硫酸根负二价,硝酸根、氢氧根负一价,只有铵根正一价。
单质的化学式:化合物的化学式:氧化物:一氧化碳CO , 二氧化碳CO2, 五氧化二磷P2O5二氧化硫SO2, 二氧化锰MnO2 , 三氧化二铁Fe2O3 , 氧化亚铁FeO , 四氧化三铁Fe3O4 , 氧化镁MgO , 氧化钙CaO , 三氧化二铝Al2O3氧化汞HgO , 氧化铜CuO酸:盐酸HCl 硫酸H2SO4硝酸HNO3碳酸H2CO3磷酸H3PO4碱:氢氧化钠NaOH , 氢氧化钙Ca(OH)2, 氢氧化钡Ba(OH)2氢氧化钾KOH , 氢氧化铁(红褐色)Fe(OH)3氢氧化铜(蓝色)Cu(OH)2, 氢氧化镁(白色)Mg(OH)2盐:盐酸盐:氯化钠NaCl , 氯化镁MgCl2, 氯化铝AlCl3氯化钾KCl , 氯化铁FeCl3, 氯化亚铁FeCl2, 氯化锌ZnCl2氯化钡BaCl2, 氯化铜CuCl2, 氯化银AgCl 碳酸盐:碳酸钙CaCO3, 碳酸钠Na2CO3, 碳酸钾K2CO3碳酸钡BaCO3硫酸盐: 硫酸亚铁FeSO4, 硫酸铁Fe2(SO4)3, 硫酸钠Na2SO4硫酸镁MgSO4, 硫酸铝Al2(SO4)3, 硫酸铜CuSO4硫酸锌ZnSO4, 硫酸钡BaSO4硝酸盐:硝酸银AgNO3硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2硝酸钡Ba(NO3)2硝酸铝Al(NO3)3硝酸铁Fe(NO3)3硝酸铜Cu(NO3)2硝酸钙Ca(NO3)2常见的离子:钾离子K+,钠离子Na+,银离子Ag+,氢离子H+ ,氟离子F-,氯离子Cl-,钙离子Ca2+,镁离子Mg2+, 钡离子Ba2+ , 锌离子Zn2+,汞离子Hg2+,铜离子Cu2+,亚铁离子Fe2+ , 铁离子Fe3+,铝离子Al3+,氧离子O2-, 硫离子S2-,碳酸跟离子CO32-, 硫酸根离子SO42- , 硝酸根离子NO3-氢氧根离子OH- , 铵根离子NH4+, 磷酸根离子PO43-化学方程式一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、铜在空气中受热:2Cu+ O2加热 2CuO5、氢气在空气中燃烧:2H2 +O2点燃 2H2O6、红磷在空气中燃烧:4P +5O2点燃 2P2O57、硫粉在空气中燃烧: S+ O2点燃 SO28、碳在氧气中充分燃烧:C +O2 点燃 CO2二、分解反应1、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑2、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑3、加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+3O2↑4、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑。
初中常见离子符号化学式和化学方程式化学式是指用元素符号和数字的组合表示物质组成的式子。
每种纯净物质的组成是固定不变的,所以表示每种物质组成的'化学式只有一个。
以下是店铺为大家整理的初中常见离子符号化学式和化学方程式,仅供参考,希望能够帮助大家。
1、带一个单位正电荷的锂离子:Li+ 钾离子:K+ 钠离子:Na+ 银离子:Ag+ 亚铜离子:Cu+2、带两个单位正电荷的钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铁离子:Fe2+ 铜离子:Cu2+3、带三个单位正电荷的铁离子:Fe3+铝离子:Al3+ 常见的非金属离子:1、带一个单位负电荷的氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I— 2、带两个单位负电荷的——硫离子:S2 氧离子 O2 3、带一个单位正电荷的氢离子:H+常见的原子团:(也叫酸根离子,NH4+除外)硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子 ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—锰酸根离子:MnO42—铵根离子:NH4+ 说明:带正电荷的叫阳离子(如金属离子)带负电荷的叫阴离子(如常见的非金属离子和常见的原子团。
H+和NH4+除外。
)1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S的化合价为—23、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
化学常用化学式化学是一门探究物质组成、性质及其变化的科学。
在化学中,化学式是非常重要的概念,它是用来描述化学物质组成的符号表示法。
化学式可以分为分子式和离子式两种,其中分子式用来表示分子中各种原子的种类和数量,离子式则用来表示离子中阳离子和阴离子的种类和数量。
本文将详细介绍常用的化学式及其应用。
一、常用离子式1.氢离子:H+氢离子是最简单的离子,由一个质子和一个电子组成。
它在化学反应中起着重要作用,例如酸碱中和反应、水解反应等。
2.氢氧根离子:OH-氢氧根离子是一种强碱性离子,在水中存在的浓度可以决定水的酸碱性质。
它是许多化学反应的重要参与者,如酸碱反应、酯化反应、烷基化反应等。
3.氯离子:Cl-氯离子是一种常见的阴离子,具有强氧化性。
它在水中的存在可以影响水的味道和气味,同时也是许多化学反应的重要参与者,如氯化反应、溴化反应等。
4.铵离子:NH4+铵离子是由氨基和氢离子组成的阳离子,在化学反应中起着重要作用。
它可以和许多阴离子形成盐类,如氯化铵、硫酸铵等。
5.氧化铁离子:Fe2+/Fe3+氧化铁离子是由铁原子和氧原子组成的离子,可以存在于两种不同的价态:二价的Fe2+和三价的Fe3+。
它们在许多化学反应中起着重要作用,如氧化还原反应、催化反应等。
二、常用分子式1.水:H2O水是一种无色、无味、无臭的液体,是地球上最常见的物质之一。
它的分子式为H2O,由两个氢原子和一个氧原子组成。
水在生物体内起着重要的作用,如溶解物质、维持体温等。
2.二氧化碳:CO2二氧化碳是一种无色、无味、无臭的气体,它的分子式为CO2,由一个碳原子和两个氧原子组成。
二氧化碳在地球大气中起着重要作用,它可以吸收太阳辐射,同时也是植物进行光合作用的重要原料。
3.甲烷:CH4甲烷是一种无色、无味、无臭的气体,它的分子式为CH4,由一个碳原子和四个氢原子组成。
甲烷是一种重要的燃料,可以用于燃气灶、汽车发动机等。
4.氧气:O2氧气是一种无色、无味、无臭的气体,它的分子式为O2,由两个氧原子组成。