热力学第二定律统计意义
- 格式:ppt
- 大小:524.00 KB
- 文档页数:23

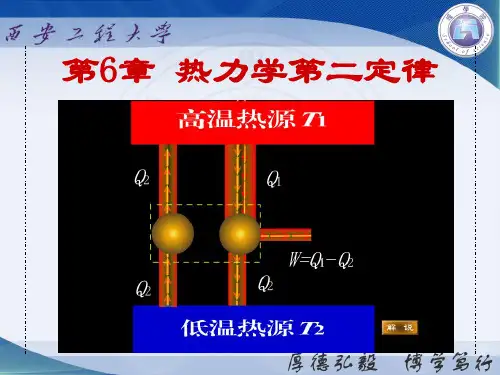


热力学第二定律为什么可能有多种表述作者:曹良腾罗来辉来源:《物理教学探讨》2008年第09期人教社2000年全日制高中教材《物理》(第二册)说“热力学第二定律有多种表达”,这是为什么呢?本文进行讨论。
1 从定律实质看大家知道,热力学第二定律的实质,在于指出一切与热现象有关的实际宏观过程都是不可逆的。
而大家也知道,自然界的各种不可逆过程都有是互相联系的,如热力学第二定律表达(定性)中,通常采用的克氏和开氏两种表达是完全等效的。
又如,由气体自由膨胀的不可逆性可以导出功变热过程的不可逆,如此等等。
原则上讲,任何一种不可逆的宏观热现象过程均可作为热力学第二定律的表述,因此热力学第二定律的表述可能有多种。
2 从定律的统计意义看大家也知道,热力学第二律的统计意义为:一个不受外界影响的“孤立系统”,其内部发生的过程,总是由几率小的状态向几率大的状态进行,由包含微观状态数目少的宏观状态向包含微观状态数目多的宏观状态进行。
而系统的一切热现象所含过程可能不止一种,而每一过程均满足上述条件,其中任一过程皆可用以判定过程进行的方向,而且可达到与热力学第二定律相同的结果,因此用作热力学第二定律的表述当然可能有多种。
如一杯清水中滴入几滴温度不同的墨水,该系统用绝热材料包起来构成一绝热系统。
由于分子运动,其中至少有三个过程:由于墨水粒子不均匀要产生扩散;分子间相互碰撞要作功;粒子间温度不同要产生热传导等。
显然每个过程均可判定过程进行的方向。
由此可以看到:为什么热力学系统不可以只由少数粒子(分子、原子等)组成。
3 为什么热力学第二定律表述(定性)只用“克氏说法”和“开氏说法”两种?根据上面的讨论,定律的表述可能会有很多种,但为什么通常看定律的表述(定性)只有“克氏说法”和“开氏说法”两种?应该怎样解释呢?因为在1850年克劳修斯最早在《物理学与化学年鉴》上发表了《论热的动力及由此推出的关于热本质定律》的文章,该文扬弃了热质说的错误,最先建立了热力学第二定律;W.汤姆逊(1892年被封为开尔文爵士后易名开尔文)于1851年连续在《爱丁堡皇家学会会刊》上发表了三篇文章,对热力学第二定律的研究比克劳修斯论述更明确,把对热力学第二定律的研究引向深入,因此科学界通用上述两人的表述作为热力学第二定律表述(定性)而不再利用其它不可逆过程作为热力学第二定律的定性表述,它并不是说热现象不可逆过程只有“克氏说法”和“开氏说法”两种。



物理热力学第二定律知识点整理归纳物理热力学第二定律知识点整理归纳物理是高中生学好高中的重要组成部分,学好直接影响着高中三年的成绩。
下面是店铺收集整理的物理热力学第二定律知识点整理归纳,希望大家喜欢!一、热力学第二定律建立的历史过程19世纪初,巴本、纽可门等发明的蒸汽机经过许多人特别是瓦特的重大改进,已广泛应用于工厂、矿山、交通运输,但当时人们对蒸汽机的理论研究还是非常缺乏的。
热力学第二定律就是在研究如何提高热机效率问题的推动下,逐步被发现的,并用于解决与热现象有关的过程进行方向的问题。
1824年,法国陆军工程师卡诺在他发表的论文论火的动力中提出了著名的卡诺定理,找到了提高热机效率的根本途径。
但卡诺在当时是采用热质说的错误观点来研究问题的。
从1840年到1847年间,在迈尔、焦耳、亥姆霍兹等人的努力下,热力学第一定律以及更普遍的能量守恒定律建立起来了。
热动说的正确观点也普遍为人们所接受。
1848年,开尔文爵士(威廉汤姆生)根据卡诺定理,建立了热力学温标(绝对温标)。
它完全不依赖于任何特殊物质的物理特性,从理论上解决了各种经验温标不相一致的缺点。
这些为热力学第二定律的建立准备了条件。
1850年,克劳修斯从热动说出发重新审查了卡诺的工作,考虑到热传导总是自发地将热量从高温物体传给低温物体这一事实,得出了热力学第二定律的初次表述。
后来历经多次简练和修改,逐渐演变为现行物理教科书中公认的克劳修斯表述。
与此同时,开尔文也独立地从卡诺的工作中得出了热力学第二定律的另一种表述,后来演变为更精炼的现行物理教科书中公认的开尔文表述。
上述对热力学第二定律的两种表述是等价的,由一种表述的正确性完全可以推导出另一种表述的正确性。
二、热力学第二定律的实质1、可逆过程与不可逆过程一个热力学系统,从某一状态出发,经过某一过程达到另一状态。
若存在另一过程,能使系统与外界完全复原(即系统回到原来的状态,同时消除了原来过程对外界的一切影响),则原来的过程称为可逆过程。


热力学第二定律的统计意义热力学第二定律是热力学中的一条基本定律,它表明在自然界中存在着一种趋势,即热量自热源向周围环境传递,而不会自动从低温体传向高温体,因此熵(或热力学不可逆性)总是增加的。
然而,这个定律的本质并不明确,这导致了许多学者对它的解释存在争议。
随着物理学的发展,人们发现这个定律与热力学的统计基础有着密切的关系。
首先,我们需要理解热力学中一个基本概念——熵。
熵是一种用来度量系统无序程度的物理量,表示了体系各个微观状态的分布不均匀程度。
通常来说,系统内互相独立的微观变化越多,其熵就越大。
例如,对于一个有序的水晶,在所有原子处于完美排列状态时,其熵最小。
而当温度升高时,原子会破坏这个有序状态,等效于增加了水晶的“混乱程度”,其熵也就增加了。
热力学第二定律实际上是在告诉我们一个事实:任何一个完全隔离的系统,熵不可能永远减少。
也就是说,熵的增加是一个不可逆的过程,这也是热量从高温体传向低温体时熵增加的原因。
概括而言,该定律表明了一个趋势,即系统中的能量将倾向于从高能量的状态向低能量的状态流动,从而使得系统的熵增加。
从统计学的角度来看,热力学第二定律是由这样一个事实推导而来的:在一个大的体系中,微观粒子的随机运动会经常导致某些相对独立事件的不完全或无法恢复性,这些事件包括:1. 分子/原子的碰撞: 分子或原子相互碰撞时,有一部分能量被转移给周围环境中的分子,这会导致大的系统中的能量总体降低;2. 动能的分布: 分子的运动速度分布不服从热力学平衡状态的Maxwell-Boltzmann分布时,也将导致无序增加;3. 热交换: 热量从高温体向低温体传递时,热力学不可逆性也将随之增加。
以上这些现象都会导致系统设在某个起始状态后一段时间后回不到原始状态的情况,这也就是在热力学第二定律中所描述的不可逆性增加。
这个过程是由大量微观粒子的无序运动造成的,也被称为热力学平衡状态的降解。
总体来说,热力学第二定律的统计意义是,它实际上是对许多微观随机过程导致的热力学不可逆性增加的描述。

热力学第二定律的统计意义
热力学第二定律是热力学中的一个基本定律,它描述了热能的转化过程中存在的不可逆性。
热力学第二定律的统计意义是将宏观不可逆过程与微观粒子运动的随机性联系起来,从而解释热力学第二定律的基本原理。
在热力学中,熵是一个重要的概念,它描述了系统中的混乱程度。
热力学第二定律可以被表述为熵在任何一个孤立系统中总是增加的原则。
这个原则可以通过微观粒子的随机热运动来解释。
在一个系统中,随着时间的推移,分子的位置和速度会随机变化,使得系统的状态逐渐变得更为混乱。
因此,熵增加代表着系统的混乱程度增加,也就是更接近于平均状态。
此外,热力学第二定律还可以通过热力学概率来解释。
热力学概率是指一个系统处于某个状态的概率。
根据热力学第二定律,处于高熵(即更为混乱)状态的概率更大,因为这样的状态更接近于平均状态。
这也反映了分子热运动的随机性,即处于高熵状态的概率更大,因为更多的状态都是高熵状态。
总之,热力学第二定律的统计意义是将宏观的不可逆过程与微观粒子的随机性联系起来,从而解释热力学第二定律的基本原理。
这个原理可以通过系统中的熵增加、分子热运动的随机性以及热力学概率等方面来进行解释。

热力学第二定律统计意义热力学第二定律是热力学中的重要定律之一,其统计意义可以通过热力学的统计学方法来解释。
热力学第二定律表明,在孤立系统中,不发生外界干扰的情况下,热量不可能从低温物体传递到高温物体。
这个定律的统计学意义是基于热力学理论中的熵的概念。
熵是一个衡量系统无序程度的物理量。
熵越大,系统的无序程度越高。
在孤立系统中,熵的增加是不可避免的,因为它与系统的无序程度有关。
因此,热力学第二定律可以用熵的概念来说明。
在热力学理论中,有一个重要的概念叫做微观状态。
微观状态是指一个系统在某个瞬间的所有粒子的位置、速度和动量等细节参数。
对于一个宏观体系来说,其微观状态的数量非常巨大,因此宏观热力学只考虑了一些平均量,如温度、压力和体积等。
但是,对于一个孤立的宏观体系来说,其微观状态是保持不变的,因此熵也是保持不变的。
但是,如果我们考虑一个孤立的宏观体系与其外界发生相互作用的情况下,就会发现熵的增加是不可避免的。
这是因为,外界的干扰会导致系统微观状态的变化,而微观状态的变化会导致熵的增加。
由于熵的增加代表系统的无序增加,因此热力学第二定律也就表明了系统无序程度的增加是不可避免的。
具体来说,考虑一个受到外界干扰的系统,如果其能量分布保持不变,那么其微观状态数量也是不变的。
这就意味着,任何微观状态的出现的概率都是相等的。
但是,我们可以发现,如果能量分布不均匀,例如在一个被分割成两部分的系统中,把高能量的粒子放在一侧,低能量的粒子放在另一侧,那么高能量与低能量之间就会产生一个能量差,从而导致能量从高温物体流向低温物体,也就是出现了“热流”的现象。
从统计学的角度来看,这种现象是微观状态变化所导致的。
高能量与低能量之间的差异会导致一些微观状态的出现概率比其他微观状态高,因此会引起一部分微观粒子流动的现象,也就是热流现象。
这种现象符合热力学第二定律的要求,也就表明了该定律的统计学意义。
综上所述,热力学第二定律的统计学意义是基于熵的概念,主要是通过微观状态变化引起的无序程度增加来解释的。
热力学第二定律是热力学中的基本定律之一,它描述了热量的流动规律,即热量总是从高温物体流向低温物体,而不会反过来。
从哲学的角度来看,热力学第二定律具有以下几个方面的意义:
1.确定性与无序性:热力学第二定律表明,在一个封闭系统内,热量不可能自行从低温物体流向高温物体,这表明了自然界的无序性和确定性。
这也意味着,如果一个系统处于一个更加有序的状态,那么这个系统将趋向于更加无序的状态,这也是熵增定律的基础。
2.生命的起源:热力学第二定律也为生命的起源提供了哲学上的解释。
生命的存在需要一定的能量输入和物质交换,而这些过程都是不可逆的,因此生命的存在是基于热力学第二定律的。
3.环境保护:热力学第二定律的意义也在于它提醒人们环境保护的重要性。
如果我们过度消耗自然资源,破坏环境平衡,那么我们将会面临更加严重的环境问题,这也是热力学第二定律的一个重要应用。
总之,热力学第二定律是一个非常重要的自然定律,它不仅在物理学、化学等自然科学领域有着广泛的应用,而且在哲学、生态学等领域也有着深刻的意义。
热力学中的热力学第二定律的物理意义热力学是研究热现象和与之相关的物理过程的一门学科。
其中,热力学第二定律是热力学的重要定律之一,它描述了热能的自然流动方向。
本文将介绍热力学第二定律的物理意义及其应用。
一、热力学第二定律的定义热力学第二定律又称为热力学不可逆定律,最初由克劳修斯在19世纪中叶提出。
该定律的定义如下:在一个孤立的系统中,热量不能从低温物体自动流向高温物体,除非添加外部工作,使之成为一个热泵或热机。
二、热力学第二定律的物理意义热力学第二定律描述了热能的自然流动方向,即从高温物体向低温物体传递。
这意味着,如果没有外部工作或能量源,即使两个物体接触,高温物体的热量也不能自动转移到低温物体。
这一定律反映了物理系统中热量的流动方向,与我们日常生活中经验相符。
例如,热茶会自然冷却,因为热量从高温茶中流向周围的低温环境;冰水会自然变暖,因为热量从温度较高的环境中流向冰水。
由此看来,热力学第二定律是解释自然现象的重要工具。
三、热力学第二定律的应用热力学第二定律不仅有理论意义,在实际应用中也有很多使用。
以下是几个例子:1、热机效率热机是一种将热能转化为机械能的设备。
热力学第二定律告诉我们,热机不能无限制地将热能转化为动能或电能。
根据热力学第二定律,热机效率的理论上限是卡诺效率。
卡诺效率是一个与热机的温度差有关的常数,它告诉我们在给定温度差的情况下,最大可获得多少机械功。
2、热泵热泵是一种将热能从低温环境中抽取,并将其输送到高温环境中的设备。
根据热力学第二定律,这一过程需要额外的能量输入。
这意味着热泵需要消耗能量才能够将低温环境中的热量转移到高温环境中。
3、热传导热力学第二定律还告诉我们,热从高温物体向低温物体自然流动,因此热传导是一种自然过程。
在热传导的过程中,热量从高温部分向低温部分自然流动。
因此,对于温度差较大的物体,热传导特别显著。
四、结论总之,热力学第二定律描述了热量的流动方向,为热能转化及应用提供了理论依据。