盐析和变性的区别
- 格式:ppt
- 大小:429.00 KB
- 文档页数:1


蛋白质的盐析与变性
1.盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程。
如:加浓(NH4)2SO4使蛋白质凝聚的过程;在乙酸的酯化反应中加入饱和碳酸钠溶液,降低乙酸乙酯溶解度,使其分层现象更明显的过程。
2.向某些蛋白质溶液中加入某些无机盐溶液后,可以使蛋白质凝聚而从溶液中析出,这种作用叫作盐析,可复原。
2.(2)向某些蛋白质溶液中加入某些重金属盐,可以使蛋白质凝聚而从溶液中析出,这种作用叫作变性,性质改变,无法复原。
豆腐的原料黄豆富含蛋白质,蛋白质含量36%~40%,经水浸、磨浆、除渣、加热,得到的蛋白质的胶体(一种介于溶液和悬浊液、乳浊液之间的混合物)。
点豆腐就是设法使蛋白质发生凝聚而与水分离。
盐卤是结晶氯化镁[MgCl2·6H2O]的水溶液,属电解质溶液,可以中和胶体微粒表面吸附的离子的电荷,使蛋白质分子凝聚起来得到豆腐。
既然点豆腐是让蛋白质发生凝聚,所采用的凝胶剂就不一定是非盐卤不可,其他如石膏、酯酸、柠檬酸等都有相同的作用,都可用来点豆腐。
这里还有值得一提的是,近年来在市场上销售一种盒装豆腐,它洁白细腻,质量明显高于传统方法制做的豆腐,原来,它的凝固剂采用了一种新的化学物质——葡萄糖酸内酯,这也是新科技用于食品加工的一个例子。
当加入大量盐类(一般为碱金属的中性盐或硫酸铵)于蛋白质溶液中,由于高浓度盐离子的水合作用而破坏了蛋白质胶粒的水膜;并由于反离子对蛋白质胶粒双电层压缩的结果,使电荷中和而成沉淀析出,这种用盐使蛋白质从溶液中沉淀析出的过程,称为盐析.例如:用盐卤(主要是MgCl2)或石膏(CaSO4)等盐类加入豆浆中使蛋白质沉淀而制取豆腐,即利用这个原理.
这是典型的蛋白质盐析。

蛋白质·典型题剖析与习题蛋白质·学习要求了解蛋白质的组成、用途和存在。
掌握氨基酸的性质和几种常见氨基酸的分子结构。
掌握蛋白质的基本性质和检验方法。
了解氨基酸与蛋白质之间的关系。
本节的重点是氨基酸的分子结构、性质和蛋白质的性质。
难点是蛋白质的性质。
蛋白质·知识点精析·氨基酸的特性羧酸分子里烃基上的氢原子被氨基(-NH2)取代后的生成物。
氨基酸的命名是以羧酸为母体,氨基作为取代基,碳原子的编号通常把离羧基最近的碳原子称为α碳,离羧基次近的碳原子称为β碳原子,COOH命名为:α-氨基-β-苯基丙酸。
氨基酸通常还可根据其性质和来源而称其名称。
如:甘氨酸具有甜味,谷氨酸是由谷物中提取的等。
由于氨基酸的分子中同时含有氨基(碱性基团)和羧基(酸性基因)因此它们既具有碱性又有酸性,是两性化合物。
例如,甘氨酸能与盐酸反应蛋白质·知识点精析·蛋白质的性质多种不同的氨基酸互相结合而成的高分子化合物称为蛋白质。
蛋白质的性质有:(1)有些蛋白质能溶于水,由于蛋白质分子直径相对很大,已达到了胶体微粒的大小,形成胶体溶液,因此蛋白质溶液具有胶体的某些性质。
(2)两性由于蛋白质分子中既有—NH2又有—COOH,因此蛋白质既能与酸反应又能与碱反应。
(3)盐析少量的盐(如(NH4)2SO4,Na2SO4等)能促进蛋白质的溶解,但蛋白质在这些盐的浓溶液中由于溶解度的降低而析出,这叫做盐析。
如再加水,则析出的蛋白质仍能溶解,且不影响原来蛋白质的性质。
因此盐析属物理变化是个可逆过程。
利用盐析可分离、提纯蛋白质。
(4)变性蛋白质在某种条件下发生结构和性质上的改变而凝结起来,这种凝结属化学变化是不可逆的,不能再使它们恢复成为原来的蛋白质,这种变化叫做变性。
能使蛋白质变性的条件有加热,加酸、碱、重金属盐(如铜盐,铅盐,汞盐等)、甲醛,紫外线照射等。
注意区别Na2SO4和CuSO4对蛋白质的不同作用。

第2课时氨基酸和蛋白质[课标要求]1.了解氨基酸、蛋白质的结构特点和主要性质。
2.了解酶的催化作用的特点。
3.了解我国科学家在生命科学研究领域中的贡献,体会化学科学在生命科学发展中的重要作用。
1.氨基酸是氨基取代了羧酸分子中烃基上的氢原子形成的取代羧酸,其官能团是—NH2和—COOH。
2.氨基酸具有酸碱两性,分子间脱水可形成肽类化合物。
3.蛋白质是由α氨基酸按一定的顺序、以肽键连接起来的生物大分子,能水解为多种α氨基酸。
氨基酸和多肽1.氨基酸(1)分子结构①氨基酸是氨基取代了羧酸分子中烃基上的氢原子形成的取代羧酸。
②官能团:—NH2,—COOH。
③α氨基酸:氨基和羧基连在同一个碳原子上的氨基酸。
(2)常见的α氨基酸(3)氨基酸的性质①氨基酸分子中既含有氨基又含有羧基,是一种两性化合物,通常以两性离子形式存在,根据溶液的pH不同,可以发生不同的解离。
2.多肽(1)肽一个α氨基酸分子的羧基与另一个α氨基酸分子的氨基脱去一分子水所形成的酰胺键称为肽键,生成的化合物称为肽。
(2)官能团酰胺键,又叫肽键,表示为。
(3)分类由两个氨基酸分子脱水缩合形成的是二肽,由三个氨基酸分子脱水缩合形成的是三肽,三肽以上可称为多肽。
如二分子甘氨酸生成二肽表示为:H2N—CH2—COOH+H2N—CH2—COOH―→H2N—CH2—CO—NH—CH2—COOH+H2O。
1.某期刊封面上有如图一个分子的球棍模型图,图中“棍”代表单键或双键或叁键,不同颜色的球代表不同元素的原子,该模型图可代表一种()A.卤代羧酸B.酯C.氨基酸D.醛解析:选C由模型可知,结构简式为NH2CH2COOH,为氨基酸。
2.关于生物体内氨基酸的叙述错误的是()A.构成蛋白质的氨基酸分子的结构通式可表示为B.人体内氨基酸的分解代谢最终产物是水、二氧化碳和尿素C.人体内所有氨基酸均可以相互转化D.两分子氨基酸通过脱水缩合可以形成二肽解析:选C部分氨基酸可以在人体内相互转化,但是有几种氨基酸在人体内不能合成,必须从食物中获得,称为必需氨基酸。



第三节蛋白质和核酸学习目标核心素养1.了解氨基酸的组成和结构,知道氨基酸的两性。
2.了解氨基酸的组成、结构特点和主要化学性质,知道氨基酸和蛋白质的关系。
3.了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。
了解氨基酸、蛋白质与人体健康的关系。
4.认识蛋白质、酶、核酸等物质与人体健康的关系。
1.从微观官能团的角度理解氨基酸、蛋白质性质和核酸的性质,形成结构决定性质的观念,能从宏观和微观相结合的视角分析和解决实际问题。
(宏观辨识与微观探析)2.从蛋白质的性质出发,具有较强的问题意识,设计实验方案,并能对实验进行评价和优化。
(科学探究与创新意识)3.认识蛋白质和核酸在生命科学发展中的重要应用,感受化学对社会发展的重大贡献。
(科学态度与社会责任)一、氨基酸的结构与性质1.概念和结构:(1)概念:羧酸分子中烃基上的氢原子被氨基取代的化合物。
(2)结构:α-氨基酸的结构简式为,官能团为氨基(—NH2)和羧基(—COOH)。
(3)常见的氨基酸。
俗名结构简式系统命名甘氨酸α-氨基乙酸丙氨酸α-氨基丙酸谷氨酸2-氨基-1,5-戊二酸苯丙氨酸α-氨基苯丙酸2.氨基酸的性质:(1)物理性质。
颜色状态熔点溶解性水强酸或强碱乙醇、乙醚无色晶体较高大多数能溶能溶难溶(2)化学性质。
①两性。
氨基酸分子中既含有羧基,又含有氨基,是两性化合物,因而能与酸、碱反应生成盐。
a.α 氨基酸与盐酸的反应:。
b.α 氨基酸与氢氧化钠的反应:。
②成肽反应。
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基和另一分子的羧基间脱去一分子水,缩合成含有肽键()的化合物的反应,称为成肽反应。
例如,氨基酸二肽或多肽蛋白质。
【微思考】既能与酸反应,又能与碱反应的物质有哪些?提示:氨基酸、Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2CO3]。
【教材二次开发】教材介绍了氨基酸的成肽反应,成肽反应的反应机理是什么?有哪些成肽方式?提示:酸脱羟基、氨脱氢。


2024年高考生物复习易错点解析—蛋白质和核酸的三个理解误区易错陷阱1:蛋白质变性和盐析本质相同。
【分析】高温使蛋白质变性的原因不是高温破坏了氨基酸之间的肽键,而是高温使肽链盘曲折登形成的空间结构发生不可逆变化。
低温和盐析未使蛋白质分子的空间结构发生不可逆变。
易错陷阱2:DNA分子和蛋白质分子在高温下空间结构都会出现不可逆的变化。
【分析】DNA分子和蛋白质分子对高温的耐受性不同,DNA分子对高温的耐受性通常比蛋白质分子高。
易错陷阱3:蛋白质的水解就是氧化分解。
【分析】蛋白质初步水解的产物是:多肽,彻底水解的产物是:氨基酸,氧化分解的产物是:二氧化碳、水和尿素。
【易错点提醒一】变性≠盐析【例1】某兴趣小组采用两种途径处理鸡蛋清溶液,过程如图所示。
有关叙述正确的是()A.①③处理后溶液中含有氨基酸B.②过程可能破坏了蛋白质的空间结构C.高温后蛋白质容易被蛋白酶水解,吃熟鸡蛋容易消化D.④过程若加入取自动物消化道中的物质,会破坏蛋白质的空间结构但不影响肽键【答案】BC【解析】蛋白质经盐析处理后再溶解还是蛋白质,A错误;②过程可能破坏了蛋白质的空间结构,B正确;高温后蛋白质分子的空间结构变得伸展、松散,更易被蛋白酶水解,吃熟鸡蛋容易消化,C正确;④过程蛋白质被消化液中的蛋白酶催化水解,会破坏蛋白质的空间结构和肽键,D错误;【变式1-1】(2023·海南·高考真题)科学家将编码天然蜘蛛丝蛋白的基因导入家蚕,使其表达出一种特殊的复合纤维蛋白,该复合纤维蛋白的韧性优于天然蚕丝蛋白。
下列有关该复合纤维蛋白的叙述,正确的是()A.该蛋白的基本组成单位与天然蜘蛛丝蛋白的不同B.该蛋白的肽链由氨基酸通过肽键连接而成C.该蛋白彻底水解的产物可与双缩脲试剂发生作用,产生紫色反应D.高温可改变该蛋白的化学组成,从而改变其韧性【答案】B【解析】该蛋白的基本组成单位是氨基酸,与天然蜘蛛丝蛋白的基本单位相同,A 错误;氨基酸是组成蛋白质的基本单位,该蛋白的肽链由氨基酸经过脱水缩合反应通过肽键连接而成,B正确;该蛋白彻底水解的产物为氨基酸,不能与双缩脲试剂发生作用产生紫色反应,C错误;高温可改变该蛋白的空间结构,从而改变其韧性,但不会改变其化学组成,D错误。

第5课时蛋白质和氨基酸学习目标核心素养建构1.了解蛋白质的组成和主要性质。
2.了解蛋白质在日常生活中的应用。
3.了解氨基酸的结构特点。
[知识梳理]一、蛋白质1.存在与组成(1)存在:蛋白质广泛存在于生命体内,是组成细胞的基础物质。
动物的肌肉、毛皮、血液等的主要成分都是蛋白质;大多数酶都是蛋白质。
(2)组成:蛋白质主要由碳、氢、氧、氮等元素组成,属于天然高分子化合物。
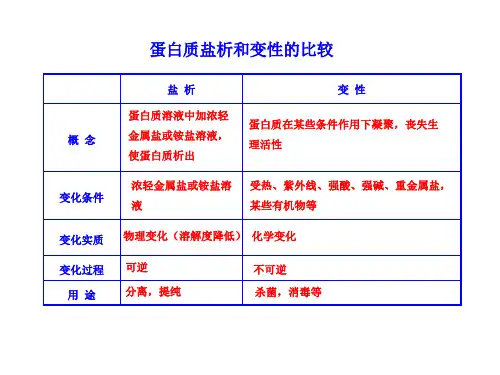
2.蛋白质的性质(1)蛋白质的盐析按表中实验操作完成实验,并填写下表:实验操作实验现象实验结论向(NH4)2SO4饱和溶液中加入鸡蛋清溶液后,有沉淀析出,沉淀加入到蒸馏水中时又溶解(NH4)2SO4饱和溶液能降低鸡蛋清在水中的溶解度,但不改变鸡蛋清的性质由实验可知:①概念:浓无机盐溶液使蛋白质的溶解度降低而使其从溶液中析出的过程叫盐析。
②条件:浓的轻金属盐溶液或铵盐溶液。
少量的无机盐能促进蛋白质的溶解。
③特点:盐析是可逆过程,继续加水时,能使沉淀溶解,不影响蛋白质的生理活性。
可用来分离、提纯蛋白质。
(2)蛋白质的变性按表中实验操作完成实验,并填写下表:实验操作实验现象加热后,鸡蛋清沉淀,凝结的鸡蛋清放入蒸馏水中不溶解加入CuSO4溶液后,鸡蛋清沉淀,凝结的鸡蛋清放入蒸馏水中不溶解加入乙醇的水溶液后,鸡蛋清沉淀,凝结的鸡蛋清放入蒸馏水中不溶解实验结论加热、CuSO4溶液、乙醇都能使蛋白质的性质发生改变由实验可知:①蛋白质的变性是在紫外线照射、加热或加入酸、碱、重金属盐、有机物(乙醇、苯酚、甲醛等)的情况下,蛋白质发生性质上的改变而聚沉的过程。
②蛋白质的变性是不可逆的化学变化过程,可以利用这一性质进行杀菌消毒。
(3)水解:蛋白质在一定条件下能发生水解反应,水解产物为氨基酸。
【自主思考】1.为什么医院里用高温蒸煮、照射紫外线、在伤口处涂抹酒精溶液等方法来杀菌消毒?提示高温、紫外线、酒精等都可以使蛋白质变性,杀死细菌,起到消毒作用。
2.为什么在农业上用波尔多液(由硫酸铜、生石灰和水制成)来消灭病虫害?提示波尔多液含有重金属盐,能使蛋白质变性。
选修1·化学与生活第一章 关注营养平衡第一节 生命的基础能源—糖类1、糖类是绿色植物光合作用的产物;由C 、H 、O 三种元素组成的一类有机化合物,也叫碳水化合物通式为C n H 20m ,但其实此名称并不能真实反应糖类的组成和特征,如鼠李糖C 6H 12O 5是糖却不符合此通式,而符合此通式的,如甲醛HCHO 、乙酸CH 3COOH 却不是糖类;2、葡萄糖分子式C 6H 12O 6,是一种白色晶体,有甜味,能溶于水3、葡萄糖的还原性: 和银氨溶液反应:3224324422()()23()Ag NH OH CH OH CHOH CHO Ag NH CH OH CHOH COONH H O +−−−−→+++水浴加热↓↑; 和新制CuOH 2反应:22422422()()()2Cu OH CH OH CHOH CHO Cu O CH OH CHOH COOH H O +−−→++△↓; 4、葡萄糖为人体提供能源①葡萄糖提供能量的方程式:6126222666;0C H O O CO H O H +−−→+酶△<; ②粮食中的糖类在人体中转化成葡萄糖而被吸收,在体内有三条途径,即:a 、直接氧化供能;b 、转化成糖元被肝脏和肌肉储存,当血液中的葡萄糖即血糖的质量分数比正常值低时,糖元就释放出来维持血糖浓度的相对稳定;c 、转变为脂肪,储存在脂肪组织里;5、蔗糖和麦芽糖是二糖,它们水解的化学方程式分别是:122211261266126C H O H O C H O C H O +−−→+酶(蔗糖)(葡萄糖)(果糖)122211261262C H O H O C H O +−−→酶(麦芽糖)(葡萄糖)6、淀粉是一种重要的多糖,分子式C 6H 10O 5n ,是一种相对分子质量很大的天然高分子有机化合物,没有甜味,是一种白色粉末,不溶于冷水,但在热水中一部分淀粉溶解在水中,一部分悬浮在水里,长时间或高温可产生糊化;它能水解;淀粉在人体内的水解过程可表示为6105n 6105m 1222116126C H O C H O C H O C H O −−→−−→−−→酶酶酶()淀粉()糊精麦芽糖葡萄糖,也可在酸的催化下逐步水解,其方程式6105n 26126nH O C H O nC H O −−−→稀硫酸()淀粉+葡萄糖; 淀粉的特性:I2能使淀粉溶液变成蓝色;这是实验室检验淀粉或I 2存在的重要原理; 7、纤维素是绿色植物通过光合作用生成的,是构成植物细胞的基础物质,它是白色,无色无味的物质,是一种多糖,属于天然有机高分子化合物;纤维素在酶或浓硫酸催化下发生水解,其化学方程式为6105n 26126nH O C H O nC H O −−−−→酶或浓硫酸()纤维素+葡萄糖;纤维素不能作为人类的营养食物,但在人体内不可或缺,如:能刺激肠道蠕动和分泌消化液,有助于失误和废物的排泄……;第二节 重要的体内能源—油脂1、油脂是由高级脂肪酸和甘油生成的酯类物质,结构可用重点,可参看教材·略来表示, R 相同的甘油酯叫单甘油酯,R 不同的甘油酯叫混甘油酯;天然油脂为混甘油酯,属于混合物;2、油脂的成分:常温下呈液态的高级脂肪酸的甘油酯称为油,呈固态的称为脂,它们统称为油脂;油脂分子烃基里所含的不饱和键越多,熔点越低;油脂的密度比水小,不溶于水;3、根据结构特点,油脂兼有酯类和不饱和烃类物质的性质;油脂在酸性环境和碱性环境都能水解,在酸性环境中的水解是可逆的,在碱性环境中的水解由于生成的高级脂肪酸可以继续和碱反应,故不可逆,油脂在碱性条件下的水解反应又叫皂化反应4、脂肪酸在人体内的四大主要功能:供给人体热量、储存能量、合成人体所需物质的原料、必需脂肪酸在体内有多种生理功能;5、常见高级脂肪酸:173515311733C H COOH C H COOH C H COOH 硬脂酸、软脂酸、油酸第三节 生命的基础—蛋白质1、氨基酸的分子中既含有氨基,又含有羧基,既能和酸反应又能和碱反应生成盐,其通式为略,但是重点2、一个氨基酸分子中的氨基和另一个氨基酸分子中的羧基之间缩去水分子后生成的产物叫二肽,含有的官能团叫做肽键;3、常见的氨基酸:甘氨酸的结构简式为:NH 2-CH 2-COOH,丙氨酸的结构简式为:CH 3CHNH 2COOH;人体必需氨基酸指的是:参考记忆口诀:意异亮氨酸甲甲硫氨酸即蛋氨酸输苏氨酸,本苯丙氨酸赖赖氨酸鞋缬氨酸色色氨酸亮亮氨酸共有8种4、蛋白质的组成元素是C 、H 、O 、N,是由氨基酸通过脱水缩合而构成的天然有机高分子化合物化合物,具有两性;蛋白质的基石是氨基酸;5、多肽和蛋白质的区别:空间结构、相对分子质量大小;氨基酸、二肽、多肽和蛋白质之间的转化关系:缩合缩合缩合水解水解水解氨基酸二肽多肽蛋白质_;、蛋白质的性质:两性、变性、盐析、颜色反应和浓硝酸、燃烧蛋白质有烧焦羽毛的气味,其中颜色反应和燃烧气味可用作蛋白质的检验8、酶是一种具有催化活性的蛋白质,其催化作用的特点:催化条件的温和性、催化效率的高效性、催化功能的专一性;第四节 维生素和微量元素1、维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物,习惯上按照不同的溶解性,把它们分为脂溶性维生素主要包括维生素A 、D 、E 、K 和水溶性维生素主要包括维生素C 、维生素B 族2、维生素C 是一种无色晶体,是一种水溶性维生素,溶液显酸性,其广泛存在于新鲜水果和绿色蔬菜中,人体不能合成,必须从食物中补充;维生素C 也称抗坏血酸,在人体内有重要的功能;维生素C 的化学特性是容易失去电子,是一种较强的还原剂,在水中或受热时很溶液被氧化,在碱性溶液中更容易被氧化;因此,生吃新鲜蔬菜比熟吃时维生素C 损失小3、人体中微量元素含量极少,质量不到体重的万分之一,如Fe 、I 、Se 等共16种,而常量元素是指含量在%以上的元素,如C 、H 、O 等共11种4、碘是人体必需的微量元素之一,有智力元素之称;碘在人体内的含量仅约为30mg,其中一半集中在甲状腺内,其余则分布在其他组织;可多吃海带、海鱼、紫菜来补充;也可吃加碘食盐含有KIO 3,但在食用时要注意:存放时密封、防潮、防晒,菜出锅时再放以防分解5、铁在人体中的含量约为4-5g,是人体必需的微量元素中最多的一种;人体内的含铁化合物主要分为两类,即功能性铁和储存性铁,它们一起参与O 2的运输,缺铁可通过铁强化酱油来补充,之所以选用酱油作为铁强化食物的载体,这主要是因为酱油可以促进铁吸收,而且具有广泛的群众食用基础,另外,人们对酱油的日摄入量稳定在相对合理的数值范围内6、中国有句名言:药补不如食补;人体有自我调节能力,只要养成科学的饮食习惯、不偏食、不挑食、全面摄取各种营养,保持膳食平衡,食物中所提供的维生素和微量元素就足够了第二章 促进身心健康 第一节 合理选择饮食1、水是人体的重要组成成分,约占人体体重的三分之二,其主要作用是良好溶剂、反应介质和反应物、调节体温;2、食物的酸碱性与化学上所指的溶液的酸碱性不相同,他是指食物的成酸性或成碱性,是按食物在体内代谢的最终产物的性质来分类的;例如,由C 、N 、S 、P 等元素组成的蛋白质,在体内经过消化、吸收后,最后氧化成对应的的酸:C 变成碳酸,N 变成尿酸,S 变成硫酸,P 变成磷酸,这些最终产物是酸,使体液呈弱酸性;又如某些蔬菜、水果多含K 、Na 、Ca 、Mg 等盐类,在人体内代谢后生成碱,使体液呈弱碱性;而人体血液的pH 总保持碱性环境;3、常见的食品添加剂的分类为着色剂、防腐剂、调味剂、营养添加剂;着色剂主要包括:胡萝卜素、胭脂红、苋菜红、柠檬黄;早期采用的防腐剂主要是食盐、食醋、糖等,现在常用的防腐剂有苯甲酸钠、硝酸盐、亚硝酸盐、二氧化硫; 调味剂主要有:食盐、食醋、味精;营养强化剂加碘食盐、铁强化酱油……第二节 正确使用药物1、人工合成药物主要有解热镇痛药、抗生素和抗酸药等2、阿司匹林是人们熟知的治感冒药,具有解热镇痛的作用,其化学名是乙酰水杨酸,是第一个重要的人工合成药物,结构式为略,重点;阿司匹林是一种有机酸,白色晶体,难于水以水杨酸为原料,使之与乙酸酐直接反应制备阿司匹林的化学反应方程式为: 参照教材,重点;可溶性阿司匹林的疗效更好,写出制备的化学反应方程式: 参照教材,重点;但长期大量服用阿司匹林会有不良反应如水杨酸反应、胃肠道反应,出现水杨酸反应这种情况是中毒的表现,应立即停药并静脉滴注NaHCO 3溶液3、青霉素是重要的抗生素即消炎药,有阻止多种细菌生长的优异功能,在使用之前要进行皮肤敏感性试验简称“皮试”,以防止过敏反应的发生4、抗酸药作用是中和胃酸,缓解胃部不适,其主要成分时能中和盐酸的化学物质,如 氢氧化铝、碳酸氢钠、碳酸镁、氢氧化镁、碳酸钙等;5、天然药物麻黄碱具有止咳平喘的作用,但服用麻黄碱有时会出现中枢兴奋所导致的不安、失眠等,晚间服用最好同服镇静催眠药以防止失眠,运动员不能服用麻黄碱;第三章 探索生活材料 第一节 合金1、合金是由两种或两种以上的金属或金属和非金属熔合而成的具有具有金属特性的物质,与各成分的金属相比,其特点为硬度比各组成成分大, 熔点比各组成成分低;2、我们经常使用的合金有铁合金、铝合金、铜合金和新型合金;3、生铁和钢是含碳量不同的的两种铁碳合金;4、钢一般分为碳素钢和合金钢两大类;根据含碳量不同,前者可以分为高碳钢、中碳钢和低碳钢;含碳量高,硬度大,韧性差、延展性差,含碳量低,硬度小,韧性好、延展性好;后者最常见的一种是不锈钢,其合金元素主要是Cr 和Ni,它在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力;但不锈钢的不锈是相对的,在海水中会被腐蚀;5、Al 是地壳中含量最多的金属元素,纯铝的硬度和强度较小,不适于制造机器零件6、常见的铜合金有黄铜Cu-Zn 合金,含Zn20%~36%和青铜Cu-Sn 合金,含Sn10%~30%第二节 金属的腐蚀和防护1、金属的腐蚀是指金属或者合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程,其本质是M-ne -=M n+;一般可以分为化学腐蚀和电化学腐蚀,前者指的是金属跟接触到的气体或液体直接发生氧化还原反应而被腐蚀的过程,后者指的是不纯的金属或合金跟接触到的气体或液体发生的间接氧化还原反应的过程,一般情况下,着两种腐蚀同时存在,只是电化学腐蚀比化学腐蚀要普遍得多;2、以不纯的钢铁为例分析钢铁的腐蚀情况:①吸氧腐蚀的实质是铁在电解质的存在下被O 2氧化,这一腐蚀过程因吸收了氧气而被称为吸氧腐蚀;发生吸氧腐蚀的条件是中性或弱酸性环境,正极反应是--22O +2H 0+4e =4OH ,负极反应是-2+Fe-2e =Fe ②析氢腐蚀条件是强酸性环境,正极反应是+-2H +2e =H ↑,负极反应是-2+Fe-2e =Fe3、影响金属腐蚀的因素包括金属本性和外部介质两个方面;就前者而言,金属越活泼,就越容易被腐蚀;后者包括温度、反应物浓度、接触面积、环境湿度等方面4、防止金属腐蚀的方法有改变金属内部结构、外加保护膜、电化学保护法;第三节 玻璃、陶瓷和水泥1、普通玻璃是Na 2SiO 3、Ca 2SiO 3、SiO 2熔化在一起得到的物质,主要成分是SiO 2;这种物质称作玻璃态物质,没有一定的熔点,而是在某个范围内逐渐软化2、在生产过程中加入不同的物质,调整玻璃的化学组成,可制成具有不同性能和用途的玻璃;如:提高SiO 2的含量或加入B 2O 3能提高玻璃的化学稳定性和降低它的热膨胀系数,从而使其更耐高温和抗化学腐蚀,可用于制造高级的化学器皿;加入PbO 后制得的光学玻璃折光率;加入某些金属氧化物可制成彩色玻璃:加入Co 2O 3玻璃呈蓝色,加入Cu 2O 玻璃呈红色,加入Fe 2+玻璃呈绿色3、制造陶瓷的主要原料是黏土主要成分可表示为Al 2O 3.2SiO 2.2H 2O;4、以石灰石和黏土为主要原料,经研磨、混合后在水泥回转窑中煅烧,然后加入适量的石膏,并研成细粉就得到普通的硅酸盐水泥;这种水泥的主要成份是硅酸二钙2CaO ·SiO 2、硅酸三钙3CaO ·SiO 2、铝酸三钙3CaO ·Al 2O 3 ,加入石膏的目的是为了延缓水泥的硬化;5、水泥的吸水性很强,能吸收空气中的水份并与之发生化学反应,所以不能长期存放,即使短期存放也要注意防潮;一般水泥的保质期是三个月6、水泥、砂子和水的混合物叫水泥砂浆,使建筑用黏合剂,可把砖、石等黏合起来;水泥、砂子和碎石的混合物叫做混凝土;8、从高纯度的SiO 2熔融体中,拉出直径约为100μm 的细丝,就得到石英玻璃纤维,其传导光的能力非常强,所以又称光导纤维,简称光纤;9、利用光缆通信,能同时传输大量信息;光缆的抗干扰能力好、通信质量高、能防窃听;光缆的质量小而且细,耐腐蚀,铺设也很方便,因此是非常好的通信材料;光导纤维除了可以用于通信外,还用于医疗、信息处理、传能传像、遥测遥控盒照明等许多方面;10、随着科学技术的发展,人们研制出了许多有特殊功能的陶瓷,如超硬陶瓷、高温结构陶瓷、生物陶瓷、超导陶瓷等,使陶瓷的用途不断扩展第四节 塑料、纤维和橡胶1、通常所说的三大合成材料是指塑料、合成纤维和合成塑料;2、塑料的主要成分是合成树脂,除此外还根据需要加入某些特定用途的添加剂,比如能提高塑性的增塑剂,防止塑料老化的抗老化剂等;3、热塑性指的是塑料冷却后又变成固体,加热后又熔化,具有线性结构,常见的热塑性塑料有聚乙烯、聚氯乙烯可用作视频、药物的包装袋、聚丙烯;热固性指的是在制造过程中受热能变软,但加工成型后受热不能再软化,具有体型网状结构结构;4、天然纤维如棉花、麻、蚕丝、羊毛等,而人造纤维如腈纶、涤纶、维纶、氯纶、丙纶、锦纶,称为“六大纶”;5、天然橡胶的化学组成是聚异戊二烯,结构式是略,重点,写出以异戊二烯为原料制备合成橡胶异戊橡胶的化学反应方程式略,重点;6、合成橡胶分为通用橡胶和特种橡胶,常用的通用橡胶有氯丁橡胶、顺丁橡胶、丁苯橡胶等;特种橡胶有耐热和耐酸碱的氟橡胶,耐高温和耐严寒的硅橡胶等7、许多橡胶是线性结构,可塑性好,但强度和韧性差,为了克服这个缺点,工业上常用硫与橡胶分子作用,使橡胶硫化,形成体型网状结构,使橡胶具有较高的强度、韧性、良好的弹性、化学稳定性;8、复合材料指的是将两种或两种以上不同性能的材料组合起来的具有优良性能的材料;玻璃纤维增强塑料玻璃钢就是玻璃纤维和合成树脂组成的复合材料;将玻璃熔化并迅速拉成细丝得到异常柔软的玻璃纤维,然后将其加到合成树脂中就得到了玻璃钢;玻璃钢广泛用于汽车车身、火车车厢、船体以及印制电路板等第四章 保护生成环境 第一节 改善大气质量1、大气污染物根据组成成分,可以分为颗粒物、氮氧化物、硫氧化物、CO 、碳氢化物、氟氯代烷常用作制冷剂,商品名叫氟利昂;2、自然界中臭氧有90%集中在距离地面15—50km 的大气平流层中,也就是通常所说的臭氧层,虽然其中臭氧含量很少,但可以吸收来自太阳的大部分紫外线,使地球上的生物免遭伤害3、正常雨水偏酸性,pH 约为,这是因为大气中的CO 2溶于雨水中的缘故;酸雨是指pH <的降水,主要是人为排放的氮氧化物和硫氧化物等酸性气体转化而成的;4、我国是世界上耗煤量最大的国家之一,为了减少煤燃烧对大气造成的污染,目前主要采取的措施有①改善燃煤质量②改进燃烧装置和燃烧技术,改进排烟设备等如调节燃烧时的空燃比和采用新型煤粉燃烧器,使煤燃烧充分,提高燃烧效率,减少污染,向煤中加入适量石灰石可大大减少燃烧产物中SO 2的量③发展洁净煤技术,开展煤的综合利用;煤的汽化和液化是高效、清洁地利用煤炭的重要途径;④调整和优化能源结构;7、减少汽车等机动车尾气的污染是改善大气质量的重要环节,可采取:①推广使用无铅汽油;因为了减少汽油燃烧,减轻爆震现象,人们常向汽油中添加抗暴震剂,四乙基铅就是最常用的抗爆剂,加有四乙基铅的汽油通常称为含铅汽油,它的广泛使用带来了严重的铅污染,对人体的许多系统都有严重的损害,尤其是神经系统;②在汽车尾气系统中装置催化转化器;此举可有效控制废气向大气的排放,通常采用铂等贵金属作催化剂;前半部分发生的反应222CO N −−−→+催化剂2CO+2NO ,后半部分发生的反应22CO −−−→催化剂22CO+O 、2278CO H O −−−→+催化剂7162C H +11O 8、室内空气污染的来源:①厨房:燃料燃烧产生的CO 、CO 2、NO 、SO 2和尼古丁等造成污染;厨房油烟;②装饰材料:主要来源甲苯、二甲苯、苯、黏合剂如油漆等;③室内吸烟:尼古丁、二恶英等第二节 爱护水资源1、由于水是一种很好的溶剂,水中的污染物种类繁多:①重金属污染:水中的重金属污染主要包括Cr 、Hg 、Cd 、Pb ……这些重金属污染物主要来源于化工、冶金、电子、电镀等行业排放的工业废水,它们能在生物体内积累不易排出体外,危害很大;②植物营养物质污染:生活污水和工业废水中,经常包括含N 、P 的化合物,它们是植物生长发育的养料,称为植物营养素;含N 的物质主要是蛋白质和工业废水,含P 的物质主要是洗涤剂和不合理使用化肥;2、污水处理的方法有混凝法如明矾的净水、中和法如用CaOH 2中和酸性废水,用H 2SO 4中和碱性废水、沉淀法如用Na 2S 除去Hg 2+;。
第三节生命的基础——蛋白质氨基酸和多肽1.蛋白质的结构为什么这么复杂?提示:氨基酸是蛋白质的基本结构单元。
种类很多,组成蛋白质时种类、数量不同,排列的次序差异很大。
所以,蛋白质的结构很复杂。
►综合拓展一、氨基酸的化学性质氨基酸分子里含有羧基和氨基,羧基表现酸性,氨基表现碱性。
因此,氨基酸与酸或碱都能反应生成盐,具有两性。
1.与碱反应:2.与酸反应:3.脱水缩合反应:氨基酸分子中的氨基和羧基之间可以发生脱水缩合反应。
(1)两个氨基酸分子间脱去1分子水生成二肽,如:(2)两个氨基酸分子间脱去2分子水生成环状化合物,如:(3)多个氨基酸分子间缩合脱水(缩聚)生成多肽,如:蛋白质的性质2.什么是蛋白质互补?蛋白质互补遵循什么原则?提示:蛋白质互补就是两种或两种以上食物蛋白质混合食用,其中含有的必需氨基酸取长补短,相互补充,达到较好的比例,从而提高蛋白质的利用率。
其遵循的原则有:①食物的生物学种属越近越好;②搭配种类越多越好;③食用时间越近越好,同时食用最好。
►综合拓展二、盐析与变性的区别盐析变性加热、紫外线、X射线、强酸、强碱、重金属变化条件浓的无机轻金属盐盐以及甲醛、乙醇等部分有机化合物物理变化变化实质化学变化(蛋白质性质改变)(溶解度降低)变化过程可逆不可逆用途分离、提纯蛋白质杀菌、消毒1.下列关于蛋白质的叙述正确的是(B)A.加热会使蛋白质变性,因此生吃鸡蛋比熟吃好B.一束光线照射蛋白质溶液,产生丁达尔现象C.向鸡蛋清中加入食盐,会使蛋白质变性D.天然蛋白质中仅含C、H、O、N四种元素解析:蛋白质溶液是胶体,能产生丁达尔现象,B项正确;食盐不是重金属盐,不能使蛋白质变性,C项错误;蛋白质中含有碳、氢、氧、氮及少量的硫,有的还含有微量磷、铁、锌、钼等元素,D项错误。
2.波尔多液由CuSO4溶液和石灰乳混合而成,其防治病虫害的原因是(C)A.硫酸铜能使菌体蛋白质发生盐析而凝固B.石灰乳能使菌体蛋白质水解而推动生理活性C.铜离子在碱性条件下可使菌体蛋白质性质改变而发生聚沉D.蛋白质可以溶解在波尔多液中解析:波尔多液是硫酸铜和氢氧化钙的混合液。
一.氨基酸1 八种必须氨基酸的英文命名及缩写。
赖氨酸Lysine Lys K甲硫氨酸Methionine Met M缬氨酸valine Val V异亮氨酸isoleucine Ile I苯丙氨酸phenylaninePhe F亮氨酸leucine Leu L色氨酸tryptophan Try W苏氨酸threonine thr T2 俩种氨基酸组成多肽时,有几种?成二肽,有四种成三肽时,有八种(仅供参考,不一定正确,有不同意见请指出来)。
二酶分析1酶活性的定义,国际常用的单位:酶活性(enzyme activity)也称为酶活力,指酶促反应速率,即规定条件下在单位时间内产物的生成量或底物的减少量。
酶活性单位:表示酶的相对含量,指在一定条件下,单位时间内生成一定量的产物或消耗一定量的底物所催化的酶量。
a.国际单位IU(µmol/min)定义:在规定条件下(25℃及其他最适条件),每分钟催化1µmol 底物转变为产物的酶量,为1IU或1U。
1IU=1µmol/min。
B.Katal单位(mol/s)定义:1Katal是在规定条件下,每秒钟催化1mol底物转变为产物的酶量。
1Katal=1mol/s。
IU与Katal单位的关系:1katal = 60×106IU,1IU = 16.67nkatal3 酶促反应酶促反应的历程:延滞期,线性期,非线性期a.酶促反应式:B.米氏方程C .Km 的含义与意义.Km 的含义:当Km=[S]时,可见Km 值等于反应速率达到最大反应速率Vmax 一半时的底物浓度。
Km 的意义:Km 是酶的一个特征性常数(其他如等电点),Km 的大小只与酶的性质有关反映酶对底物亲和力的大小选择酶的最适底物或天然底物计算不同底物浓度时的反应程度鉴别酶的种类判断可逆反应的速率判断酶偶联反应的限速反应计算工具酶的用量3.两种测定酶活性的方法:a .定时法原理:定时法是固定时间法的简称,是指测定反应开始后一段时间(t1~t2)产物的增加量或底物的减少量以测定酶活性的方法。
高二化学补充材料一、蛋白质的盐析:蛋白质溶液中加浓无机盐溶液,使蛋白质析出对象:高分子等(如蛋白质等)变化条件:浓无机盐溶液变化实质:物理变化(溶解度降低)变化过程:可逆用途:分离,提纯二、蛋白质的变性:蛋白质在某些条件作用下凝聚,丧失生理活性对象:高分子等(如蛋白质等)变化条件:受热、紫外线、强酸、强碱、重金属盐,某些有机物等变化实质:化学变化变化过程:不可逆用途:杀菌,消毒等三、蛋白质的胶体凝聚:胶体中加入强电解质,不同电荷的胶体或加热而使之凝聚成大颗粒对象:带电的胶粒变化条件:强电解质,不同电荷的胶体,加热变化实质:物理变化变化过程:不可逆用途:鉴别,分离等四、蛋白质的水解反应:蛋白质+H2O(酶的催化)=氨基酸蛋白质的性质(1)溶解性:有些蛋白质和鸡蛋白能溶解在水里形成溶液。
蛋白质分子的直径很大,达到了胶体微粒的大小,所以,蛋白质溶液具有胶体的性质。
有的难溶于水(如丝、毛等)。
(2)水解:我们从食物摄取的蛋白质,在胃液中的胃蛋白酶和胰液中的胰蛋白酶作用下,经水解反应,生成氨基酸。
氨基酸被人体吸收后,重新结合成人体所需的各种蛋白质。
人体内各种组织的蛋白质也不断地分解,最后主要生成尿素,排出体外。
(3)盐析:少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解,但如向蛋白质溶液中加入浓的盐溶液,可使蛋白质的溶解度降低而从溶液中析出。
这种作用叫做盐析。
这样析出的蛋白质在继续加水时,仍能溶解,并不影响原来蛋白质的性质。
采用多次盐析,可以分离和提纯蛋白质。
(4)变性:蛋白质受热、紫外线、X射线、强酸、强碱、重金属(如铅、铜、汞等)盐、一些有机物(甲醛、酒精、苯甲酸)等的作用会凝结,这种凝结是不可逆的,即凝结后不能在水中重新溶解,这种变化叫做变性。
蛋白质变性后,不仅丧失了原有的可溶性,同时也失去了生理活性。
运用变性原理可以用于消毒,但也可能引起中毒。
(5)颜色反应:蛋白质可以跟许多试剂发生颜色反应。
例如,有些蛋白质跟浓硝酸作用时呈黄色。