蛋白质盐析和变性的比较
- 格式:ppt
- 大小:82.00 KB
- 文档页数:1

蛋白质纯化的方法蛋白质的分离纯化方法很多,主要有:(一)根据蛋白质溶解度不同的分离方法1、蛋白质的盐析中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。
盐析时若溶液pH在蛋白质等电点则效果更好。
由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。
影响盐析的因素有:(1)温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。
一般温度低蛋白质溶介度降低。
但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。
(2)pH值:大多数蛋白质在等电点时在浓盐溶液中的溶介度最低。
(3)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质地一起沉淀出来(共沉现象)。
因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5-3.0%。
蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。
其中应用最多的硫酸铵,它的优点是温度系数小而溶解度大(25度时饱和溶液为4.1M,即767克/升;0度时饱和溶解度为3.9M,即676克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。
硫酸铵溶液的pH常在4.5-5.5之间,当用其他pH值进行盐析时,需用硫酸或氨水调节。
蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入秀析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。

蛋白质的结构与性质1.蛋白质的存在蛋白质广泛存在于生物体内,是组成细胞的基础物质。
动物的肌肉、皮肤、血液、乳汁以及毛、发、蹄、角等都是由蛋白质构成的。
许多植物(如大豆、花生、小麦、稻谷)的种子里也含有丰富的蛋白质。
2.蛋白质的组成和结构蛋白质的相对分子质量很大,从几万到几千万。
例如,烟草斑纹病毒的核蛋白的相对分子质量就超过两千万。
因此,蛋白质属于天然有机高分子化合物。
(1)蛋白质的组成蛋白质是一类非常复杂的化合物,由C、H、O、N、S等元素组成,有些蛋白质含有P,少数蛋白质还含有微量Fe、Cu、Zn、Mn等。
(2)蛋白质分子的结构氨基酸是构成蛋白质的物质基础,氨基酸分子的种类和排列顺序决定了蛋白质分子的种类及相对分子质量的大小。
名师提醒(1)蛋白质是由不同氨基酸按不同顺序相互结合而形成的高分子化合物。
(2)蛋白质溶液具有胶体的性质。
3.蛋白质的性质(1)蛋白质的物理性质溶解性:有的蛋白质不溶于水,如丝、毛等;有的蛋白质溶于水,如鸡蛋清等。
少量的盐(如硫酸铵、硫酸钠、氯化钠等)能促进蛋白质溶解。
当向蛋白质溶液中加入的盐溶液达到一定浓度时,反而使蛋白质的溶解度降低而从溶液中析出,这种作用称为盐析。
实验探究 教材P89实验4-2 蛋白质的盐析名师提醒(1)盐析只改变蛋白质的溶解度,不改变其结构和化学性质,析出的蛋白质还能溶于水。
(2)盐析必须是浓的盐溶液,少量盐能促进蛋白质溶解。
(3)盐析常用于分离提纯蛋白质。
(2)蛋白质的化学性质 ①蛋白质的两性形成蛋白质的多肽是由多个氨基酸脱水形成的,在多肽链的两端存在着自由的—NH 2和—COOH 。
而且,侧链中也有酸性或碱性基团。
因此,蛋白质与氨基酸一样具有两性,既能与酸反应,又能与碱反应。
②蛋白质的水解在酸、碱或酶的催化作用下,蛋白质能发生水解反应。
蛋白质是由多种氨基酸构成的高分子化合物,其水解反应逐步进行:蛋白质−−−−−→水解酸、碱或酶相对分子质量较小的肽类化合物−−−→水解各种氨基酸。
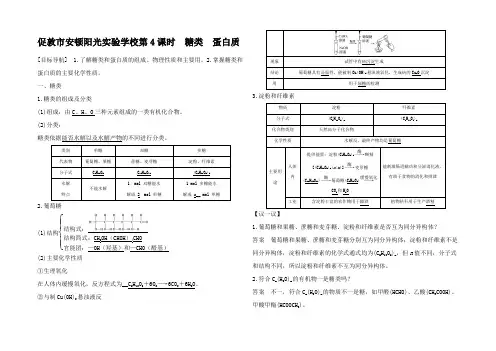
促敦市安顿阳光实验学校第4课时 糖类 蛋白质[目标导航] 1.了解糖类和蛋白质的组成、物理性质和主要用。
2.掌握糖类和蛋白质的主要化学性质。
一、糖类1.糖类的组成及分类(1)组成:由C 、H 、O 三种元素组成的一类有机化合物。
(2)分类:糖类依据能否水解以及水解产物的不同进行分类。
类别 单糖 双糖 多糖 代表物 葡萄糖、果糖蔗糖、麦芽糖 淀粉、纤维素分子式 C 6H 12O 6C 12H 22O 11 (C 6H 10O 5)n 水解特点不能水解1 mol 双糖能水解成 2 mol 单糖1 mol 多糖能水解成 n __ mol 单糖2.葡萄糖(1)结构⎩⎪⎨⎪⎧结构式:结构简式:CH 2OH (CHOH )4CHO 官能团:—OH (羟基)和—CHO (醛基)(2)主要化学性质 ①生理氧化在人体内缓慢氧化,反方程式为__C 6H 12O 6+6O 2―→6CO 2+6H 2O 。
②与制Cu(OH)2悬浊液反现象 试管中有砖沉淀生成结论 葡萄糖具有还原性,能被制Cu(OH)2悬浊液氧化,生成砖的Cu 2O 沉淀用用于尿糖的检测3.淀粉和纤维素物质 淀粉 纤维素 分子式 (C 6H 10O 5)n (C 6H 10O 5)n化合物类别 天然高分子化合物化学性质水解反,最终产物均是葡萄糖主要用途人体内提供能量:淀粉(C 6H 10O 5)n ――→酶糊精[(C 6H 10O 5)x (x <n )]――→酶麦芽糖(C 12H 22O 11)――→酶葡萄糖(C 6H 12O 6)――→缓慢氧化CO 2和H 2O能刺激肠道蠕动和分泌消化液,有助于食物的消化和排泄工业含淀粉丰富的农作物用于酿酒植物秸秆用于生产酒精 【议一议】1.葡萄糖和果糖、蔗糖和麦芽糖、淀粉和纤维素是否互为同分异构体? 答案 葡萄糖和果糖、蔗糖和麦芽糖分别互为同分异构体;淀粉和纤维素不是同分异构体,淀粉和纤维素的化学式通式均为(C 6H 10O 5)n ,但n 值不同,分子式和结构不同,所以淀粉和纤维素不互为同分异构体。

第2课时蛋白质课前自主预习一、蛋白质1.化学组成(1)元素组成:C、H、O、N、P、S等。
(2)代表物:肌肉、毛发等。
2.化学性质(1)特征反应①浓硝酸可以使蛋白质变黄,称为蛋白质的颜色反应。
②烧焦时有烧焦羽毛的气味。
(2)水解反应蛋白质在酶等催化剂作用下可以水解,生成氨基酸。
二、蛋白质在生产、生活中的重要作用1.蛋白质的存在:作为生命的基础物质,蛋白质是细胞结构里复杂多变的化合物,存在于一切细胞中。
2.蛋白质的主要作用(1)人们从食物中摄取的蛋白质,在人体胃蛋白酶和胰蛋白酶的作用下,经过水解最终生成氨基酸。
氨基酸被人体吸收后,重新结合成人体所需要的各种蛋白质,其中包括上百种的激素和酶。
人体内的各种组织蛋白质也在不断地分解,最后主要生成尿素排出体外。
(2)动物的毛和皮、蚕丝等可以制作纺织原料,动物胶可以制造照相用片基,驴皮制的阿胶还是一种药材。
从牛奶中提取的酪素,可以用来制作食品和塑料。
(3)酶是一类特殊的蛋白质,是生物体内重要的催化剂。
课堂互动探究蛋白质性质的拓展应用1.蛋白质的盐析和变性(1)加少量的轻金属盐能促进蛋白质的溶解。
加浓的轻金属盐能使蛋白质降低溶解度而从溶液中析出,这种作用叫做蛋白质的盐析。
蛋白质的盐析具有可逆性,蛋白质的生理活性不会改变。
利用这个性质,可以采用多次盐析的方法来分离、提纯蛋白质。
(2)在紫外线或X射线照射、加热或加入重金属盐(如铜、汞、铅、钡等的盐)、强酸、强碱、乙醇、甲醛、苯酚、高锰酸钾、84消毒液、过氧乙酸等物质的作用下,使蛋白质发生性质上的改变而聚沉,这种作用叫做蛋白质变性。
蛋白质的变性是不可逆的,蛋白质失去生理活性不能再恢复成原来的蛋白质。
利用这个性质,可以采取措施灭菌、消毒、预防中毒或缓解中毒的程度,保存动物体的标本,鞣制皮革等。
蛋白质的盐析和变性可按下列方案进行实验。
2.蛋白质的鉴别、分离与提纯(1)鉴别蛋白质的依据主要有:①有些蛋白质分子中有苯环存在,这样的蛋白质跟浓HNO3作用时呈黄色。

第2课时氨基酸和蛋白质[课标要求]1.了解氨基酸、蛋白质的结构特点和主要性质。
2.了解酶的催化作用的特点。
3.了解我国科学家在生命科学研究领域中的贡献,体会化学科学在生命科学发展中的重要作用。
1.氨基酸是氨基取代了羧酸分子中烃基上的氢原子形成的取代羧酸,其官能团是—NH2和—COOH。
2.氨基酸具有酸碱两性,分子间脱水可形成肽类化合物。
3.蛋白质是由α氨基酸按一定的顺序、以肽键连接起来的生物大分子,能水解为多种α氨基酸。
氨基酸和多肽1.氨基酸(1)分子结构①氨基酸是氨基取代了羧酸分子中烃基上的氢原子形成的取代羧酸。
②官能团:—NH2,—COOH。
③α氨基酸:氨基和羧基连在同一个碳原子上的氨基酸。
(2)常见的α氨基酸(3)氨基酸的性质①氨基酸分子中既含有氨基又含有羧基,是一种两性化合物,通常以两性离子形式存在,根据溶液的pH不同,可以发生不同的解离。
2.多肽(1)肽一个α氨基酸分子的羧基与另一个α氨基酸分子的氨基脱去一分子水所形成的酰胺键称为肽键,生成的化合物称为肽。
(2)官能团酰胺键,又叫肽键,表示为。
(3)分类由两个氨基酸分子脱水缩合形成的是二肽,由三个氨基酸分子脱水缩合形成的是三肽,三肽以上可称为多肽。
如二分子甘氨酸生成二肽表示为:H2N—CH2—COOH+H2N—CH2—COOH―→H2N—CH2—CO—NH—CH2—COOH+H2O。
1.某期刊封面上有如图一个分子的球棍模型图,图中“棍”代表单键或双键或叁键,不同颜色的球代表不同元素的原子,该模型图可代表一种()A.卤代羧酸B.酯C.氨基酸D.醛解析:选C由模型可知,结构简式为NH2CH2COOH,为氨基酸。
2.关于生物体内氨基酸的叙述错误的是()A.构成蛋白质的氨基酸分子的结构通式可表示为B.人体内氨基酸的分解代谢最终产物是水、二氧化碳和尿素C.人体内所有氨基酸均可以相互转化D.两分子氨基酸通过脱水缩合可以形成二肽解析:选C部分氨基酸可以在人体内相互转化,但是有几种氨基酸在人体内不能合成,必须从食物中获得,称为必需氨基酸。

第一章1、所有细胞(包括原核细胞)遗传物质为DNA。
2、水绵为低等植物,黑藻为高等植物,低等植物有中心体,高等植物没有。
3、细胞学说揭示了动植物细胞的统一性和生物体结构的统一性,并指出新细胞可以从老细胞中产生。
4、原核细胞没有染色体,其遗传物质DNA是环状裸露的。
5、生命系统结构一般层次:细胞?组织 ?器官 ?系统 ?个体 ?种群 ?群落 ?生态系统 ?生物圈。
植物无“系统”这一生命层次。
6、显微镜放大的是长度或者宽度,面积需要平方。
显微镜成像是倒立的虚像,所以在移动装片的时候是同向移动。
低倍镜使用粗准焦螺旋,高倍镜使用细准焦螺旋。
7、病毒无细胞结构,但是可以进行新陈代谢和繁殖后代,所以属于生物。
病毒有蛋白质和核酸( DNA或 RNA)构成,根据核酸的种类可分为 DNA病毒、 RNA病毒。
8、原核生物有细胞壁,其成分主要为肽聚糖。
植物细胞的细胞壁成为主要为纤维素和果胶。
9、艾滋病患者不是死于艾滋病病毒,而是因为患者的淋巴细胞被艾滋病病毒大量破坏,导致人体免疫力降低,病人大多死于其他病原微生物的感染。
10、单细胞生物是地球上最早出现的生命形式。
11、原核生物只有核糖体这一种细胞器,但是它可以进行光合作用和有氧呼吸(包含相关的酶和色素就行)。
12、细胞的统一性表现在:细胞膜、细胞质、核糖体、DNA。
第二章1、注意题干中元素的大量元素还是微量元素。
大量元素、微量元素是根据元素的含量划分的。
无论是大量元素还是微量元素,都是生物体必需的元素,对于维持生物体的生命活动都起着重要的作用。
2、任何细胞含量最多的化合物一定是水。
活细胞中含量最多的元素是氧元素,但数量最多的是氢原子。
3、三大物质鉴定实验:(1) 鉴定非还原糖 ( 如蔗糖 ) 时:如果与斐林试剂混合,水浴加热后的现象不是无色,而是浅蓝色[Cu(OH) 2 的颜色 ] 。
(2)脂肪鉴定现象观察①若要观察被染色的脂肪颗粒,则使用显微镜。
②若要通过观察溶液颜色变化,则不必使用显微镜。


第三节蛋白质和核酸学习目标核心素养1.了解氨基酸的组成和结构,知道氨基酸的两性。
2.了解氨基酸的组成、结构特点和主要化学性质,知道氨基酸和蛋白质的关系。
3.了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。
了解氨基酸、蛋白质与人体健康的关系。
4.认识蛋白质、酶、核酸等物质与人体健康的关系。
1.从微观官能团的角度理解氨基酸、蛋白质性质和核酸的性质,形成结构决定性质的观念,能从宏观和微观相结合的视角分析和解决实际问题。
(宏观辨识与微观探析)2.从蛋白质的性质出发,具有较强的问题意识,设计实验方案,并能对实验进行评价和优化。
(科学探究与创新意识)3.认识蛋白质和核酸在生命科学发展中的重要应用,感受化学对社会发展的重大贡献。
(科学态度与社会责任)一、氨基酸的结构与性质1.概念和结构:(1)概念:羧酸分子中烃基上的氢原子被氨基取代的化合物。
(2)结构:α-氨基酸的结构简式为,官能团为氨基(—NH2)和羧基(—COOH)。
(3)常见的氨基酸。
俗名结构简式系统命名甘氨酸α-氨基乙酸丙氨酸α-氨基丙酸谷氨酸2-氨基-1,5-戊二酸苯丙氨酸α-氨基苯丙酸2.氨基酸的性质:(1)物理性质。
颜色状态熔点溶解性水强酸或强碱乙醇、乙醚无色晶体较高大多数能溶能溶难溶(2)化学性质。
①两性。
氨基酸分子中既含有羧基,又含有氨基,是两性化合物,因而能与酸、碱反应生成盐。
a.α 氨基酸与盐酸的反应:。
b.α 氨基酸与氢氧化钠的反应:。
②成肽反应。
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基和另一分子的羧基间脱去一分子水,缩合成含有肽键()的化合物的反应,称为成肽反应。
例如,氨基酸二肽或多肽蛋白质。
【微思考】既能与酸反应,又能与碱反应的物质有哪些?提示:氨基酸、Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2CO3]。
【教材二次开发】教材介绍了氨基酸的成肽反应,成肽反应的反应机理是什么?有哪些成肽方式?提示:酸脱羟基、氨脱氢。

课时3糖类、油脂和蛋白质目标与素养:1.了解糖类的组成、物理性质和主要应用。
(宏观辨识)2.掌握糖类的主要化学性质。
(变化观念)3.了解油脂的组成、性质及应用。
(科学态度与社会责任)4.了解蛋白质的组成和主要性质。
(科学探究)一、糖类1.组成和分类(1)组成:由C、H、O三种元素组成,大多数糖类符合通式C n(H2O)m。
(2)分类糖类根据其能否水解以及水解产物的不同来分类。
微点拨:(1)有甜味的物质不一定是糖类,糖类物质也不一定是甜的。
例如,木糖醇和糖精都是甜的,但不属于糖。
淀粉和纤维素属于糖,但是都不甜。
(2)有些糖类物质在分子组成上不符合C n(H2O)m通式,如鼠李糖的分子式为C6H12O5,脱氧核糖的分子式为C5H10O4;还有些分子式符合C n(H2O)m的物质不是糖,如乙酸的分子式为C2H4O2,甲醛的分子式为CH2O等。
2.葡萄糖(1)结构①与新制Cu(OH)2悬浊液反应实验现象:试管中有砖红色沉淀生成。
实验结论:葡萄糖具有还原性,能被弱氧化剂如新制Cu(OH)2悬浊液氧化,生成砖红色氧化亚铜沉淀。
应用:这一反应可用于尿糖的检测。
②体内氧化葡萄糖在人体组织中发生氧化反应,为生命活动提供能量。
化学方程式为C6H12O6+6O2―→6CO2+6H2O。
微点拨:含醛基的有机物均能与新制Cu(OH)2悬浊液反应生成砖红色沉淀,且反应条件均为碱性环境和加热。
3.淀粉和纤维素(1)淀粉①属于天然高分子化合物,主要存在于植物的种子或块根里,淀粉在酸或酶的催化作用下可以逐步水解,最终生成葡萄糖。
②在常温下,淀粉遇碘变蓝,可用于检验食物中淀粉是否存在。
(2)纤维素①天然高分子化合物,是构成植物细胞壁的基本成分,一切植物中都含纤维素。
人体不能消化纤维素。
②它在一定条件下水解也能生成葡萄糖。
微点拨:利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程:二、油脂1.分类(1)油:植物油脂通常呈液态,如:豆油、花生油等。


2024年高考生物复习易错点解析—蛋白质和核酸的三个理解误区易错陷阱1:蛋白质变性和盐析本质相同。
【分析】高温使蛋白质变性的原因不是高温破坏了氨基酸之间的肽键,而是高温使肽链盘曲折登形成的空间结构发生不可逆变化。
低温和盐析未使蛋白质分子的空间结构发生不可逆变。
易错陷阱2:DNA分子和蛋白质分子在高温下空间结构都会出现不可逆的变化。
【分析】DNA分子和蛋白质分子对高温的耐受性不同,DNA分子对高温的耐受性通常比蛋白质分子高。
易错陷阱3:蛋白质的水解就是氧化分解。
【分析】蛋白质初步水解的产物是:多肽,彻底水解的产物是:氨基酸,氧化分解的产物是:二氧化碳、水和尿素。
【易错点提醒一】变性≠盐析【例1】某兴趣小组采用两种途径处理鸡蛋清溶液,过程如图所示。
有关叙述正确的是()A.①③处理后溶液中含有氨基酸B.②过程可能破坏了蛋白质的空间结构C.高温后蛋白质容易被蛋白酶水解,吃熟鸡蛋容易消化D.④过程若加入取自动物消化道中的物质,会破坏蛋白质的空间结构但不影响肽键【答案】BC【解析】蛋白质经盐析处理后再溶解还是蛋白质,A错误;②过程可能破坏了蛋白质的空间结构,B正确;高温后蛋白质分子的空间结构变得伸展、松散,更易被蛋白酶水解,吃熟鸡蛋容易消化,C正确;④过程蛋白质被消化液中的蛋白酶催化水解,会破坏蛋白质的空间结构和肽键,D错误;【变式1-1】(2023·海南·高考真题)科学家将编码天然蜘蛛丝蛋白的基因导入家蚕,使其表达出一种特殊的复合纤维蛋白,该复合纤维蛋白的韧性优于天然蚕丝蛋白。
下列有关该复合纤维蛋白的叙述,正确的是()A.该蛋白的基本组成单位与天然蜘蛛丝蛋白的不同B.该蛋白的肽链由氨基酸通过肽键连接而成C.该蛋白彻底水解的产物可与双缩脲试剂发生作用,产生紫色反应D.高温可改变该蛋白的化学组成,从而改变其韧性【答案】B【解析】该蛋白的基本组成单位是氨基酸,与天然蜘蛛丝蛋白的基本单位相同,A 错误;氨基酸是组成蛋白质的基本单位,该蛋白的肽链由氨基酸经过脱水缩合反应通过肽键连接而成,B正确;该蛋白彻底水解的产物为氨基酸,不能与双缩脲试剂发生作用产生紫色反应,C错误;高温可改变该蛋白的空间结构,从而改变其韧性,但不会改变其化学组成,D错误。
第5课时蛋白质和氨基酸学习目标核心素养建构1.了解蛋白质的组成和主要性质。
2.了解蛋白质在日常生活中的应用。
3.了解氨基酸的结构特点。
[知识梳理]一、蛋白质1.存在与组成(1)存在:蛋白质广泛存在于生命体内,是组成细胞的基础物质。
动物的肌肉、毛皮、血液等的主要成分都是蛋白质;大多数酶都是蛋白质。
(2)组成:蛋白质主要由碳、氢、氧、氮等元素组成,属于天然高分子化合物。
2.蛋白质的性质(1)蛋白质的盐析按表中实验操作完成实验,并填写下表:实验操作实验现象实验结论向(NH4)2SO4饱和溶液中加入鸡蛋清溶液后,有沉淀析出,沉淀加入到蒸馏水中时又溶解(NH4)2SO4饱和溶液能降低鸡蛋清在水中的溶解度,但不改变鸡蛋清的性质由实验可知:①概念:浓无机盐溶液使蛋白质的溶解度降低而使其从溶液中析出的过程叫盐析。
②条件:浓的轻金属盐溶液或铵盐溶液。
少量的无机盐能促进蛋白质的溶解。
③特点:盐析是可逆过程,继续加水时,能使沉淀溶解,不影响蛋白质的生理活性。
可用来分离、提纯蛋白质。
(2)蛋白质的变性按表中实验操作完成实验,并填写下表:实验操作实验现象加热后,鸡蛋清沉淀,凝结的鸡蛋清放入蒸馏水中不溶解加入CuSO4溶液后,鸡蛋清沉淀,凝结的鸡蛋清放入蒸馏水中不溶解加入乙醇的水溶液后,鸡蛋清沉淀,凝结的鸡蛋清放入蒸馏水中不溶解实验结论加热、CuSO4溶液、乙醇都能使蛋白质的性质发生改变由实验可知:①蛋白质的变性是在紫外线照射、加热或加入酸、碱、重金属盐、有机物(乙醇、苯酚、甲醛等)的情况下,蛋白质发生性质上的改变而聚沉的过程。
②蛋白质的变性是不可逆的化学变化过程,可以利用这一性质进行杀菌消毒。
(3)水解:蛋白质在一定条件下能发生水解反应,水解产物为氨基酸。
【自主思考】1.为什么医院里用高温蒸煮、照射紫外线、在伤口处涂抹酒精溶液等方法来杀菌消毒?提示高温、紫外线、酒精等都可以使蛋白质变性,杀死细菌,起到消毒作用。
2.为什么在农业上用波尔多液(由硫酸铜、生石灰和水制成)来消灭病虫害?提示波尔多液含有重金属盐,能使蛋白质变性。
·研究探讨·295蛋白质的性质重庆西南大学 陈沛文一、教学目标知识与技能:了解蛋白质的组成、结构及用途;了解蛋白质的盐析、水解、变性、显色等性质;过程与方法:通过小组实验,了解蛋白质的性质及特征反应;结合生活实际,了解蛋白质的应用及在生命活动中的重要作用。
情感态度价值观: 培养实验操作能力,激发对化学学科的兴趣; 通过学生自己动手做实验,激发学生的学习兴趣,营造宽松、愉快的教学氛围。
二、教学重点及难点重点:蛋白质的结构及性质难点:变性与盐析的比较三、教学过程【讲】老师在家做煎鸡蛋的时候发现鸡蛋煎出的效果有两种,同学们能告诉我有哪些不一样吗?原来,这是一个假鸡蛋。
人造鸡蛋的蛋清主要是树脂、淀粉、凝固剂等成分。
而真鸡蛋的主要成分是蛋白质。
那么你能运用你们已学的知识来验证蛋白质吗?【提问】我们还可以运用什么方法来解决这个问题吗?学了蛋白质的性质你就知道了。
【讲】首先请大家阅读教材第88页回答以下问题。
1.蛋白质的组成元素是什么?2.蛋白质具有怎样的空间结构?3.蛋白质所含的官能团有哪些?【提问】根据官能团,你能推测出蛋白质具有怎样的化学性质吗?【讲解】由于蛋白质是氨基酸脱水形成肽链而来的,它和氨基酸一样有游离的氨基和羧基具有两性。
同时形成的肽键,能够发生水解反应。
【讲解】人体中蛋白质在酸、碱或酶的催化作用下首先形成了多肽然后再进一步水解断开肽键一端接羟基,一端接氢,生成氨基酸。
天然的蛋白质水解后是天然的氨基酸。
【提问】请大家判断下列结构片段的蛋白质在胃中水中水解产生的氨基酸有几种?【讲解】蛋白质易发生水解肽链中的肽键断裂。
一端接羟基一端接氢,形成氨基酸。
因此形成的氨基酸就有2种。
【提问】氨基酸在人体内有一部分用于供能,而另外一部分则组合成新的蛋白质,所以我们要通过食用大量富含蛋白质的食物。
例如血旺、豆腐等。
它们是怎么的来的呢?在这个凝结的过程中又发生了哪些反应呢?【讲解】我们一起进行蛋白质的性质实验。
一.氨基酸1 八种必须氨基酸的英文命名及缩写。
赖氨酸Lysine Lys K甲硫氨酸Methionine Met M缬氨酸valine Val V异亮氨酸isoleucine Ile I苯丙氨酸phenylaninePhe F亮氨酸leucine Leu L色氨酸tryptophan Try W苏氨酸threonine thr T2 俩种氨基酸组成多肽时,有几种?成二肽,有四种成三肽时,有八种(仅供参考,不一定正确,有不同意见请指出来)。
二酶分析1酶活性的定义,国际常用的单位:酶活性(enzyme activity)也称为酶活力,指酶促反应速率,即规定条件下在单位时间内产物的生成量或底物的减少量。
酶活性单位:表示酶的相对含量,指在一定条件下,单位时间内生成一定量的产物或消耗一定量的底物所催化的酶量。
a.国际单位IU(µmol/min)定义:在规定条件下(25℃及其他最适条件),每分钟催化1µmol 底物转变为产物的酶量,为1IU或1U。
1IU=1µmol/min。
B.Katal单位(mol/s)定义:1Katal是在规定条件下,每秒钟催化1mol底物转变为产物的酶量。
1Katal=1mol/s。
IU与Katal单位的关系:1katal = 60×106IU,1IU = 16.67nkatal3 酶促反应酶促反应的历程:延滞期,线性期,非线性期a.酶促反应式:B.米氏方程C .Km 的含义与意义.Km 的含义:当Km=[S]时,可见Km 值等于反应速率达到最大反应速率Vmax 一半时的底物浓度。
Km 的意义:Km 是酶的一个特征性常数(其他如等电点),Km 的大小只与酶的性质有关反映酶对底物亲和力的大小选择酶的最适底物或天然底物计算不同底物浓度时的反应程度鉴别酶的种类判断可逆反应的速率判断酶偶联反应的限速反应计算工具酶的用量3.两种测定酶活性的方法:a .定时法原理:定时法是固定时间法的简称,是指测定反应开始后一段时间(t1~t2)产物的增加量或底物的减少量以测定酶活性的方法。
蛋白质盐析实验注意事项及实验步骤蛋白质盐析实验注意事项及实验步骤一、注意事项:1. 盐析的成败决定于溶液的 pH 值与离子强度,溶液 pH 值越接近蛋白的等电点,蛋白质越容易沉淀。
2. 盐析一般用的硫酸铵,容易吸潮,因而在使用前,一般先磨碎,平铺放入烤箱内 60 摄氏度烘干后再称量,这样更准确。
3. 在加入盐时应该缓慢均匀,搅拌也要缓慢,越到后来速度应该更注意缓慢,如果出现一些未溶解的盐,应该等其完全溶解后再加盐,以免引起局部的盐浓度过高,导致酶失活。
4. 盐析后最好搅拌 40 分钟到一个小时而且再在冰浴中放置一段时间。
3.5 为了避免盐对酶的影响,一般脱盐处理后再测酶活性。
5. 盐析后的蛋白质最好尽快脱盐处理,以免变性,透析较慢,一般可用超滤或者 G-25, G-50 处理。
6. 一般粗提物蛋白完全沉淀是在硫酸铵浓度在70%左右。
二、实验步骤:蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。
其中应用最多的硫酸铵,由下表可以看出:它的优点是温度系数小而溶解度大 (20 度时饱和溶液为 754 克/ 升;0 度时饱和溶解度为 706 克/ 升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来; 另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。
硫酸铵溶液的 pH 常在 4.5-5.5 之间,当用其他 pH 值进行盐析时,需用硫酸或氨水调节。
表 1 几种盐在不同温度下的溶解度(克 /100 毫升水)o c20 C80 C100 C(NH4)2SO470.675.495.3103Na2SO44.918.943.342.2NaH2PO41.67.893.8101饱和硫酸铵法:1. 取 x ml 血清加 x ml 生理盐水,于搅拌下逐滴加入 2xml 饱和硫酸铵,硫酸铵的终饱和度为50%。
2. 4 C, 3h以上,使其充分沉淀离心(3000rpm),20min, 充上清,以 xml 生理盐水溶解沉淀,再逐滴加饱和硫酸铵 x/2ml 。