计算机化系统分类清单
- 格式:doc
- 大小:34.50 KB
- 文档页数:5
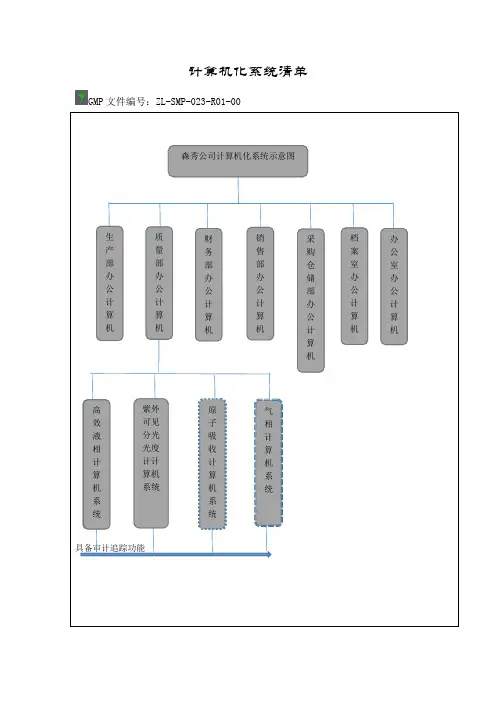
GMP文件编号:ZL-SMP-023-R01-00具备审计追踪功能森秀公司计算机化系统示意图生产部办公计算机质量部办公计算机财务部办公计算机销售部办公计算机采购仓储部办公计算机档案室办公计算机办公室办公计算机高效液相计算机系统气相计算机系统原子吸收计算机系统紫外可见分光光度计计算机系统GMP文件编号:ZL-SMP-023-R01-00序号计算机编号名称安装部门责任人药品生产质量管理相关的功能备注1 JSJ-001 生产部办公计算机生产部初金芝药品生产管理2 JSJ-002 采购仓储部办公计算机采购仓储部侯文华原辅料成品库存3 JSJ-003 财务部办公计算机财务部任晓敏药品财务发票4 JSJ-004 销售部办公计算机销售部侯文华销售发货,召回5 JSJ-005 办公室办公计算机办公室马义人员管理6 JSJ-006 设备部办公计算机生产部郑宏宇设备档案7 JSJ-007 质量部办公计算机质量部齐天宝药品质量管理8 JSJ-008 紫外-可见计算机质控室谢应舟含量测定9 JSJ-009 高效液相计算机质控室谢应舟液相含量检测具审计追踪功能10 JSJ-010 高效气相计算机质控室谢应舟气相含量测定具审计追踪功能11 JSJ-011 原子吸入分光光度计计算机质控室谢应舟含量测定具审计追踪功能计算机系统管理员清单更新日期:年月日。
1.目的:建立计算机系统管理规程,规范公司计算机系统的使用,确保公司数据安全。
2.范围:公司所有计算机化系统。
3.责任人:企业负责人、质量负责人、生产负责人及各部门负责人。
4.内容:4.1计算机化系统定义:由硬件、系统软件、应用软件以及相关外围设备组成的,可执行某一功能或一组功能的体系。
4.2计算机化系统管理原则:4.2.1计算机化系统代替人工操作时,应当确保不对产品的质量、过程控制和其质量保证水平造成负面影响,不增加总体风险。
4.2.2风险管理应当贯穿计算机化系统的生命周期全过程,应当考虑数据完整性和产品质量。
作为质量风险管理的一部分,应当根据书面的风险评估结果确定验证和数据完整性控制的程度。
4.2.3供应商提供产品或服务时(如安装、配置、集成、验证、维护、数据处理等),应当与供应商签订正式协议,明确双方责任,并基于风险评估的结果开展供应商质量体系审计。
4.3术语:4.3.1计算机化系统生命周期:计算机化系统从提出用户需求到终止使用的过程,包括设计、设定标准、编程、测试、安装、运行、维护等阶段。
4.3.2应用程序:安装在既定的平台/硬件上,提供特定功能的软件。
4.3.3 PLC(programmable logic controller):可编程控制器。
4.3.4 URS:用户需求标准,用户需求说明书.4.3.5 I/O:输入/输出4.3.6白盒法:白盒法也称为结构测试或者是逻辑驱动测试,是在软件测试过程中,由详细设计提供的文档,从软件的具体的逻辑结构和执行路径出发,设计测试用例,完成测试的目的,白盒法测试主要用于测试程序内部逻辑。
4.3.7黑盒法:黑盒法也称功能测试或者数据驱动测试,是基于规格说明的测试,它是在已知产品所应具有的功能,通过测试来检测每个功能是否都能正常使用,在测试时,把程序看作一个不能打开的黑盒子,在完全不考虑程序内部结构和内部特性的情况下,测试者在程序接口进行测试,它只检查程序功能是否按照需求规格说明书的规定正常使用,程序是否能适当地接收输入数据而产生正确的输出信息,并且保持外部信息(如数据库或文件)的完整性,常用如下4 种方法:4.3.7.1 等价划分法(将系统的输入区域划分为若干等价类,用每个等价类中的一个具有代表性的数据作为测试数据)。

1. 目的:规范在药品生产质量管理过程中应用的计算机化系统,确保其运行稳定、可靠、数据真实,计算机化系统代替人工操作时,不会对产品的质量、过程控制和其保证水平造成负面影响,不增加新的风险。
2. 范围:适用于本公司在药品生产质量管理过程中应用的计算机化系统。
3. 责任者:所有参与计算机化系统操作、管理、维护及验证管理的相关人员执行本规程,质量管理部监督本规程的实施。
4. 正文:4.1 计算机化系统的定义:由硬件、系统软件、应用软件以及相关外围设备组成的,可执行某一功能或一组功能的体系。
4.2 计算机化系统管理原则4.2.1 计算机化系统代替人工操作时,应当确保不对产品的质量、过程控制和其质量保证水平造成负面影响,不增加总体风险。
4.2.2 风险管理应当贯穿计算机化系统的生命周期全过程,应当考虑患者安全、数据完整性和产品质量。
作为质量风险管理的一部分,应当根据书面的风险评估结果确定验证和数据完整性控制的程度。
4.2.3 计算机化系统供应商提供产品或服务时(安装、集成、验证、维护、数据处理等),应当与供应商签订正式协议,明确双方责任,并基于风险评估的结果开展供应商质量体系审计,并按要求及时完成相关文件记录。
4.2.3.1 计算机化系统供应商管理4.2.3.1.1 应根据风险级别及计算机化系统的类别建立计算机化系统供应商档案,对于在生产质量控制及管理中起重要作用、属3类、4类的计算机化系统必须建立完善的供应商档案,档案的内容应包括供应商的联系方式及联系人、供应商介绍、供应商资质证明、供应商审计记录及批准报告、质量保证协议等等。
4.2.3.1.2 计算机化系统供应商审计也需要根据风险级别及计算机化系统的类别开展。
审计团队应包括使用部门、工程设备部、质量管理部。
审计方式可以采取三种方式:a. 历史经验(基于可用信息的判断),根据公司的经验总结共享;b. 调查问卷邮寄审计;c. 现场审计,此种审计费用较高,但是对于风险级别较高、系统复杂的计算机化系统供应商,开展现场审计是非常必要的。

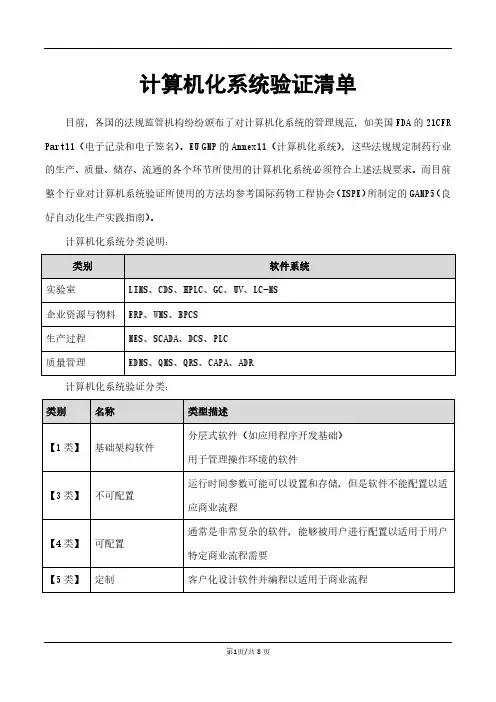
计算机化系统验证清单
目前,各国的法规监管机构纷纷颁布了对计算机化系统的管理规范,如美国FDA的21CFR Part11(电子记录和电子签名)。
EU GMP的Annex11(计算机化系统),这些法规规定制药行业的生产、质量、储存、流通的各个环节所使用的计算机化系统必须符合上述法规要求。
而目前整个行业对计算机系统验证所使用的方法均参考国际药物工程协会(ISPE)所制定的GAMP5(良好自动化生产实践指南)。
计算机化系统分类说明:
计算机化系统验证分类:
1.1计算机化系统验证流程
1.2计算机化系统验证清单
序号验证阶段内容框架类别
【1】计划阶段
01
用户需求说明
(URS)
【编写用户需求】
【审核用户需求】
【批准用户需求】
用户需求(URS)是从用户的角度描述系统的需求。
它应当
根据系统的工艺需求,描述系统所需具备的功能、控制参
数、数据采集、数据存储、数据输出、数据备份、数据还
原、权限控制、电子签名等各项要求,确保系统的功能满
足法规要求及符合预定用途。
用户需求(URS)主要内容:
1、文件的整体介绍,内容包括:
文件内容摘要
目的:阐述写该项目URS的目的。
适用范围:要确定文件用在项目建设中哪个阶段,指导
什么工作。
参考文献:主要列出在描述URS时引用的文献资料名
称、版本、章节等。
2、项目简介、背景
这部分内容应该摘自项目计划书。
3、文件内容,包括:
甲方编写。


XXXXX有限公司【生产质量计算化系统验证管理规程】适用于我公司在药品生产质量管理过程中应用的计算机化系统管理目录1.计算机化系统定义分类1.1系统定义1.2管理原则1.3硬件分类1.4系统分级1.5系统清单2.计算机化系统验证管理规程2.1系统生命周期及管理2.2风险评估管理2.3供应商管理2.4系统台账管理2.6权限安全管理2.7数据安全管理2.8应急预案2.9验证文件的管理3.计算机化系统验证操作规程3.1可行性研究3.2工程计划3.3需求定义3.4系统设计3.5系统测试3.6用户需求标准(URS)3.7安装确认阶段3.8 运行确认阶段3.9性能确认阶段3.10运行阶段3.11系统变更3.12系统引退附件:1、计算机化系统清单2、计算机化系统权限清单3、新用户使用电子系统申请表4、现有用户更改系统权限申请表5、现有用户取消系统授权申请表6、数据备份记录表7、系统验证证书XXXXX有限公司目的:计算机化系统验证工作应遵从的基本程序,使计算机系统验证符合GMP的法规要求,同时使验证工作有组织、有计划的顺利进行。
为了测试、评估计算机和PLC釆取的URS、设计、采购、安装、验证、使用过程,确保计算机和PLC符合设计要求和使用要求,特制定本规程。
范围:适用于公司药品生产质量管理过程中应用的计算机化系统、PLC控制系统。
用于公司所有GMP计算机和自动化系统的管理,此类系统用于或为GMP 法规环境提供支持。
责任:质量部、设备工程部、总办(信息管理)对此规程和实施负责。
参与计算机化系统软件的规划、选型、购置、安装、调试、验收、验证、维修、检查、改造及供应商审计等工作,并在计算机化系统使用及维护过程中提供技术支持。
使用部门:根据计算机化系统标准管理规程正确使用、维护、验证计算机化系统。
依据:中华人民共和国食品药品监督管理《药品生产质量管理规范》等相关条款和要求。
正文:1.计算机化系统定义由硬件、系统软件、应用软件以及相关外围设备组成的,可执行某一功能或一组功能的体系。

4、SCADA系统(集团级)
即分布式数据采集和监控系统,它集中了PLC系统的现场测控功能和DCS系统的组网通讯能力两大优点,性价比高,主要用于大系统、大量、甚至远程数据的采集和监控。
三、C类:检验数据处理类计算机
1、实验室设备计算机控制/数据采集处理分析系统
HPLC(液相)、GC(气相)、IR(红外光谱)、UV(紫外)
CDS色谱工作站(普通个人计算机+特定的数据采集系统+检验仪器)与(工业控制计算机+IO接口+输入输出信号)类似
四、D类:办公及管理类计算机
1、个人电脑(生产质量管理、文件记录管理、人员培训管理)
2、LIMS系统:实验室信息管理系统
6、基于互联网的电子商务版ERP。
计算机化系统管理文件体系的建立前几天,有些人一直在问我计算机化系统到底怎么样验证,管理文件怎么弄,他们觉得计算机化系统是如此的另类,必须有单独的《计算机化系统管理规程》、《计算机化系统验证主计划》、《计算机化系统验证SOP》、《计算机化系统变更管理规程》、《计算机化系统偏差管理规程》、《计算机化系统操作管理规程》、《计算机化系统维护管理规程》……,反正,只要别的设备有的,计算机化系统也要有,恨不得为“计算机化系统”另外建立一套完整的GMP体系文件,这真是一个庞大的世纪工程!前面的几期微信中,我一直在说,“计算机硬件”其实就是普通的电气设备、或者主设备和主系统的一个组成部分,我们把它理解为设备的一个关键部件也可以,那么“计算机软件”就是写给计算机系统进行运行的“操作SOP”,计算机硬件按照软件指令进行工作,那么“软件”就和写给人的操作SOP文件没有本质区别。
如果把计算机比作人也可以,我们没必要去研究人的五脏六腑、七情六欲,只要经过适当的培训,他能够按照SOP进行正常的操作,就OK了!如果真的要为计算机化系统建立一些管理规程,我觉得也没必要全部都特别单独建立。
1、质量风险管理计算机系统作为一台设备或者设备的一个部件进行风险管理就可以了,没必要单独写一份计算机化系统的质量风险管理文件,计算机化系统代替人工操作,不应增加风险,风险主要来自于计算机执行的动作和实现的功能对产品质量的影响。
而且风险管理应当贯穿设备的生命周期,当然包括计算机化系统,作为质量风险管理的一部分,就可以了。
2、验证主计划如果非想单独写一份计算机化系统的验证主计划,也可以,随便吧。
制药项目实施阶段可以有项目验证主计划,也可以分车间和QC,当然也可以分计算机和非计算机,正常运行阶段有公司的验证主计划,当然也可以把计算机系统单列,不过我认为没必要。
3、计算机化系统分类清单台账登记,可以把嵌入式计算机系统(比如智能仪表)不单独登记,但是它们肯定也是计算机系统。
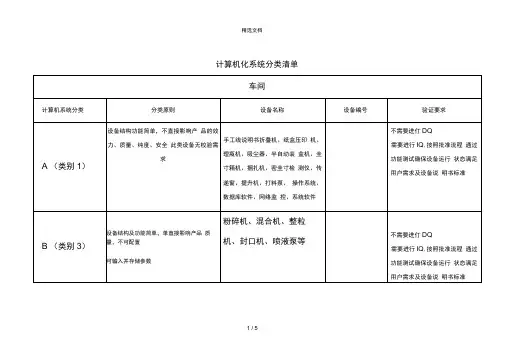
计算机化系统分类清单计算机化系统分类清单车间计算机系统分类分类原则设备名称设备编号验证要求A(类别1)设备结构功能简单,不直接影响产品的效力、质量、纯度、安全此类设备无校验需求手工线说明书折叠机、纸盒压印机、理瓶机、吸尘器、半自动装盒机、封箱机、捆扎机、密封检测仪、传递窗、提升机、打料泵、操作系统、数据库软件、网络监控、系统软件不需要进行DQ需要进行IQ,按照批准流程通过功能测试确保设备运行状态满足用户需求及设备说明书标准B(类别3)设备结构及功能简单,单直接影响产品质量,不可配置可输入并存储参数粉碎机、混合机、整粒机、封口机、喷液泵等不需要进行DQ需要进行IQ,按照批准流程通过功能测试确保设备运行状态满足用户需求及设备说明书标准设备结构、功能相对复杂,对产品质量有一定影响,但非关键中包机、全自动装箱机、纸箱码垛机、检重仪、金属探测器、烘箱、洗衣机、干衣机1.需要进行DQ(成熟品牌的商用设备可通过“URS反馈表”完成设计确认)2.需要进行IQ、OQ,个别设备还应考虑PQC类(类别3)设备结构复杂,可通过对运行中采集参数(信号)的处理实现相应的反馈,并最终实现设备的调整(自动或手动)设备会严重影响到产品的质量、效力、纯度、安全,某些功能的失效会带来法规风险制备罐、贮罐、压片机、胶囊填充机、包衣机、灌封机、计数装瓶机、泡罩包装机、全自动装盒机、贴标机、批号打印装置、照相检测装置、药监码系统、自动清洗机、手套箱等实验室计算机系统分类分类原则设备名称设备编号验证要求A(类别1)没有测量能力或者没有常规校验要求的保准设备氮气发生器、氢气发生器、水蒸气发生器、电子干燥箱、冰箱、显微镜、均质器、超声波清洗机、水浴锅、磁力搅拌器、漩涡搅拌器、离心机、摇床、菌类计数器、微波消解仪等不需要进行DQ需要进行IQ通过功能测试确保设备运行状态满足用户要求及设备说明书标准B(类别1)提供测量值得标准仪器和设备,仪器可通过需要校准的物理参数(如温度、压力或流量)进行控制。
.目的:规范我公司实验室计算机化系统管理,确保其准确、稳定、可靠运行。
.范围:适用于实验室计算机化系统责任:负责对本规程的编写、修订、审核、培训和执行;负责对本规程的执行进行监督;质量部负责人负责对本规程的批准。
内容:计算机化系统定义:计算机化系统由一系列硬件和软件组成,利用一系列指令(软件)执行自动功能的设备(硬件)。
实验室计算机化系统分类没有测量能力或没有常规校验要求的检验设备;没有用户界面,不产生原始数据及测试结果。
如氢气发生器、冰箱、磁力搅拌器、微波消解仪、离心机、菌落计数器等。
提供测量值的标准仪器和设备;仪器可通过需要校准的物理参数(如温度、压力、或流量)进行控制;仪器提供的功能和操作限制与用户要求一致;没有用户界面,产生原始数据及测试结果但不存储及处理。
如硬度仪、崩解仪、折光仪、旋光仪、电子天平、滴定仪、恒温恒湿箱、计等用户对于功能、运行和操作的限度要求与实际的分析应用相关;配置参数可存储并可再使用;没有用户界面,产生原始数据及测试结果但不存储及处理,如键盘控制仪器。
仪器结构复杂,包括仪器和与之相关的计算机化系统;有单一用户界面,配置参数可存储及再使用,但软件不能配置;产生原始数据及测试结果及处理。
如、、、、等。
实验室计算机化系统管理原则计算机化系统代替人工操作时,不会对产品的质量、过程控制和其质量保证水平造成负面影响,不增加总体风险。
风险管理应当贯穿计算机化系统生命周期全过程,应当根据书面的风险评估结果确定验证和数据完整性控制的程度。
制定实验室计算机化系统供应商管理规程,供应商提供产品和服务时,企业应当与供应商签订正式协议,明确双方责任。
根据风险评估结果提供与供应商质量体系和审计相关的文件。
计算机化系统权限管理实验室计算机化系统实行三级管理权限:管理员权限(管理员)、标准用户权限(实验室负责人、经理)、受限制用户权限(仪器分析员)管理员拥有最高权限,可以修改计算机系统的任何设置。
如建立各种计算机化系统账户,设置电脑系统时间、系统日志、操作员权限、增减登录帐户和初始登录帐户密码等。