醛酮的亲核加成反应
- 格式:ppt
- 大小:928.00 KB
- 文档页数:31





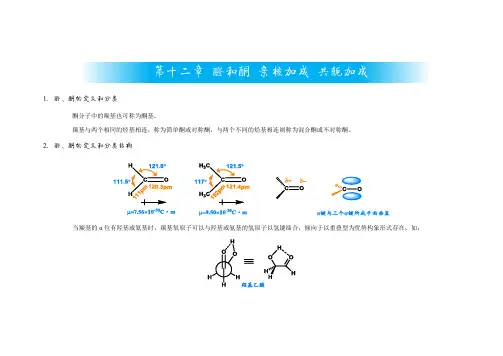
1. 醛、酮的定义和分类酮分子中的羰基也可称为酮基。
羰基与两个相同的烃基相连,称为简单酮或对称酮,与两个不同的烃基相连则称为混合酮或不对称酮。
2. 醛、酮的定义和分类结构当羰基的α位有羟基或氨基时,羰基氧原子可以与羟基或氨基的氢原子以氢键缔合,倾向于以重叠型为优势构象形式存在,如:第十二章 醛和酮 亲核加成 共轭加成3.醛、酮的物理性质由于羰基的偶极矩增加了分子间的吸引力,因此醛、酮的沸点比相应相对分子质量的烷烃高,但比醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水混溶(甲醛易溶于水,丙酮能与水以任意比例互溶,乙醛的溶解度为16g(100g H2O)-1)。
脂肪族醛酮相对密度小于1,芳香族醛酮相对密度大于1。
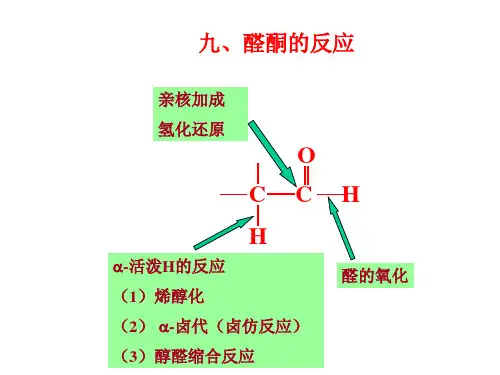
4.醛、酮的反应(1)羰基的亲核加成由于电子效应和空间位阻的原因,醛比酮表现的更活泼。
1)和含碳亲核试剂的加成①与有机金属化合物的加成此反应仅限于酮的烃基和格氏试剂的烃基都不太大,即空间位阻不很突出。
否则将发生两种“不正常”的反应:烯醇化反应及酮被还原。
烷基锂体积较小,因此当格氏试剂反应结果不好时,有时可以用烷基锂进行反应,会得到较好的结果,因此,格氏试剂与烷基锂可以相互补充。
当羰基与一个手性中心相连时,它与格氏试剂(也包括氢化铝锂等试剂)反应就是一个手性诱导反应。
亲核加成反应遵循Cram规则一,即:亲核试剂从空间位阻较小的一边进攻羰基碳原子。
为什么R与L取重叠型构象?因为这些试剂与羰基发生加成反应时,它们的金属部分须与羰基氧络合,因此羰基氧原子一端位阻增大,α碳上最大基团(L)与羰基处于反式,故R与L取重叠型构象为最有利于反应的构象。
②与HCN的加成丙酮与氢氰酸在氢氧化钠的水溶液中反应,生成丙酮羟腈,然后和甲醇在硫酸的作用下,即发生失水及腈的醇解反应,氰基变成甲氧酰基(-COOCH3):工业上就是利用这个反应步骤合成有机玻璃的。
碱性条件能加速该反应,这是由于氢氰酸是弱酸,其离解很少,[CN-]浓度很低,当加入NaOH时,碱与H+ 结合促使离解平衡右移,使亲核性的增大,但是碱性不能太强,因为最后还需要H+才能完成反应。

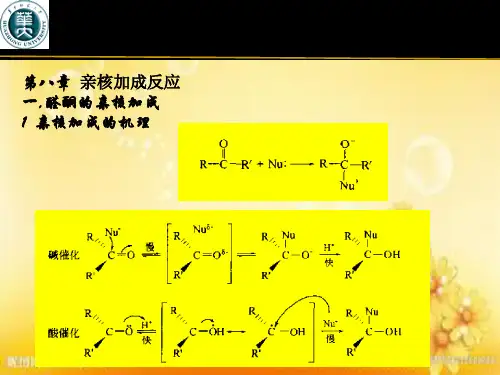

醛酮和氨的衍生物的反应
醛酮和氨的衍生物可以发生多种不同的反应。
以下是其中一些常见的反应及其解释:
1. 亲核加成反应:醛酮和氨可以发生亲核加成反应,形成亚胺。
在这个反应中,醛酮中的羰基碳与氨中的氮原子发生亲核反应,生成一个新的碳-氮键。
这个反应通常在碱性条件下进行,如氢氧化钠存在下的水溶液。
亲核加成反应对于合成具有胺基的化合物具有重要的意义。
2. 斯奈普斯合成:斯奈普斯合成是一种通过醛或酮与胺反应制备α-胺基酮的方法。
这个反应通过醛或酮与胺发生亲核加成反应,生成一个中间体,然后经过内分子重排,最终得到α-胺基酮。
斯奈普斯合成在有机合成中是一种重要的方法,可以用来构建复杂的有机分子骨架。
3. 纳卡莫拉反应:纳卡莫拉反应是一种利用醛和胺反应合成氨基醇的方法。
在这个反应中,醛和胺发生亲核加成反应,生成一个中间体亚胺。
然后,通过内分子重排和消除反应,亚胺转化为氨基醇。
纳卡莫拉反应可以用来合成含有氨基醇功能团的化合物,这些化合物在药物合成和天然产物合成中有重要的应用。
这些是醛酮和氨的衍生物可能发生的一些反应。
然而,需要根据具体的反应条件和分子结构来确定具体的反应路径和产物。
关于醛、酮亲核加成反应的几点教学体会[权威资料] 关于醛、酮亲核加成反应的几点教学体会[摘要]本文从羰基的结构特点入手,通过醛、酮的几个亲核加成反应实例,介绍了与醛、酮进行亲核加成的常用试剂、亲核加成反应机理,通过结构分析和理论分析判断不同反应物的反应活性等,揭示了醛、酮亲核加成反应本质。
[关键词]羰基;醛、酮;化学性质;活性J523 A 1009-914X(2015)08-0017-02醛、酮是一类重要的有机化合物。
其结构上的特点,决定了醛、酮具有非常活泼的化学性质。
其中,羰基的亲核加成是醛、酮最重要的化学性质之一。
一、有机化合物化学性质的判断和分析,应从官能团结构特征入手。
醛、酮的官能团都含有羰基。
其结构特点如下:1、羰基中含有不饱和键,化学性质活泼,可发生加成反应。
2、C原子采用sp2杂化轨道与O原子未杂化的2p原子轨道成键,形成平面结构。
3、羰基中的C=O是极性双键。
由于O原子的大电负性,使得体系电子云强烈偏向O原子(δ-),同时使得C原子带部分正电荷(δ+)。
4、Oδ- 比O原子稳定;由于C原子的价电子构型为2s22p2,既不易得电子,也不易失电子,所以Cδ+ 使得C原子很不稳定,容易受到带异性电荷的亲核试剂进攻,引起亲核加成反应。
二、常见的亲核试剂有:NaOH、NaCN、RO-Na+(醇钠或醇钾)、NH3、H2O等。
其中的亲核部分分别是:OH-、CN-、RO-(烷氧基负离子)、NH3(:N原子)、H2O(:O: 原子)。
三、醛、酮与HCN(NaCN)的亲核加成根据电子效应,写出该反应的产物并不难。
但笔者认为,重要的并不是结论,而是培养学生的分析判断、推导结论和进一步思考的能力。
大学教育要教给学生知识,更要教给学生方法。
对于上述反应,应启发学生做如下思考:1、反应为什么可逆,HCN是弱酸(Ka 量级为10-10),其解离出的CN-(亲核试剂)浓度过低,使得反应很快达到平衡。
2、如何改进这种可逆性,要使反应进行得较为彻底,可以考虑使用更强的亲核试剂:NaCN,即在HCN体系中加入NaOH。
醛酮类化合物发生亲核加成反应的反应机理一、引言醛酮类化合物发生亲核加成反应是一种常见的有机反应。
双官能团有芳烃醛或芳醛酮类。
在该反应中,由于原子间共价偶合作用,由芳氧基与另一原子间形成的双键(此处指羟基–氢键)具有相对极性,导致双官能团结合部分之间形成较强的亲核结合并发生加成反应。
二、反应机理(1)碱试剂和醛酮类化合物在碱性环境中发生反应,构成亲核碱的中间体(主要是(a)构建碱和双醛侧碱及(b)水解中间体发生水解)(2)中间体发生水解,产生亲核加成产物。
2、亲核碱的中间体的构建在一般情况下,醛酮类化合物发生亲核加成反应时,反应物中的醛或酮都可构建碱介质——亲核碱(以下缩写为CN)。
由于碱试剂存在,当芳氧基受到碱试剂的影响时,原子之间形成共价作用,在双官能团结构中形成共价键——双醛侧碱(也称为亲核结合)。
双官能团结构中和双醛侧碱共存的是两个电子对,其中一个电子对有一个电荷,是双官能团结构电子,另一个电子对有两个电荷,是双官能团特殊结构特异电子。
此处牵涉到元素原子间的氧化还原反应,在这两个电子对之间形成相对极性,从而形成芳氧基及其它原子(如碱试剂)间的羟基–氢键,也就是我们所说的双醛侧碱(对芳氧基来说是羟基–氢键,对碱试剂来说是质子–氢键)。
3、水解中间体的发生及反应结束双官能团结构中及双醛侧碱形成后,经过电子转移和重新局部还原等反应步骤,此交叉结构的中间体进行水解的步骤,最终形成亲核加成产物,反应结束。
三、总结醛酮类化合物发生亲核加成反应是一种碱式加成反应机理的常见反应,反应机理主要是双官能团化合物上的羟基–氢键形成亲核碱中间体,并在和水的反应过程中发生水解,最终形成亲核加成产物,反应结束。
醛酮的化学性质——羰基上的加成
羰基双键与烯烃不同,由于π键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
1.与氰化氢加成
醛和甲基酮可与HCN加成生成α—羟腈。
2.与NaHSO3加成
醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应
醛酮与格氏试剂反应是合成醇的重要方法之一。