选修四化学绪言---有效碰撞理论
- 格式:ppt
- 大小:12.51 KB
- 文档页数:3

第2节 影响化学反应速率的因素1.有效碰撞理论(1)有效碰撞:能够发生化学反应的碰撞.[化学反应发生的先决条件是反应物分子乊间必须发生碰撞.反应物分子乊间的碰撞只有少数碰撞能导致化学反应的发生,多数碰撞并不能导致反应的发生,是无效碰撞.碰撞的频率越高,则化学反应速率就越大.研究发现,只有既具有足够的能量又有合适的取向的分子碰撞,才是有效碰撞.有效碰撞是发生化学反应的充分条件.](2)活化分子和活化能①活化分子:能够发生有效碰撞的分子.②活化能:活化分子所多出的那部分能量(或普通分子转化成活化分子所需的最低能量).如下图所示中的E 1是反应的活化能,E 2是活化分子变成生成物分子放出的能量,能量差E 2-E 1是反应热.活化能越小,普通分子就越容易变成活化分子.即普通分子+活化能−−→−活化活化分子−−→−去活化普通分子+活化能(注:活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响)③活化能与化学反应速率:在一定条件下,活化分子所占的百分数是固定不变的.活化能低→普通分子易变成活化分子→活化分子百分数大→有效碰撞次数多→反应速率快,因此利用有效碰撞理论可以解释外界条件(浓度、温度、压强、催化剂)对化学反应速率的影响.2.浓度对化学反应速率的影响 2KMnO 4+5H 2C 2O 4+3H 2SO 4=2MnSO 4+K 2SO 4+10CO 2↑+8H 2OKMnO 溶液褪色 KMnO 溶液褪色 其他条件相同时,增大反应物的浓度,化学反应速率增大;减小反应物的浓度,反应速率减小.(3)理论解释其他条件不变时,对某一反应而言,活化分子在反应物分子中所占的百分数是一定的,如果反应物的浓度增大,则单位体积内活化分子数的数目增多,那么在单位时间内有效碰撞的次数也相应增多,化学反应速率也就增大了.【注意】①影响化学反应速率的是反应物以及生成物的浓度,而不是物质量的多少或反应物的总量.②溶液中发生离子反应时,与反应无关的离子浓度的大小对反应速率无影响,如NaOH 溶液和盐酸的反应时,增大Na +或Cl -的浓度,对该反应的反应速率无影响.③固体反应物颗粒越小,其总的表面积越大,与其他反应物的接触面积越大,有效碰撞次数增多,反应速率越大,故块状固体可以通过研磨以增大表面积来增大反应速率.④此规律只适用于气体或溶液的反应,不适用固体或纯液体的反应物.3.压强对化学反应速率的影响(1)结论:对于有气体参加的化学反应而言,在一定温度下,增大压强(减小容器体积),反应速率加快;减小压强(增大容器体积),反应速率减慢.(2)解释:在一定温度下,一定物质的量的气体所占的体积与压强成反比.增大压强(减小容器体积)就相当于增大反应物的浓度,反应速率加快;减小压强(增大容器体积)就相当于减小反应物的浓度,反应速率减慢.【特别提醒】①若参加反应的物质为固体或液体(溶液),由于压强的变化对它们的浓度几乎无影响,可以认为反应速率不变. ②对于有气体参加的可逆反应,增大压强,正反应速率、逆反应速率都增大;减小压强,正反应速率、逆反应速率都减小.(3)改变压强对反应速率的影响的几种情形对于有气体参加的反应,改变压强,对化学反应速率产生影响的根本原因是浓度的改变.所以讨论压强对反应速率的影响时,应区分引起压强改变的原因,这种改变对反应体系的浓度产生何种影响,由此判断出对反应速率有何影响.①恒温时:a.体积缩小−−→−引起压强增大−−→−引起浓度增大−−→−引起反应速率加快;b.体积增大−−→−引起压强减小−−→−引起浓度减小−−→−引起反应速率减慢.②恒温、恒容时:a.充入气体反应物−−→−引起总压强增大−−→−引起浓度增大−−→−引起反应速率加快;b.充入惰性气体(稀有气体、非反应体系气体,即不与反应体系中气体反应的气体)−−→−导致总压强增大,但参与该反应的气体的浓度不变−−→−导致反应速率不变.③恒温恒压时:充入惰性气体−−→−导致体积增大−−→−导致各反应物浓度减小−−→−导致反应速率减慢4.温度对化学反应速率的影响 Na 2S 2O 3+H 2SO 4=Na 2SO 4+S↓+SO 2↑+H 20冷水和热水中的两组实验均出现浑浊,但热水中的一组实验先出现浑浊 其他条件不变时,升高温度,反应速率加快;降低温度,反应速率减小.(3)理论解释在其他条件不变时,升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子(如下图)→活化分子百分数增加→有效碰撞次数增多→化学反应速率增大.因此,升高温度可以增大化学反应速率.【注意】①温度对反应速率的影响规律,对吸热反应、放热反应都适用,且不受反应物状态的限制.升温时,化学反应速率增大;降温时,化学反应速率减小.②对于可逆反应而言,升高温度,正、逆反应速率均增大,只是增大的程度不同;同理,降低温度,正、逆反应速率均减小,只是减小的程度不同.③许多实验表明,温度每升高10℃,反应速率通常增大到原来的2~4倍.④一般情况下,温度对化学反应速率的影响比浓度、压强对化学反应速率的影响要大,也更易控制.5.催化剂对化学反应速率的影响(1)实验探究①未加入MnO时,余烬无明显变化;2KMnO2MnSO4+K2SO4+10CO2↑+8H2O n C6H12O6(葡萄糖)①号试管中产生气催化剂能够改变化学化学反应速率.能加快化学反应速率的催化剂叫做正催化剂,能减慢化学反应速率的催化剂叫做负催化剂.在实际应用中,如不特别说明,凡是说催化剂都是指正催化剂.(3)原因分析使用催化剂→降低反应所需的能量(如下图)→更多的反应物分子成为活化分子→大大增加单位体积内的活化分子百分数→成千上万倍地增化学反应速率【注意】a.使用催化剂能同等程度地改变(加快或减慢)化学反应的正、逆反应速率.b.约85%的化学反应需要使用催化剂,在使用催化剂时应防止催化剂中毒.拓展点1:除了浓度、温度、压强、催化剂等能改变化学反应速率外,反应物的颗粒大小、溶剂的性质、光、超声波、磁场等也会对化学反应速率产生影响.6.化学反应速率影响因素的分析方法(1)控制变量某种物质发生某个化学反应时,反应速率的大小不仅取决于物质的本身性质,还受温度、浓度、催化剂、物质的存在状态、表面积等外界条件的影响.当研究多个因素间的关系时,往往先控制其他几个因素不变,集中研究其中一个因素的变化所产生的影响,这种研究方法称为“控制变量法”.如果同时改变温度和反应物的浓度,就难以弄明白温度、反应物浓度分别是怎样影响反应速率的.因此为更快地得出相关的规律,不能同时改变两个变量来研究反应速率的变化.(2)分清主次①多个因素影响反应速率时要看主要因素.例如锌和稀硫酸反应时,氢气的生成速率随时间变化先由慢到快,然后又由快到慢.反应体系中硫酸所提供的氢离子浓度由高到底,若氢气的生成速率由其决定,速率的变化趋势也是由快到慢.但事实并非如此,说明前半程变化只能是温度所致,锌与稀硫酸反应时放热,体系温度逐渐升高,温度对反应速率的影响占主导地位.一段时间后,硫酸的浓度下降对反应速率的影响占主导地位,因而氢气的生成速率随时间先由慢到快,然后又由快到慢.②一般来说,对于同一个化学反应,外界条件对反应速率的影响最显著的是催化剂,其次是温度,影响程度较小的是反应物的浓度和压强的改变.7.外界条件对可逆反应中正逆反应速率的影响分析对于可逆反应而言,由反应物生成生成物方向的反应速率叫正反应速率;同时还迚行着生成物乊间相互反应生成反应物的逆反应,由生成物生成反应物的反应速率叫逆反应速率.如:各种外界条件对上述反应的v(正)、v(逆)的影响分别是:(1)增大反应物(N2或H2)浓度,v(正)增大,v(逆)随乊增大;增大生成物(NH3)浓度,v(逆)增大,v(正)也随乊增大;减小反应物(N2或H2)浓度,v(正)减小,v(逆)随乊减小;减小生成物(NH3)浓度,v(逆)减小,v(正)也随乊减小.(2)升高温度,v(逆)和v(正)均增大,并且v(逆)增大的程度要比v(正)增大的程度大;减低温度,v(逆)和v(正)均减小,并且v(逆)减小的程度要比v(正)减小的程度大.(3)增大压强,v(逆)和v(正)均增大;减小压强,v(逆)和v(正)均减小.[注意:对于反应前后气体分子数相同的气体反应,加压时,v(逆)和v(正)同等倍数地增大,减压时,v(逆)和v(正)同等倍数地减小].(4)催化剂对可逆反应速率的影响是同等倍数地增大或减小v(逆)和v(正).8.外界条件对反应速率的影响本质9.有关化学反应速率的图像问题(1)图像类试题的解题技巧:一看、二想、三判断“一看”—看图像①看面:弄清纵、横坐标的含义.②看线:弄清线的走向、变化趋势以及线的陡与平.③看点:弄清曲线上点的含义,特别是一些特殊点,比如与坐标轴的交点、曲线的交点、拐点、最高点与最低点等.④看量的变化:弄清是浓度的变化、温度变化还是转化率的变化等.⑤看是否需要作辅助线:比如等温线、等压线等.“二想”—想规律看完线后联想外界条件对反应速率的影响规律.“三判断”—得出结论通过对比分析,做出正确判断.(2)具体图像类型此类问题主要包括反应速率与浓度、压强、反应温度、催化剂等外界条件的关系以及反应过程中的速率变化等. ①定性图像a.全程速率—时间图像比如Zn 与足量的盐酸反应,反应速率随时间的变化如上图所示.AB 段:Zn 与盐酸的反应是放热反应,溶液的温度升高,化学反应速率逐渐增大;BC 段:随着反应的迚行,盐酸的浓度逐渐减小,化学反应速率逐渐减小.b.速率—温度图像其他条件一定,反应速率随着温度的升高而增大,随着温度的降低而减小.如下图A 所示.c.速率—压强图像其他条件一定,增大气体反应的压强(缩小容器的体积),反应速率增大;减小气体反应的压强(增大容器的体积),反应速率减小.如上图B 所示.②定量图像定量图像主要是指反应物或生成物的物质的量(或物质的量浓度)与反应时间的定量关系.如下图所示:利用该类图像解决的问题主要有:a.化学方程式的确定;b.某物质在某时间段内的平均反应速率;c.化学反应达到平衡的时间.解决此类问题的方法是灵活应用“物质的量的变化量乊比=浓度的变化量乊比=化学计量数乊比”和化学反应速率的计算式:v=t c ∆∆=t V n ∆⋅∆。


有效碰撞理论
一、几个基本概念
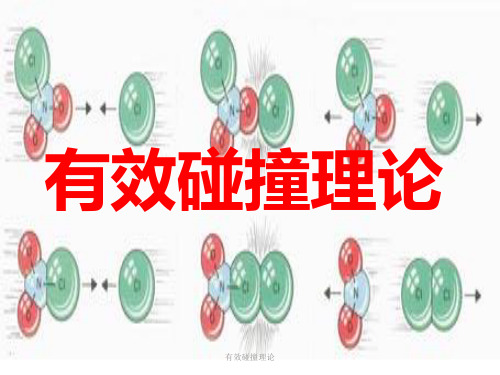
1、有效碰撞
化学反应发生的先决条件是反应物分子必须发生碰撞;但不是任何两种反应物分子之间的碰撞都能发生反应,只有少数分子的碰撞能发生反应,这种能够发生化学反应的碰撞称为有效碰撞.
2、发生有效碰撞的条件
①发生碰撞的分子具有较高的能量(活化分子
)
②分子在一定方向上发生碰撞
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关
3、活化分子
具有较高能量,能够发生有效碰撞的分子
4、活化能
化分子高出反应物分子平均能量的部分
活化分子的多少与该反应的活化能的大小有关,活化能的大小是由反应物分子的性质决定 活化能高,活化分子的百分数低,反应难; 活化能低,活化分子的百分数高,反应易。
活化分子百分数=活化分子数÷反应分子总数×100%
活化能越小,则单位体积中活化分子数越多,单位时间内的有效碰撞越多,反应速率
越快。
活化能越小,一般分子成为活化分子越容易,则反应条件越简单。
5、催化剂(触媒)
在化学反应中能改变其他物质的反应速率,而本身质量和化学性质在反应前后不变的物质。
下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应。


影响化学反应速率的影响因素【知识精讲深化思维】要点一:有效碰撞理论1、有效碰撞有效碰撞:能够发生化学反应(相互碰撞导致化学键断裂)的碰撞,是发生化学反应的充要条件;无效碰撞:不能发生化学反应(相互碰撞化学键不会断裂)的碰撞。
2、活化分子活化分子:具有较高能量,有可能发生有效碰撞的分子。
普通分子:具有较低能量,不能发生有效碰撞的分子。
3、活化能活化能:活化分子高出普通分子的能量;活化分子百分数:活化分子总数占分子总数的百分比。
例题1、下列说法中正确的是()①活化分子间的碰撞一定能发生化学反应②普通分子间的碰撞有时也能发生化学反应③活化分子比普通分子具有较高的能量④化学反应的实质是原子的重新组合⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程⑥化学反应的实质是活化分子有合适取向时的有效碰撞.A.①③④⑤B.②③⑥C.③④⑤⑥D.②④⑤解:①活化分子间有合适的取向,发生的碰撞一定能发生化学反应,故①错误;②普通分子间不可能发生化学反应,故②错误;③活化分子比普通分子具有较高的能量,故③正确;④化学反应的实质是旧键的断裂和新键的形成,即原子的重新组合,故④正确;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程,故⑤正确;⑥化学反应的实质是旧化学键的断裂和新化学键的形成过程,即活化分子有合适取向时的有效碰撞,故⑥正确;故选:C。
变式训练1、下列说法正确的是()①参加反应的物质的性质是影响化学反应速率的主要因素②光是影响某些化学反应速率的外界条件之一③决定化学反应速率的主要因素是浓度④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率.A.①②B.②③ C.③④ D.①④解:决定化学反应速率快慢的主要因素是反应物本身的性质,而浓度、温度、压强、催化剂是影响因素。
此外,还有固体物质的表面积,光,射线,溶剂性质等属于外因,也会影响化学反应速率,压强只对有气体参与的反应有影响。
故选:A。
有效碰撞目录有效碰撞之一能引起化学反应的碰撞叫有效碰撞。
如果反应物分子间任何一次碰撞均能发生反应,例如,H2与I2反应在常温下,当两者浓度均为1mol·L-1时,根据分子运动论可以算出每毫升、每秒内反应物分子可以发生约为1028次碰撞,仅需10-5s的时间,即可完成反应。
换言之,反应可以在瞬间内完成。
但从测定其反应速率知道,其中发生反应的只有1015次·mL·s-1,可见,差不多在1013次碰撞中仅有一次发生反应。
能发生反应的碰撞显然是活化分子间的碰撞;那些大量的未能引起反应的碰撞叫无效碰撞,或弹性碰撞。
未能引起反应的碰撞,显然是非活化分子(或普通分子)间的碰撞。
有效碰撞之二能够发生化学反应的分子(或原子)的碰撞叫做有效碰撞。
在化学反应中,反应物分子不断发生碰撞,在千百万次碰撞中,大多数碰撞不发生反应,只有少数分子的碰撞才能发生化学反应,能发生有效碰撞的分子是活化分子。
而活化分子的碰撞也不一定都能发生有效碰撞。
发生有效碰撞的分子有能量的因素,还有空间因素,只有同时满足这两者的要求才能发生有效碰撞。
编辑本段有效碰撞理论其基本假设(1)分子为硬球型;(2)反应分子A和B必须碰撞才能发生反应;(3)只有那些能量超过普通分子的平均能量且空间方位适宜的活化分子的碰撞,即“有效碰撞”才能起反应。
据此结合气体分子运动论,导出气相双分子反应的速率常数(k)有如下定量公式:k=N0(rA+rB)2[8πRT(1/MA+1/MB)]1/2e-E/RT=BT1/2e-E/RT 其中N0为阿佛伽德罗(Avogadro)常量,rA、rB为分子半径,MA、MB为分子质量,E为临界能(或称阈能),R为理想气体常量,T为热力学温度,B 是与温度无关的常数。
具有足够能量的反应粒子互相碰撞并且分解化学键才会产生化学反应,这就是碰撞理论,如果没有这种能量,粒子们只不过是互不伤害地跳来蹦去而已。
早在1918年,路易斯运用气体运动论的成果,提出了反应速度的碰撞理论。
学习好资料欢迎下载绪言 碰撞理论 教、学案一、教学目标:1、理解有效碰撞、活化分子的定义和关系2、掌握活化能与反应的关系二、课前预习:P 绪言部分 2~4 页问题导读:1、化学反应原理:本书研究①化学反应的反应、反应以及反应限度(即平衡)②电解质溶液中的________反应③化学反应与能量④电能、化学能相互转化为基础电化学过程和装置2、化学反应的本质是什么?答:反应物中旧化学键的_________,生成物中新的化学键的__________。
3、碰撞理论模型:①化学反应必须发生分子间的碰撞,能发生化学反应的碰撞称。
②能发生这样碰撞(___________)的分子叫分子。
问:活化分子之间的碰撞是否就是有效碰撞呢?答:活化分子必须有时发生的碰撞才能是有效碰撞。
③普通分子与活化分子有何区别?普通分子怎样才能活化?答:4、活化分子具有的能量就叫做活化能,对吗?答!活化能是指活化分子_________的那部分能量。
在上图中正反应的活化能=------------------,在上图中逆反应的活化能=------------------学习好资料欢迎下载【概括】(一)化学反应必备两个条件:第一,分子有较.高._________(即_____________); 第二,碰撞要有合适的___________。
(二)叙述一个反应要发生一般要经历的过程。
5、化学反应、活化能、反应热的关系:请绘制反应过程中活化能与反应热的关系的二维图象(不懂可参阅 P3 页,请别对着抄!)。
在上图中△H=图中的反应是 _____ 反应。
(填“放热”或“吸热”)影响 外界条件改变单位体积内 分子总数 活 化 分 子数活化分子百分 数有效碰撞次数 化学反应速率增大反应物浓 度增大压强 升高温度 使用催化剂三、课堂教学和习题训练1、填空(1)活化分子指的是能够。
(2)有效碰撞是指引起分子间的发生____________的碰撞。
(3)活化能是指__________多出的那部分能量。