初中化学总复习—-物质的分类.
- 格式:ppt
- 大小:1.02 MB
- 文档页数:36

初中化学知识点总结归纳精华化学是一门研究物质组成、性质、变化和能量转化的科学。
在初中阶段,学生们接触到了一些基础的化学知识点,这些知识点对于他们进一步学习化学打下了坚实的基础。
本文将对初中化学知识点进行总结和归纳,以帮助学生们更好地掌握这些重要概念。
一、物质的分类和性质1. 物质的分类:物质可以分为纯物质和混合物。
纯物质包括元素和化合物,而混合物则是由两种或两种以上的物质混合而成。
2. 元素和化合物的区别:元素是由同种原子组成的纯物质,化合物则是由不同种原子按照一定比例结合而成的物质。
3. 物质的性质:物质的性质分为物理性质和化学性质。
物理性质包括颜色、形状、密度等,而化学性质则涉及物质的变化和反应。
二、常见元素和元素周期表1. 常见元素:在初中化学中,学生们需要掌握一些常见元素的符号和性质。
例如,氧气(O)、氢气(H)和氮气(N)等。
2. 元素周期表:元素周期表是一张表格,将所有已知的元素按照一定的规律排列在一起。
学生们需要了解元素周期表的结构和各种元素的分布规律。
三、化学方程式和化学反应1. 化学方程式:化学方程式用化学符号和化学式表示化学反应过程。
学生们需要学会编写化学方程式,包括平衡化学方程式。
2. 化学反应类型:化学反应可以分为合成反应、分解反应、置换反应和离子反应等。
学生们需要了解各种反应类型的特点和示例。
四、酸碱与中和反应1. 酸和碱:酸和碱是化学的基本概念,它们具有不同的性质和呈现出酸性和碱性的特点。
2. 中和反应:酸和碱反应可以产生盐和水,这个过程被称为中和反应。
学生们需要了解中和反应的条件和实际应用。
五、离子和离子键1. 离子:离子是带有正电荷或负电荷的粒子。
阳离子带有正电荷,阴离子带有负电荷。
2. 离子键:离子通过电荷吸引力结合在一起,形成离子键。
离子键具有较高的熔点和沸点。
六、化学平衡和溶液1. 化学平衡:化学反应在一定条件下可以达到动态平衡。
学生们需要了解化学平衡的概念和平衡常数的计算方法。

中考化学复习知识点总结物质的分类物质的分类是化学中的一个重要内容,也是中考化学考试的重点之一、下面是关于物质的分类的知识点总结:1.物质的分类原则:(1)按物质的纯净程度分类:纯物质和混合物。
(2)按物质的组成分类:元素和化合物。
(3)按物质的状态分类:固体、液体和气体。
(4)按物质的性质分类:金属、非金属和半金属。
2.纯物质和混合物:(1)纯物质是由同一种物质组成的,有固定的化学组成,在一定条件下具有一定的物理性质和化学性质。
(2)混合物是由两种或两种以上的纯物质按一定比例物理上混合而成的,可以通过物理方法分离。
3.元素和化合物:(1)元素是由原子组成,是化学中最基本的物质单位,不能被化学方法分解成其他物质。
(2)化合物是由两种或两种以上元素以一定的化学组成比例通过化学反应联结而成的物质。
4.固体、液体和气体:(1)固体的分子间距离小,分子之间有规则排列,密度大,体积固定,不易被压缩。
(2)液体的分子间距离较大,可以流动,密度较小,体积不固定,不易被压缩。
(3)气体的分子间距离最大,自由运动,无固定体积和形状,可被压缩。
5.金属、非金属和半金属:(1)金属具有良好的导电性、导热性和延展性,大多数具有金属光泽,常为固态。
(2)非金属通常为气体、液体或固体,导电性、导热性较差,通常无金属光泽。
(3)半金属具有金属和非金属的一些性质,导电、导热性较差,弹性和脆性。
以上就是关于物质的分类的一些基本知识点。
中考化学复习时,可以通过复习这些知识点来加深对物质分类的理解,并结合实例进行巩固。
同时,还应重点掌握物质分类的应用,如根据物质的性质选择适当的分离纯化方法等。
希望对你的学习有所帮助!。

初三化学全册必背知识点(精华)初三化学全册必背知识点(精华)化学作为一门基础科学,是初中学习中重要的一部分。
为了帮助同学们更好地掌握化学知识,下面将为大家总结初三化学全册的必背知识点,希望能够对同学们的学习有所帮助。
一、物质的分类1. 纯物质:由同种元素或化合物构成的物质,如金属铜、氧气等。
2. 混合物:由不同物质混合而成的物质,如空气、盐水等。
二、化学变化与物理变化1. 化学变化:物质发生新的物质变化,如燃烧、酸碱中和等。
2. 物理变化:物质只是在形态、状态上发生改变,如固体溶解于水中、水的沸腾等。
三、原子与分子1. 原子:构成物质的最基本单位,具有质量且带有电荷。
2. 元素:由相同类型的原子组成的物质,如氧气、金属铁等。
3. 分子:由两个或多个原子结合而成的粒子,若原子间是不同的则称为化合物,如水分子(H2O)等。
四、化学方程式化学方程式以化学式表示化学反应过程,包括反应物、产物以及它们的配比关系。
五、常见化学反应1. 氧化还原反应:有氧化剂和还原剂参与的反应,如金属与非金属氧化物反应,火焰燃烧等。
2. 酸碱反应:酸和碱之间发生的中和反应,如盐酸与氢氧化钠反应等。
3. 酸和金属反应:酸与金属发生反应生成气体和盐,如盐酸与锌反应等。
六、离子理论1. 正离子:失去电子后带正电荷的离子,如氢离子(H+)。
2. 负离子:获得电子后带负电荷的离子,如氯离子(Cl-)。
3. 离子化合物:由正离子和负离子组成的化合物,如氯化钠(NaCl)。
七、溶液和溶解度1. 溶液:由溶质和溶剂组成的均匀混合物,如盐水。
2. 饱和溶液:在一定温度下,溶剂中溶解的溶质数量已达最大值的溶液。
3. 溶解度:在一定温度下,单位体积的溶剂中溶解的溶质的最大量。
八、常见化合物1. 重要无机化合物:如氯化钠、氧化铜等。
2. 重要有机化合物:如甲烷、乙醇等。
九、化学实验常见仪器1. 锥形瓶:用于反应时的混合溶液的容器。
2. 密封瓶:贮存气体或固体试剂的容器。
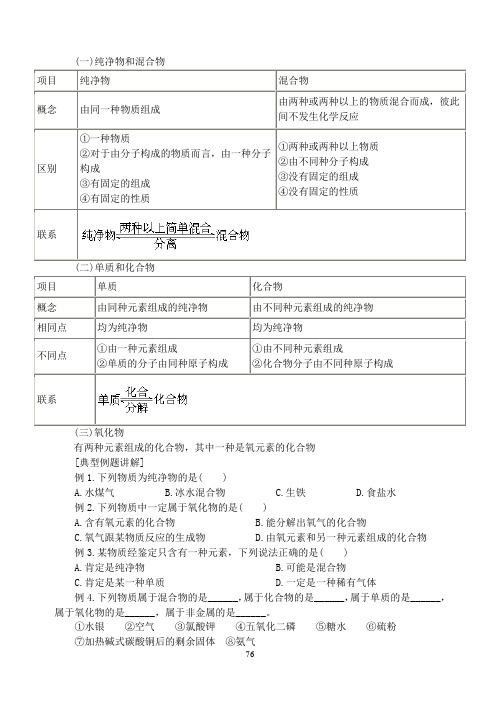
(一)纯净物和混合物
(二)单质和化合物
(三)氧化物
有两种元素组成的化合物,其中一种是氧元素的化合物
[典型例题讲解]
例1.下列物质为纯净物的是( )
A.水煤气
B.冰水混合物
C.生铁
D.食盐水
例2.下列物质中一定属于氧化物的是( )
A.含有氧元素的化合物
B.能分解出氧气的化合物
C.氧气跟某物质反应的生成物
D.由氧元素和另一种元素组成的化合物
例3.某物质经鉴定只含有一种元素,下列说法正确的是( )
A.肯定是纯净物
B.可能是混合物
C.肯定是某一种单质
D.一定是一种稀有气体
例4.下列物质属于混合物的是______,属于化合物的是______,属于单质的是______,属于氧化物的是______,属于非金属的是______。
①水银②空气③氯酸钾④五氧化二磷⑤糖水⑥硫粉
⑦加热碱式碳酸铜后的剩余固体⑧氨气
[综合测试]
一、选择题:
1.下列各组物质中,从物质分类的角度看,后者从属于前者的是( )
A.纯净物、混合物
B.金属、非金属
C.纯净物、化合物
D.含氧酸、无氧酸
2.下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A.稀有气体、浓硫酸、胆矾
B.金刚石、石灰石、铁矿石
C.天然气、碱式碳酸铜、液氧
D.石墨、熟石灰、水煤气。

初中化学总复习化学是自然科学的一门学科,研究物质的性质、构成以及它们之间的相互转化关系。
化学的学习不仅可以帮助我们认识世界,还可以培养我们的逻辑思维能力和实践动手能力。
接下来,我将对初中化学的知识进行总复习。
一、物质的分类根据物质的组成和性质,我们可以将物质分为三类:元素、化合物和混合物。
1. 元素:由于元素是由相同类型的原子组成的纯物质,因此它们无法被分解为更简单的物质。
例如,氧气(O2)和金属铁(Fe)就是由氧原子和铁原子组成的元素。
2. 化合物:化合物是由两种或更多种不同类型的原子以固定比例结合而成的物质。
化合物可以通过化学反应进行分解。
例如,水(H2O)是由氢原子和氧原子组成的化合物。
3. 混合物:混合物是由两种或更多种不同类型的物质通过物理手段混合而成的物质。
不同物质在混合物中保留其各自的性质。
例如,沙子和水混合而成的沙水就是一种混合物。
二、常见的物质改变在日常生活中,我们常常会遇到各种物质改变。
1. 物理变化:物理变化是指物质在改变外观、形态、状态等方面发生变化,但其分子结构和组成不发生改变。
例如,水从液态变为固态的冰,再从固态变为气态的水蒸气,都是物质的物理变化。
2. 化学变化:化学变化是指物质在化学反应中,分子结构和组成发生改变。
例如,铁生锈、纸燃烧、苹果变黑等都是物质的化学变化。
三、常见的化学反应化学反应是物质发生化学变化的过程,根据反应的不同类型,可以将化学反应分为几个常见的类型。
1. 氧化反应:氧化反应是指物质与氧气发生化学反应的过程,常常伴随着产生燃烧和放热的现象。
例如,燃烧是一种氧化反应。
2. 酸碱反应:酸碱反应是指酸和碱之间发生中和反应的过程,产生盐和水。
例如,氢氧化钠和盐酸反应生成氯化钠和水。
3. 氧化还原反应:氧化还原反应是指物质中原子的氧化态和还原态发生变化的反应。
其中,氧化剂接受电子,被还原;还原剂失去电子,被氧化。
例如,金属和非金属之间的反应经常是氧化还原反应。

初中化学知识点汇总(超完整)初中化学知识点汇总化学是一门研究物质组成、性质、变化和应用的科学。
作为初中学习的一部分,学生们需要掌握一些基本的化学知识。
本文将对初中化学的知识点进行汇总,以便学生们能够更好地理解和掌握化学的基础知识。
一、物质与能量1. 物质的分类:物质可以分为纯物质和混合物。
纯物质包括元素和化合物,而混合物则是由两种或两种以上的物质混合而成。
2. 物质的性质:物质的性质包括物理性质和化学性质。
物理性质是不改变物质本质的性质,如颜色、形状、密度等;而化学性质则是可以发生化学变化的性质,如燃烧、腐蚀等。
3. 能量与物质的转化:能量在物质中可以以化学能和物理能的形式存在,物质的变化常常伴随着能量的转化。
二、物质的组成与结构1. 原子:物质的最小单位,由质子、中子和电子组成。
其中,质子带正电,中子中性,电子带负电。
2. 元素和化合物:由同一种原子组成的物质称为元素,而由不同种原子以一定比例组成的物质称为化合物。
3. 元素周期表:元素周期表按照原子序数和元素性质的规律排列,可以方便地查找元素的信息。
4. 分子:由原子通过化学键结合而成的粒子。
分子的化学式可以用来表示化合物的化学组成。
三、化学反应1. 反应物和生成物:参与化学反应的物质称为反应物,而产生的新物质称为生成物。
2. 化学方程式:用化学符号表示化学反应的过程。
化学方程式可以表示反应物的摩尔比例和生成物的量。
3. 反应类型:常见的化学反应类型包括合成反应、分解反应、置换反应和氧化还原反应等。
4. 反应速率:化学反应的进行速度。
影响反应速率的因素有温度、浓度、催化剂等。
四、酸碱中和反应1. 酸和碱:酸是指能产生H+离子的物质,碱是指能产生OH-离子的物质。
2. 酸碱中和反应:酸和碱反应产生盐和水的反应称为酸碱中和反应。
3. pH值:用于表示溶液酸碱性的指标,pH值越小,溶液越酸;pH值越大,溶液越碱。
五、氧化还原反应1. 氧化和还原:氧化是指物质失去电子,还原是指物质获得电子。
初中化学重难点知识点归纳整理重难点知识点归纳整理:一、物质的分类1.物质的分类:元素和化合物元素是由相同的原子组成,化合物是由不同元素组成的。
2.化合物的分类:离子化合物和共价化合物离子化合物是由正离子和负离子组成,共价化合物是由共价键连接的不同原子组成。
3.含氧化物的分类:碱性氧化物、中性氧化物和酸性氧化物碱性氧化物和金属氧化物反应得到碱,酸性氧化物和非金属氧化物反应得到酸,中性氧化物没有酸碱性质。
二、质量守恒定律1.质量守恒定律:封闭系统中,化学反应前后质量不变。
2.实验室称重:天平称重、量筒称重。
3.质量守恒定律应用:化学反应中物质的质量计算。
三、物质的组成1.原子:构成物质的基本微粒,由质子、中子和电子组成。
2.分子:由原子通过共价键连接而成。
3.离子的形成:正电荷和负电荷相吸引形成离子。
4.元素的符号:元素周期表中元素的符号和名称。
四、化学方程式和化学反应1.化学反应:物质之间发生的化学变化。
2.化学方程式:反应物和生成物的化学式符号组成的方程式。
3.原子的守恒和电荷的守恒:反应物和生成物中原子的种类和数量不变,反应中总正电荷和总负电荷不变。
五、相对分子质量和摩尔质量1.相对分子质量:分子的质量相对于碳-12的质量。
2.摩尔质量:一摩尔物质的质量。
六、化合价1.化合价:原子参与化学反应时的化合能力。
2.原子价:最稳定的化合价。
七、离子和离子键1.离子:带电荷的原子或分子。
2.阴离子和阳离子:带负电荷的离子称为阴离子,带正电荷的离子称为阳离子。
3.离子键:金属和非金属原子之间电子的转移形成的键。
八、氧化还原反应1.氧化还原反应:氧化剂和还原剂之间的电子转移反应。
2.氧化和还原的概念:氧化是失去电子,还原是获得电子。
九、常见气体的性质及制取1.氧气的性质:促使燃烧的气体。
2.氢气的性质:易燃烧的气体。
3.氮气的性质:空气中最主要的气体。
4.氢气和氧气的制取。
十、金属的性质1.金属的导电性:金属内具有自由电子,良好导电性。
2024年中考化学复习考点归纳总结—物质的分类(全国通用)知识点一、纯净物和混合物1.由单一物质组成的物质称为纯净物,如氧气(O2)、水(H2O)等。
2.由两种或两种以上不同物质组成的物质叫混合物,如空气、海水、合金等。
知识点二、单质和化合物1.按组成元素的种数又可以将纯净物分为单质和化合物。
2.单质:由同种元素组成的纯净物,如铜(Cu)、银(Ag)、氮气(N2)等。
3.化合物:由不同种元素组成的纯净物,如H2O、KClO3等。
化合物主要分为有机化合物和无机化合物。
(1)有机化合物是指含碳元素的化合物,如甲烷(CH4)、乙醇(C2H5OH)、蛋白质等。
(2)无机化合物是指不含碳元素的化合物。
但有些含碳化合物也属于无机物,包括CO、CO2、H2CO3、Na2CO3(碳酸盐)和NaHCO3(碳酸氢盐)等。
【易错辨析】(1)区分混合物和纯净物时不看元素种类,看物质种类。
相同的元素可组成不同的物质,如H2O 和H2O2等。
(2)冰水混合物是纯净物而不是混合物。
知识点三、氧化物、酸、碱、盐1.氧化物:由两种元素组成,其中一种元素是氧元素的化合物,如CO2、H2O等。
2.酸:在水溶液中解离出的阳离子全部为H+的化合物,如HCl、H2SO4等。
3.碱:在水溶液中解离出的阴离子全部为OH-的化合物,如NaOH、Ca(OH)2、NH3·H2O等。
4.盐:由金属阳离子(或NH4+)与酸根阴离子构成的化合物,如NaCl、NaHCO3、K2MnO4等。
【易错辨析】(1)含有氧元素的化合物不一定是氧化物,如H2SO4是酸而不是氧化物。
(2)酸性物质不一定是酸,碱性物质不一定是碱。
考点一.从组成上识别氧化物1.(2023•永州)分类是学习和研究化学的常用方法。
下列物质属于氧化物的是()A.O3B.KMnO4C.CaO D.H2SO4【解答】解:A.O3是由氧元素组成的单质,不属于氧化物,故选项错误;B.KMnO4是由钾元素、锰元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;C.CaO是由钙元素和氧元素组成的化合物,属于氧化物,故选项正确;D.H2SO4是由氢元素、硫元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;故选:C。
中考化学总复习知识点规纳化学是一门涉及物质组成、性质和变化的科学学科。
中考化学考察的内容主要包括物质的组成与性质、化学反应、物质的转化与能量的变化等方面的知识。
下面是对中考化学知识点的大致总结:1.物质的组成与性质:(1)物质的分类:根据物质的组成和性质,可以将物质分为纯物质和混合物。
(2)纯物质:指组成相同、性质统一的物质,包括单质和化合物。
-单质:由一个种类的原子组成的纯物质,如金属、非金属元素等。
-化合物:由两种或两种以上不同元素按照一定的化学方式结合而成的纯物质,如水、氧化铁等。
(3)混合物:由两种或两种以上的纯物质按照一定的比例混合在一起形成的物质,如空气、溶液等。
(4)物质的性质:包括物理性质和化学性质。
-物理性质:不改变物质组成的性质,如颜色、形状、密度等。
-化学性质:指物质在发生化学反应时所表现出的性质,如酸碱中和、金属与酸反应产生气体等。
2.化学反应:(1)化学方程式:用化学符号表示化学反应过程的方程式,分为不可逆反应和可逆反应。
(2)反应物与生成物:反应物是参与反应发生的起始物质,生成物是通过反应转化生成的物质。
(3)化学方程式的平衡:指在反应进行的过程中,反应物与生成物浓度达到一定比例的状态。
(4)探究化学反应的条件:包括温度、浓度、催化剂等对化学反应速率的影响。
3.物质的转化与能量的变化:(1)物质的转化:-氧化还原反应:指物质在与氧气或其他氧化剂反应时,电子的转移。
-酸碱中和反应:指酸与碱反应生成盐和水的反应。
-金属与非金属反应:金属可以与非金属元素反应,生成金属化合物。
(2)能量的变化:-放热反应和吸热反应:反应过程中释放出能量的反应称为放热反应,吸收能量的反应称为吸热反应。
-化学能:物质内部存储的能量,可以通过化学反应释放出来。
-燃烧:是一种放热反应,是物质与氧气发生强烈反应,释放出能量。