初中化学中物质分类解析
- 格式:doc
- 大小:41.50 KB
- 文档页数:3

初中化学物质与化学计量知识点汇总化学是一门研究物质组成、结构和变化的科学,是自然科学中重要的一支。
初中化学作为学生学习的第一门化学课程,主要涉及物质与化学计量的基本概念和知识点。
本文将从物质分类、化学元素与化合物、化学式及化学方程式、化学计量等几个方面进行汇总和总结。
首先,我们来了解一下物质的分类。
物质分为纯物质和混合物两大类。
纯物质包括元素和化合物。
元素是由一种类型的原子组成,不能通过化学方法分解成其他物质。
化合物是由两种或两种以上的元素通过化学反应组成的物质,具有固定的化学组成和性质。
混合物是由两种或两种以上的物质按照一定比例混合而成,可以通过物理方法分离。
其次,化学元素是构成物质的基本单位。
目前已知的化学元素有118个。
元素由原子组成,原子由原子核和电子构成。
化学元素可以用化学符号表示,化学符号由拉丁文或英文首字母组成。
例如,氧元素的符号是O,氢元素的符号是H。
化学元素还可以按照其在元素周期表中的位置进行分类,包括金属、非金属和类金属。
化合物是由不同化学元素通过化学反应形成的物质。
化合物由化学式表示,化学式由元素符号和下标组成。
下标表示相应元素的原子数目。
例如,H2O表示水分子,其中H表示氢元素,O表示氧元素,下标2表示氢元素的原子数目为2。
化合物还可以按照其组成元素的比例进行分类,包括单质、氧化物、酸、盐等。
化学方程式是描述化学反应过程的符号表示法。
化学方程式由反应物、产物和反应条件组成。
反应物位于化学方程式的左边,产物位于化学方程式的右边。
反应条件包括温度、压力、催化剂等。
化学方程式还可以通过配平来保持原子数目的平衡,确保反应前后原子的数目不变。
例如,2H2 + O2 -> 2H2O表示氢和氧发生反应生成水,其中反应物和产物的原子数目均保持平衡。
化学计量是化学中重要的概念和计算方法,用于研究化学反应中物质的数量关系。
其中,摩尔是化学计量的基本单位,表示物质的量。
1摩尔的物质包含的基本粒子数目是阿伏伽德罗常数,约为6.02×10^23个。

初中化学中的常见物质分类化学是一门研究物质组成、性质及其变化的科学,而物质则是构成我们周围世界的基本元素。
在初中化学的学习中,我们需要对常见物质进行分类,以便更好地理解它们的特征和相互关系。
本文将介绍初中化学中几种常见物质的分类。
一、无机物和有机物的分类无机物是指由非生物过程形成的物质,主要由无机元素构成,例如金属、酸、碱、盐等。
它们通常没有碳-碳化学键或碳-氧化学键。
无机物具有很高的熔点和沸点,大多数是固体。
有机物则是由生物过程形成的物质,主要由碳元素构成,包括碳氢化合物、脂肪、蛋白质、核酸等。
有机物通常具有较低的熔点和沸点,大多数是液体或气体。
二、酸、碱和盐的分类酸是一类能够在水中释放出氢离子(H+)的化合物,如盐酸(HCl)、硫酸(H2SO4)等。
碱是一类能够在水中释放出氢氧化物离子(OH-)的化合物,如氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)等。
盐是由酸和碱反应生成的化合物,包含阳离子和阴离子,如氯化钠(NaCl)、硫酸铜(CuSO4)等。
酸、碱和盐在我们的日常生活中广泛应用,在调味品、肥皂、药品等方面具有重要作用。
三、金属和非金属的分类金属是指具有良好导电性、延展性和光泽性的元素,如铜、铁、铝等。
金属的特点包括在常温下为固体,具有较高的熔点和沸点。
非金属则是指不具备金属特性的元素,如氧、氮、碳等。
非金属多为气体或固体,熔点和沸点较低。
金属和非金属的结合形成了化合物,例如盐是金属离子和非金属离子的结合。
四、分子和离子化合物的分类在化学中,物质可以分为分子化合物和离子化合物。
分子化合物是由非金属元素通过共享电子形成的化合物,如氨气(NH3)、二氧化碳(CO2)等。
分子化合物通常具有较低的熔点和沸点。
离子化合物是由金属和非金属元素之间通过电荷吸引力形成的化合物,如氯化钠(NaCl)、硫酸铜(CuSO4)等。
离子化合物通常具有较高的熔点和沸点。
综上所述,初中化学中的常见物质可以按照不同的分类方式进行归类,包括无机物和有机物、酸、碱和盐、金属和非金属,以及分子化合物和离子化合物等。

一、初中化学常见物质的分类1、单质:非惰性气体一般由两个原子组成:F2, 02, H2, C122、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI二、初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。
三、初中化学敞口置于空气中质量改变的(一)质量增加的1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;2、由于风化而减少的:碳酸钠晶体。
四、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。

一、初中化学常见物质的分类1、单质:非惰性气体一般由两个原子组成: F2,O2,H2,Cl22、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI二、初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。
三、初中化学敞口置于空气中质量改变的(一)质量增加的1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;2、由于风化而减少的:碳酸钠晶体。
四、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。

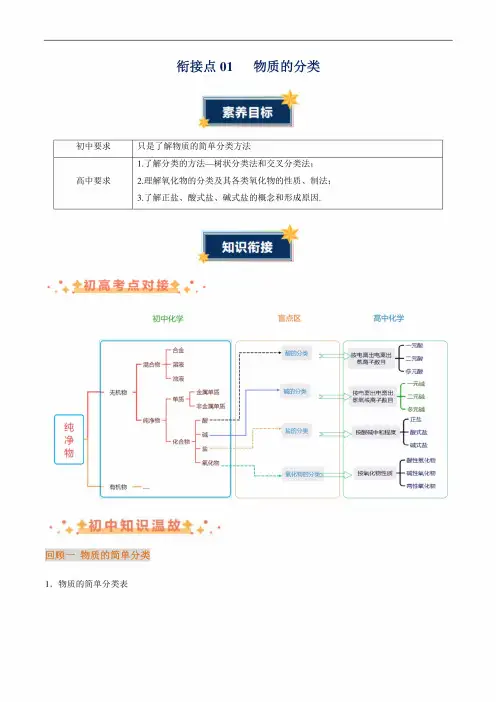
衔接点01 物质的分类初中要求只是了解物质的简单分类方法高中要求1. 了解分类的方法一树状分类法和交叉分类法;2. 理解氧化物的分类及其各类氧化物的性质、制法;3. 了解正盐、酸式盐、碱式盐的概念和形成原因.• 初高考点对接七初中化学盲点区 高中化学纯净物[-谜-混合物-一溶液_浊液无机物-厂金属单质一单质~\L ■非金属单质1-纯净物-「酸-化欲-碱-盐碱的分类_______■氧化物的分凳L —元酸ng 出一二元酸I 多元酸----、按电菠出电离出 __息。
基氧根高球目 一 一兀例L 多元碱「皿: 按酸碱中和费——稣盐「酸性氧化物A 按氧化物性质——碱性氧化物j 两性氧化物-酸的分类wA 盐的分类 W•••♦,初中知识温故tA-回顾一物质的简单分类1.物质的简单分类表「混合物'金属单质单质,非金属单质、稀有气体物质<纯净物<化合物,厂酸碱无机化合物〈盐氧化物I有机化合物回顾二几组重要概念1.混合物和纯净物混合物纯净物宏观由不同种物质组成由一种物质组成微观由不同种分子构成由同种分子构成性质没有固定的组成,各组分保持各自的化学性质。
没有固定的熔点和沸点具有固定的组成,具有固定的熔点、沸点;具有固定的化学性质例如空气是混合物,由氧气、二氧化碳、氮气等组成,含有N2、。
2、C02、田0等不同种分子水是纯净物,由水(H2。
)分子构成;氧气是纯净物,由氧(。
2)分子构成【易错提醒】(1)不要被“洁净、混合”等字眼迷惑,洁净物不一定是纯净物,例如:洁净的空气、干净的矿泉水就是混合物。
(2)不要被物质的名称迷惑,例如:二氧化碳是物质的名称,“氧”“碳”指组成物质的元素,不是两种物质,二氧化碳是纯净物,不是混合物。
2.单质、化合物和氧化物类别单质化合物氧化物概念由回种元素组成的纯净物由不同种元素组成的纯净物由两种元素组成,且其中一种元素是氧元素的化合物判断方法必须是纯净物;只含一种元素必须是纯净物;含两种或两种以上元素必须是化合物举例氮气(N2)、氢气(田)、氧气(02)、铁(Fe)和碳水(H2。

一、物质的分类工程酸性氧化物碱性氧化物概念凡能跟碱起反响生成盐和水的氧化物凡能跟酸起反响而生成盐和水的氧化物组成大多数是非金属氧化物(穿插关系) 都是金属氧化物(附属关系)性质①与水反响生成对应的含氧酸(SiO2除外)②与可溶性碱反响元生成盐和水①与水反响生成可溶性碱②与酸反响生成盐和水工程酸碱盐概念电离时生成的阳离子全部是氢离子的化合物电离时生成的阴离子全部是氢氧根离子的化合物电离时生成金属离子和酸根离子的化合物一样点均为化合物,其水溶液都能导电(电离)不同点酸=H++酸根离子碱=金属离子+OH-盐=金属离子+酸根离子组成特点肯定含氢元素肯定含氢、氧两种元素肯定含有非金属元素联络酸+碱→盐+水(中和反响)同步稳固练习1.下列是含碳元素的物质:①石墨②一氧化碳③干冰④碳酸⑤碳酸钙⑥乙醇⑦C60⑧甲烷⑨纯碱。
其中属于单质的是____(填序号,下同);属于酸性氧化物的是____;属于盐的是____,属于酸的是____;属于有机物的是____。
2.下列各组均有四种物质,其中有一种物质与其他三种物质的类别不同,请将该物质的化学式或名称填在横线上。
(1)CuO、NO2、NaOH、Fe2O3,____;(2)O2、N2、Al、C____;(3)空气,氢气,碘酒,盐酸____;(4)食盐,蔗糖,酒精,醋酸____。
3.填写下表(类别指酸、碱、盐、氧化物、单质)4.在酸、碱、盐、氧化物这四类物质中,肯定含有氢氧两种元素的是____,肯定只含有两种元素的是____。
二、四种根本化学反响类型(一)化合反响:两种或两种以上物质 ==== 一种化合物(多变一)A +B +…(可以是单质或化合物) ==== AB(二)分解反响:化合物 === 两种或两种以上物质(可以是单质或化合物)(一变多)AB === A + B +…(三)置换反响:单质+化合物 === 另一种单质+另一种化合物(单换单)A + BC ====B + AC★金属活动性依次口诀相应化学元素:钾钙钠镁铝锌铁锡铅氢,铜汞银铂金1.金属 + 酸 ===== 盐 + 氢气反响条件:①酸不能用强氧化性酸,如硝酸、浓硫酸;常用稀硫酸、盐酸。


初中化学物质五大类别五大类别是指物质种类,也叫质料种类,是指物质分类依据的最主要范畴,其中最主要的五大类是无机物、有机物、水溶液、混合物和高分子物质。
无机物是指不含有机连续碳的物质,无论从结构还是性质上均不属于有机物质。
典型的无机物包括氧化物、碱金属、无机酸、盐类、水、稀土元素等物质。
无机物的存在有助于海洋生物的繁殖和存活。
一些无机物,如溶解性铁、钙和镁,是海洋生物的重要营养物质。
有机物是生物体体内存在的物质,它含有有机连续碳链,是生物体最主要的物质形式之一。
它是指含有有机连续碳链的化学物质,主要以醇、酮、脂类、蛋白质等多种形式存在。
常见的有机物有树脂、油、煤、沥青、煤焦油等。
水溶液指水和其他溶解物混合而成,它形成了水与其他溶解物之间存在一定的持续性相互作用,由于水极易溶解其他物质,所以水溶液不仅是非常重要的相对应性系统,也是多种物质在物理、化学上进行相互作用的重要介质。
不同物质形成的水溶液,其特性也不同,它不仅仅溶解物质,还有其他特殊性质,如渗透性、浊度、表观密度等。
混合物是指由两种或者两种以上物质混合而成的物质,这些物质任何一种物质都不会完全溶解,而只是暂时性结合在一起,它们之间可能有相互作用也可能完全没有作用。
混合物可以是晶体混合物、气体混合物、液体混合物等,水是最常见的混合物,一般情况下水是无色、无味、无定形的,但实际上是由水分子和许多其他物质混合而成的。
高分子物质是指由许多小分子经过化学反应,形成的大分子类物质,是基本上不再发生分子交联和分解反应,由若干相同或不同单体连接而成大分子共聚物,其分子量较大,其大小一般超过104以上,结构十分复杂。
高分子物质主要有聚烯烃、聚醚、聚醚、聚丙烯酸酯等。
高分子物质的特性决定了其随处可见的应用,如塑料、胶粘剂、油漆等。


初中化学《物质的组成、性质和分类》知识点考点1物质的组成1.元素一一宏观概念,说明物质的宏观组成。
元素是质子数相同的一类原子的统称。
质子数相同的微粒不一定是同一种元素, 因为微粒的含义要比原子广泛。
2.分子、原子、离子一一微观概念,说明物质的微观构成。
(1)分子是保持物质化学性质的一种微粒。
(单原子分子、双原子分子、多原子分子)(2)原子是化学变化中的最小微粒。
(不是构成物质的最小微粒)(3)离子是带电的原子或原子团。
(基:中性原子团)3.核素一一具有一定数目的质子和一定数目的中子的一种原子同位素一一具有相同质子数和不同中子数的原子互称为同位素同素异形体一一同种元素形成的结构不同的单质特别提醒:离子基团定义帝电的原子或嫌子团化学中对原子团和基的总称区别带有正电荷或员电荷不带电’为缺电子物质’呈电中性联系两者通过得失电子可以互相转化实例___ QIL—1Wq:一艷二」 2 -α -g⅛1.离子与基团:2.同位素与同素异形体:]j同位素同素异形体定义同种元素形成的不同种原子同种元素形成的不同种单质≡区别≡ 是种嫌子\、 ____ ⅞-⅜¾⅜ 联系同位素原子在一定条件下以一定的方式可构成同素异形体一「实例 16O 和】8O 5 12C 和 叱 ] O 2和6 ;金刚石和石墨[知识规律]物质到底是由分子、原子还是离子构成?这与物质所属的晶体类型有关。
如金 刚石(C )、晶体Si 都属原子晶体,其晶体中只有原子;NaCI > KCIO3属离子晶 体,其晶体中只有阴阳离子;单质S 、P,属分子晶体,它们是由原子形成分子, 进而构成晶体的。
具体地:(1)由分子构成的物质(分子晶体):① 非金属单质:如H2、X 2> 02s O, N2、P4、S 、C6。
、稀有气体等 ② 非金属氢化物:如HX 、⅛0、NH3、H 2S 等 ③ 酸Sh 如 SO :、Co2、So3、P 2O 5s N 2O 5 等 ④ 酸类:如 HClOx HCIO 、H 2SO H H 3PO H H 2SiO 3 等 ⑤ 有机物:如坯类、怪的衍生物、糖类、氨基酸等 ⑥ 其它:如No 、Ng 、ALCl6等(2 )由原子直接构成的物质(原子晶体):稀有气体、金刚石、晶体硅、二 氧化硅、碳化硅、石墨(混合型晶体)等;(3 )由阴阳离子构成的物质(离子晶体):绝大多数盐、强碱、低价金属氧 化物。
初中化学的归纳与解析常见无机盐的性质与分类总结化学是一门研究物质组成、性质以及它们之间相互关系的科学。
而无机盐是化学中一个重要的概念,它们的性质与分类对于我们理解化学的基本原理和应用都具有重要意义。
本文将对常见的无机盐的性质进行归纳与解析,并进行分类总结。
一、氯化物氯化物是由氯离子(Cl-)和其他金属或非金属离子组成的盐类,常见的氯化物有氯化钠(NaCl)、氯化钾(KCl)等。
氯化物的性质主要包括溶解性、水合性以及化学反应性。
1. 溶解性:氯化物大多能够溶解于水中,形成溶液。
溶解度的大小与溶剂的温度有关,通常随着温度的升高而增加。
2. 水合性:部分氯化物能够与水分子结合形成水合物,例如氯化钠可以与水形成含有结晶水分子的结晶物质。
3. 化学反应性:氯化物在化学反应中表现出一定的活性。
例如,氯化钠与硝酸银反应会产生白色的沉淀物,这是因为氯离子与银离子发生置换反应。
基于上述性质,氯化物可以按照溶解性、水合性以及化学反应性进行分类。
二、硫酸盐硫酸盐是由硫酸根离子(SO42-)和其他金属或非金属离子组成的盐类,常见的硫酸盐有硫酸钠(Na2SO4)、硫酸镁(MgSO4)等。
硫酸盐的性质主要包括溶解性、酸碱性以及化学反应性。
1. 溶解性:大部分硫酸盐具有良好的溶解性,可以溶解于水中,但也有少数硫酸盐如硫酸钡(BaSO4)的溶解度较小。
2. 酸碱性:硫酸盐溶解后会使溶液呈酸性,因为硫酸根离子是强酸离子。
3. 化学反应性:硫酸盐在化学反应中表现出不同的特性。
例如,硫酸氢钠(NaHSO4)加热分解会放出二氧化硫气体,而硫酸钡与硝酸反应时则会生成沉淀物。
基于上述性质,硫酸盐可以按照溶解性、酸碱性以及化学反应性进行分类。
三、碳酸盐碳酸盐是由碳酸根离子(CO32-)和其他金属或非金属离子组成的盐类,常见的碳酸盐有碳酸钙(CaCO3)、碳酸氢钠(NaHCO3)等。
碳酸盐的性质主要包括溶解性、酸碱性以及化学反应性。
1. 溶解性:碳酸盐具有较小的溶解度,大部分碳酸盐在水中只能溶解一部分,形成碳酸的氢氧根离子。
初中化学物质分类
一、混合物和纯净物
1、混合物:组成中有两种或多种物质。
常见的混合物有:空气、海水、自来水、土壤、煤、石油、天然气、爆鸣气及各种溶液。
2、纯净物:组成中只有一种物质。
例如名字是“某化某”或者“某酸某”这种。
①宏观上看有一种成分,微观上看只有一种分子;
②纯净物具有固定的组成和特有的化学性质,能用化学式表示;
③纯净物可以是一种元素组成的(单质),也可以是多种元素组成的(化合物)。
二、单质和化合物
单质:只由一种元素组成的纯净物。
可分为金属单质、非金属单质及稀有气体。
例如氢气、水银。
化合物:由两种或两种以上的元素组成的纯净物。
例如名字是“某化某”或者“某酸某”这种。
三、氧化物、酸、碱和盐
氧化物:由两种元素组成的,其中有一种元素为氧元素的化合物。
氧化物可分为金属氧化物和非金属氧化物;还可分为酸性氧化物、碱性氧化物和两性氧化物;
酸:在溶液中电离出的阳离子全部为氢离子的化合物。
酸可分为强酸和弱酸;一元酸与多元酸;含氧酸与无氧酸等。
碱:在溶液中电离出的阳离子全部是氢氧根离子的化合物。
碱可分为可溶性和难溶性碱。
盐:电离时电离出金属阳离子和酸根阴离子的化合物。
盐可分为正盐、酸式盐和碱式盐。
初中化学常见物质的分类知识化学是探究物质变化及其原理的学科,而初中化学则是化学知识的基础,对于初中生是非常重要的。
初中化学的学习和实践,需要深入理解和掌握化学的基本概念,其中物质分类是化学中一个最基础的概念。
本文将介绍初中化学中的常见物质分类知识。
一、物质分类的基本原则物质是所有化学过程的基础,因此,正确分类和分析物质类型,是化学学习的核心所在。
物质通常被分为纯粹物质和混合物,其中纯粹物质是指仅由一种化学物质组成的物质,而混合物则由两种或两种以上的不同化学物质组成。
二、常见物质分类1. 纯粹物质(1)单质:由同一种元素组成的纯粹物质称为单质,例如氢气、氧气、金属铜等都是单质。
(2)化合物:由两种或更多种不同元素按照一定比例结合而成的纯粹物质称为化合物,例如水、氢氧化物等都是化合物。
2. 混合物(1)均质混合物:由至少两种性质相同的物质按照一定比例混合而成的混合物称为均质混合物。
例如气体混合物、溶液等都是均质混合物。
(2)非均质混合物:由至少两种性质不同的物质组成的混合物称为非均质混合物。
例如沉淀、泥浆、水果沙等都是非均质混合物。
三、常见物质分类的特点1. 单质单质在常温下的状态有固体、液体和气体三种,其中固体单质较为稳定,而液体和气体单质较不稳定。
例如,氢气和氧气在高温或高压条件下能够反应生成水。
2. 化合物化合物的组成成分是稳定的,并且比比例一一对应。
因此,化合物的物理性质和化学性质与其组成的原子或离子无关。
例如,在任何条件下,水总会由一个氧原子和两个氢原子组成。
3. 均质混合物均质混合物具有相同的组成比例和化学性质。
例如,水是一种常见的均质混合物,其组成比例是固定的,无论是在自来水中,还是在瓶装水中,其组成比例都是相同的。
4. 非均质混合物非均质混合物的组成非常复杂,各种成分的比例和化学性质在不同情况下都有所不同。
例如,土壤是一种非均质混合物,其中含有诸多有机和无机成分。
四、物质分类的重要性物质分类是初中化学的基础,通过分类,我们能够更好地理解和掌握化学的基本概念。
一、初中化学常见物质的分类1、单质:非惰性气体一般由两个原子组成:F2,O2,H2,Cl22、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI二、初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。
三、初中化学敞口置于空气中质量改变的(一)质量增加的1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;2、由于风化而减少的:碳酸钠晶体。
四、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
⼀一、初中化学常⻅见物质的分类1、单质:⾮非惰性⽓气体⼀一般由两个原⼦子组成: F2,O2,H2,Cl22、惰性⽓气体:⼀一般由⼀一个原⼦子组成:He,Ne,Ar,Kr,Xe3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI⼆二、初中化学常⻅见物质的颜⾊色(⼀一)、固体的颜⾊色1、红⾊色固体:铜,氧化铁2、绿⾊色固体:碱式碳酸铜3、蓝⾊色固体:氢氧化铜,硫酸铜晶体4、紫⿊黑⾊色固体:⾼高锰酸钾5、淡⻩黄⾊色固体:硫磺6、⽆无⾊色固体:冰,⼲干冰,⾦金金刚⽯石7、银⽩白⾊色固体:银,铁,镁,铝,汞等⾦金金属8、⿊黑⾊色固体:铁粉,⽊木炭,氧化铜,⼆二氧化锰,四氧化三铁,(碳⿊黑,活性炭)9、红褐⾊色固体:氢氧化铁10、⽩白⾊色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化⼆二磷,氧化镁(⼆二)、液体的颜⾊色11、⽆无⾊色液体:⽔水,双氧⽔水12、蓝⾊色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿⾊色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、⻩黄⾊色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红⾊色溶液:⾼高锰酸钾溶液16、紫⾊色溶液:⽯石蕊溶液(三)、⽓气体的颜⾊色17、红棕⾊色⽓气体:⼆二氧化氮18、⻩黄绿⾊色⽓气体:氯⽓气19、⽆无⾊色⽓气体:氧⽓气,氮⽓气,氢⽓气,⼆二氧化碳,⼀一氧化碳,⼆二氧化硫,氯化氢等⽓气体。
三、初中化学敞⼝口置于空⽓气中质量量改变的(⼀一)质量量增加的1、由于吸⽔水⽽而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;2、由于跟⽔水反应⽽而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟⼆二氧化碳反应⽽而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(⼆二)质量量减少的1、由于挥发⽽而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨⽔水;2、由于⻛风化⽽而减少的:碳酸钠晶体。
四、初中化学物质的检验(⼀一)、⽓气体的检验1、氧⽓气:带⽕火星的⽊木条放⼊入瓶中,若⽊木条复燃,则是氧⽓气.2、氢⽓气:在玻璃尖嘴点燃⽓气体,罩⼀一⼲干冷⼩小烧杯,观察杯壁是否有⽔水滴,往烧杯中倒⼊入澄清的⽯石灰⽔水,若不不变浑浊,则是氢⽓气.3、⼆二氧化碳:通⼊入澄清的⽯石灰⽔水,若变浑浊则是⼆二氧化碳.4、氨⽓气:湿润的紫红⾊色⽯石蕊试纸,若试纸变蓝,则是氨⽓气.5、⽔水蒸⽓气:通过⽆无⽔水硫酸铜,若⽩白⾊色固体变蓝,则含⽔水蒸⽓气.(⼆二)、离⼦子的检验.6、氢离⼦子:滴加紫⾊色⽯石蕊试液/加⼊入锌粒7、氢氧根离⼦子:酚酞试液/硫酸铜溶液8、碳酸根离⼦子:稀盐酸和澄清的⽯石灰⽔水9、氯离⼦子:硝酸银溶液和稀硝酸,若产⽣生⽩白⾊色沉淀,则是氯离⼦子10、硫酸根离⼦子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴⼊入氯化钡11、铵根离⼦子:氢氧化钠溶液并加热,把湿润的红⾊色⽯石蕊试纸放在试管⼝口12、铜离⼦子:滴加氢氧化钠溶液,若产⽣生蓝⾊色沉淀则是铜离⼦子13、铁离⼦子:滴加氢氧化钠溶液,若产⽣生红褐⾊色沉淀则是铁离⼦子(三)、相关例例题14、如何检验NaOH是否变质:滴加稀盐酸,若产⽣生⽓气泡则变质15、检验⽣生⽯石灰中是否含有⽯石灰⽯石:滴加稀盐酸,若产⽣生⽓气泡则含有⽯石灰⽯石16、检验NaOH中是否含有NaCl:先滴加⾜足量量稀硝酸,再滴加AgNO3溶液,若产⽣生⽩白⾊色沉淀,则含有NaCl。
初中化学物质的分类及物质的性质与变化化学是一门研究物质的科学,它研究的对象是物质的性质与变化。
在我们日常生活中,我们接触到的物质各有不同,那么这些物质是如何分类的呢?它们有哪些性质和变化呢?下面我们来一起探索一下初中化学中关于物质分类及物质的性质与变化的知识。
一、物质的分类物质是由不同种类的元素以及元素的组合构成的。
根据物质的组成和性质,我们可以将物质分为纯物质和混合物两大类。
1. 纯物质纯物质是由同一种物质构成的,具有一定的化学性质和物理性质。
纯物质可以进一步分为单质和化合物。
(1)单质:由同一种元素组成的物质称为单质,如金属铁、非金属硫等。
(2)化合物:由两个或更多种不同的元素按照一定的比例结合而成的物质称为化合物,如水(H2O)、二氧化碳(CO2)等。
2. 混合物混合物是由不同种类的物质按照一定比例混合而成的物质。
混合物可以进一步分为均质混合物和非均质混合物。
(1)均质混合物:由两种或更多种物质经过充分混合后,组成的物质在各处的成分和性质都是相同的,如盐水、空气等。
(2)非均质混合物:由两种或更多种物质构成,其组成物质在不同的部位具有不同的性质和比例,如沙与石子的混合物、霜淇淋等。
二、物质的性质与变化物质的性质是指物质本身所固有具有的特点和特性,而物质的变化是指物质由一种状态或性质转变为另一种状态或性质的过程。
1. 物质的性质物质的性质包括物质的物理性质和化学性质。
(1)物理性质:物质的物理性质是指物质在不发生化学变化的情况下所表现出的性质。
例如,颜色、味道、密度、导电性等都是物质的物理性质。
(2)化学性质:物质的化学性质是指物质在发生化学反应时所表现出的性质。
例如,与氧气反应产生燃烧、与酸反应产生气体等都是物质的化学性质。
2. 物质的变化物质的变化可以分为物理变化和化学变化两种。
(1)物理变化:物理变化是指物质在改变环境条件下,其物理性质发生改变,但物质的化学性质并未发生变化的过程。
例如,水的沸腾、冰的融化等都是物理变化。
物质的分类
混合物:是由两种或两种以上的物质混合而成
(或由不同种物质组成)。
例如,空气,溶液(盐酸、澄清的
石灰水、碘酒、矿泉水),
矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物
纯净物、
混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
纯净物:由一种物质组成的。
例如:水、水银、蓝矾(CuSO4 ·5H2 O)都是纯净物
冰与水混合是纯净物。
名称中有“某化某”“某酸某”的都是纯净物,是化合物。
例一、某种物质经鉴定只含有一种元素,则下列说法正确的是()
A 该物质一定是稀有气体
B 该物质肯定是纯净物
C 该物质肯定是单质
D 该物质可能是几种单质的混合物
单质:由同种(或一种)元素组成的纯净物。
例如:铁氧气(液氧)、氢气、水银。
化合物:由不同种(两种或两种以上)元素组成的纯净物。
氧化物:由两种元素组成,其中一种是氧元素的化合物。
酸:电离时生成的阳离子全部是氢离子的化合物。
酸溶液的PH值小于7
酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H”,酸由氢和酸根离子组成
紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
碱通常由金属离子和氢氧根离子构成
酸碱盐溶解性口诀:
钾钠硝铵溶溶碱有五种钡钾钙钠氨
不溶氯化物AgCl 不溶硫酸盐BaSO4 碳酸盐只溶钾钠铵
口诀的含义:含有钾、钠、硝酸根、铵根的物质都溶于水
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水
含Cl的化合物只有AgCl不溶于水,其他都溶于水;
含SO42-的化合物只有BaSO4 不溶于水,其他都溶于水
含CO32-的物质只有含K+ Na+ NH4+溶于水,其他都不溶于水
课后练习
1、有下列10种物质:空气、水、液态汞、石灰水、红磷、干冰、铜绿、煤、醋酸、胆矾,请回答下列问题:
①属于混合物的是;②属于单质的是;③属于盐类的是;④属于有机物的是;⑤属于化合物的是;⑥属于酸性氧化物的是。
2、氧气、铁、二氧化碳、碳酸钙、硫酸、空气、氢氧化钙、石灰水、硫、氧化铜请回答下列问题:
①属于混合物的是;②属于单质的是;③属于化合物的是;④属于纯净物的是
化学来自于生活,用于生活,下表是生活中常用物质溶液的PH值及主要成分的化学式:
试回答:
⑴将上表①~⑤中主要成分进行分类(填序号,下同):
属于酸的是____________;属于碱的是____________;属于盐的是____________;属于有机物的是____________。
⑵当有人被蚊虫(释放一种酸性物质)叮咬后,为减轻疼痛,可在伤处涂____________。
⑶用久的铝壶内有水垢(主要成分为CaCO3、Mg(OH)2可用____________少量多次清除。