中药制剂申报资料8年前模板-8号资料
- 格式:doc
- 大小:204.50 KB
- 文档页数:18
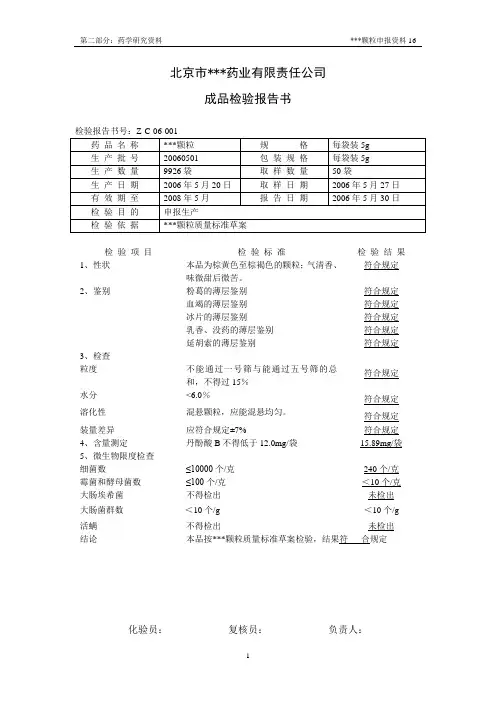
成品检验报告书检验报告书号:Z-C-06-001检验项目检验标准检验结果1、性状本品为棕黄色至棕褐色的颗粒;气清香、味微甜后微苦。
符合规定2、鉴别粉葛的薄层鉴别血竭的薄层鉴别冰片的薄层鉴别乳香、没药的薄层鉴别延胡索的薄层鉴别符合规定符合规定符合规定符合规定符合规定3、检查粒度不能通过一号筛与能通过五号筛的总和,不得过15%符合规定水分<6.0%符合规定溶化性混悬颗粒,应能混悬均匀。
符合规定装量差异应符合规定±7% 符合规定4、含量测定丹酚酸B不得低于12.0mg/袋15.89mg/袋5、微生物限度检查细菌数≤10000个/克240个/克霉菌和酵母菌数≤100个/克<10个/克大肠埃希菌不得检出未检出大肠菌群数<10个/g <10个/g 活螨不得检出未检出结论本品按***颗粒质量标准草案检验,结果符合规定化验员:复核员:负责人:成品检验报告书检验报告书号:Z-C-06-002检验项目检验标准检验结果1、性状本品为棕黄色至棕褐色的颗粒;气清香、味微甜后微苦。
符合规定2、鉴别粉葛的薄层鉴别血竭的薄层鉴别冰片的薄层鉴别乳香、没药的薄层鉴别符合规定符合规定符合规定符合规定3、检查粒度不能通过一号筛与能通过五号筛的总和,不得过15%符合规定水分<6.0%符合规定溶化性混悬颗粒,应能混悬均匀。
符合规定装量差异应符合规定±7% 符合规定4、含量测定丹酚酸B不得低于12.0mg/袋16.08mg/袋5、微生物限度检查细菌数≤10000个/克260个/克霉菌和酵母菌数≤100个/克<10个/克大肠菌群数<10个/g <10个/g 大肠埃希菌不得检出未检出活螨不得检出未检出结论本品按***颗粒质量标准草案检验,结果符合规定化验员:复核员:负责人:成品检验报告书检验报告书号:Z-C-06-003检验项目检验标准检验结果1、性状本品为棕黄色至棕褐色的颗粒;气清香、味微甜后微苦。
符合规定2、鉴别粉葛的薄层鉴别血竭的薄层鉴别冰片的薄层鉴别乳香、没药的薄层鉴别符合规定符合规定符合规定符合规定3、检查粒度不能通过一号筛与能通过五号筛的总和,不得过15%符合规定水分<6.0%符合规定溶化性混悬颗粒,应能混悬均匀。

对主要研究结果的总结及评价4.1 品种概况“***颗粒”是由“***片”改剂型而来,属中药、天然药物第8类新药,其处方来源于《部颁中药成方制剂》第十册收载的“***片”。
处方由丹参、没药、鸡血藤、血竭、延胡索(醋制)、当归、郁金、制何首乌、桃仁(炒)、黄精(蒸)、红花、粉葛、乳香(炒)、冰片等十四味中药材组成。
在制备颗粒剂时,我们所用的辅料为糊精。
将片剂改为颗粒剂,其工艺无质的改变,既很好地保留了片剂原有的优点,又可以降低生产成本,为患者提供又一可选剂型。
由于是改剂型品种,其功能主治和日服用生药材量与“***片”完全一致。
4.2 主要研究结果的总结***片经过长期的临床实践证明,其对冠心病、心绞痛,冠状动脉供血不足等症的疗效可靠,为给患者提供更多用药选择空间,我公司拟将其改剂型为颗粒剂,在“***片”工艺未作质的改变的前提下,确定了“***颗粒”的具体的提取工艺和制剂成型参数。
为了保证***颗粒安全、有效、质量可控,我公司对***颗粒的质量标准和稳定性进行了相关研究。
4. 工艺研究“***颗粒”是由“***片”改剂型而来,原《部颁中药成方制剂》第十册所载的“***片”没有明确提取工艺的具体参数,为此,在工艺无质的改变的前提下,确定了***颗粒的提取工艺参数。
试验中我们以粉葛中的主要有效成分粉葛素的含量为指标,通过对比试验,以确定最佳的提取条件。
经试验证明,提取工艺为药材加水煎煮二次,第一次加10倍量水煎煮3小时,第二次加8倍量水煎煮2小时,滤过,合并滤液浓缩成相对密度为(60℃)的稠膏;在大量试验的基础上,工艺确定为:稠膏与粉葛等细粉混合,加入适量甜菊素、糊精制成颗粒,干燥,整粒,将冰片用适量乙醇溶解,喷入上述颗粒,混匀,低温干燥,制粒,即得。
按照确定的工艺条件,制备了三批中试样品,成品收率为98%以上,经检验,其质量符合颗粒剂质量标准草案。
质量与质量标准的研究在“***颗粒”的质量标准研究中,参考文献及原片剂质量标准,我们考察了处方中粉葛、血竭、冰片、乳香、没药、延胡索等的薄层色谱鉴别,并纳入“***颗粒”的质量标准草案当中。

药品注册申报资料模版第一篇:药品注册申报资料模版注册分类:中药、天然药物第11类申报资料目录(一)综述资料1、药品名称2、证明性文件3、立题目的与依据4、对主要研究成果的总结与评价5、药品说明书样稿、起草说明及最新参考文献6、包装、标签设计样稿(二)药学研究资料7、药学研究资料综述8、药材来源及鉴定依据12、生产工艺的研究资料及文献资料,辅料来源及质量标准15、药品标准草案及起草说明,并提供药品标准物质的有关资料16、样品及检验报告书17、药物稳定性研究的试验资料及文献资料18、直接接触药品的包装材料和容器的选择依据及质量标准(一)综述资料1、药品名称:汉语拼音:命名依据:根据《中华人民共和国卫生部药品标准中药成方制剂第十册》页。
2、证明性文件:附件1《药品生产企业许可证》复印件。
附件2《营业执照》复印件。
附件3《GMP认证证书》复印件。
附件4《不侵权行为保证书》。
附件5《药品包装材料和容器注册证》复印件。
3、立题目的与依据中药“ ”处方来自《中华人民共和国卫生部药品标准中药成方制剂第十册》页。
处方由、、、、、等十七味中药构成,其中的作用为清热解毒、消肿散结,利尿通淋;的作用为泻热通肠、凉血解毒,逐淤通经;的作用为清热燥湿,泻火除蒸,解毒疗疮。
因此,具有,消肿止痛的功效。
对于脏腑毒热,血液不清引起的,血淋,白浊,尿道刺痛,大便秘结,疥疮,红肿疼痛均有很好的疗效,受到广大医药工作者和患者的欢迎,市场前景广阔。
所以,我们选择了这个品种,通过试验对其生产工艺及质量标准进行了研究,进一步加强了生产过程中的中间体及产品的质量控制,提高了产品的质量。
4、对主要研究成果的总结及评价:“ ” 收载于《中华人民共和国卫生部药品标准中药成方制剂第十册》,根据国家有关药品管理的政策要求,现按中药注册分类第11类要求开展有关的研究工作,现将各项研究工作总结如下:4.1 工艺研究我们对的提取工艺进行了研究。
其君药大黄的主要有效成分是蒽醌甙类物质,我们以大黄酚作为对照品,用HPLC法测定大黄酚的含量,计算提取过程中大黄酚的转移率,以确定最佳的提取条件。

医疗机构传统中药制剂备案申报资料项目及要求一、申报资料项目(一)《医疗机构应用传统工艺配制中药制剂备案表》原件。
(二)制剂名称及命名依据。
(三)立题目的和依据;同品种及该品种其他剂型的市场供应情况。
(四)证明性文件,包括:1.《医疗机构执业许可证》复印件、《医疗机构制剂许可证》复印件。
2. 医疗机构制剂或者使用的处方、工艺等的专利情况及其权属状态说明,以及对他人的专利不构成侵权的保证书。
3. 直接接触制剂的包装材料和容器的注册证书复印件或核准编号。
4. 未取得《医疗机构制剂许可证》或《医疗机构制剂许可证》无相应制剂剂型的医疗机构还应当提供以下资料:(1)委托配制中药制剂双方签订的委托配制合同复印件;(2)制剂受托配制单位的《医疗机构制剂许可证》或《药品生产许可证》复印件。
(五)说明书及标签设计样稿。
(六)处方组成、来源、理论依据及使用背景情况。
(七)详细的配制工艺及工艺研究资料。
包括工艺路线、所有工艺参数、设备、工艺研究资料及文献资料。
(八)质量研究的试验资料及文献资料。
(九)内控制剂标准及起草说明。
(十)制剂的稳定性试验资料。
(十一)连续3批样品的自检报告书。
(十二)原、辅料的来源及质量标准,包括药材的基原及鉴定依据、前处理、炮制工艺、有无毒性等。
(十三)直接接触制剂的包装材料和容器的选择依据及质量标准。
(十四)主要药效学试验资料及文献资料。
(十五)单次给药毒性试验资料及文献资料。
(十六)重复给药毒性试验资料及文献资料。
二、医疗机构传统中药制剂备案申报资料要求1. 资料项目(三)应充分证明备案的制剂不属于市场供应的品种及该品种其他的剂型。
2. 资料项目(七)、(九)、(十)、(十四)、(十五)、(十六)应按照《黑龙江省医疗机构应用传统工艺配制中药制剂研究技术指导原则(试行)》研究并提供相应资料。
3. 资料项目(八)是指针对质量控制所研究的全部试验及相关的文献资料。
4. 资料项目(十一)是指由医疗机构对制剂及原料/饮片及辅料进行检验并出具的检验报告书,其中原料/饮片及辅料可以是申报单位自检,也可以是其他有资质的检测单位出具。

药品注册申报资料模版资料一、药品注册申报申请书模板编号:申请日期:申请品种名称:(通用名称/商品名称)申请分类:(化学药品/生物制品/中药制剂/中药提取物/辅料/其他)申请单位:(申请单位名称、地址、邮编、联系人、电话、传真、邮箱)二、申请单位承诺书模板编号:日期:申请单位(全称):(以下简称甲方)地址:邮编:联系人:电话:传真:邮箱:甲方承诺:自本合同签订之日起,在药品注册申报流程中无假证、隐瞒或者提供虚假文件、信息、资料等行为,义不容辞地承担由此产生的一切法律责任和经济责任。
甲方声明:本软件所提供的全部资料、文件、信息均属甲方公司原创或者经过甲方公司合法获得,并且不存在第三人对该软件中任何内容的著作权、专利权、商标权、知识产权等权利的争议。
否则,产生的一切法律责任和经济责任均由甲方承担。
特此声明和承诺!甲方(盖章):签字:年月日:被授权代表(盖章):(以下简称乙方)注:本承诺书请由甲方填写并盖章,乙方在获取甲方授权代表签字后亦需签署并加盖公司公章。
四、申请人代理授权委托书现委托授权人:(申请单位名称)〔名称〕为了本药品将在全中国境内使用,为进一步表示保证,书面委托并且授权代理公司〔委托代理名称〕作为本产品经销人,负责以下任务:1.在中国办理所有必要的许可证申请及其他事宜。
2.在中国组织本产品的促销,并协助市场的推广与维护。
3.在紧急情况下,代为处理送货、借等事宜,并提问解答抱怨和询问。
4.配合和协助在中国或其他地方发生的投诉或其他质量问题。
5.履行其他委托书所要求的各种任务。
在本授权书代表人履行上述任务时,受委托代理所负担的所有权利、义务、责任和义务均应继承并负担于本委托书项下授权代理。
带有本委托书复印件的一份原件有效,译成中文后的原件也可作为法律文件使用。
本授权委托书有效期自下列日期起两年有效:百分之百委托授权〔申请单位名称〕_______________〔委托代理名称〕授权代表签字:。


第二部分:药学研究资料 ***颗粒申报资料12 1 生产工艺的研究资料及文献资料,辅料来源及质量标准
12.1 生产工艺:处方、制法、工艺流程 12.1.1处方 丹参 112.5g 没药(炒) 25.5g 鸡血藤 112.5g 血竭 25.5g 延胡索(醋制) 45g 当归 45g 郁金 45g 制何首乌 75g 桃仁(炒) 30g 黄精(蒸) 75g 红花 30g 粉葛 112.5g 乳香(炒) 25.5g 冰片 4.5g 甜菊素 10g 糊精适量 制成颗粒 1000g 12.1.2 制法 以上十四味,冰片研细;粉葛、乳香、没药、血竭、郁金、延胡索粉碎成细粉,过100目筛;其余丹参等七味加水煎煮二次,第一次加10倍量水煎煮3小时,第二次加8倍量水煎煮2小时,合并煎液,滤过,浓缩成相对密度为1.20(60℃)的清膏,与上述粉葛等细粉混合,加入适量甜菊素、糊精制成颗粒,干燥,整粒,将冰片用适量乙醇溶解,喷入至上述颗粒,混匀,低温干燥,制成1000g,即得。 12.1.3 工艺流程图 第二部分:药学研究资料 ***颗粒申报资料12
2
12.2 制剂工艺研究的试验资料 12.2.1 剂型选择 “***颗粒”是由《部颁中药成方制剂》第十册中收载的品种“***片”改剂型而来的,本品具有活血化瘀,行气止痛的功效。用于以胸部刺痛、固定不移、入夜更甚、心悸不宁,舌质紫暗,脉沉弦为主症的冠心病,心绞痛,冠状动脉供血不足。***片临床应用疗效较好,但其为糖衣片,部分患者不适合选择含糖药物,且片剂不易吞服,患者在剂型选择的时候余地较小,在一定程度上限制了患
粉葛、乳香、没药、血竭、郁金、延胡索 滤液
稠膏 颗粒 加入甜菊糖和糊精,制成颗粒、干燥、整粒
包装 成品
加水煎煮两次,第一次加10倍量水,煎煮3小时,第二次加8倍量水,煎煮2小时,合并煎液,滤过
浓缩至相对密度为1.20(60℃)的清膏 丹参、鸡血藤、红花、桃仁(炒)、当归、黄精(蒸)、制何首乌 粉碎,过100目筛

医院制剂中药品种申报资料技术要求详解演示文稿一、引言中药作为我国传统医学的重要组成部分,在药物治疗中具有重要地位。
为加强对中药品种的管理和监督,医院制剂中药品种申报资料的准备和提交具有关键性的作用。
本文旨在详细介绍医院制剂中药品种申报资料的技术要求,以便医疗机构正确准备和提交资料,提高审核通过率和申报效率。
二、资料准备1.申报申请书2.中药品种说明书中药品种说明书应包括以下内容:(1)药品名称:中药品种的通用名称、商品名称和英文名称。
(2)药品规格:中药品种的制剂规格,包括剂型、含量、包装规格等。
(3)生产工艺:中药品种的生产工艺和制剂工艺,包括原料选用、制剂方法等。
(4)质量控制:中药品种的质量控制要求,包括质量标准、检验方法等。
(5)用法用量:中药品种的用法用量说明,包括给药途径、剂量等。
(6)不良反应:中药品种的不良反应情况,包括常见不良反应、严重不良反应等。
(7)禁忌症和注意事项:中药品种的禁忌症和使用注意事项。
(8)药物相互作用:中药品种可能出现的药物相互作用。
3.质量控制资料质量控制资料应详细介绍中药品种的质量控制体系,包括质量标准、检验方法、稳定性等方面的内容。
同时还要提供中药品种的原材料质量标准和原材料供应的可行性分析。
4.临床试验资料对于具有新药成分的中药品种,需要提供相应的临床试验资料,包括临床试验方案、试验结果等。
5.产能分析对于申报的中药品种,需要提供相关的产能分析,包括中药品种的生产线、设备、人员等。
同时,还要提供关于生产能力和生产成本的分析。
6.相关证件申报单位需要提供相关的营业执照、生产许可证、GMP认证证书等相关证件的复印件。
三、资料提交申报单位应将准备好的资料逐项整理并装订成册,同时填写并附上申报申请书。
然后将资料提交至相关管理部门,并按照管理部门的要求进行缴费和申报确认。
四、总结医院制剂中药品种申报资料的准备是确保医院制剂中药品种能够顺利获得批准的重要步骤。
申报单位必须严格按照管理部门的要求准备和提交资料,以确保资料的完整性和准确性。

药品标准草案及起草说明,并提供药品标准物质及有关资料15.1药材质量标准草案1丹参Danshen RADIX ET RHIZOMA SALVIAE MILTIORRHIZAE 基源:本品为唇形科植物丹参Ralvia miltiorrhiza Bge的干燥根及根茎。
本品应符合《中华人民共和国药典》2005版一部第52页丹参项下的有关规定。
2没药Moyao MYRRHA基源:本品为橄榄科植物没药树Commiphora myrrha Engl.或爱伦堡没药树Balsamodendron ehrennbergianum Berg.的干燥胶树脂。
前者习称“天然没药”,后者习称“胶质没药”。
本品应符合《北京市中药饮片标准》第329页没药项下的有关规定。
3鸡血藤Jixueteng CAULIS SPATHOLOBI基源:本品为豆科植物密花豆Spatholobus suberectus Dunn的干燥藤茎。
本品应符合《中华人民共和国药典》2005版一部第134页鸡血藤项下的有关规定。
4血竭Xuejie SANGUIS DRACONIS基源:本品为棕榈科植物麒麟竭Daemonorops draco Bl.果实渗出的树脂经加工制成。
本品应符合《中华人民共和国药典》2005版一部第96页血竭项下的有关规定。
5延胡索Yanhusuo RHIZOMA CORYDALIS基源:本品为罂粟科植物延胡索Corydalis yanhusuo W.T.的干燥块茎。
本品应符合《中华人民共和国药典》2005版一部第94页延胡索项下的有关规定。
6当归Danggui RADIX ANGELICAE SINENSIS基源:本品为伞形科植物当归Angelica sinensis(Oliv.)Diels的干燥根及根茎。
本品应符合《中华人民共和国药典》2005版一部第89页当归项下的有关规定。
7郁金Yujin RADIX CURCUMAE基源:本品为姜科植物温郁金Curcuma wenyujin Y.H.Chenet C.Ling姜黄Curcuma longa L.广西莪术Curcuma kwangsiensis S.G.Lee et C.F.Liang 或蓬莪术Curcuma phaeocaulis Val.的干燥块根。

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。

第二部分:药学研究资料 ***颗粒申报资料7 1 药学研究资料综述
“***颗粒”是由“***片”改剂型而来,“***片”收载于《部颁中药成方制剂》第十册,我公司根据《中药、天然药物注册分类及申报资料》的要求,按中药、天然药物注册分类第8类新药要求开展有关的研究工作,现将药学研究资料综述如下: 7.1 主要研究结果综述 7.1.1 剂型选择及规格的确定依据 (1)剂型选择依据 ***片主要用于治疗活血化淤,活血止痛的功效,临床常用于以胸部刺痛、固定不移、入夜更甚、心悸不宁、舌质紫暗,脉沉弦为主症的冠心病、心绞痛,冠状动脉供血不足,其作用显著,应用广泛,市场前景广阔,具有很高的再次开发价值。将片剂改剂型为颗粒剂,在保存了片剂优点的同时,由于在生产过程中减少了压片、包衣等工序,又降低了生产成本,减轻了患者负担,并能较好地满足市场需求,在保持用药的准确、方便的同时,为广大患者提供又一用药选择。 (2)规格的确定依据 “***颗粒”是由“***片”改剂型而来,其功能主治与原片剂完全一致。按照颗粒剂与片剂每次和每天服用生药材量一致的原则,我们确定了颗粒剂的规格:每袋的重量为5g(相当于生药材3.8175g),颗粒剂的服用方法是每次5g,每天3次,即每次服用生药材量为3.8175g,每天服用生药材量11.4525g,与片剂每次和每天服用生药材量完全一致。 7.1.2 制备工艺及研究内容 “***颗粒”是由“***片”改剂型而来,原《部颁中药成方制剂》第十册“***片”质量标准中没有明确提取工艺的具体参数,因此,在工艺无质的改变的前提下,确定了***颗粒的提取工艺参数,试验中我们以丹参中的主要有效成分丹酚酸B的含量为指标,通过对比试验,确定最佳的提取条件。经试验证明,提取工艺为药材加水煎煮二次,第一次加10倍量水煎煮3小时,第二次加8倍量水煎煮2小时,滤过,合并滤液并浓缩成稠膏;在大量试验的基础上,制粒工艺确定为:稠膏与粉葛等细粉混合,加入适量甜菊素、糊精制成颗粒,干燥,整粒,第二部分:药学研究资料 ***颗粒申报资料7 2 将冰片用适量乙醇溶解,喷入上述颗粒,混匀,低温干燥,制粒,即得。按照确定的工艺条件,制备了三批中试样品,成品收率为98%以上,经检验,其质量符合颗粒剂质量标准草案。 ***颗粒的提取、分离、浓缩和干燥工艺相对片剂而言,无质的改变,仅仅是细化了相关工艺参数;在试验中确定的制剂成型工艺,经多批样品的中试研究,也说明了本工艺稳定、可行、科学合理。 7.1.3 质量研究与质量标准 ***颗粒处方中原药材丹参、鸡血藤、血竭、延胡索(醋制)、当归、郁金、制何首乌、桃仁(炒)、黄精(蒸)、红花、粉葛、冰片符合《中华人民共和国药典》2005年版一部各药材项下标准,没药、乳香(炒)符合北京市中药材质量标准项下的有关规定。辅料符合《中华人民共和国药典》2005年版二部相关辅料项下标准。在制剂的质量标准研究中,通过大量试验,我们制订了颗粒剂的质量标准草案,检查部分,除按《中华人民共和国药典》2005版一部附录I C颗粒剂项下有关的各项规定检查外,还增加了按《中华人民共和国药典》2005版一部附录XI E、F测定方法,测定了三批样品重金属和砷盐限量,结果重金属限量均小于10µg/g,砷盐限量均小于2µg/g,符合新药技术要求,未收入正文;鉴别部分,在试验中研究了原药材粉葛、血竭、冰片、乳香、没药、延胡索等的薄层色谱鉴别,并将其收入质量标准草案;含量测定部分,为了控制产品质量和保证用药安全,我们增加了丹参中丹酚酸B的含量测定方法,经过详细的方法学研究,建立了***颗粒成品中的丹酚酸B的含量测定方法。本法灵敏、专属、可靠,使得本品的质量更加可控。采用此方法测定了三批样品中丹酚酸B的含量在15mg/袋以上,考虑到不同产地药材的差异,暂定本品每粒含丹酚酸B不得少于12.0mg/袋;此外还进行了性状、微生物限度等的检查。按质量标准草案对多批中试样品进行检验,其结果均符合规定,不仅说明我们所确定的工艺稳定可行,也说明制定的质量标准科学、可控。 7.1.4 稳定性考察 (1)初步稳定性考察 ***颗粒(批号:20050801、20050802、20050803)在模拟市售包装条件进行初步稳定性考察,在室温(10~30℃),相对湿度60%±10%条件下放置6个第二部分:药学研究资料 ***颗粒申报资料7 3 月,在试验期间分别于第0、3、6个月取样,按照***颗粒质量标准草案检查。考察项目为性状、鉴别、检查、含量测定、微生物限度检查等项。 (2)加速稳定性考察 ***颗粒(批号:20050801、20050802、20050803)在模拟市售包装条件进行加速稳定性考察,温度为40℃±2℃、相对湿度为75%±5%的条件下放置6个月,在试验期间分别于第0、1、2、3、6个月取样,按照***颗粒质量标准草案检查。考察项目为性状、鉴别、检查、含量测定、微生物限度检查等项。 (3)考察结果与结论 在室温(10~30℃),相对湿度60%±10%条件下留样观察6个月,各项质量指标无明显变化,说明本品在现有的包装条件下,其产品质量基本稳定,其执行的质量标准是可行的。加速试验各项指标均未发生明显变化,表明本品在加速试验条件下稳定。通过上述对***颗粒的稳定性试验考察,结果表明本品在室温、密封条件下稳定。暂定有效期2年。 7.1.5 说明书、包装、标签 本品内包装采用铝箔包装,无毒,无污染,符合药用要求,其注册证和质量标准见复印件。说明书、包装和标签中的内容详见申报资料5和6,内容编写严格按照国家食品药品监督管理局颁发的《中药、天然药物药品说明书撰写指导原则》进行。 7.2 分析与评价 该颗粒剂的制备工艺完全按照片剂的工艺操作,相对片剂而言,有效物质基础没有变化,保证了颗粒剂的有效和安全。按确定工艺条件,制备了多批中试样品,并制定了科学、可行的质量标准草案,按照制定的质量标准草案对中试样品进行检验,结果均符合规定,说明了“***颗粒”的质量具有很好的可控性。通过六个月稳定性和加速稳定性考察,结果表明该制剂在加速稳定期内是稳定的,暂定有效期2年。 综上所述,我公司在现有的制备工艺下制备的***颗粒,产品安全、有效、质量可控。
医院制剂中药品种申报资料技术要求详解演示文稿医院制剂中药品种申报资料是指将中药制剂引入医院临床使用前所需提交的一系列申报资料。
这些资料对中药制剂的质量、疗效、安全性等方面进行了详细的要求和说明,以确保中药制剂的安全有效使用。
下面是对医院制剂中药品种申报资料技术要求的详细解析。
1.中药制剂的名称和通用名称:申报时需要提供中药制剂的正式名称和通用名称,以便与其他药品进行区分,并方便医护人员使用和患者就诊。
2.中药制剂的剂型和规格:在申报中需要明确中药制剂的剂型,例如颗粒、丸剂、煎剂等,并注明具体的规格,如每袋中药颗粒的重量或每瓶中药丸剂的粒数。
3.生产单位和批号:申报时需要提供中药制剂的生产单位名称和地址,并注明批号,以便追溯制剂的生产过程和检验情况。
5.中药制剂的制备方法:申报中需要详细描述中药制剂的制备方法,包括提取、炮制、配伍、炮制等工艺参数和步骤,以确保制剂的一致性和质量。
6.中药制剂的质量控制:申报中需要提供中药制剂的质量控制标准和方法,包括质量指标、检验方法、仪器设备等信息,以确保制剂的质量符合规定标准。
7.中药制剂的质量稳定性:申报中需要提供中药制剂的质量稳定性研究结果,包括长期稳定性、热稳定性、光稳定性等,以确保制剂在储存和使用过程中质量不受影响。
8.中药制剂的药效学研究:申报中需要提供中药制剂的药效学研究结果,包括体内外药效学实验、毒理学实验等,以确保制剂的疗效和安全性。
9.中药制剂的临床研究:申报中需要提供中药制剂的临床研究结果,包括临床试验方案、研究数据和统计分析等,以证明制剂的临床疗效和安全性。
10.中药制剂的不良反应监测:申报中需要提供中药制剂的不良反应监测计划和结果,包括临床试验中的不良反应情况和药物市场使用后的不良反应报告,以便及时发现和处理不良反应事件。
以上就是对医院制剂中药品种申报资料技术要求的详细解析。
医院制剂中药品种申报资料要求提供中药制剂的各个环节的详细信息和研究结果,以确保制剂的质量、疗效和安全性。
XX省医疗机构制剂注册申报资料一、申请免临床试验制剂品种的申报资料项目(一)制剂名称(包括中文名、英文名或汉语拼音)。
(二)该品种的市场供应情况。
(三)证明性文件。
(四)标签及说明书设计样稿。
(五)处方组成、来源、理论依据以及使用背景情况。
(六)制剂的质量标准及来源说明。
(七)制剂的稳定性试验资料。
(八)三批样品的自检报告书。
(九)制剂所用的化学原料药、中药材、中药饮片及辅料的质量标准。
(十)直接接触制剂的包装材料和容器的选择依据及质量标准。
(十一)化学药品主要生物等效性试验资料及文献资料。
如该品种符合“处方在本医疗机构具有5年以上(含5年)使用历史的中药制剂”,并申请免临床的,应提供详细的5年临床使用报告,包含处方解析、申报制剂与原方剂处方对比、中医主治症候与病例中的中医症状描述、入选病例的诊断和评定标准、临床回顾性总结等内容。
二、已完成临床试验制剂品种的申报资料项目(一)临床试验总结报告。
(二)临床试验结束后,凡对临床试验申请报送资料内容有所变更的,应报送相应变更内容的说明材料和变更依据。
三、说明(一)资料项目3证明性文件包括:(1)《医疗机构执业许可证》复印件、《医疗机构制剂许可证》复印件;(2)医疗机构制剂或者使用的处方、工艺等的专利情况及其权属状态说明,以及对他人的专利不构成侵权的保证书;(3)提供化学原料药、中药材、中药饮片及辅料的合法来源证明文件,包括:批准证明性文件、购进凭证、检验报告书等资料复印件;(4)提供直接接触制剂的包装材料和容器的合法来源证明文件,包括:批准证明性文件、购进凭证、检验报告书等资料复印件;(5)《医疗机构制剂临床试验批件》复印件;(6)未取得《医疗机构制剂许可证》或《医疗机构制剂许可证》无相应制剂剂型的医疗机构申请医疗机构中药制剂,还应当提供以下资料:委托配制中药制剂双方签订的委托配制合同、制剂配制单位《医疗机构制剂许可证》、《药品生产许可证》及《药品生产质量管理规范》认证证书复印件。
中药申报资料资料格式体例
中药申报资料的格式体例通常包括以下几个方面:
1. 申报资料的封面,封面应包括申报单位名称、申报时间、申
报项目名称等基本信息,并标明“中药申报资料”。
2. 申报资料的目录,列出申报资料的各个部分及其页码,方便
审阅人员查找相关内容。
3. 申报单位基本信息,包括单位名称、单位地址、联系电话等
基本信息。
4. 申报项目概况,对申报的中药项目进行简要介绍,包括项目
名称、研究目的、研究内容等。
5. 中药材信息,包括中药材的学名、别名、来源地、性味归经、功效主治等内容。
6. 中药制剂信息,如果申报的是中药制剂,需要提供制剂的配方、工艺流程、质量标准等相关信息。
7. 中药研究报告,包括中药的研究背景、研究方法、实验结果、结论等内容。
8. 申报单位的资质证明,如申报单位的执照、资质认证证书等
相关文件。
9. 其他附加资料,根据具体情况,可能需要提供其他相关的资料,比如中药生产许可证、药品注册证书等。
总的来说,中药申报资料的格式体例应当清晰、完整、规范,
便于审阅人员查阅和审阅。
同时,根据具体的申报要求和标准,格
式体例可能会有所不同,申报人需要根据实际情况进行具体的规范。
立题目的与依据3.1 处方来源“***颗粒”处方来源于《部颁中药成方制剂》第十册收载的“***片”,标准号为:WS3-B-****-**。
3.2 选题依据心血管疾病是当今世界上威胁人类最严重的疾病之一,其发病率和死亡率已超过肿瘤性疾病而跃居第一。
心脑血管疾病已成为威胁我国公众健康的重要疾病,其发生率已高达总人口的8%,死亡率高,冠心病是其中主要致死原因之一。
冠状动脉性心脏病(coronary heart disease),简称冠心病,是指因狭窄性冠状动脉疾病而引起的心肌缺氧(供血不足)所造成的缺血性心脏病。
与发达国家相比,我国属冠心病低发国家,据报告,我国冠心病死亡粗率:城市为36.9/10万,农村为15.6/10万。
但近年来呈快速发展和发病年轻化趋势。
据专家估计,每年死于各种冠心病的人数超过100万。
且目前还有继续快速发展趋势。
因此,开发新的具有较好疗效的,具有我国自主知识产权的治疗冠心病的中药具有巨大的市场前景。
冠心病的治疗包括三个治疗方案,即药物治疗、介入治疗和心外科搭桥手术。
介入治疗创伤小、恢复快,能迅速解决冠状动脉狭窄,缓解心肌缺血,改善生活质量,缺点是花费大、部分病人不适合做介入治疗、部分病人会出现扩开的血管再次出现狭窄。
搭桥手术效果可靠,但需开胸手术,创伤较大,恢复时间较长。
市场调查显示***片市场需求大,为满足市场需求,我公司在调研的基础上,将其改为颗粒剂,为患者提供又一种药物治疗的选择。
3.3 有关该品种生产、使用情况的综述“***颗粒”处方由丹参、没药、鸡血藤、血竭、延胡索(醋制)、当归、郁金、制何首乌、桃仁(炒)、黄精(蒸)、红花、粉葛、乳香(炒)、冰片等十四味中药材组成,本品具有活血化淤,活血止痛的功效,临床常用于以胸部刺痛、固定不移、入夜更甚、心悸不宁、舌质紫暗,脉沉弦为主症的冠心病、心绞痛,冠状动脉供血不足。
***片自投入市场以来受到广大医药工作者和患者的欢迎。
同时根据网上调查,该品种临床反映疗效很好,无毒副作用,市场前景广阔。
药材来源及鉴定依据1丹参Danshen RADIX ET RHIZOMA SALVIAE MILTIORRHIZAE 基源:本品为唇形科植物丹参Ralvia miltiorrhiza Bge的干燥根及根茎。
主产地:主产四川、山西、河北、江苏、安徽。
鉴定依据:《中华人民共和国药典》2005版一部第52页丹参项下的有关规定。
2没药Moyao MYRRHA基源:本品为橄榄科植物没药树Commiphora myrrha Engl.或爱伦堡没药树Balsamodendron ehrennbergianum Berg.的干燥胶树脂。
前者习称“天然没药”,后者习称“胶质没药”。
主产地:广西、广东、海南。
鉴定依据:《北京市中药饮片标准》第329页没药项下的有关规定。
3鸡血藤Jixueteng CAULIS SPATHOLOBI基源:本品为豆科植物密花豆Spatholobus suberectus Dunn的干燥藤茎。
主产地:广西。
鉴定依据:《中华人民共和国药典》2005版一部第134页鸡血藤项下的有关规定。
4血竭Xuejie SANGUIS DRACONIS基源:本品为棕榈科植物麒麟竭Daemonorops draco Bl.果实渗出的树脂经加工制成。
主产地:广东、台湾。
鉴定依据:《中华人民共和国药典》2005版一部第96页血竭项下的有关规定。
5延胡索Yanhusuo RHIZOMA CORYDALIS基源:本品为罂粟科植物延胡索Corydalis yanhusuo W.T.的干燥块茎。
主产地:浙江磐安、东阳。
鉴定依据:《中华人民共和国药典》2005版一部第94页延胡索项下的有关规定。
6当归Danggui RADIX ANGELICAE SINENSIS基源:本品为伞形科植物当归Angelica sinensis(Oliv。
)Diels的干燥根及根茎。
主产地:主产甘肃、云南、四川;多栽培。
鉴定依据:《中华人民共和国药典》2005版一部第89页当归项下的有关规定。
7郁金Yujin RADIX CURCUMAE基源:本品为姜科植物温郁金Curcuma wenyujin Y.H.Chenet C.Ling姜黄Curcuma longa L.广西莪术Curcuma kwangsiensis S.G.Lee et C.F.Liang 或蓬莪术Curcuma phaeocaulis Val.的干燥块根。
主产地:浙江、四川、广东、广西、云南、福建、台湾、江西。
鉴定依据:《中华人民共和国药典》2005版一部第144页郁金项下的有关规定。
8制何首乌Zhiheshouwu RADIX POLYGONI MULTIFLORI PRAEPARATA CUM SUCCO GLUCINES SOTAE基源:本品为何首乌的炮制加工品。
主产地:河南、广东、贵州、江苏、湖北、四川。
鉴定依据:《中华人民共和国药典》2005版一部第123页制何首乌项下的有关规定。
9桃仁Taoren RADIX ET RHIZOMA SALVIAE基源:本品为唇形科植物丹参Ralvia miltiorrhiza Bge的干燥根及根茎。
主产地:山东。
鉴定依据:《中华人民共和国药典》2005版一部第52页桃仁项下的有关规定。
10黄精Huangjing RHIZOMA POLYGONATI基源:本品为百合科植物颠黄精Polygonatum kingianum Coll.et Hemsl.、黄精Polygonatum sibiricum Red.或多花黄精Polygonatum cyrtonema Hua的干燥根茎。
主产地:滇黄精主产于贵州、广西、云南等省区。
黄精主产于河北、内蒙古、陕西等省区。
多花黄精主产于贵州、湖南、云南、安徽、浙江等省。
鉴定依据:《中华人民共和国药典》2005版一部第215页黄精项下的有关规定。
11红花Taoren RADIX ET RHIZOMA SALVIAE基源:本品为菊科植物红花Ralvia miltiorrhiza Bge的干燥根及根茎。
主产地:新疆、塔城盆地、云南等地。
鉴定依据:《中华人民共和国药典》2005版一部第103页红花项下的有关规定。
12粉葛Fengen RADIX PUERARIAE THOMSONII基源:本品为豆科植物甘藤葛Pueraria thomsonii Benth.的干燥根。
主产地:湖南、浙江、河南、广东。
鉴定依据:《中华人民共和国药典》2005版一部第203页粉葛项下的有关规定。
乳香为13乳香Ruxiang OLIBANUM基源:本品为橄榄科植物卡氏乳香树Boswellia Carterii Birdw.及同属其它数种植物渗出的油胶树脂。
主产地:广西、广东、海南。
鉴定依据:《北京市中药饮片标准》第332页乳香项下的有关规定。
14冰片Bingpian BORNEOLUM SYNTHETICUM基源:本品为合成龙脑。
主产地:广东、广西、云南、贵州。
鉴定依据:《中华人民共和国药典》2005版一部第98页冰片项下的有关规定。
丹参检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合规定【鉴别】 薄层色谱鉴别1 薄层色谱鉴别2 应符合规定 应符合规定符合规定 符合规定【检查】 水分 总灰分 酸不溶性灰分 不得过13.0% 不得过10.0% 不得过3.0%10.2% 7.8% 1.6% 【浸出物】 水溶性浸出物 醇溶性浸出物 重金属及有害元素不得少于35.0% 不得少于15.0% 应符合规定46.8% 27.9% 符合规定【含量测定】丹参酮ⅡA本品含丹参酮ⅡA (C 19H 18O 3)不得少于0.20% 0.34%丹酚酸B本品按干燥品计算,含丹酚酸B (C 36H 30O 16)不得少于3.0%3.9% 结 论:本品符合《中华人民共和国药典》2005版一部第52页丹参项下的有关规定。
没药检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合“炒没药”的规定【鉴别】 化学鉴别1 化学鉴别2应符合规定 应符合规定符合规定 符合规定结 论:本品符合《北京市中药饮片标准》第329页没药项下的有关规定。
鸡血藤检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合规定【鉴别】 显微鉴别 薄层色谱鉴别 应符合规定 应符合规定符合规定 符合规定【检查】 水分 总灰分 酸不溶性灰分 不得过13.0% 不得过4.0% 不得过0.6% 10.1% 2.9% 0.41% 【浸出物】不得少于8.0%12.4%结 论:本品符合《中华人民共和国药典》2005版一部第134页鸡血藤项下的有关规定。
血竭检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合规定【鉴别】 化学鉴别 薄层色谱鉴别1 薄层色谱鉴别2 应符合规定 应符合规定 应符合规定符合规定 符合规定 符合规定【检查】 总灰分 松香 酸不溶物 不得过6.0% 应符合规定 不得过25.0%4.3% 符合规定 19.8% 【含量测定】本品含血竭素(C 17H 14O 3)不得少于1.0%1.9%结 论:本品符合《中华人民共和国药典》2005版一部第96页血竭项下的有关规定。
延胡索检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合规定【鉴别】 显微鉴别 薄层色谱鉴别 应符合规定 应符合规定符合规定 符合规定【检查】 水分 总灰分 酸不溶性灰分 不得过15.0% 不得过4.0% 不得过1.5% 10.7% 2.9% 0.97% 【浸出物】不得少于13.0% 17.2%【含量测定】本品按干燥品计算,含延胡索乙素(C 21H 25NO 4)不得少于0.050%0.081%结 论:本品符合《中华人民共和国药典》2005版一部第94页延胡索项下的有关规定。
当归检验报告单化验员: 复核员: 负责人检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合规定【鉴别】 显微鉴别 应符合规定 符合规定 薄层色谱鉴别1 应符合规定 符合规定 薄层色谱鉴别2 应符合规定符合规定【检查】 水分 总灰分 酸不溶性灰分 不得过12.0% 不得过7.0% 不得过2.0% 7.3% 3.2% 0.9% 【浸出物】 不得少于45.0% 63.0%【含量测定】本品按干燥品计算,含阿魏酸(C 10H 10O 4)不得少于0.050%0.079% 结 论:本品符合《中华人民共和国药典》2005版一部第89页当归项下的有关规定。
郁金检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果【性状】 应符合规定符合“黄丝郁金”的规定【鉴别】 显微鉴别 应符合规定符合“黄丝郁金”的规定【检查】 水分 总灰分不得过15.0% 不得过9.0%11.3% 7.4%结 论:本品符合《中华人民共和国药典》2005版一部第144页郁金项下的有关规定。
制何首乌检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合规定【鉴别】 薄层色谱鉴别 应符合规定符合规定【检查】 水分 总灰分 酸不溶性灰分 不得过12.0% 不得过9.0% 不得过2.0% 8.1% 6.9% 1.2% 【浸出物】不得少于5.0%7.6%【含量测定】本品按干燥品计算,含2,3,5,4’-四羟基二苯乙烯-2-O -β-D-葡萄糖苷(C 20H 22O 9)不得少于0.70%0.99%结 论:本品符合《中华人民共和国药典》2005版一部第123页制何首乌项下的有关规定。
桃仁检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合“桃仁”的规定【鉴别】显微鉴别 应符合规定符合“桃仁”的规定【检查】 酸值 羰基值不得过10.0 不得过11.07.9 9.3结 论:本品符合《中华人民共和国药典》2005版一部第196页桃仁项下的有关规定。
黄精检验报告单化验员: 复核员: 负责人:检 验 结 果检验项目 检验标准 检验结果 【性状】 应符合规定符合“大黄精”的规定【鉴别】显微鉴别 应符合规定符合“大黄精”的规定【检查】 水分 总灰分 酸不溶性灰分 不得过18.0% 不得过4.0% 不得过1.0% 15.9% 2.8% 0.78% 【浸出物】不得少于45.0% 52.9%【含量测定】本品按干燥品计算,含黄精多糖以无水葡萄糖(C 6H 12O 6)计,不得少于7.0%10.1%结 论:本品符合《中华人民共和国药典》2005版一部第215页黄精项下的有关规定。