痰培养标本采集与运送标准操作规程
- 格式:doc
- 大小:42.00 KB
- 文档页数:2
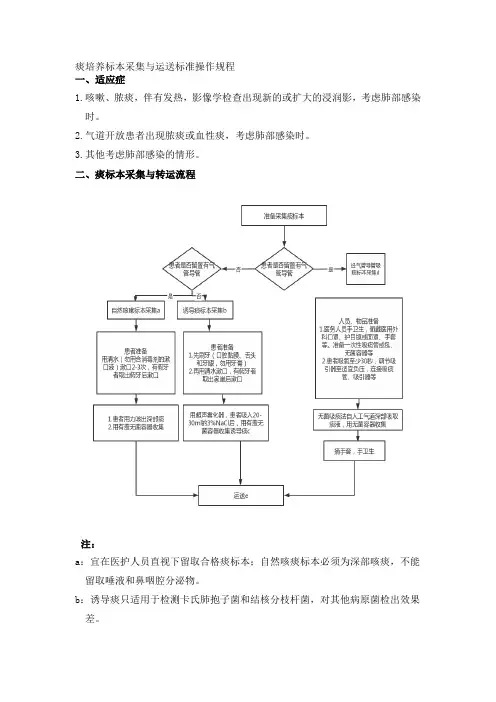
痰培养标本采集与运送标准操作规程一、适应症1.咳嗽、脓痰,伴有发热,影像学检查出现新的或扩大的浸润影,考虑肺部感染时。
2.气道开放患者出现脓痰或血性痰,考虑肺部感染时。
3.其他考虑肺部感染的情形。
二、痰标本采集与转运流程注:a:宜在医护人员直视下留取合格痰标本;自然咳痰标本必须为深部咳痰,不能留取唾液和鼻咽腔分泌物。
b:诱导痰只适用于检测卡氏肺抱子菌和结核分枝杆菌,对其他病原菌检出效果差。
C.有气道高反应者慎用高渗NaCl诱导。
d.仅当气管插管的患者出现肺炎症状时,可采集气管导管吸出物标本(气管在插管24小时后即有定植菌,若未有肺部感染指征时送检气管吸出物,可导致结果与疾病不符)。
e.室温下应在2小时内送至微生物室,如不能及时送检,可将标本放置2〜8°C 环境保存2〜24小时;延迟送检将导致非苛养的口咽部定植菌过度生长,有临床意义的病原菌数量相对减少,低温保存会使肺炎链球菌等苛养菌的分离机会和数量减少;故若标本延迟送检,应在报告中予以说明并指出可能对培养结果的影响。
三、标本拒收标准1.显微镜下细胞学检查发现标本受口咽部菌群污染,合格痰标本鳞状上皮细胞﹤10 个/低倍视野。
2.送检标本为唾液、口咽分泌物或鼻咽部窦内引流物等。
3.痰液中含有食物残渣。
4.无标签或标签贴错;标识信息不明,未提供釆集时间及送检目的等。
5.送检时间超过2小时且未正确保存的标本。
6.收集容器有渗漏或容器存在其他不合格情况。
四、注意事项1.24小时内不要重复采集痰标本。
2.咳痰、诱导痰、气管吸出痰标本不适合做厌氧菌培养。
3.尽量在首剂抗菌药物使用前及更换抗菌药物前釆集标本。
只要有可能得到合格的痰标本,应马上釆集、送检。
4.当肺部感染患者伴有发热(≥38°C)或低体温(≤36°C)、白细胞增多或粒细胞减少等血培养送检指征时,应同时釆集血标本送检。
5.申请单应注明患者的临床诊断、症状、是否使用了抗菌药物、检测目的、标本釆集时间,并标识是普通培养、抗酸杆菌培养还是真菌培养。


取痰标本操作流程
取痰标本是临床医学中常见的一项操作,用于检测痰中的病原微生物,帮助医生诊断疾病。
下面我将介绍一下取痰标本的操作流程。
首先,准备好所需的工具和材料,包括痰杯、无菌采样棒、标签、手套、口罩等。
确保所有工具都是干净的,以避免污染标本。
接着,让患者坐在椅子上或者躺在床上,让他们深呼吸几次以帮助产生痰液。
可以让患者喝一些温水或者吸入盐水蒸气来刺激咳嗽,促使产生痰液。
然后,让患者咳嗽并将痰液吐入痰杯中。
确保痰液不被口水或其他物质污染,以免影响检测结果。
接下来,用无菌采样棒将痰液取出,并涂抹在培养皿或者玻璃片上。
注意避免接触其他物体,以免污染标本。
最后,将标本送往实验室进行检测。
在送检之前,务必在标签上标明患者的姓名、年龄、性别等信息,并确保标本的保存和运输符合规定。
总的来说,取痰标本的操作流程并不复杂,但需要严格遵守无菌操作规范,以确保检测结果的准确性。
希望以上介绍能帮助您更
好地了解取痰标本的操作流程。

痰标本采集操作规程一、目的(1)常规痰标本:检查痰的一般形状,涂片检查细胞、细菌、虫卵,以及观察其性质、颜色、气味和量以协助诊断呼吸系统疾病。
(2)痰培养标本:检查痰中的致病菌,及确定病菌类型。
(3)24h痰标本:检查24h痰的量及性状,协助诊断。
二、评估(1)病人的一般情况,病人的理解能力及其合作能力。
(2)病人的临床诊断和目前的病情、治疗情况。
(3)检查目的。
三、计划(1)用物准备:①病人能自行留痰者:标本容器(痰培养标本被无菌容器及漱口溶液200ml,24h痰标本备广口集痰器)、检验单(标明科室、床号、姓名、住院号、检查目的、送检日期时间)。
②病人无法咳痰或不合作:集痰器,检验单(标明病室、床号、姓名)、吸痰用物(吸引器、吸痰管)、生理盐水、手套。
痰培养标本需备无菌用物。
(2)病人准备:核对并向病人解释收集痰液的方法和注意事项。
(3)环境准备:通风。
(4)护士准备:做好个人防护。
四、实施(1)操作步骤:①常规痰标本A、病人能自行留痰者:贴标签于标本容器上,携用物至床旁→再次查对并做好解释→请病人于清晨醒来未进食前先漱口,数次深呼吸后用力咳出气管深处的痰液,盛于痰盒内,盖好痰盒→给予漱口或口腔护理→洗手、记录→送检B、无法咳痰或不合作者贴标签于标本容器上,携用物至床旁→再次查对并做好解释)→协助病员取合适卧位,由下向上叩击病人背部→用集痰器和吸引器按照吸痰法将痰吸入集痰器内,加盖→给予漱口或口腔护理→洗手、记录→送检②痰培养标本A、病人能自行留取痰液贴标签于标本容器上,携用物至床旁→再次查对并做好解释→病人清晨起床后,未进食前先用漱口溶液漱口,再用清水漱口,数次深呼吸后用力咳出气管深处的痰液于无菌集痰器内,盖好瓶盖→给予漱口或口腔护理→洗手、记录→送检B、无法咳嗽或不合作病人贴标签于标本容器上,携用物至床旁→再次查对并做好解释→取合适卧位,由下向上叩击病人背部→戴好无菌手套,用无菌集痰器和吸引器按吸痰法将痰吸入无菌集痰器内,加盖→给予漱口或口腔护理→洗手、记录→送检③24h 痰标本贴标签于标本容器上,携用物至床旁→再次查对并做好解释→在广口集痰器内加少量清水→从7am 未进食前漱口后第一口痰开始留取,次日晨7am 未进食前第一漱口后第一口痰作为结束,将24h 的全部痰液吐入集痰器内→给予漱口或口腔护理→洗手、记录→送检(2)注意事项:①帮助病人排痰,如伤口疼痛无法咳嗽,可用软枕或手掌压迫伤口,减轻肌肉张力,减少咳嗽时的疼痛。

痰培养标本质量控制痰培养标本质量控制引言痰培养是一项常见的临床实验室检查方法,用于确定病原体引起的呼吸道感染。
为了确保痰培养结果的准确性和可靠性,标本的质量控制非常重要。
本文将介绍痰培养标本的采集、存储和运送等方面的质量控制措施,以确保实验室可以得到可靠的检测结果。
1. 标本采集1.1 采集时间痰培养标本的采集时间应尽可能在早晨。
这是因为痰在清晨常常较为稠厚,有助于提高痰中病原体的检出率。
1.2 采集方法痰样可通过自主咳嗽或刺激咳嗽来采集。
采集前可以给患者提供清水漱口,以减少口腔中的细菌数量对结果的影响。
患者被要求深吸气,然后咳嗽将痰样吐入无菌容器中。
1.3 标本量痰培养所需的标本量应达到一定的要求,一般为5~10mL。
不足的标本量可能导致病原体无法得到充分的检测。
1.4 标本处理将采集到的痰样进行处理前,应该检查样本的外观,确保没有明显的污染或黏液,否则将会影响病原体的检测。
2. 标本存储和运送2.1 存储温度采集到的痰样应尽快送到实验室进行检测。
在运送过程中,痰样应存放在4℃以下的温度下,以防止细菌的生长和繁殖。
2.2 容器选择痰样应存放在无菌容器中,以避免外部细菌的污染。
常用的容器包括无菌塑料瓶和试管等。
2.3 运送方式痰样的运送方式多样,可以通过特快专递、邮政运输或专门的医院运输系统进行。
在运送过程中,应尽量避免剧烈的摇晃或震荡,以防止痰样的损坏。
3. 质控措施3.1 临床信息记录在进行痰培养之前,必须要有完整的临床信息记录。
这些信息包括患者的年龄、性别、病史、症状等,有助于判断痰中病原体的可能种类。
3.2 培养方法选择适当的培养方法对痰样进行处理。
常用的培养方法包括血培养、肉汤培养和专门的培养基等。
在处理过程中,要严格遵守实验室操作规范,避免污染。
3.3 负对照样本每次进行痰培养实验时,还需要设置相关的负对照样本。
负对照样本是一种不包含病菌的标本,用来验证实验操作的准确性和结果的可靠性。

一、痰液标本
痰培养仅用于下呼吸道感染,主要是肺部感染的诊断。
但它不是诊断肺部感染的最佳标本。
血培养、肺泡灌洗液或经气管吸取物的培养结果更加准确。
痰标本不能进行厌氧菌培养。
痰标本采集前,要判断患者是否有能力配合完成深部咳痰。
要向患者充分说明口腔清洁、深咳、避免口咽部菌群污染的意义,指导患者如何正确留取痰标本。
二、痰标本的采集时间
1.采集标本的最佳时机应在使用抗菌药物之前。
2.宜采集清晨痰液。
三、采集方法
1.自然咳痰法:嘱咐患者先用温开水漱口数次,以减少长居菌的污染(有假牙的病人应先取下假牙),然后用力咳出气管深部的痰液,吐入无菌痰杯中立即送检。
2.诱导咳痰:对无痰、少痰或痰浓不易咳出者,可用3%生理盐水5ml雾化吸入5min后留取痰液;对于小儿可采取轻压胸骨柄的方法。
3.体位引流:支气管扩张症患者,清晨起床后进行,可采集大量痰标本。
4.对咳嗽乏力或晕迷病人,可用吸痰管经鼻腔或口腔抵达气管腔内取痰。
5.双侧肺部感染伴人工气道如气管切开或气管插管患者,可用吸痰管经人工气道插至支气管水平取痰。
6.对重症、难治或伴免疫或疑似厌氧菌引起的医院内肺部感染,可采用环甲膜穿刺经气管吸引(TTB)、经胸壁毛刷(PSB)或防污染支气管肺泡(PBBL)
90。
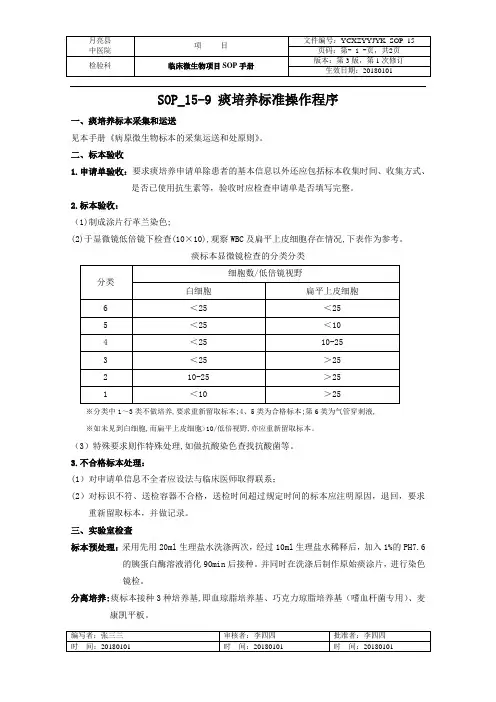
SOP_15-9 痰培养标准操作程序一、痰培养标本采集和运送见本手册《病原微生物标本的采集运送和处原则》。
二、标本验收1.申请单验收:要求痰培养申请单除患者的基本信息以外还应包括标本收集时间、收集方式、是否已使用抗生素等,验收时应检查申请单是否填写完整。
2.标本验收:(1)制成涂片行革兰染色;(2)于显微镜低倍镜下检查(10×10),观察WBC及扁平上皮细胞存在情况,下表作为参考。
痰标本显微镜检查的分类分类※分类中1~3类不做培养,要求重新留取标本;4、5类为合格标本;第6类为气管穿刺液,※如未见到白细胞,而扁平上皮细胞>10/低倍视野,亦应重新留取标本。
(3)特殊要求则作特殊处理,如做抗酸染色查找抗酸菌等。
3.不合格标本处理:(1)对申请单信息不全者应设法与临床医师取得联系;(2)对标识不符、送检容器不合格,送检时间超过规定时间的标本应注明原因,退回,要求重新留取标本,并做记录。
三、实验室检查标本预处理:采用先用20ml生理盐水洗涤两次,经过10ml生理盐水稀释后,加入1%的PH7.6的胰蛋白酶溶液消化90min后接种。
并同时在洗涤后制作原始痰涂片,进行染色镜检。
分离培养:痰标本接种3种培养基,即血琼脂培养基、巧克力琼脂培养基(嗜血杆菌专用)、麦康凯平板。
培养条件:置烛缸普通培养18-24h如无病菌生长时,应将所有培养基继续培养24h。
四、结果观察和报告1.结果观察和评价:2.阴性培养结果报告:无致病菌生长/上呼吸道正常菌群生长。
3.阳性培养结果报告:有意义的阳性培养结果报告:细菌种属名称及标准抗菌药物敏感性试验结果。

X京立医院痰培养标本采集与运送标准操作规程(SOP)〔试行〕一、目的正确采集、运送痰标本。
二、内容〔一〕采集目的一般可用于一般细菌、分枝杆菌、真菌和军团菌的涂片或培养检测,经气管穿刺吸引物可用于厌氧菌的检测。
〔二〕一般原则1 采集标本的最正确时机应在使用抗菌药物之前。
2 宜采集清晨第二口痰液。
3 对于一般细菌性肺炎,痰标本送检每天1次,连续2~3天。
不建议24h内屡次采样送检,除非痰液外观性状出现改变。
4 疑心分枝杆菌感染者,应连续搜集3天清晨痰液送检。
〔三〕采集方法1 自然咳痰法与雾化导痰法1.1 用物打算:无菌容器、生理盐水、化验单。
1.2 核对患者床号、姓名等。
1.3 无痰或痰量极少者可用3%~5%氯化钠溶液5ml雾化吸入约5min后留取痰液。
1.4 如有可能,应在医护人员直视下留取清晨第二口痰。
叮嘱患者留取前摘取牙托,清洁口腔,如刷牙后反复用生理盐水漱口;深吸气后用力自气管深部咳出痰液,置无菌容器内。
应尽可能预防唾液及鼻咽局部泌物混入样品,不应用纸巾包裹痰液。
2 经人工气道吸引法2.1 用物打算:负压吸引器、生理盐水、一次性吸痰管、无菌手套、无菌容器、化验单。
2.2 核对患者床号、姓名等。
2.3 将患者头部转向操作者一侧。
2.4 进行手卫生后将一次性吸痰管末端拆开,连接吸引器,调节吸引器至适宜负压〔成人:40.0~53.3kPa;小儿:<40.0kPa〕。
2.5 将一次性吸痰管外包装去除,戴手套持吸痰管试吸生理盐水,检查管道是否通畅。
2.6 折叠一次性吸痰管末端,插入口腔或鼻腔或人工气道至适宜深度,放开吸痰管末端,柔和、灵敏、迅速地左右旋转上提吸痰管吸痰。
见吸痰管内有痰液吸出,即折叠一次性吸痰管退出,将一次性吸痰管与吸引器别离〔使用人工呼吸机者,一次吸痰时间不超过15s,吸痰前后需吸入高浓度氧气1~2min〕。
2.7 将痰液注入无菌容器内,如痰液黏稠可用一次性针筒向吸痰管末端注入少量生理盐水,将痰液冲入无菌容器内。

痰标本采集一、目的根据医嘱采集患者痰液标本,进行临床检验,为诊断和治疗提供依据。
二、操作标准(一)操作前准备(1)评估患者询问了解患者身体状况,向患者解释,取得配合,昏迷患者病情平稳。
观察患者口腔黏膜有无异常和咽部情况。
(2)个人准备仪表端庄,服装整洁,洗手戴口罩。
(3)用物准备无菌手套、一次性痰培养器。
(4)环境准备安静、舒适。
(二)操作步骤(1)核对医嘱及患者。
(2)洗手,戴无菌手套。
(3)助手协助打开痰培养器,若为呼吸机辅助呼吸患者,助手协助按下纯氧和静音按钮。
(4)痰培养器接负压吸引器。
(5)助手协助固定患者头部,若为气管插管患者,助手协助断开患者气管插管接头处。
(6)吸痰管插入到合适深度后,开放负压吸引痰液。
当标本瓶内痰液达到需要量时关闭负压,退出吸痰管,痰培养器加盖。
(7)再次核对患者姓名。
(8)洗手,记录。
三、注意事项(1)严格无菌操作,避免污染标本,影响检验结果。
(2)在抗生素使用前采集价值高。
(3)痰液标本采集最好在上午进行。
(4)连续采集3~4次,采集间隔时间>24小时。
(5)不能用无菌水冲洗吸痰管,否则会稀释标本。
(6)退吸痰管时不能开放负压,否则会引起上呼吸道分泌物污染标本。
(7)标本送检不超过2小时,不能及时送检者可暂存4℃冰箱。
(8)痰液标本采集后应评估标本量、颜色、形状,进行痰液涂片,检查确定标本来源,若怀疑细菌感染,应进行革兰染色、细菌培养和药物敏感试验。
(9)送检标本应注明来源、检验目的和采样时间,使实验室能正确选用相应的培养基和适宜的培养环境。

痰培养标本采集方法及注意事项痰培养是检测呼吸系统感染的常用方法,通过痰样标本的培养可以帮助医生判断感染病原体的种类和药物敏感性,从而指导治疗方案的制定。
下面将详细介绍痰培养标本采集方法及注意事项。
一、痰样标本采集方法:1.患者要求深呼吸几次,使痰呈现泡沫状。
2.用清洁的容器接收痰液,避免采集过程中的外界污染。
3.采集痰样前应安排好病人的入院体位和浅铁片大小,以便用病号自创碎片痰标本。
卧床患者宜用小瓶采痰,以后实验室且固体约5mL。
立即送到实验室。
4.采集过程中,医务人员应佩戴口罩、手套等防护用品,避免病原体的交叉感染。
5.采样前要嘱患者先漱口,然后用生理盐水漱口,以减少口腔中的细菌污染。
早晨空腹时采样,减少食物残渣的干扰。
二、痰样标本采集注意事项:1.严格掌握正确的采集方法,避免误采或污染导致结果不准确。
2.对于痰液量较少或黏稠的病人,可以采用辅助手法,如用雾化器辅助吸痰或经床边有机器吸痰管进行吸痰。
3.应及时将采集的痰样送至实验室,避免延迟送检导致细菌的增生或减少。
4.实验室应尽快进行标本的处理和培养,以避免细菌的变性或死亡。
5.采样过程中应注意避免口腔分泌物、咳出物、鼻涕等其他物质的污染,以免对细菌培养和鉴定结果产生干扰。
6.严禁用消毒液直接接触标本,以免对菌落生长产生抑制作用。
7.采样器具要用无菌材料制作,标本容器要清洁干净。
痰培养标本采集方法及注意事项对检测呼吸系统感染具有重要意义,采集得到的标本质量直接关系到培养结果的准确性和可靠性。
医务人员和实验室人员必须严格遵守操作规范,保证标本的无菌和准确性,为临床病人的治疗提供有效的依据。
同时,病人也应积极配合,按照医生的要求正确采集标本,以保证检测的准确性和有效性。

痰标本采集与运送标准操作规程一、痰液标本痰培养仅用于下呼吸道感染,主要是肺部感染的诊断。
但它不是诊断肺部感染的最佳标本。
血培养、肺泡灌洗液或经气管吸取物的培养结果更加准确。
痰标本不能进行厌氧菌培养。
痰标本采集前,要判断患者是否有能力配合完成深部咳痰。
要向患者充分说明口腔清洁、深咳、避免口咽部菌群污染的意义,指导患者如何正确留取痰标本。
二、痰标本的采集时间1.采集标本的最佳时机应在使用抗菌药物之前。
2.宜采集清晨痰液。
三、采集方法1.自然咳痰法:嘱咐患者先用温开水漱口数次,以减少长居菌的污染(有假牙的病人应先取下假牙),然后用力咳出气管深部的痰液,吐入无菌痰杯中立即送检。
2.诱导咳痰:对无痰、少痰或痰浓不易咳出者,可用3%生理盐水5ml 雾化吸入5min 后留取痰液;对于小儿可采取轻压胸骨柄的方法。
3.体位引流:支气管扩张症患者,清晨起床后进行,可采集大量痰标本。
4.对咳嗽乏力或晕迷病人,可用吸痰管经鼻腔或口腔抵达气管腔内取痰。
5.双侧肺部感染伴人工气道如气管切开或气管插管患者,可用吸痰管经人工气道插至支气管水平取痰。
6.对重症、难治或伴免疫或疑似厌氧菌引起的医院内肺部感染,可采用环甲膜穿刺经气管吸引(TTB)、经胸壁毛刷(PSB)或防污染支气管肺泡(PBBL)采集无口咽部菌群污染的痰液,进行精确的感染病原学诊断。
7. 支气管镜下采集法:由临床医师利用支气管镜取气管刷洗物支气管肺泡灌洗液等标本,臵于无菌痰杯后立即送检。
(四)注意事项1.常规细菌培养及鉴定标本须在常温下2 小时内送至微生物实验室,疑为嗜血杆菌感染、肺炎链球菌感染,标本采集后应立即送检。
2.标本内切勿混入唾液及鼻咽分泌物,标本量>1ml,一天仅需送检一次。
3.气管镜标本和痰标本一般不适用于厌氧菌培养及鉴定,痰标本不理想时可考虑采集支气管肺泡灌洗液标本。
痰培养标本采集和运送SOP
文件编号:
持有部门:医院感染管理科医务部护理部检验科各临床科室
修订时间:年月
执行日期:年月日
具体内容:
一、采集方法
1. 自然咳痰法:以早晨第一口痰为宜,并且是从气管深部咳出的痰,标本量≥1ml。
清晨进食前,在医护人员指导下,用冷开水反复漱口,深吸气后用力咳出气管深处的痰液于无菌痰盒内,盖好送检。
患者痰液不易咳出时,可在咳痰前叩背,协助排痰;无痰或痰量极少者,可给予雾化吸入,使痰液稀释易于排出。
2. 吸痰法:协助病人取平卧位、头偏向一侧,先用普通吸痰管,吸出气道外部的痰液,然后更换一次性婴儿吸痰器连接吸引器,左手折曲吸痰管,右手持无菌镊夹持吸痰管缓慢送入气道深部,打开负压,痰液会自动收集至吸痰器的无菌瓶内,关闭吸引器,折曲封闭一次性婴儿吸痰器的两个接口后送检。
3. 支气管镜采集法:用支气管镜在肺内病灶附近用导管吸引或用支气管刷直接取得标本,该方法有一定的痛苦,患者不易接受。
4.支气管肺泡灌洗法:由临床医生按相应操作规程进行,吸出支气管肺泡灌洗液送检,培养结果较为可靠。
5.胃内采痰法:适用于无自觉症状的肺结核患者和婴幼儿不会咳嗽时,通过胃管从胃内抽取。
6.填写申请单时,应注明标本来源、检验目的、采样时间和抗菌药物使用情况等相关信息。
二、标本运送
1.已采集的标本应视为潜在性生物危险品,均应置于防渗漏、相对密封的容器中收集、存储与转运。
2.标本采集后应立即送检,不能及时送检,室温保存≤2小时。
三、注意事项
1.严格无菌技术操作,避免标本污染,
2.采集标本尽量在抗菌药物使用之前。
痰培养标本采集与运送标准操作规程目的:正确采集痰培养标本并运送内容:一.标本来源:痰/气管抽吸物(TA)、支气管肺灌洗吸出液、支气管刷子、气管内管、肺穿刺或活组织等。
二.容器:洁净、广口、无菌、加盖、密封、防渗漏。
不含防腐剂和抑菌剂,一次性使用。
三.采集方法清晨痰量多,含菌量亦大,嘱病人先用洁口液,再用清水漱口,以除去口腔中细菌,深吸气后用力咳出1-2口痰于培养皿或瓶中,痰量极少可用45℃10%氯化钠溶液雾化吸入导痰。
建立人工气道,如气管切开或气管插管者,戴无菌手套或用无菌镊子取一次性无菌专用吸痰管,一头缓慢插入气管致隆突(叶支气管)水平,一头接电动吸引器,螺旋式抽吸,吸引痰液。
四.注意事项1.以清晨第二口痰为佳。
防止唾液及上呼吸道分泌物污染。
2.在抗生素使用前采集价值高。
3.连续采集3~4次,采集间隔时间>24h。
五.结果判断1.正常人体的下呼吸道是无菌的,上呼吸道有正常菌群栖居。
2.合格痰的涂片镜检鳞状上皮细胞〈10个/低倍视野,白细胞〉25个/低倍视野,或两者比例小于1:2.5。
3.连续两次分离出相同的病原菌可认为是感染病原菌。
4.经纤维支气管镜和人工气道吸引采集分泌物分离出的细菌可认为是感染病原菌。
5.痰液与血液或胸水中分离到相同病原体,有诊断意义。
6.痰培养常见病原菌为肺炎链球菌、乙型溶血性链球菌、金黄色葡萄球菌、厌氧性球菌、结核分枝杆菌等。
7.痰中的病原菌不少属于机会致病菌,应根据病情判断。
六.临床微生物标本送检的注意事项1.标本及时送检避免干燥,不能及时送检者可暂存4℃冰箱。
如在室温下放置数小时,则定植于口咽部的非致病菌过度生长,而肺炎球菌和流感嗜血杆菌检出率则明显下降。
故标本采集后送检时间不得超过2小时。
2.送检标本应注明来源、检验目的和采样时间,使实验室能正确选用相应的培养基和适宜的培养环境。
3.送检期间要予以安全防护:放标本的容器必须防漏,禁止将渗漏的标本送往实验室。
欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
门诊痰标本采集作业标准
◊病人留取标本前清水漱口一深呼吸数次一收腹用力咳出自支气深部的脓样或黏液样痰液一盛于无菌集痰器中一放在标本收取处
◊留取痰找结核杆菌标本时,避免混入漱口液、唾液、鼻涕等
◊做漂浮或浓集结核杆菌检验时,应采集12、24小时内的痰液
◊在治疗期留痰培养标本,应在停药48小时后留取
◊病理学检验以清晨第一口痰标本最适宜;细胞学检验以上午9-10时留痰最好标♦护士根据化验、检查单、姓名给病人标本留取器
本♦核对正确后收回标本
送♦将采集完的标本进行条码扫描
检♦按照送检时间及时送验。
一、【目的】1.评估患者痰液的量、颜色、气味及浓稠度。
2.了解疾病进展和治疗成效。
3.收集患者痰液做细菌培养、细胞学检查,协助诊断。
二、【操作前准备】1.评估:(1)患者病情、年龄、治疗、排痰情况和配合程度。
(2)评估患者口腔粘膜有无异常。
(3)观察痰液的颜色、性质、量、气味、粘稠度。
(4)解释留痰目的、方法、注意事项。
2.护士准备:洗手、戴帽子、口罩。
3.用物准备:化验单、痰标本容器(留取痰培养标本时需备无菌标本容器及漱口液)、吸痰用物一套(一次性痰液收集器、无菌手套、生理盐水、负压吸引器一套)。
三、【操作步骤】1.双人核对医嘱,打印条码。
2.按医嘱备痰标本容器,容器上贴好条形码。
3.洗手,戴口罩、手套。
4.携用物至患者床旁,再次核对患者姓名、住院号,向病人解释,取得配合。
5.指导或帮助患者按要求排痰:(1)常规痰液标本:晨起清水漱口后,深吸气用力咳出呼吸道深部第二口痰液,置于清洁容器内。
标本不小于1ml,痰液内禁止混入漱口水和食物残渣。
(2)痰培养标本:晨起清水漱口后,深吸气用力咳出呼吸道深部第二口痰液,置于无菌容器内。
(3)难于自然咳嗽、不合作或人工气道患者痰液采集法:取舒适卧位,先叩击患者背部,戴无菌手套连接集痰器与负压吸引装置,抽吸痰液2-5ml于集痰器内。
(4)24小时痰标本采集法:在广口瓶内加少量清水患者起床后进食前漱口后第一口痰开始留取,至次晨进食前漱口后最后一口痰结束,全部痰液留入集痰瓶内,记录痰标本总量、外观和性状。
(须在容器上注明起止时间)(5)咽试子采集法:患者用清水漱口,取出无菌试子蘸取少量无菌生理盐水,用压舌板轻压舌部,迅速擦拭患者口腔两侧鄂弓、咽、扁桃体的分泌物,避免咽试子触及其他部位;迅速把咽试子插入无菌管内塞紧。
6.脱手套,消毒双手,再次核对,整理床单位,协助患者取舒适体位。
7.观察痰液的色,质,量。
8.处理用物,洗手。
9.按要求将痰标本及时送检。
四、【注意事项】1.除24小时痰标本外,痰液收集时间宜选择在清晨。
痰液采集的操作流程及评分标准痰液采集是一项非常重要的临床操作,它能够为医生提供病人的痰液样本用于病原体检测和诊断。
本文将介绍痰液采集的操作流程及评分标准,以帮助医护人员正确进行痰液采集并保证采集到高质量的样本。
一、痰液采集的操作流程1.准备工作在进行痰液采集前,首先需要进行一些准备工作,包括:- 确保采集工具的干净和消毒。
采集痰液需要使用无菌的痰杯或痰液容器,务必确保其表面清洁并进行充分消毒。
- 确保患者的安全和舒适。
在进行痰液采集前,需要告知患者该操作的目的和过程,并征得其同意。
同时,确保患者处于舒适的姿势,以方便进行采集。
2.提醒患者进行嘴腔清洗痰液采集需要患者咳嗽产生痰液样本,因此在开始采集前应提醒患者进行嘴腔清洗,以保持口腔的清洁。
患者可以用清水漱口或漱口水来清洁口腔。
3.采集痰液样本(1)口腔采集法口腔采集法是一种常用的痰液采集方法,操作步骤如下:- 请患者舌头外伸,张嘴蓄气。
- 轻轻握住痰杯的手柄,将其推至舌根处。
- 继续蓄气,患者深深吸气,待患者感觉难以忍受时,让患者迅速用力咳嗽,将咳出的痰液直接吐进痰杯中。
- 确保痰液样本足够,将痰杯盖好,送至实验室进行检测。
(2)气管刷取法气管刷取法适用于患者无法产生有效痰液样本的情况,操作步骤如下:- 在鼻腔入口处用无菌的生理盐水湿润气管刷,然后将其插入鼻腔深处至气管。
- 轻轻旋转刷头,然后缓慢拉出。
- 将刷头放入无菌的痰杯或培养瓶中。
- 将痰杯或瓶盖好,送至实验室进行检测。
4.采集结束后的后续工作采集结束后,需要进行一些后续工作,包括:- 检查采集到的痰液样本是否足够,并确保采集到的样本不受外界污染。
- 需要记录病人的相关信息,如姓名、年龄、性别等,方便后续的分析和诊断。
- 废弃已使用的采集工具,对其他工具进行消毒或处理。
二、评分标准为了保证痰液采集的质量,需要根据采集操作的规范与标准进行评分。
以下是一些常见的评分标准:1.痰液样本质量评分- 样本容量评分:根据采集到的痰液样本容量进行评估,通常分为满量、稍少、明显少或者无痰四个等级。
痰培养标本采集方法及注意事项痰培养是一种常见的临床检查方法,用于检测呼吸道感染病原体。
正确的痰培养标本采集方法和注意事项对保证检测结果的准确性至关重要。
下面将介绍痰培养标本采集的方法和注意事项。
一、痰培养标本采集方法:1.采集时间:最佳采集时间是早上起床后,患者尚未进食或漱口。
2.患者准备:患者应先漱口,以清除口腔中的细菌。
然后深呼吸几次,以刺激喉部分泌物,并咳嗽2-3次。
3.采集器具:可用无菌的宽口塑料杯作为痰培养容器,避免使用铁罐、玻璃瓶等容器,以免残留的细菌影响培养结果。
4. 采集过程:患者在咳嗽时将痰直接咳出到容器中,或者在漱口后用唾液吐痰至容器中,以保持采集的痰液的干净和无菌。
采集量应达到2-5ml为宜,以保证培养的条件。
二、痰培养标本采集注意事项:1.避免污染:采集标本时要避免口腔的污染,患者可以先漱口,然后再咳嗽或吐痰类似的方法将痰液采集到容器中。
注意不要将痰液和唾液混在一起,以免影响病原体的检测结果。
2.采集时机:痰培养的最佳时机是早上起床后,此时呼吸道分泌物较多,容易采集到足够的标本。
如果患者口干舌燥,可以喝一些水以增加分泌物的量。
3. 采集量:痰液的采集量应达到2-5ml,以充分满足检测的需要。
如果痰液量不足,可以多次采集或者进行刺激咳嗽后再采集,但是注意避免过度刺激引起不适。
4.容器选择:选择无菌、宽口、密封性良好的容器作为痰液的采集容器。
避免使用金属容器,因为金属容器可能含有微量的抑菌剂,对病原体的生长产生干扰。
5.标本传送:采集完痰液后,应及时将标本送往实验室进行培养,以保证标本的新鲜度和培养结果的准确性。
标本可以存放在4°C的冰箱中,但是加热前要再次加热至室温。
6.严格遵守感染控制措施:在痰液采集过程中,医务人员要严格遵守感染控制措施,包括佩戴口罩、手套等防护用具,避免交叉感染的发生。
总结起来,痰培养标本的正确采集方法和注意事项包括避免污染、选择合适的采集时机、保证足够的采集量、选择无菌的容器、及时送往实验室进行培养,同时医务人员要严格遵守感染控制措施,以确保痰培养结果的准确性。