盐酸表柔比星杂质有哪些
- 格式:pdf
- 大小:122.39 KB
- 文档页数:2

盐酸多柔比星脂质体注射液质量标准盐酸多柔比星脂质体注射液,是一种用于治疗癌症的药物。
其主要成分是盐酸多柔比星,以及一种称为脂质体的药物传递系统。
在本文中,我们将详细介绍盐酸多柔比星脂质体注射液的质量标准。
1.外观:盐酸多柔比星脂质体注射液应该是无颗粒、无悬浮物和无杂质的透明液体。
其中,脂质体应该是均匀分散在溶液中,并且具有均一的颗粒大小和形状。
2. pH值:盐酸多柔比星脂质体注射液的pH值应该在4.0-7.0之间。
pH值的范围对于药物的稳定性和生物利用度非常重要,过高或过低的pH值可能会影响药物的疗效。
3.盐酸多柔比星含量:盐酸多柔比星脂质体注射液的盐酸多柔比星含量应符合国家药典或企业自行制定的规定。
这是确保该药物在治疗癌症方面提供有效结果的重要指标。
4.脂质体粒径:盐酸多柔比星脂质体注射液中的脂质体应具有一定的粒径范围。
这是由于脂质体的大小会影响其在体内的分布和吸收情况。
通常来说,脂质体粒径应在100-200纳米之间。
5.无菌性:盐酸多柔比星脂质体注射液必须符合无菌性的要求。
这意味着在制造和包装过程中,要严格控制微生物的污染。
如果存在细菌、霉菌或其他致病微生物的污染,可能对患者的健康产生严重影响。
6.稳定性:盐酸多柔比星脂质体注射液在储存和运输过程中应该具有良好的稳定性。
药物的稳定性包括其在不同温度、光照和湿度条件下的物化特性和有效性。
针对盐酸多柔比星脂质体注射液,一般要求其在室温下储存,并且在有效期内保持其活性。
7.溶解度:盐酸多柔比星脂质体注射液的溶解性是十分重要的。
治疗的有效性与药物的溶解度密切相关。
因此,盐酸多柔比星脂质体注射液的溶解性应符合一定的标准,以确保在用药过程中能够得到良好的溶解。
综上所述,盐酸多柔比星脂质体注射液的质量标准涉及到外观、pH值、盐酸多柔比星含量、脂质体粒径、无菌性、稳定性以及溶解度等方面。
只有在这些方面都能达到标准,药物才能发挥其治疗癌症的作用。
不过需要注意的是,具体的质量标准可能因国家药典、公司标准或医疗监管要求而有所不同。

高效液相法测定注射用盐酸表柔比星的含量作者:董海飞来源:《中国科技博览》2016年第07期[摘要]目的建立注射用盐酸表柔比星含量测定方法。
方法采用高效液相色谱法,色谱柱为waters柱(150mm*4.6mm,5um),以甲醇:水:乙腈(35:45:20)为流动相,流速为2.0ml/min,检测波长为254nm。
结果乳糖及羟苯甲酯不干扰本品含量测定,耐用性试验结果符合要求,系统适用性试验结果表明表柔比星与多柔比星分离度符合规定,溶液溶度在0.2mg/ml~1.0mg/ml的范围内线性好,准确度试验的平均回收率为99.8%,RSD为1.6%,重复性及中间精密度符合规定,溶液稳定性实验结果表明溶液在4小时内稳定。
结论所建立的含量测定方法操作简便、准确,重现性好,可用于本品含量测定。
[关键词]表柔比星方法学含量测定中图分类号:O856 文献标识码:A 文章编号:1009-914X(2016)07-0050-01盐酸表柔比星为阿霉素的主体异构体,是阿霉素氨基糖部分中 C4羟基的反式构型,它既可直接嵌入 DNA,与 DNA的双螺旋结构形成复合物,阻断依赖于 DNA的 RNA形成,又有形成超氧基自由基的动能本品为半合成的第二代蒽环类抗癌抗生素。
主要药理作用为直接嵌入DNA,与其双螺旋结构形成复合物,从而阻断RNA合成,它还可形成超氧基自由基团,因此本药既可作用于细胞核,又可影响瘤细胞的细胞膜和其运转系统,属细胞周期非特异性药物。
我们采用高效液相色谱法测定唑来膦酸制剂含量,建立本品含量测定方法[1-4]。
1.仪器与试药Agilent 1200 Series高效液相色谱仪(DAD检测器),色谱柱Waters C18?5μm?4.6×150mm表柔比星对照品(含量:99.8%),盐酸多柔比兴对照品,来源均为中检院,注射用盐酸表柔比星由哈药集团生物工程公司提供,其它试剂均为色谱纯,乳糖及羟苯甲酯为处方中辅料,均为药用级辅料。
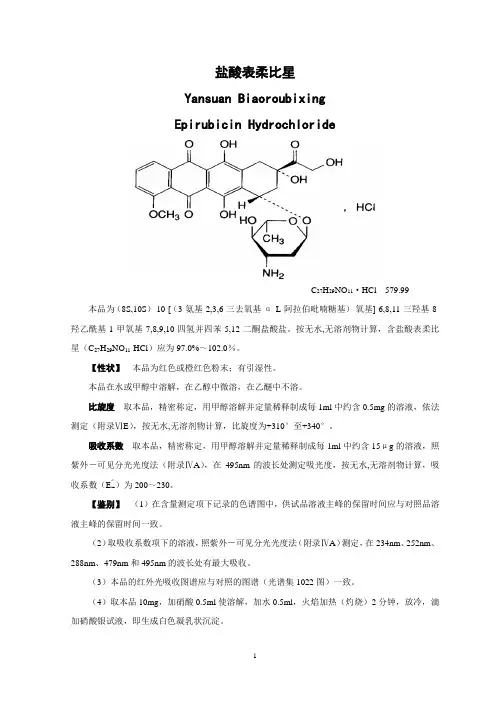
盐酸表柔比星Yansuan BiaoroubixingEpirubicin HydrochlorideC27H29NO11·HCl 579.99 本品为(8S,10S)-10-[(3-氨基-2,3,6-三去氧基-α-L-阿拉伯吡喃糖基)-氧基]-6,8,11-三羟基-8-羟乙酰基-1-甲氧基-7,8,9,10-四氢并四苯-5,12-二酮盐酸盐。
按无水,无溶剂物计算,含盐酸表柔比星(C27H29NO11·HCl)应为97.0%~102.0%。
【性状】本品为红色或橙红色粉末;有引湿性。
本品在水或甲醇中溶解,在乙醇中微溶,在乙醚中不溶。
比旋度取本品,精密称定,用甲醇溶解并定量稀释制成每1ml中约含0.5mg的溶液,依法测定(附录ⅥE),按无水,无溶剂物计算,比旋度为+310°至+340°。
吸收系数取本品,精密称定,用甲醇溶解并定量稀释制成每1ml中约含15μg的溶液,照紫外-可见分光光度法(附录ⅣA),在495nm的波长处测定吸光度,按无水,无溶剂物计算,吸收系数(E1%1cm)为200~230。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取吸收系数项下的溶液,照紫外-可见分光光度法(附录ⅣA)测定,在234nm、252nm、288nm、479nm和495nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1022图)一致。
(4)取本品10mg,加硝酸0.5ml使溶解,加水0.5ml,火焰加热(灼烧)2分钟,放冷,滴加硝酸银试液,即生成白色凝乳状沉淀。
【检查】酸度取本品,加水制成每1ml中含5mg的溶液,依法测定(附录VI H),pH 值应为4.0~5.5。
溶液的澄清度取本品5份,各10mg,分别加水5ml溶解后,溶液应澄清;如显浑浊,与1号浊度标准液(附录ⅨB)比较,均不得更浓。
![注射用盐酸表柔比星说明书20110718(法玛新)[1]](https://uimg.taocdn.com/455c4d0390c69ec3d5bb75ed.webp)

注射用盐酸表柔比星说明书注射用盐酸表柔比星说明书一、商品名称注射用盐酸表柔比星二、药品分类处方药三、药品成分每1毫升含盐酸表柔比星2毫克四、适应症此药适用于治疗以下感染疾病:1. 呼吸道感染,如急性喉炎、急性支气管炎等。
2. 皮肤和软组织感染,如表浅性脓肿、痈、蜂窝织炎等。
3. 泌尿道感染,如肾盂肾炎、尿道炎等。
4. 消化道感染,如胃肠炎、胆囊炎等。
5. 骨骼系统感染,如骨髓炎,化脓性关节炎等。
五、用法用量该药应由医生按病情和患者体重等因素决定用药剂量和疗程,不宜自行调整。
1. 成人和12岁以上儿童:每次0.25毫克/千克,一日2次给药。
2. 特殊人群:(1)肝功能不全患者:应减小剂量或增加给药间隔时间。
(2)肾功能不全患者:根据肾功能状况,调整用药剂量和给药间隔时间,严重肾功能不全应禁用。
(3)老年患者:应注意肾功能变化,酌情调整剂量和给药间隔时间。
(4)儿童患者:剂量应按体重计算,给予成人剂量的半数。
六、注意事项1. 禁忌症:对本药过敏、严重肝功能不全和婴儿期患嗜血细胞减少症等禁用。
2. 孕妇和哺乳期妇女应慎用。
3. 本药物可能出现过敏、肝损伤、肾损伤、血液系统不良等不良反应,如出现不适应立即停药并就医。
4. 在药物使用期间应避免饮酒、吸烟等影响药效的行为。
5. 长期应用本药可能导致细菌耐药性增加,应尽可能遵医嘱使用。
七、药物相互作用1. 与苯扎氯铵合用可增加中枢神经系统毒性。
2. 与卡马西平合用可增强前者的抗高血压作用。
3. 与华法林、保泰松等药物合用可增加出血风险。
八、贮藏方法本药品需存放于干燥,阴凉和避光的环境内,离达到最佳效果的安瓿打开时间不超过24小时。
避免冷藏,不得使用色素变化、浑浊、有颗粒物的溶液。
九、过期时间该药品保质期为2年。
十、包装规格每瓶装2毫升,每盒12瓶。
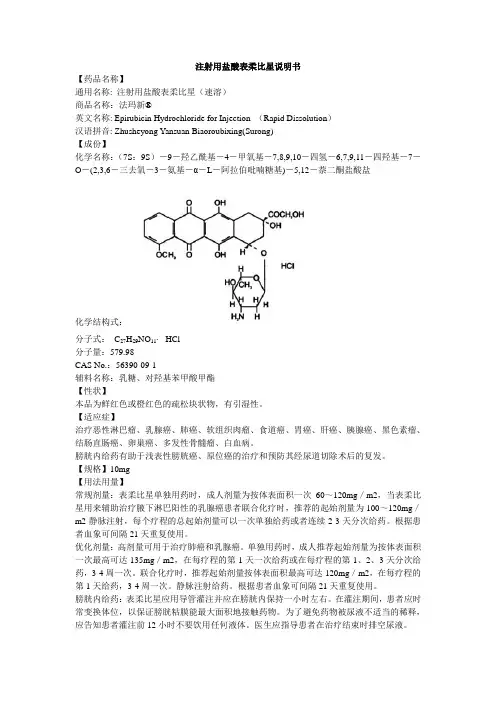
注射用盐酸表柔比星说明书【药品名称】通用名称: 注射用盐酸表柔比星(速溶)商品名称:法玛新®英文名称: Epirubicin Hydrochloride for Injection (Rapid Dissolution)汉语拼音: Zhusheyong Yansuan Biaoroubixing(Surong)【成份】化学名称:(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐化学结构式:分子式:C27H29NO11⋅ HCl分子量:579.98CAS No.:56390-09-1辅料名称:乳糖、对羟基苯甲酸甲酯【性状】本品为鲜红色或橙红色的疏松块状物,有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】10mg【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg/m2,当表柔比星用来辅助治疗腋下淋巴阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg/m2,在每疗程的第1天给药,3-4周一次。
静脉注射给药。
根据患者血象可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。


注射用盐酸表柔比星注射用盐酸表柔比星,适应症为治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
药品名称注射用盐酸表柔比星药品类型处方药、医保工伤用药用途分类细胞毒性药物1成份化学名称:(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐化学结构式:分子式:C27H29NO11·HCl分子量:579.98辅料名称:乳糖、对羟基苯甲酸甲酯2性状本品为鲜红色或橙红色的疏松块状物,有引湿性。
3适应症治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
4规格(1)10mg;(2)50mg;(按C27H29NO11·HCl 计)5用法用量[u]常规剂量[/u]:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg/m[sup]2[/sup],当表柔比星用来辅助治疗腋下淋巴阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m[sup]2[/sup]静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
[u]优化剂量[/u]:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m[sup]2[/sup],在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg/m[sup]2[/sup],在每疗程的第1天给药,3-4周一次。

注射用盐酸表柔比星说明书【药品名称】通用名称:注射用盐酸表柔比星 商品名称:艾达生英文名称:Epirubicin Hydrochloride for Injection 汉语拼音:Zhusheyong Yansuan Biaoroubixing 【成 份】化学名称:本品的主要成份为盐酸表柔比星,化学名为(7S ∶9S )-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O -(2,3,6-三去氧-3-氨基--L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐。
化学结构式:分子式:C 27H 29NO 11·HCl 分子量:579.98 CAS No.:56390-09-1 辅 料:乳糖 【性状】本品为鲜红色或橙红色的疏松块状物;有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】10mg 【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg /m 2,当表柔比星用来辅助治疗腋下淋巴结阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m 2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量*:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m 2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg /m 2,在每疗程的第1天给药,3-4周一次。
静脉注射给药。
根据患者血象可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。

注射用盐酸表柔比星说明书请仔细阅读说明书并在医师指导下使用警告:组织坏死,继发的急性白血病和骨髓抑制1.如果在给药时出现外渗可引起严重的局部组织坏死。
不可经由肌肉或皮下途径给药。
2.在表柔比星治疗期间或治疗结束后数月乃至数年可能发生心脏毒性,包括致死性充血性心衰(CHF),在550mg/m2累积剂量下出现临床显著的CHF的概率约0.9%,700 mg/m2累积剂量下为1.6%,900mg/m2累积剂量下为3.3%。
在乳腺癌辅助治疗临床试验中,最大累积剂量为720 mg/m2。
当累积剂量超过900 mg/m2时出现CHF的风险迅速增加,因此如超过该剂量使用必须极其谨慎。
存在活动性或非活动性心脏疾病,既往或当前合并有纵隔/心包区域的放疗,既往接受过蒽环类或蒽醌类药物治疗,或合并使用其他心脏毒性药物的患者出现心脏毒性的风险增加。
表柔比星的心脏毒性也可能发生在较低的累计剂量下,或无心脏风险高危因子的情况下。
3.在接受包括表柔比星在内的蒽环类药物治疗的乳腺癌患者中报道了继发的急性髓细胞白血病(AML)。
当此类药物与破环DNA的抗肿瘤药物合用时,尤其在患者曾经接受过高强度的细胞毒药物治疗,或更高剂量的蒽环类药物治疗时,发生难治性继发性白血病的可能更为多见。
在7110例接受含表柔比星的方案辅助治疗的乳腺癌患者出现治疗相关的AML或骨髓异常增生综合征(MDS)的概率为:3年0.27%,5年0.46%,8年0.55%。
4.可能发生了严重的骨髓抑制。
【药品名称】通用名称:注射用盐酸表柔比星商品名:力创英文名称:Epirubicin Hydrochloride for Injection汉语拼音:Zhusheyong Yansuan Biaoroubixing【成份】本品主要成份为盐酸表柔比星。
化学名称:(8S,10S)-10-[(3-氨基-2,3,6-三脱氧-α-L-阿拉伯吡喃糖基)氧]-6,8,11-三羟基-8-(羟基乙酰基)-1-甲氧基-7,8,9,10-四氢并四苯-5,12-二酮盐酸盐辅料:乳糖、羟苯甲酯。

柔红霉素盐酸多柔比星和盐酸表柔比星的HPLC分析摘要本文通过高效液相色谱(HPLC)的方法对柔红霉素、盐酸多柔比星和盐酸表柔比星进行分析。
实验使用的是InertSustain C18柱,采用乙腈和50mM磷酸缓冲液的梯度洗脱,检测波长为210nm。
实验结果表明,在最佳条件下,柔红霉素、盐酸多柔比星和盐酸表柔比星的峰面积与浓度呈良好的线性关系,其线性范围分别为5-100μg/mL、2-100μg/mL和2.5-100μg/mL,相关系数均大于0.999。
背景柔红霉素、盐酸多柔比星和盐酸表柔比星都属于广谱抗生素,具有广泛的临床应用价值。
为了保证其质量和安全性,需要对其进行质量控制。
HPLC是一种高效、准确、可靠的分析方法,已被广泛应用于药物质量控制的实验室研究中。
本文通过HPLC的方法对柔红霉素、盐酸多柔比星和盐酸表柔比星进行分析,以期为药品生产和质量检验提供技术支持。
实验方法实验药品柔红霉素、盐酸多柔比星和盐酸表柔比星均为化学纯品,购自Sigma-Aldrich。
仪器设备HPLC仪器型号为Waters e2695,检测器型号为Waters 2998 PDA;色谱柱为InertSustain C18(4.6mm×250mm,5μm)。
实验条件流速:1.0mL/min;检测波长:210nm;进样量:10μL;流动相A:乙腈;流动相B:50mM磷酸缓冲液;洗脱方案:0-5min,95% A;5-12min,95%-60% A;12-17min,60% A;17-19min,60%-95% A;20-25min,95% A。
样品制备将柔红霉素、盐酸多柔比星和盐酸表柔比星分别加入50mL容量瓶中,加入5mL甲醇溶解,使用紫外分光光度计分别测定其波长最大处的吸收峰值(λmax)以确定检测波长。
将各样品中的药物加标准液分别制成浓度为1mg/mL的药物标准溶液。
然后将标准溶液进行适当稀释,得到3个不同浓度的药物标准曲线溶液。
盐酸表柔比星的合成
盐酸表柔比星是一种常见的药物,常用于治疗心血管疾病。
它具有抑制血小板聚集和抗凝血作用,可以有效预防血栓形成,改善心血管循环。
下面将介绍盐酸表柔比星的合成过程。
盐酸表柔比星的合成需要使用一些常见的化学试剂和设备。
原料中包括柔比星、盐酸和溶剂等。
合成过程的第一步是将柔比星与盐酸反应,得到盐酸表柔比星。
具体操作是将柔比星溶于适量的溶剂中,然后慢慢加入盐酸,并加热反应。
在反应过程中,需要控制温度和反应时间,以确保反应的完全进行。
接下来,反应混合物需要经过过滤和洗涤步骤,以去除杂质和未反应的物质。
通过过滤,可以得到纯净的盐酸表柔比星晶体。
将得到的盐酸表柔比星晶体进行干燥处理,以去除残余的溶剂,并得到最终的盐酸表柔比星药物。
干燥的过程需要进行温度控制,以避免晶体的破坏。
经过以上步骤,我们成功合成了盐酸表柔比星。
这种药物在临床中被广泛使用,对于心血管疾病的治疗具有重要的作用。
它可以有效地预防血栓形成,降低心脑血管事件的发生率,提高患者的生活质量。
盐酸表柔比星的合成是一个复杂的过程,需要严格控制反应条件和操作技术。
通过合理的操作和处理,我们可以得到高纯度的盐酸表柔比星药物,为临床治疗提供有效的药物选择。
高效液相法测定注射用盐酸表柔比星的含量盐酸表柔比星为阿霉素的主体异构体,是阿霉素氨基糖部分中 C4羟基的反式构型,它既可直接嵌入 DNA,与 DNA的双螺旋结构形成复合物,阻断依赖于 DNA的 RNA形成,又有形成超氧基自由基的动能本品为半合成的第二代蒽环类抗癌抗生素。
主要药理作用为直接嵌入DNA,与其双螺旋结构形成复合物,从而阻断RNA合成,它还可形成超氧基自由基团,因此本药既可作用于细胞核,又可影响瘤细胞的细胞膜和其运转系统,属细胞周期非特异性药物。
我们采用高效液相色谱法测定唑来膦酸制剂含量,建立本品含量测定方法[1-4]。
1.仪器与试药Agilent 1200 Series高效液相色谱仪(DAD检测器),色谱柱Waters C18? 5μm?4.6×150mm表柔比星对照品(含量:99.8%),盐酸多柔比兴对照品,来源均为中检院,注射用盐酸表柔比星由哈药集团生物工程公司提供,其它试剂均为色谱纯,乳糖及羟苯甲酯为处方中辅料,均为药用级辅料。
2.方法与结果色谱条件与系统适用性试验??用十八烷基硅烷键合硅胶为填充剂,以甲醇:水:乙腈(35:45:20)为流动相,流速为2.0ml/min,检测波长为254nm。
理论塔板数以表柔比星计不低于8000。
测定法??取本品,精密称定,用流动相溶解并制成每1ml 含0.5mg的溶液,精密量取20μl注入液相色谱仪,记录色谱图,另精密称取对照品,同法测定。
按外标法以峰面积计算,即得。
2.1 系统适用性取盐酸表柔比星及盐酸多柔比星对照品,加流动相溶解制成0.5mg/ml的溶液,按照测定法进样,考察分离度,结果盐酸表柔比星与多柔比星分离度为4.5,符合规定,峰纯度监测结果表明峰纯度符合规定,说明表柔比星与其它杂质峰亦可有效分离。
2.2 专属性试验取表柔比星、空白辅料(乳糖、羟苯甲酯),分别加流动相溶解,按照拟定方法进样测定,结果盐酸表柔比星与其它物质可有效分离,盐酸表柔比星峰纯度符合规定,表明辅料不干扰含量测定。
盐酸表柔比星混合杂质对照品的研究与制备闻宏亮;蒋孟虹;杨美成;秦峰;刘浩;胡昌勤【摘要】目的研究盐酸表柔比星的杂质谱并制备混合杂质对照品.方法通过对盐酸表柔比星杂质谱的研究,选择合适的目标杂质;采用控速降解条件结合添加工艺杂质,优化制备工艺,研制了混合杂质对照品;以质谱法和单体对照品对照法,鉴定了混合杂质对照品中各主要杂质.结果制备了含有6种主要杂质的盐酸表柔比星混合杂质对照品,可用于有机杂质峰的确认.结论在杂质谱研究基础上,研制混合杂质对照品,不仅可有效评价色谱体系对各杂质的分离效能,还可快速准确归属多个杂质色谱峰,为分析杂质来源、评价样品质量提供依据.【期刊名称】《中国抗生素杂志》【年(卷),期】2017(042)001【总页数】6页(P46-51)【关键词】盐酸表柔比星;杂质谱;混合杂质对照品;制备;质谱法【作者】闻宏亮;蒋孟虹;杨美成;秦峰;刘浩;胡昌勤【作者单位】上海市食品药品检验所,上海201203;上海市食品药品检验所,上海201203;上海市食品药品检验所,上海201203;上海市食品药品检验所,上海201203;上海市食品药品检验所,上海201203;中国食品药品检定研究院,北京100050【正文语种】中文【中图分类】R978.1药物中的杂质与药物的安全性、有效性密切相关,随着公众对药品安全的日益关注,对杂质的控制已成为药品质量控制的重要项目。
人用药品注册技术要求国际协调会(ICH)已经制定了与杂质控制相关的切实可行的指导原则[1],多个国家药典也在附录中设有专门的杂质检查通则[2-5]。
胡昌勤等[6]阐述了化学药品中杂质控制的现状与策略,指出杂质控制理念已由纯度控制、限度控制转变为杂质谱控制,即对药品中的每个杂质依据其特性分别控制。
但药品中的杂质来源复杂、种类繁多,制备单个杂质对照品耗时耗力,且有时无法获得,因此急需建立快速归属多个杂质峰的方法,以加强药品杂质控制。
盐酸表柔比星属于广谱抗肿瘤抗生素,收载于多个国家药典[2-5],由于其杂质分离纯化工艺复杂、制备成本高,无法长期获得大量杂质对照品,目前均采用相对保留时间法归属各特定杂质峰。