甲型肝炎灭活疫苗(人二倍体细胞)
- 格式:doc
- 大小:100.50 KB
- 文档页数:9

甲型肝炎灭活疫苗(人二倍体细胞)Jiaxing Ganyan Miehuoyimiao (Ren Erbeiti Xibao)Hepatitis A Vaccine(Human Diploid Cell), Inactivated•••本品系用甲型肝炎病毒(简称甲肝)接种人二倍体细胞,经培养、收获,病毒纯化、灭活和氢氧化铝吸附后制成。
用于预防甲型肝炎。
1.基本要求生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”有关要求。
2.制造2.1生产用细胞生产用细胞为人二倍体细胞(2BS株、KMB17株或其他经批准的细胞株)。
2.1.1 细胞库管理及检定应符合“生物制品生产和检定用动物细胞基质制备及检定规程”的有关规定。
取自同批工作细胞库的1支或多支细胞管,经复苏扩增后的细胞仅用于一批疫苗的生产。
2BS细胞株原始细胞库应不超过第14代,主细胞库应不超过第31代,工作细胞库次应不超过第44代。
KMB17株原始细胞库应不超过第6代,主细胞库应不超过第15代,工作细胞库应不超过第45代。
2.1.2 细胞制备取工作细胞库中的1支或多支细胞管,经复苏、扩增制备的一定数量并用于接种病毒的细胞为一个消化批。
2. 2毒种2.2.1名称及来源••••生产用毒种为甲型肝炎病毒TZ84株、吕8株或其他批准的人二倍体细胞适应的甲型肝炎病毒株。
2.2.2种子批的建立应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
甲型肝炎病毒TZ84株原始种子批不超过第20代,主种子批为第22代,工作种子批为第23代,生产的疫苗代次应不超过第24代。
吕8株原始种子批应不超过第24代,主种子批不超过第25代,工作种子批不超过第30代,生产的疫苗病毒代次应不超过第31代。
2.2.3种子批的检定主种子批应进行以下全面检定,工作种子批进行2.2.3.1鉴别试验用甲肝病毒特异高效价免疫血清(非人源)和甲肝抗体阴性血清分别与500~1000CCID50/ml甲肝病毒等量混合,置37℃水浴60分钟,接种人二倍体细胞2BS株或KMB17株,置35℃培养至病毒增殖高峰期,提取培养物后用酶联免疫法测定,经中和的培养物检测结果应为阴性,未经中和的病毒液检测结果应为阳性。


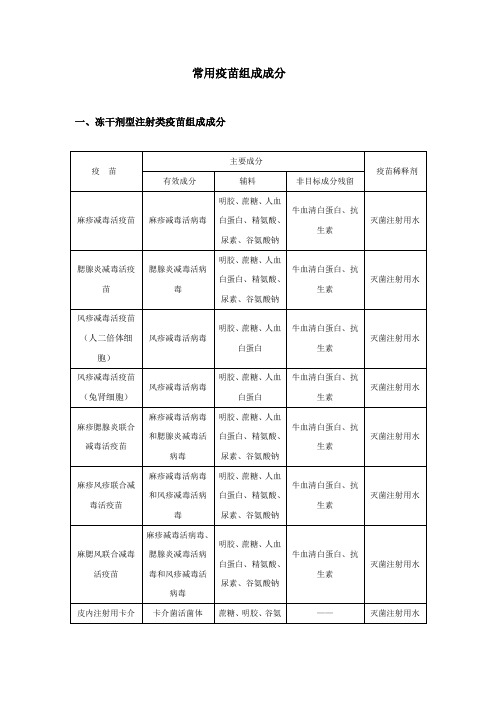
十大儿童必打疫苗儿童免疫的10种疫苗1、麻疹疫苗:麻疹疫苗是一种减毒活疫苗,接种反应较轻微,免疫持久性良好,婴儿出生后按期接种,可以预防麻疹。
【接种部位】上臂外侧三角肌附着处,皮下注射。
【剂量】0。
2ml【反应】注射后局部一般无反应。
在6-10天时少数人可能发热,一般不超过2天,偶有散在皮疹。
【禁忌】患严重疾病、发热或有过敏史(特别是有鸡蛋过敏史者)不得接种。
【注意事项】用75%酒精消毒皮肤,要待干后再注射;注射过丙种球蛋白者接种本疫苗至少间隔6周以上,接种麻疹疫苗至少2周后方可注射丙种球蛋白。
2、脊髓灰质炎疫苗(简称脊灰糖丸):脊灰糖丸是一种口服疫苗制剂,白色颗粒状糖丸,接种安全。
婴儿出生后按计划服用糖丸,可有效地预防脊髓灰质炎(小儿麻痹症)。
【接种部位】口服。
【剂量】糖丸剂型1粒,液体剂型2滴【反应】只有极少数婴幼儿服用脊灰疫苗后发生一过性腹泻,可不治自愈。
【禁忌】有免疫缺陷症禁服;在接受免疫抑制剂治疗期间禁服。
对牛乳及牛乳制品过敏者禁服糖丸型疫苗,可服液体疫苗。
【注意事项】本疫苗只供口服;本品系活疫苗,切勿加在热开水或热的食物内服用;偶尔超剂量多剂次服苗对人体无害。
3、百白破制剂:是将百日咳菌苗,精制白喉类毒素及精制破伤风类毒素混合制成,可同时预防百日咳、白喉和破伤风。
【接种部位】臀部外上1/4或上臂三角肌,肌内注射。
【剂量】0。
5ml【反应】①局部可出现红肿、疼痛、发痒或有低热、疲倦头痛等。
一般不需特殊处理即自行消退。
偶见过敏性皮疹、血管性水肿。
②无菌性化脓。
多系注射过浅或疫苗未摇匀,硬结不能吸收而形成注射部位化脓。
③若全身反应较重,应及时到医院进行诊治。
【禁忌】有癫痫、神经系统疾患及抽风史者禁用;急性传染病(包括恢复期)及发热者暂缓注射;儿童免疫制剂,成人禁用。
【注意事项】使用时必须充分摇匀;制品不能冻结,冻结后出现凝块,不能使用;采用肌内注射,局部可能有硬结,可逐步吸收,注射第2针时应更换另侧部位;应备有1:1000肾上腺素,供偶有发生休克时急救用;注射第1针后出现高热、惊厥等异常情况者,不再注射第2针。

爱巴苏(甲型肝炎灭活疫苗)【用法用量】1.剂量学:(1)19岁以及19岁以上成人单剂量成人甲型肝炎灭活疫苗1440(1.0毫升悬液)用于基础免疫。
(2)1-18岁(岁括18岁)的儿童和青少年单剂量儿童甲型肝炎灭活疫苗720(0.5毫升悬液)用于基础免疫。
建议在初次接种后6-12个月之间的任何时间进行甲型肝炎灭活疫苗成人1440或甲型肝炎灭活疫苗儿童720的加强免疫,以确保长期保护。
2.接种方法:(1)甲型肝炎灭活疫苗用于肌内注射,成人和儿童注射于在三角肌区,幼龄儿童注射于大腿的前侧部。
(2)疫苗不应注射于臂部区域。
(3)由于皮下/皮内注射得不到最佳的抗HAV抗体应答,应避免使用这些注射途径。
(4)甲型肝炎灭活疫苗在任何情况下不能静脉注射。
(5)血小板减少症或出血性疾病患者注射甲型肝炎灭活疫苗时应慎重,因为肌肉注射可使这些急者发生出血。
注射部位应压实至少两分钟(不得揉擦)。
【注意事项】1.如同应用其他疫苗一样,急性严重发热性疾病患者应推迟接种甲型肝炎灭活疫苗,但是,轻度炎症不是免疫的禁忌。
2.有可能在接种疫苗时,被接种者或许已经处在甲型肝炎潜伏期中,在这种情况下,甲型肝炎灭活疫苗能否预防甲型肝炎尚不清楚。
3.血液透析患者或免疫系统受到损害者,经单剂量免疫后可能不会产生足够的抗HAV抗体滴度。
因此,这些患者需要再注射预外剂量的疫苗。
4.如同其他注射用疫苗一样,应随时准备提供适当的医疗处理和监控手段,以便在少数人使用疫苗发生过敏反应时采取措施。
5.甲型肝炎灭活疫苗可以用于HIV感染者。
6.用前应肉眼观察疫苗是否有异物和/或物理性状改变,使用甲型肝炎灭活疫苗之前应充分振摇小瓶或注射器使疫苗置轻微不透明白色悬液。
如有异物、应丢弃疫苗。
7.接种疫苗不太可能对驾驶和操作机器产生影响。
【不良反应】1.在有对照的临床试验中,从接种甲型肝炎灭活疫苗后开始对所有对象进行了四天的症状观察,采用临床反应观察表,还要求被接种者报告观察期间发生的任何临床反应。

核准日期:2007年04月13日修改日期:2008年08月14日修改日期:2009年08月19日修改日期:2010年10月01日修改日期:2011年11月06日修改日期:2013年01月21日甲型乙型肝炎联合疫苗说明书【药品名称】通用名称:甲型乙型肝炎联合疫苗商品名称:倍尔来福○R英文名称:Hepatitis A and B Combined Vaccine汉语拼音:Jiaxing Yixing Ganyan Lianhe Yimiao【成份和性状】本品系用甲型肝炎病毒(简称甲肝)T284株接种人胚肺二倍体细胞2BS株,经培养、病毒收获、纯化、灭活、铝剂吸附后,与经铝剂吸附后的重组酵母菌表达的乙型肝炎(简称乙肝)病毒表面抗原(HBsAg)混合后制成,为乳白色混悬液体,不舍防腐剂。
主要成分为:灭活甲型肝炎病毒和重组酵母菌表达的HBsAg。
辅料为:氢氧化铝、磷酸氢二钠、磷酸二氢钠、氯化钠。
【接种对象】儿童剂型甲型乙型肝炎联合疫苗适用于1-15岁(包括15岁)无免疫力和有感染甲型肝炎和乙型肝炎危险的婴幼儿和少年。
成人剂型甲型乙型肝炎联合疫苗适用于无免疫力和有感染甲型肝炎和乙型肝炎危险的成人和16岁以上(包括16岁)青少年。
【作用与用途】接种本疫苗后,可刺激机体产生抗甲型肝炎病毒和抗乙型肝炎病毒的保护性抗体,用于预防甲型肝炎病毒和乙型肝炎病毒的感染。
【规格】每支(瓶)0.5ml或1 .0ml。
每1次成人用剂量1.0ml,含灭活甲肝病毒抗原500u、HBsAg l0µg;或每1次儿童用剂量为0.5ml,含灭活甲肝病毒抗原250u、HBsAg 5µg。
【免疫程序和剂量】免疫程序:上臂三角肌肌内注射。
基础免疫:基础免疫标准接种程序为3剂。
首剂于选定日期接种1剂疫苗,1个月及6个月后接种第2、3剂疫苗加强免疫:在国外已有接种甲型乙型肝炎联合疫苗后60个月的抗体长期持续性数据;基础免疫后所观察到的抗-HBs和抗-HA V抗体滴度与接种单价甲肝、乙肝疫苗后所观察到的滴度范围相似。
甲型肝炎灭活疫苗(人二倍体细胞)Jiaxing Ganyan Miehuoyimiao (Ren Erbeiti Xibao)Hepatitis A V accine(Human Diploid Cell), Inactivated•••本品系用甲型肝炎病毒(简称甲肝)接种人二倍体细胞,经培养、收获,病毒纯化、灭活和氢氧化铝吸附后制成。
用于预防甲型肝炎。
1.基本要求生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”有关要求。
2.制造2.1生产用细胞生产用细胞为人二倍体细胞(2BS株、KMB17株或其他经批准的细胞株)。
2.1.1 细胞库管理及检定应符合“生物制品生产和检定用动物细胞基质制备及检定规程”的有关规定。
取自同批工作细胞库的1支或多支细胞管,经复苏扩增后的细胞仅用于一批疫苗的生产。
2BS细胞株原始细胞库应不超过第14代,主细胞库应不超过第31代,工作细胞库次应不超过第44代。
KMB17株原始细胞库应不超过第6代,主细胞库应不超过第15代,工作细胞库应不超过第45代。
2.1.2 细胞制备取工作细胞库中的1支或多支细胞管,经复苏、扩增制备的一定数量并用于接种病毒的细胞为一个消化批。
2. 2毒种2.2.1名称及来源••••生产用毒种为甲型肝炎病毒TZ84株、吕8株或其他批准的人二倍体细胞适应的甲型肝炎病毒株。
2.2.2种子批的建立应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
甲型肝炎病毒TZ84株原始种子批不超过第20代,主种子批为第22代,工作种子批为第23代,生产的疫苗代次应不超过第24代。
吕8株原始种子批应不超过第24代,主种子批不超过第25代,工作种子批不超过第30代,生产的疫苗病毒代次应不超过第31代。
2.2.3种子批的检定主种子批应进行以下全面检定,工作种子批进行2.2.3.1~2.2.3.4项检定。
2.2.3.1鉴别试验用甲肝病毒特异高效价免疫血清(非人源)和甲肝抗体阴性血清分别与500~1000CCID50/ml甲肝病毒等量混合,置37℃水浴60分钟,接种人二倍体细胞2BS株或KMB17株,置35℃培养至病毒增殖高峰期,提取培养物后用酶联免疫法测定,经中和的培养物检测结果应为阴性,未经中和的病毒液检测结果应为阳性。
2.2.3.2病毒滴定取毒种做10倍系列稀释,取至少3个稀释度,分别接种人二倍体细胞,置35℃培养至病毒增殖高峰期,收获后提取甲型肝炎病毒,用酶联免疫法进行病毒滴定,病毒滴度应不低于6.50lgCCID50/ml。
2.2.3.3无菌检查•••依法检查(附录XⅡ A),应符合规定。
2.2.3.4支原体检查依法检查(附录XⅡ B),应符合规定。
2.2.3.5病毒外源因子检查依法检查(附录XⅡ C),应符合规定。
供试品可不经甲型肝炎病毒免疫特异性血清中和,直接接种小鼠观察。
2.2.3.6 免疫原性检查用主种子批毒种制备原疫苗,将疫苗4倍系列稀释至少三个稀释度,每个稀释度接种18-22g ICR 小鼠10只,每只腹腔接种1.0ml。
接种4-5周后采血,用ELISA 方法检测甲肝抗体,计算ED50,应符合规定。
2.2.4 毒种保存毒种应于-60℃以下保存。
2.3 原液2.3.1细胞制备同2.1.2项。
2.3.2培养液培养液为含适宜浓度新生牛血清的MEM或Eagle’s液。
新生牛血清的质量应符合要求(附录XIII D),且甲肝抗体检测应为阴性。
2.3.3对照细胞外源因子检查依法检查(附录XⅡ C),应符合规定。
2.3.4病毒接种和培养取工作种子批毒种按适宜的MOI接种于人二倍体细胞(同一工作种子批应按同一MOI接种)。
于适宜温度下培养,培养期间根据细胞生长情况换维持液,维持液为含适宜浓度新生牛血清的MEM或Eagle’s液。
2.3.5病毒收获培养至病毒增殖高峰期后,采用适宜浓度的胰蛋白酶或其他适宜方法消化含甲肝病毒的细胞,经离心或过滤的方法收集后为病毒收获物。
2.3.6病毒收获物检定按3.1项进行2.3.7病毒提取检定合格的病毒收获物经冻融和(或)超声波或其他适宜方法处理收获病毒后,用三氯甲烷抽提以提取甲肝病毒。
2.3.8 合并同一细胞批生产的病毒收获物经提取病毒后可进行合并。
2.3.9 病毒纯化采用柱色谱法或其他适宜的方法进行纯化。
纯化前或纯化后超滤浓缩至确定蛋白质含量范围内,纯化后取样进行抗原含量测定。
2.3.9病毒灭活将纯化后甲肝病毒液除菌过滤后,加入终浓度为250ug/ml的甲醛,于36.5℃±0.5℃灭活12天,病毒灭活到期后,每个灭活容器应立即取样,分别进行病毒灭活验证试验。
灭活后的病毒液即为原液2.3.10 原液保存于2-8℃保存。
2.3.11原液检定按3.2项进行。
2.4半成品2.4.1配制病毒原液经铝吸附后,按规定的抗原量进行稀释,可加入适宜浓度的2-苯氧乙醇作为防腐剂,即为半成品。
2.4.2半成品检定按3.3项进行。
2.5成品2.5.1分批应符合“生物制品分批规程”规定。
2.5.2分装应符合“生物制品分装和冻干规程”规定。
2.5.3 规格每支0.5ml或1.0ml,每1次成人用剂量为0.5ml或1.0ml,含甲肝病毒抗原含量按批准的执行。
2.5.4包装应符合“生物制品包装规程”规定。
3.检定3.1病毒收获物检定3.1.1 无菌检查依法检查(附录XⅡ A),应符合规定。
3.1.2支原体检查依法检查(附录XⅡ B),应符合规定。
3.1.3抗原含量采用ELISA法测定,标准应按批准的执行。
3.1.4 蛋白质含量采用附录VI B第二法测定,标准应按批准的执行3.2 原液检定3.2.1无菌检查依法检查(附录XⅡ A),应符合规定。
3.2.2抗原含量采用ELISA法测定,标准应按批准的执行。
3.2.3蛋白质含量采用附录VI B第二法测定,标准应按批准的执行。
3.2.4 病毒灭活验证试验取病毒灭活后供试品,将病毒灭活液接种人二倍体细胞,置33-35℃培养适宜时间(TZ84株不少于21天,吕8株不少于12天)收获,同法盲传2代,用ELISA方法检测甲肝病毒,应为阴性。
同时设病毒阳性对照,病毒滴度应不低于6.50 lgCCID50/ml。
3.2.5牛血清白蛋白残留量用ELISA方法进行测定,应不高于100ng/ml。
3.2.6去氧胆酸钠残留量采用去氧胆酸钠作为细胞裂解剂的,应按本标准附录1 进行该项检定测,残留量应不高于20μg/ml。
3.2.7聚山梨酯80残留量生产过程中使用聚山梨酯80的,残留量应不高于20μg/ml(附录VI H)。
3.3半成品检定3.3.1无菌检查••••依法检查(附录XⅡ A),应为符合规定。
3.3.2 pH值测定应为5.5~7.0(附录V A)。
3.2.3氢氧化铝吸附效果测定••••取吸附后上清液,用ELISA方法检测甲肝抗原含量,上清液中甲肝抗原应小于吸附总量的5%。
3.3.4 铝含量测定••••应不高于1.20mg/ml(附录VII F)。
3.3.5聚乙二醇6000残留量应小于10μg/ml(附录VI G)。
3.4成品检定3.4.1鉴别试验采用酶联免疫方法检查,应证明含有甲型肝炎病毒抗原。
3.4.2 外观••••应为微乳白色混悬液体,可因沉淀而分层,易摇散,不应有摇不散的块状物,无异物。
3.4.3装量••••按附录I A 装量项下进行,应不低于标示量。
3.4.4 pH值应为5.5~7.0(附录V A)。
3.4.5铝含量••••应不高于1.20mg/ml(附录VII F)。
3.4.6游离甲醛含量••••应不高于50μg/ml(附录VI L)。
3.4.7 三氯甲烷残留量•应不高于0.006%(附录VI V)3.4.8 2-苯氧乙醇含量采用2-苯氧乙醇作为防腐剂的进行该项检测,按本标准附录 2 进行检测,应为4.0-6.0mg/ml。
3.4.9无菌检查••••依法检查(附录XⅡ A),应符合规定。
3.4.10细菌内毒素检查应不高于10EU/ml(附录XII E凝胶限量试验)。
3.4.11异常毒性检查依法检查(附录XⅡ F),应符合规定。
3.4.12 体外相对效力测定应不低于0.75附录(附录X S)3.4.13 抗生素残留量生产过程中加入抗生素的应进行该项检查。
采用酶联免疫法,应不高于10ng/ml 4.保存、运输及有效期•2~8℃避光保存。
自生产之日起,按批准有效期执行。
5. 说明书6. 附录附录1 去氧胆酸钠残留量测定法附录2 2-苯氧乙醇含量测定附录1去氧胆酸钠残留量测定法本法系将供试品与去氧胆酸钠标准溶液置酸性条件下,于387nm波长处测定A值,采用对照品法计算供试品中去氧胆酸钠的残留量。
1.试剂(1)去氧胆酸钠标准溶液(100μg/ml)精密称取干燥恒重的去氧胆酸钠0.0 5g于烧杯内,加入冰乙酸30ml使溶解,转入50ml 容量瓶内,用适量水冲洗烧杯洗液转入容量瓶,再补加水至50ml。
使用时10倍稀释即为100μg/ml。
(2)60% 乙酸溶液取冰乙酸150ml,加水100ml,混匀。
(3)43.5% 硫酸溶液量取浓硫酸453ml,缓慢加入500ml水中,边加边搅拌,补水至1000ml。
2. 测定方法(1)标准曲线制备:精密吸取去氧胆酸钠标准溶液(100μg/ml)0ml,0.1ml,0.2ml,0.4ml,0.8ml, 于50ml比色管中,各加60% 乙酸溶液至1.0ml,使去氧胆酸钠浓度分别为0μg/ml,10μg/ml,20μg/ml, 40μg/ml, 80μg/ml, 各加43.5% 硫酸溶液14.0ml,摇匀,70℃加热20分钟,冷却,于387nm波长处测定吸光度。
(2)供试品制备:取供试品1.0ml于50ml比色管中,加43.5% 硫酸溶液14.0ml,摇匀,70℃加热20分钟,冷却,于387nm波长处测定吸光度。
以去氧胆酸钠标准溶液的浓度对其相应的吸光度作直线回归,将供试品溶液的吸光度代入回归方程,计算供试品中去氧胆酸钠含量。
附录22-苯氧乙醇含量测定采用高效液相色谱法进行2-苯氧乙醇含量测定。
1. 试验设备高效液相色谱:BBK089,UV-270nm检测色谱柱:micro Bondapack C18 10um流动相:乙腈(CH3CN-H2O)50/50 v/v流速:1ml/min上样量:10ul2. 测定法2.1. 标准品制备准确称取2-苯氧乙醇标准品50mg于10ml容量瓶中,溶解后用蒸馏水定容至10ml,取1ml于10ml容量瓶中,用乙腈定容至10ml,用0.45μm滤膜过滤。
2.2 供试品制备取1ml供试品于10ml容量瓶中,用乙腈定容至10ml,用0.45μm滤膜过滤。
3. 结果计算供试品中2-苯氧乙醇含量(mg/ml)=(供试品峰面积÷标准品峰面积)×供试品稀释倍数×标准品浓度(mg/ml)。