原位杂交流程(探针制备开始)
- 格式:pdf
- 大小:1.10 MB
- 文档页数:12

原位杂交操作流程1、使用地高辛标记的核酸探针进行石蜡切片的RNA原位杂交第一天1)二甲苯于37℃脱蜡2次,每次15分钟;2)无水乙醇浸泡2次,每次3分钟;3) 95%乙醇浸泡2次,每次3分钟;4) PBS清洗3分钟;5) 2%焦碳酸二乙酯室温下浸泡10分钟;6) PBS清洗10分钟;7)加入胃蛋白酶25ul/ml,37℃孵育15分钟;8) PBS清洗2次,每次3分钟;9) 0.2N的HCl孵育30分钟;10)PBS清洗2次,每次3分钟;11)0.25%无水乙酸和0.1M三乙醇胺孵育10分钟;12)PBS清洗2次,每次5分钟;13)预杂交缓冲液孵育30分钟;14)准备核酸探针混合物:使用预杂交缓冲液稀释探针,85℃加热5分钟,置于冰块中10分钟;15)杂交;第二天16)将玻片置于SSC中2次,每次5分钟以去除封片;17)PBS清洗3分钟;18)RNA酶A溶液中(或0.1-1ng/mlPBS中),37℃孵育30分钟;19)PBS清洗5分钟;20)室温,2×SSC清洗10分钟;21)37℃,1×SSC清洗10分钟;22)37℃,0.5×SSC清洗10分钟;23)缓冲液A孵育10分钟;24)缓冲液A(1%正常绵羊血清和0.03%三重氢核X-100)孵育30分钟;25)加入抗地高辛抗体(1/200的上述缓冲液,来自Boehringer Mannheim),37℃孵育3 小时;26)缓冲液A清洗2次,每次10分钟;27)缓冲液B清洗2次,每次5分钟;28)制成NBT/BCIP暗处保存30-60分钟,显微镜下进行观察,如果背景尚佳,显色时间可延长到16小时;29)停止缓冲液B的反应,用水进行简单的清洗;30)固红,脱水以及封片进行核的复染。
2、使用地高辛标记的寡核苷酸探针进行石蜡切片的原位DNA杂交第一天1)二甲苯于37℃脱蜡2次,每次15分钟;2)无水乙醇浸泡2次,每次5分钟;3) 95%乙醇浸泡2次,每次5分钟;4) PBS清洗5分钟;5) 2%焦碳酸二乙酯室温下浸泡10分钟;6) PBS清洗5分钟;7)加入胃蛋白酶25ul/ml,37℃孵育10分钟;8) PBS清洗2次,每次5分钟;9) 0.2N的HCl孵育30分钟;10)PBS清洗2次,每次5分钟;11)0.25%无水乙酸和0.1M三乙醇胺孵育10分钟;12)PBS清洗5分钟;13)预杂交缓冲液孵育30分钟;14)准备寡核苷酸探针混合物:使用预杂交缓冲液稀释探针;15)杂交;第二天16)将玻片置于SSC中以去除封片;17)室温,2×SSC清洗10分钟;18)37℃,1×SSC清洗10分钟;19)37℃,0.5×SSC清洗10分钟;20)缓冲液A孵育10分钟;21)缓冲液A孵育30分钟;22)加入抗地高辛抗体37℃孵育3小时;23)缓冲液A清洗2次,每次5分钟;24)缓冲液B清洗2次,每次5分钟;25)制成NBT/BCIP暗处保存30-60分钟,显微镜下进行观察,如果背景尚佳,显色时间可长到16小时;26)停止缓冲液B的反应,用水进行简单的清洗;27)固红,脱水以及封片进行核的复染。

原位杂交操作流程1、使用地高辛标记的核酸探针进行石蜡切片的RNA原位杂交第一天1)二甲苯于37°C脱蜡2次,每次15分钟;2)无水乙醇浸泡2次,每次3分钟;3)95%乙醇浸泡2次,每次3分钟;4)PBS清洗3分钟;5)2%焦碳酸二乙酯室温下浸泡10分钟;6)PBS清洗10分钟;7)加入胃蛋白酶25ul/ml,37°C孵育15分钟;8)PBS清洗2次,每次3分钟;9)0.2N的HCl孵育30分钟;10)PBS清洗2次,每次3分钟;11)0.25%无水乙酸和0.1M三乙醇胺孵育10分钟;12)PBS清洗2次,每次5分钟;13)预杂交缓冲液孵育30分钟;14)准备核酸探针混合物:使用预杂交缓冲液稀释探针,85°C加热5分钟,置于冰块中10分钟;15)杂交;第二天16)将玻片置于SSC中2次,每次5分钟以去除封片;17)PBS清洗3分钟;18)RNA酶A溶液中(或0.1-1ng/mlPBS中),37°C孵育30分钟;19)PBS清洗5分钟;20)室温,2XSSC清洗10分钟;21)37°C,1XSSC清洗10分钟;22)37°C,0.5XSSC清洗10分钟;23)缓冲液A孵育10分钟;24)缓冲液A(1%正常绵羊血清和0.03%三重氢核X-100)孵育30分钟;25)加入抗地高辛抗体(1/200的上述缓冲液,来自BoehringerMannheim),37°C孵育3小时;26)缓冲液A清洗2次,每次10分钟;27)缓冲液B清洗2次,每次5分钟;28)制成NBT/BCIP暗处保存30-60分钟,显微镜下进行观察,如果背景尚佳,显色时间可延长到16小时;29)停止缓冲液B的反应,用水进行简单的清洗;30)固红,脱水以及封片进行核的复染。
2、使用地高辛标记的寡核苷酸探针进行石蜡切片的原位DNA杂交第一天1)二甲苯于37C脱蜡2次,每次15分钟;2)无水乙醇浸泡2次,每次5分钟;3)95%乙醇浸泡2次,每次5分钟;4)PBS清洗5分钟;5)2%焦碳酸二乙酯室温下浸泡10分钟;6)PBS清洗5分钟;7)加入胃蛋白酶25ul/ml,37C孵育10分钟;8)PBS清洗2次,每次5分钟;9)0.2N的HCl孵育30分钟;10)PBS清洗2次,每次5分钟;11)0.25%无水乙酸和0.1M三乙醇胺孵育10分钟;12)PBS清洗5分钟;13)预杂交缓冲液孵育30分钟;14)准备寡核苷酸探针混合物:使用预杂交缓冲液稀释探针;15)杂交;第二天16)将玻片置于SSC中以去除封片;17)室温,2XSSC清洗10分钟;18)37°C,1XSSC清洗10分钟;19)37°C,0.5XSSC清洗10分钟;20)缓冲液A孵育10分钟;21)缓冲液A孵育30分钟;22)加入抗地高辛抗体37C孵育3小时;23)缓冲液A清洗2次,每次5分钟;24)缓冲液B清洗2次,每次5分钟;25)制成NBT/BCIP暗处保存30-60分钟,显微镜下进行观察,如果背景尚佳,显色时间可长到16小时;26)停止缓冲液B的反应,用水进行简单的清洗;27)固红,脱水以及封片进行核的复染。

荧光原位杂交实验具体步骤及详细说明荧光原位杂交(fluorescence in situ hybridization,FISH)是一种用于确定DNA或RNA序列在细胞或组织中的位置的技术。
下面将详细介绍荧光原位杂交的具体步骤和相应的详细说明。
1.细胞准备首先,需要准备细胞样本。
可以选择使用原代细胞,细胞悬液或切片等。
2.固定将细胞固定在载玻片或载玻片上面。
固定通常使用的试剂是乙酸乙酯和甲醇的混合物,通常比例为1:33.水合将载玻片中的组织或细胞水合处理。
这一步可以通过将载玻片浸泡在去离子水或缓冲液中进行。
4.处理将载玻片进行预处理,以使DNA或RNA序列更易于杂交。
常用的预处理方法有:-煮沸:将载玻片浸泡在2×SSC(1×SSC:0.15MNaCl,0.015MNa3C6H5O7·2H2O,pH7.0)中,然后置于热盖板上加热至100°C,持续约10-20分钟。
-碱性水解:将载玻片浸泡在10%NaOH中,进行碱性水解,然后在盐溶液中冲洗。
5.杂交探针准备荧光探针或荧光标记的引物。
探针的选择取决于要检测的DNA或RNA序列。
探针的设计通常基于目标序列的序列信息,并且通过化学修饰和荧光标记以增加其杂交效率和检测灵敏度。
6.杂交将探针加到载玻片上的样本上,并与目标序列进行杂交。
杂交过程中,探针与目标序列进行互补配对,形成探针-目标复合物。
杂交的温度取决于探针的碱基组成和目标序列的GC含量。
7.洗涤将载玻片在洗涤缓冲液中进行洗涤,以去除未与目标序列杂交的探针。
8.检测使用荧光显微镜观察载玻片上的标记。
荧光标记的探针将通过荧光显微镜检测获得荧光信号。
根据荧光信号的数量和强度,可以确定目标序列的位置和数量。
9.成像和分析通过拍摄荧光显微镜图像来记录荧光信号。
使用图像处理软件进行图像分析,包括亮度分析和定量信号分析。
总结:荧光原位杂交是一种用于确定DNA或RNA序列在细胞或组织中位置的强大技术。

荧光原位杂交试剂及其配制方法(以下试剂均需用RNase-free水配制):1×PBS:NaCl 8g∕L、KCl 0.2 g∕L、Na2HPO4 1.44 g∕L、KH2PO4 0.24 g∕L,溶于DEPC处理的去离子水中,用pH 计测其pH,再用NaOH调其pH为7.4;PBST:PBS加0.1%吐温-20;LiCI:配4M LiCI 100ml需要LiCI.H20 25.6g,配好后加入千分之一的DEPC,37℃,12h放置,高温灭菌。
4%多聚甲醛(4%PFA):准确称取40g多聚甲醛,溶于1000ml的1×PBS中,避光于摇床(37℃,160r∕m)上,待其全部溶解后,用棕色瓶分装成小体积包装,保存于-20℃。
(注:本方法与其他一些文献用NaOH和HCl先后调节pH而促其溶解的方法略有不同,因是考虑到pH的稳定性;另外之所以采用上述方法使多聚甲醛缓慢溶解而没有采用文献中提及的用NaOH调节其pH至10促其溶解后再用HCl调节pH的原因,除了用一般的pH试纸测量配置好的4%多聚甲醛的pH不够准确外,也因为不能用pH计对其酸碱度进行测量,因为它会损坏pH 计)。
取以上各成分,溶于DEPC处理过一定量的纯水(或双蒸水)中,测定其pH(放置一段时间待其pH稳定后),据此以HCl或NaOH来调节其pH值至7.4,定容至所要求的体积。
(注:根据实际情况,因DEPC处理过的水其pH会下降,故本实验中实际上是用1mol∕L的NaOH来调节其pH)。
75%甲醇/PBST:将无水甲醇按75%(V/V)比例溶于PBST;50%甲醇/PBST:将无水甲醇按50%(V/V)比例溶于PBST;25%甲醇/PBST:将无水甲醇按25%(V/V)比例溶于PBST;HYB-溶液:50%甲酰胺(V/V)、5×SSC(终浓度)、0.1%吐温-20(终浓度)、RNase-free水(-20℃)pH6.2HYB+溶液:HYB-溶液、500ug/ml酵母tRNA、50ug/ml(终浓度)肝素,(-20℃);pH6.250%甲酰胺/2×SSCT:50%甲酰胺(V/V),2×SSCT(终浓度);2×SSCT:2×SSCT(终浓度),0.1%吐温-20;MAB马来酸缓冲液(Maleic acid buffer):100mM maleic acid,150mM NaCl,pH 7.5(20℃),溶于双蒸水,用浓缩或固体的NaOH调节pH 为7.5,并过滤除菌(sterile)MABT:MAB,使用前加入0.1%吐温-20;10×Blocking reagent(阻断剂):将阻断试剂(Blocking reagent)溶于马来酸缓冲液中,摇晃并在加热器或微波炉上加热,使其终浓度为10%(w/v);此储存液(原液)需高温除菌?(is autoclaved)并分装后保存于-20℃。

原位杂交实验操作步骤撰写人:范为民一、实验原理原位杂交是指借助于核酸分子杂交的方法,在显微镜水平检测和定位特异的核苷酸片段。
现在原位杂交已经成为在分子水平研究肿瘤和遗传性疾病的发生,发展和调控等根本性问题的有力工具。
二、试剂盒本实验室常用的原位杂交试剂盒是博士德公司生产的敏感加强型原位杂交检测试剂盒,此试剂盒分为两种,一种为过氧化物酶(POD)检测(MK1030型),一种为碱性磷酸酶(AP)检测系统(MK1032型),用于mRNA的杂交。
过氧化物酶(POD)检测的最终信号为棕黄色,而碱性磷酸酶(AP)检测的信号为紫色,因后者信号比较突出,所以一般采用后一种检测方法。
两种检测方法的实验步骤相差不多,所用洗脱缓冲液也大同小异。
用于杂交的探针也可以分为两种,一种是DNA探针,即是用DNA与组织中的mRNA杂交,另一种是RNA 探针,即用RNA与组织中的mRNA杂交。
DNA探针处理操作简单,但杂交信号一般不如RNA探针强烈,所以条件允许的话一般采用RNA探针。
下面先介绍碱性磷酸酶(AP)检测试剂盒,采用RNA作为探针的操作步骤。
三、实验步骤原位杂交实验主要包括三大部分,即组织冰冻切片、RNA探针标记、原位杂交三部分。
(一)组织冰冻切片1. 实验准备(1)原位杂交专用载玻片:用多聚赖氨酸处理后的载玻片,使切片紧密粘附在玻片上,可以用于后面的洗脱。
一般一张载玻片上可以贴至多十张切片(可以是不同组织的切片),所以需要玻片的数目需要根据实验的要求而定。
这种专用载玻片可以从中杉金桥公司购买,目前价格是每片2.2元,玻片有一面的一端是毛玻璃,用于标记组织名称等,切片应该贴在此面,切勿贴到反面。
(2)缓冲液配备1.1器具准备剪刀、镊子各三把,开壳钳一把,100ml量筒一个,磁力搅拌子一个;100ml试剂瓶一个,250ml试剂瓶三个。
以上器具均洗净后置于180摄氏度以上烘烤6小时以上。
铅笔、显微镜、冰、吸水纸、一次性塑料手套等。
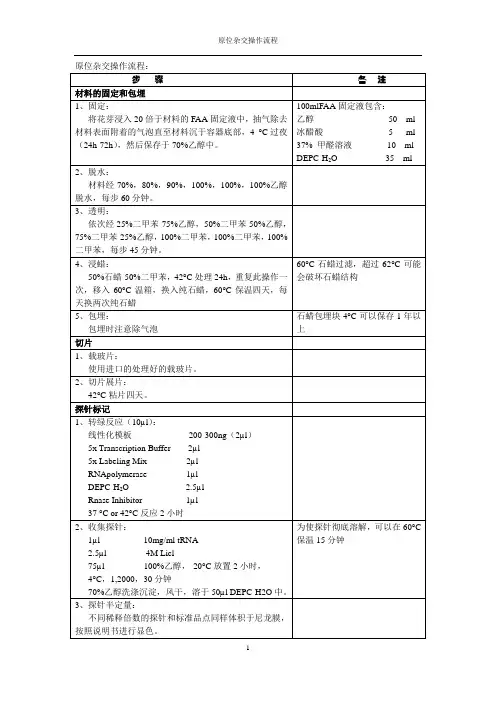
原位杂交操作流程:步骤备注材料的固定和包埋1、固定:将花芽浸入20倍于材料的FAA固定液中,抽气除去材料表面附着的气泡直至材料沉于容器底部,4 °C过夜(24h-72h),然后保存于70%乙醇中。
100mlFAA固定液包含:乙醇50 ml 冰醋酸 5 ml 37% 甲醛溶液10 ml DEPC-H2O 35 ml2、脱水:材料经70%,80%,90%,100%,100%,100%乙醇脱水,每步60分钟。
3、透明:依次经25%二甲苯-75%乙醇,50%二甲苯-50%乙醇,75%二甲苯-25%乙醇,100%二甲苯,100%二甲苯,100%二甲苯,每步45分钟。
4、浸蜡:50%石蜡-50%二甲苯,42°C处理24h,重复此操作一次,移入60°C温箱,换入纯石蜡,60°C保温四天,每天换两次纯石蜡60°C石蜡过滤,超过62°C可能会破坏石蜡结构5、包埋:包埋时注意除气泡石蜡包埋块4°C可以保存1年以上切片1、载玻片:使用进口的处理好的载玻片。
2、切片展片:42°C粘片四天。
探针标记1、转绿反应(10µl):线性化模板200-300ng(2µl)5x Transcription Buffer 2µl5x Labeling Mix 2µlRNApolymerase 1µlDEPC-H2O 2.5µlRnase Inhibitor 1µl37 °C or 42°C反应2小时2、收集探针:1µl 10mg/ml tRNA2.5µl 4M Licl75µl 100%乙醇,-20°C放置2小时,4°C,1,2000,30分钟70%乙醇洗涤沉淀,风干,溶于50µl DEPC-H2O中。
为使探针彻底溶解,可以在60°C 保温15分钟3、探针半定量:不同稀释倍数的探针和标准品点同样体积于尼龙膜,按照说明书进行显色。

荧光原位杂交实验具体步骤及详细说明用已知的标记单链核酸为探针,按照碱基互补的原则,与待检材料中未知的单链核酸进行异性结合,形成可被检测的杂交双链核酸。
由于DNA分子在染色体上是沿着染色体纵轴呈线性排列,因而可以探针直接与染色体进行杂交从而将特定的基因在染色体上定位。
1. 探针变性将探针在75℃恒温水浴中温育5 min,立即置0℃,5~10 min,使双链DNA探针变性。
2. 标本变性(1)将制备好的染色体玻片标本于50℃培养箱中烤片2~3 h。
(经Giemsa 染色的标本需预先在固定液中退色后再烤片)。
(2)取出玻片标本,将其浸在70~75℃的体积分数70% 甲酰胺/2x SSC的变性液中变性2~3 min。
(3)立即按顺序将标本经体积分数70%、体积分数90%和体积分数100%冰乙醇系列脱水,每次5 min,然后空气干燥。
3. 杂交将已变性或预退火的DNA探针10 uL 滴于已变性并脱水的玻片标本上,盖上18x18盖玻片,用Parafilm封片,置于潮湿暗盒中37℃杂交过夜(约15~17 h)。
由于杂交液较少,而且杂交温度较高,持续时间又长,因此为了保持标本的湿润状态,此过程在湿盒中进行。
4. 洗脱此步骤有助于除去非特异性结合的探针,从而降低本底。
(1)杂交次日,将标本从37℃温箱中取出,用刀片轻轻将盖玻片揭掉。
(2)将已杂交的玻片标本放置于已预热42~50℃的体积分数50%甲酰胺/2xSSC中洗涤3次,每次5 min。
(3)在已预热42~50℃的1xSSC中洗涤3次,每次5 min。
(4)在室温下,将玻片标本于2xSSC中轻洗一下。
(5)取出玻片,自然干燥。
(6)取200 uL复染溶液(PI/antifade或DAPI/antifade染液)滴加在玻片标本上,盖上盖玻片。
5. 杂交信号的放大(适用于使用生物素标记的探针)(1)在玻片的杂交部位加150 uL封闭液I,用保鲜膜覆盖,37℃温育20min。

(一)、仪器设备医用微波炉;水浴锅。
(二)、试剂1)95%乙醇,DEPC水配制2)70%乙醇,DEPC水配制3)0.1M甘氨酸glycine(用0.1M PBS配制)4)0.3%TritonX-100(用0.1M PBS配制)5)TE缓冲液配制:0.1M Tria-HCl,0.05M EDTA,pH8.0,DEPC水配制6)蛋白酶K (5-20 ug/ml),(用PBS缓冲液配制)7)4% Paraformaldehyde(PFA)(用0.1M PBS配制)8)0.1mol/L Triethanolamine TEA (pH8.0): Triethanolamine 5.33ml,DEPC水定容0.4L。
9)醋酸酐溶液: 0.1mol/L Triethanolamine中醋酸酐(用前加至浓度0.25M)。
10)杂交缓冲液:50% deionized formamide, sterile 4X SSC(DEPC 水配制)11)杂交液:50% deionized formamide, 100 μg/ml heparin, 5X SSC, 0.1% Tween20, 5 mM EDTA, 1X Denhardt's, 1 mg/ml total RNA; stored frozen in 50 ml aliquots.12)20×SSC(pH7.0):20X SSC [175 g NaCl, 88.5 g trisodium citrate, DEPC-H2O and 200 ul 10M HCl to 1L, pH 7.4 (DEPC treated and autoclaved)]. Store frozen in 40 ml aliquots. All reagents are purchased from Sigma.13)10mg/ml RNA: 让RNase溶于NTE缓冲液。

原位杂交实验步骤原位杂交实验步骤原位杂交组织(或细胞)化学(In situ Hybridization Histochemistry,ISHH)简称原位杂交(In Situ Hybridization),属于固相分子杂交的范畴,它是用标记的DNA或RNA为探针,在原位检测组织细胞内特定核酸序列的方法。
根据所用探针和靶核酸的不同,原位杂交可分为DNA-DNA杂交,DNA-RNA杂交和RNA-RNA 杂交三类。
根据探针的标记物是否直接被检测,原位杂交又可分为直接法和间接法两类。
直接法主要用放射性同位素、荧光及某些酶标记的探针与靶核酸进行杂交,杂交后分别通过放射自显影、荧光显微镜术或成色酶促反应直接显示。
间接法一般用半抗原标记探针,最后通过免疫组织化学法对半抗原定位,间接地显示探针与靶核酸形成的杂交体。
原位杂交最初是以同位素标记探针进行的。
尽管同位素标记(如35S,3H,32P等)仍然广泛使用,但非同位素标记探针的迅速发展(尤其是生物素标记探针和地高辛标记探针),更引起科技工作者的极大兴趣。
一、基本要求1.组织取材:组织取材应尽可能新鲜。
由于组织RNA降解较快,所以新鲜组织和培养细胞最好在30min内固定。
2.固定目的是:(1)保持细胞结构;(2)最大限度地保持细胞内DNA或RNA的水平;(3)使探针易于进入细胞或组织。
最常用的固定剂是多聚甲醛,与其它醛类固定剂(如戊二醛)不同,多聚甲醛不会与蛋白质产生广泛的交叉连接,因而不会影响探针穿透入细胞或组织。
3.增强组织的通透性和核酸探针的穿透性:(1)稀酸处理和酸酐处理:为防止探针与组织中碱性蛋白之间的静电结合,以降低背景,杂交前标本可用0.25%乙酸酐处理10min,经乙酸酐处理后,组织蛋白中的碱性基团通过乙酰化而被阻断。
组织和细胞标本亦可用0.2M HCl处理10min,稀酸能使碱性蛋白变性,结合蛋白酶消化,容易将碱性蛋白移除。
(2)去污剂处理:去污剂处理的目的是增加组织的通透性,利于杂交探针进入组织细胞,最常应用的去污剂是Triton X-100。

原位杂交实验流程
原位杂交实验是一种将核酸探针与细胞或组织切片上的DNA或RNA进行杂交,从而对特定核酸进行定位和定量分析的方法。
以下是原位杂交实验的一般流程:
1. 样品制备:获得待检测的样品,可以是细胞、组织、细胞核或染色体等。
样品需要进行处理,包括固定、脱水和烘干等步骤,以便于后续的处理。
2. 探针制备:探针是一段具有特定序列的DNA或RNA,用于检测样品中的特定序列。
可以通过化学合成或PCR扩增等方法制备探针。
探针需要标记一定的标记物,如荧光素或辐射性核素等,以便于检测。
3. 杂交反应:将制备好的探针与处理好的样品进行杂交反应。
反应条件包括温度、盐浓度、pH值等,需要根据探针和样品的特性进行调整。
杂交后,探针会与样品中的特定DNA序列结合,并形成探针-目标DNA复合物。
4. 洗涤:杂交后,需要用洗涤液将未结合的探针洗去,以减少背景信号。
洗涤条件需要根据探针和样品的特性进行选择。
5. 检测:在洗涤后,通过特定的检测方法对探针-目标DNA复合物进行检测。
常用的检测方法包括荧光显微镜观察、放射自显影、免疫组织化学染色等。
6. 结果分析:根据检测结果,对杂交信号进行分析和解释。
通常需要比较杂交信号与已知标准品的信号,以确定样品中是否存在目标核酸序列。
7. 实验重复:为了确保结果的可靠性和准确性,通常需要进行重复实验,并对不同实验条件下的结果进行比较和分析。
总之,原位杂交实验需要精心设计和严格控制实验条件,以确保结果的准确性和可靠性。

原位杂交流程以下是用含有cDNA的质粒酶切出DNA片段标记探针 对石蜡切片进行mRNA检测的流程图。
这些实验操作方法很多参考书中均有 但没有一本书是专为这个目的而系统地加以总结的 因此特加以综合供同行参考 在具体操作过程中很多地方可酌情变更。
在临床应用中 常常可以买到已经标记好的商品探针 那么前面一大部分扩增基因、酶切鉴定、标记探针的工作就可以省去 从石蜡切片处理做起即可。
下面介绍的方法笔者已亲手做过数次 可获满意结果。
主要操作步骤制备感受态细菌用含目的基因的质粒转化细菌小量培养转化的细菌小量提取质粒小量酶切质粒电泳鉴定大量培养转化的细菌大量提取质粒大量酶切质粒电泳分离、回收及纯化标记探针石蜡切片的处理预杂交、杂交杂交后处理抗体连接、显色制备感受态细菌【试剂及配制】1 LB液体培养基在900ml三蒸水中加入胰蛋白胨(bacto-tryptone) 10g酵母提取物(bacto-extract) 5gNaCl 10g磁力搅拌使完全溶解 用5mol NaOH调节pH至7.0 如用进口试剂则不必调 。
定容为1000ml 高压灭菌20min。
2 0.1mol CaCl2溶液1.1g无水氯化钙 溶于90ml三蒸水中 定容至100ml 用0.22μm滤器过滤除菌置于灭菌试剂瓶中 4℃保存。
【材料】大肠杆菌单菌落或冻存菌种 也可复苏陈旧的感受态细菌重新制备新的感受态。
【操作方法】1 从37℃培养12 16h的平板中用无菌的接种环 用前酒精灯烧红晾凉 挑一单菌落 转入含有5ml LB培养基的无菌试管 37℃振摇 200r/min 过夜。
次日取菌液1ml 加入含100ml LB培养基的500ml 锥形烧瓶 37℃振摇培养 200 300r/min 约2 3h将烧瓶取出立即置冰浴10 15min2 以下均为无菌操作。
在超静工作台中将细菌转移到一个灭过的冰预冷50ml离心管中3 4℃离心 5000g ×10min 回收细菌4 弃去培养液 将管倒置于滤纸上1min 流尽培养液5 用冰预冷的0.1mol CaCl2 10ml 重悬菌体 置冰浴30min6 4℃离心 5000g ×10min 弃上清 倒置于滤纸上1min7 加4ml 用冰预冷的0.1mol CaCl2 重悬菌体 动作要轻8 置4℃冰箱12 24h 即可用于转化。
显色原位杂交一、引言显色原位杂交(FISH)是一种基因分子生物学技术,可以用来检测染色体和基因的位置,也可以用来诊断某些疾病。
FISH技术具有高灵敏度、高特异性和高分辨率的优点,已经被广泛应用于医学、生物学和农业领域。
二、FISH技术的基本原理1.探针的制备探针是FISH技术中最重要的部分,它是一段DNA序列或RNA序列,可以与待检测样品中的目标序列互补结合。
探针通常由DNA合成或PCR扩增得到,并且需要进行标记,常见的标记有荧光标记和酶标记。
2.样品制备待检测样品需要进行前处理,使得细胞核或染色体能够与探针结合。
通常的处理包括细胞固定、脱水和变性等步骤。
3.杂交反应将标记好的探针与待检测样品进行杂交反应。
在适当条件下,探针会与目标序列结合形成稳定复合物。
4.信号检测通过荧光显微镜或酶标记检测方法,可以检测到探针与目标序列的结合情况。
荧光标记的探针可以直接在显微镜下观察到荧光信号,而酶标记的探针需要添加底物后才能看到颜色反应。
三、FISH技术的应用1.染色体诊断FISH技术可以用来检测染色体异常,如染色体缺失、重复、易位等。
对于一些遗传性疾病的诊断,FISH技术已经成为一种常规方法。
2.基因定位FISH技术可以用来定位基因在染色体上的位置。
通过对目标基因进行探针标记,可以在显微镜下观察到探针与染色体上特定区域的结合情况。
3.肿瘤诊断FISH技术可以用来检测肿瘤细胞中的基因异常。
例如,在乳腺癌中常见的HER2基因扩增,就可以通过FISH技术进行检测和诊断。
4.生物学研究FISH技术在生物学研究中有广泛应用。
例如,通过对不同组织中特定基因的表达情况进行FISH检测,可以研究基因的表达模式和调控机制。
四、FISH技术的优缺点1.优点FISH技术具有高灵敏度、高特异性和高分辨率的优点。
可以检测到非常小的基因或染色体异常,并且可以进行多重探针同时检测。
2.缺点FISH技术需要标记探针,并且不同标记方式的信号强度可能不同,会影响结果的准确性。
(一)、仪器设备医用微波炉;水浴锅。
(二)、试剂1)95%乙醇,DEPC水配制2)70%乙醇,DEPC水配制3)0.1M甘氨酸glycine(用0.1M PBS配制)4)0.3%TritonX-100(用0.1M PBS配制)5)TE缓冲液配制:0.1M Tria-HCl,0.05M EDTA,pH8.0,DEPC水配制6)蛋白酶K (5-20 ug/ml),(用PBS缓冲液配制)7)4% Paraformaldehyde(PFA)(用0.1M PBS配制)8)0.1mol/L Triethanolamine TEA (pH8.0): Triethanolamine 5.33ml,DEPC水定容0.4L。
9)醋酸酐溶液: 0.1mol/L Triethanolamine中醋酸酐(用前加至浓度0.25M)。
10)杂交缓冲液:50% deionized formamide, sterile 4X SSC(DEPC 水配制)11)杂交液:50% deionized formamide, 100 μg/ml heparin, 5X SSC, 0.1% Tween20, 5 mM EDTA, 1X Denhardt's, 1 mg/ml total RNA; stored frozen in 50 ml aliquots.12)20×SSC(pH7.0):20X SSC [175 g NaCl, 88.5 g trisodium citrate, DEPC-H2O and 200 ul 10M HCl to 1L, pH 7.4 (DEPC treated and autoclaved)]. Store frozen in 40 ml aliquots. All reagents are purchased from Sigma.13)10mg/ml RNA: 让RNase溶于NTE缓冲液。
第1篇一、目的原位荧光杂交技术是一种在细胞或组织切片上进行DNA或RNA定位的方法,通过对特定序列的DNA或RNA进行标记,从而实现对特定基因或染色体的定位和定量分析。
本规程旨在规范原位荧光杂交操作,确保实验结果的准确性和可靠性。
二、适用范围本规程适用于所有原位荧光杂交实验,包括细胞原位杂交、组织切片原位杂交等。
三、材料与设备1. 材料:- 标本:细胞或组织切片- 探针:标记有荧光染料的DNA或RNA探针- 酶标抗体:针对探针标记的荧光染料- 洗涤液:如磷酸盐缓冲盐溶液(PBS)- 抗荧光抗体:用于检测酶标抗体- 封片剂:如甘油封片剂2. 设备:- 荧光显微镜- 原位杂交仪- 热循环仪- 高速离心机- 显微镜载物台- 离心管- 移液器四、操作步骤1. 标本制备:- 将细胞或组织切片固定在载玻片上,进行脱水和透明处理。
- 将载玻片放入烘箱中,进行烘烤,使切片紧密贴合在载玻片上。
2. 探针制备:- 将探针进行变性,使其单链化。
- 将变性后的探针与标记有荧光染料的探针混合,进行杂交反应。
3. 杂交反应:- 将杂交混合物滴加在载玻片上的标本上,用封片剂封口。
- 将载玻片放入原位杂交仪中,进行杂交反应。
4. 洗涤:- 将杂交后的载玻片放入洗涤液中,进行洗涤。
- 洗涤过程中,注意轻柔操作,避免破坏杂交结构。
5. 酶标抗体反应:- 将酶标抗体滴加在载玻片上的杂交结构上,进行抗体结合反应。
- 将载玻片放入原位杂交仪中,进行抗体结合反应。
6. 洗涤:- 将抗体结合后的载玻片放入洗涤液中,进行洗涤。
7. 抗荧光抗体反应:- 将抗荧光抗体滴加在载玻片上的杂交结构上,进行荧光抗体结合反应。
- 将载玻片放入原位杂交仪中,进行荧光抗体结合反应。
8. 洗涤:- 将荧光抗体结合后的载玻片放入洗涤液中,进行洗涤。
9. 封片:- 将封片剂滴加在载玻片上的杂交结构上,进行封片。
10. 观察与分析:- 将载玻片放入荧光显微镜中,进行观察和分析。
荧光原位杂交实验具体步骤及方法荧光原位杂交实验具体步骤及方法用已知的标记单链核酸为探针,按照碱基互补的原则,与待检材料中未知的单链核酸进行异性结合,形成可被检测的杂交双链核酸。
由于DNA分子在染色体上是沿着染色体纵轴呈线性排列,因而可以探针直接与染色体进行杂交从而将特定的基因在染色体上定位。
1. 探针变性将探针在75℃恒温水浴中温育5 min,立即置0℃,5~10 min,使双链DNA探针变性。
2. 标本变性(1)将制备好的染色体玻片标本于50℃培养箱中烤片2~3 h。
(经Giemsa染色的标本需预先在固定液中退色后再烤片)。
(2)取出玻片标本,将其浸在70~75℃的体积分数70% 甲酰胺/2x SSC的变性液中变性2~3 min。
(3)立即按顺序将标本经体积分数70%、体积分数90%和体积分数100%冰乙醇系列脱水,每次5 min,然后空气干燥。
3. 杂交将已变性或预退火的DNA探针10 uL 滴于已变性并脱水的玻片标本上,盖上18x18盖玻片,用Parafilm封片,置于潮湿暗盒中37℃杂交过夜(约15~17 h)。
由于杂交液较少,而且杂交温度较高,持续时间又长,因此为了保持标本的湿润状态,此过程在湿盒中进行。
4. 洗脱此步骤有助于除去非特异性结合的探针,从而降低本底。
(1)杂交次日,将标本从37℃温箱中取出,用刀片轻轻将盖玻片揭掉。
(2)将已杂交的玻片标本放置于已预热42~50℃的体积分数50%甲酰胺/2xSSC中洗涤3次,每次5 min。
(3)在已预热42~50℃的1xSSC中洗涤3次,每次5 min。
(4)在室温下,将玻片标本于2xSSC中轻洗一下。
(5)取出玻片,自然干燥。
(6)取200 uL复染溶液(PI/antifade或DAPI/antifade染液)滴加在玻片标本上,盖上盖玻片。
5. 杂交信号的放大(适用于使用生物素标记的探针)(1)在玻片的杂交部位加150 uL封闭液I,用保鲜膜覆盖,37℃温育20min。
荧光原位杂交实验⽅法及步骤2.38.1 实验⽅法及步骤(1) 探针变性将探针在75℃恒温⽔浴中温育5min,⽴即置0℃,5~10min,使双链DNA探针变性。
(2) 标本变性a.将制备好的染⾊体玻⽚标本于50℃培养箱中烤⽚2~3h。
(经Giemsa染⾊的标本需预先在固定液中退⾊后再烤⽚)。
b.取出玻⽚标本,将其浸在70~75℃的体积分数70%甲酰胺/2×SSC的变性液中变性2~3min。
c.⽴即按顺序将标本经体积分数70%、体积分数90%和体积分数100%冰⼄醇系列脱⽔,每次5min,然后空⽓⼲燥。
(3) 杂交将已变性或预退⽕的DNA探针10µL 滴于已变性并脱⽔的玻⽚标本上,盖上18×18盖玻⽚,⽤Parafilm封⽚,置于潮湿暗盒中37℃杂交过夜(约15~17h)。
由于杂交液较少,⽽且杂交温度较⾼,持续时间⼜长,因此为了保持标本的湿润状态,此过程在湿盒中进⾏。
(4) 洗脱此步骤有助于除去⾮特异性结合的探针,从⽽降低本底。
a.杂交次⽇,将标本从37℃温箱中取出,⽤⼑⽚轻轻将盖玻⽚揭掉。
b.将已杂交的玻⽚标本放置于已预热42~50℃的体积分数50%甲酰胺/2×SSC中洗涤3次,每次5min。
c.在已预热42~50℃的1×SSC中洗涤3次,每次5min。
d.在室温下,将玻⽚标本于2×SSC中轻洗⼀下。
e.取出玻⽚,⾃然⼲燥。
f.取200µL复染溶液(PI/antifade或DAPI/antifade染液)滴加在玻⽚标本上,盖上盖玻⽚。
(5) 杂交信号的放⼤(适⽤于使⽤⽣物素标记的探针)a.在玻⽚的杂交部位加150µL封闭液I,⽤保鲜膜覆盖,37℃温育20min。
b.去掉保鲜膜,再加150µL avidin-FITC于标本上,⽤保鲜膜覆盖,37℃继续温育40min。
c.取出标本,将其放⼊已预热42~50℃的洗脱液中洗涤3次,每次5min。
荧光原位杂交实验具体步骤及方法用已知的标记单链核酸为探针,按照碱基互补的原则,与待检材料中未知的单链核酸进行异性结合,形成可被检测的杂交双链核酸。
由于DNA分子在染色体上是沿着染色体纵轴呈线性排列,因而可以探针直接与染色体进行杂交从而将特定的基因在染色体上定位。
1. 探针变性将探针在75℃恒温水浴中温育5 min,立即置0℃,5~10 min,使双链DNA探针变性。
2. 标本变性(1)将制备好的染色体玻片标本于50℃培养箱中烤片2~3 h。
(经Giemsa染色的标本需预先在固定液中退色后再烤片)。
(2)取出玻片标本,将其浸在70~75℃的体积分数70% 甲酰胺/2x SSC的变性液中变性2~3 min。
(3)立即按顺序将标本经体积分数70%、体积分数90%和体积分数100%冰乙醇系列脱水,每次5 min,然后空气干燥。
3. 杂交将已变性或预退火的DNA探针10 uL 滴于已变性并脱水的玻片标本上,盖上18x18盖玻片,用Parafilm封片,置于潮湿暗盒中37℃杂交过夜(约15~17 h)。
由于杂交液较少,而且杂交温度较高,持续时间又长,因此为了保持标本的湿润状态,此过程在湿盒中进行。
4. 洗脱此步骤有助于除去非特异性结合的探针,从而降低本底。
(1)杂交次日,将标本从37℃温箱中取出,用刀片轻轻将盖玻片揭掉。
(2)将已杂交的玻片标本放置于已预热42~50℃的体积分数50%甲酰胺/2xSSC中洗涤3次,每次5 min。
(3)在已预热42~50℃的1xSSC中洗涤3次,每次5 min。
(4)在室温下,将玻片标本于2xSSC中轻洗一下。
(5)取出玻片,自然干燥。
(6)取200 uL复染溶液(PI/antifade或DAPI/antifade染液)滴加在玻片标本上,盖上盖玻片。
5. 杂交信号的放大(适用于使用生物素标记的探针)(1)在玻片的杂交部位加150 uL封闭液I,用保鲜膜覆盖,37℃温育20min。