2018版高考化学一轮总复习(限时训练):第五章第17讲限时训练
- 格式:doc
- 大小:248.52 KB
- 文档页数:9

限时训练[选题细目表]仅有一个选项符合题意)1.(2017·太原模拟)下列叙述正确的是( )A.含1 mol溶质的任何溶液,物质的量浓度一定相等B.配制1 mol·L-1NaCl溶液1 L,其方法是将58.5 g NaCl溶于1 L水中即可C.体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同D.1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0。
5 mol·L-1解析:A选项未指明溶液的体积,故A选项错误。
B选项中,虽然58.5 g NaCl恰好是1 mol,但用的是1 L水,而不是最后形成1 L NaCl 溶液,故B选项错误.C选项中,不论是非电解质还是电解质,体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数必相同,故C选项正确。
D选项中,CaCl2是强电解质,溶于水电离成Ca2+和Cl-,在1 L 0.5 mol·L-1 CaCl2溶液中Ca2+和Cl-的物质的量浓度分别是0.5 mol·L-1和1 mol·L-1,故D选项不正确。
答案:C2.下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( ) A.10 g NaOH固体溶解在水中配成250 mL溶液B.将80 g SO3溶于水并配成1 L的溶液C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液D.标准状况下,将22.4 L氯化氢气体溶于水配成1 L溶液解析:A项,c(NaOH)=错误!=1 mol·L-1;B项,c(H2SO4)=错误!=1 mol·L-1;C项,蒸发掉50 g水后,溶液的体积并不是50 mL,NaNO3的浓度也不是1 mol·L-1;D项,c(HCl)=错误!=1 mol·L-1。
答案:C3.下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:该同学的错误步骤有( )A.1处B.2处C.3处D.4处解析:第①步不能把NaOH放在称量纸上称量;第④步玻璃棒应接触容量瓶内壁刻度线以下的部分;第⑤步定容时应平视刻度线.答案:C4.利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的碳酸钠溶液1 000 mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是()A.称取碳酸钠晶体100 gB.定容时俯视观察刻度线C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤D.定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线解析:A项,称取碳酸钠晶体质量应为143 g,所以结果偏低;B 项,俯视观察时液面低于刻度线,溶液体积偏小,浓度偏大;C项中,不洗涤烧杯会损失溶质,导致结果偏低;D项,摇匀后发现液面低于刻度线是由于液体沾在瓶壁和磨口处所致,不会造成偏差,若加水则使所配溶液浓度偏低。


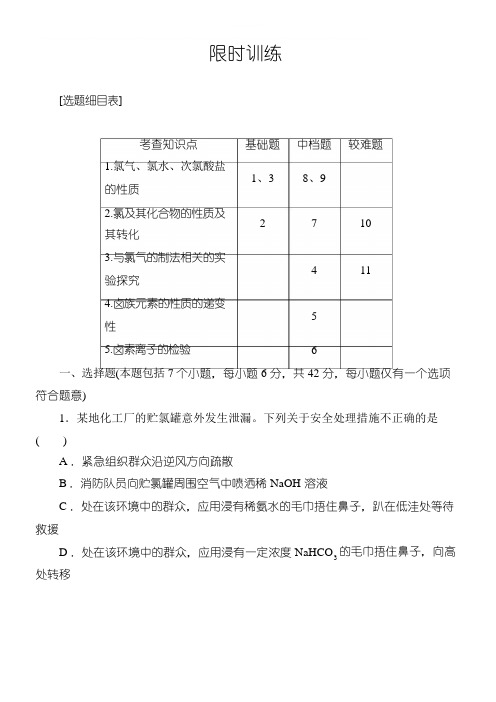
限时训练[选题细目表]考查知识点1.氯气、氯水、次氯酸盐的性质基础题1、3中档题8、9较难题2.氯及其化合物的性质及其转化3.与氯气的制法相关的实验探究4.卤族元素的性质的递变性5.卤素离子的检验271041156一、选择题(本题包括7个小题,每小题6分,共42分,每小题仅有一个选项符合题意)1.某地化工厂的贮氯罐意外发生泄漏。
下列关于安全处理措施不正确的是()A.紧急组织群众沿逆风方向疏散B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援D.处在该环境中的群众,应用浸有一定浓度NaHCO 处转移3的毛巾捂住鼻子,向高大解析:A 项,远离有氯气的地方,正确;B 项,氯气与氢氧化钠溶液反应,正确;C 项,氨水挥发出的氨气会对群众造成伤害,错误;D 项,NaHCO碱性,对人体无伤害,且能与氯气反应,正确。
答案:C2.(2016· 同模拟)下列离子方程式不正确的是( )A .Ca(ClO) 2 溶液中通入 SO 2:3 溶液显弱Ca 2++2ClO -+SO 2+H 2O===CaSOB .将 Cl 2 通入水中: Cl 2+H 2O H ++Cl -+HClO3↓+2HClOC .MnO2 与浓盐酸共热制 Cl 2:△MnO 2+4H ++2Cl -===== Mn 2++Cl 2↑+2H 2O D .Cl 2 通入冷的 NaOH 溶液中:Cl 2+2OH - ===Cl -+ClO -+H 2O解析:离子方程式解题的关键依据是①反应的客观存在性;②电荷守恒;③质量守恒及电子转移守恒等。
A 项中 ClO -氧化 SO 2 产物应为 CaSO 4。
答案:A3.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是()A .向 NaHCO 3 固体中加入新制的氯水,有无色气泡产生(H +)B .新制氯水使红色布条褪色(HClO)C .将 AgNO 3 溶液滴加到新制氯水中,有白色沉淀产生(Cl -)D .向 FeCl 2 溶液中滴加新制氯水,再滴加 KSCN 溶液,溶液呈红色(HCl)解析:A 项,新制氯水中存在 H +,能与 NaHCO3 反应产生 CO 2;B 项,新制氯水中存在 HClO ,具有漂白性,能使红色布条褪色;C 项,Ag +与氯水中的 Cl -反应生成白色沉淀 AgCl ;D 项,因氯水中含有氧化性的 HClO 和 Cl 2,可将 Fe 2+氧化成 Fe 3+,Fe 3+与 SCN -反应使溶液变红色。


专题讲座化学简答题的答题策略与模板快速、规范答题是获取高分的必要条件。
在这里将高中阶段的实验题型、文字表述题型等进行归纳,提供答题模板,点拨解题技巧,突破解题容易出现的“两不能”障碍:知其所以但不能准确表达,思路清晰但不能快速解答。
1.液体体积测量中读数的答题关键。
答题要素:(1)平视:视线与刻度线和凹液面在同一水平线上。
(2)读数:液面最低点(最底端、最底处、最底部、最低处)与刻度线相切。
得分点及关键词:(1)“平视”“刻度线”“凹液面”。
(2)“液面最低点”“相切”。
2.沉淀洗涤是否完全的检验答题模板。
取少许最后一次洗涤滤液,滴入少量……溶液(试剂),若……(现象),表示已经洗涤完全。
说明:解答此类题目要注意四个得分点:取样+试剂+现象+结论。
(1)取样:要取“少许最后一次”洗涤滤液。
(2)试剂:选择合理的试剂。
(3)现象:需有明显的现象描述。
(4)结论:根据现象作出结论。
3.实验操作的原因、目的、作用的答题要点。
答题要素:(1)明确实验目的:做什么?(2)明确操作目的:为什么这样做?(3)明确结论:这样做会有什么结果?理由是什么?得分点及关键词;(1)操作:怎么“做”?为什么这样“做”。
(2)作用:需有明确的结论、判断、理由。
4.实验现象的准确、全面描述。
答题要素:(1)现象描述要全面:看到的、听到的、触摸到的、嗅到的。
(2)现象描述要准确:如A试管中……、B处有……(3)按“现象+结论”格式描述,忌现象结论不分、由结论推现象、指出具体生成物的名称。
得分点及关键词:针对不同状态可按以下模板回答:(1)溶液中:颜色由……变成……,液面上升或下降(形成液面差),溶液变浑浊,生成(产生)……沉淀,溶液发生倒吸,产生大量气泡(或有气体从溶液中逸出),有液体溢出等。
(2)固体:表面产生大量气泡,逐渐溶解,体积逐渐变小(变细),颜色由……变成……等。
(3)气体:生成……色(味)气体,气体由……色变成……色,先变……后……(加深、变浅、褪色)等。
限时训练[选题细目表]一、选择题(本题包括7个小题,每小题6分,共42分,每小题仅有一个选项符合题意)1.下列有关摩尔质量的描述或应用中,正确的是( )A.OH-的摩尔质量是17 g·mol-1B.CO2的摩尔质量是44 gC.铁原子的摩尔质量等于铁原子的相对原子质量D.一个钠原子的质量约等于错误!答案:A2.(2016·泉州一模)某气体的摩尔质量为M g·mol-1,N A表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。
则错误!表示的是( )A.V L该气体的质量(以g为单位)B.1 L该气体的密度C.1 mol该气体的体积(以L为单位)D.1 L该气体中所含的分子数解析:错误!是该气体的物质的量,与M相乘是该气体的质量,质量除以V(体积)得气体的密度.答案:B3.(2016·周口模拟)下列叙述不正确的是( )A.CO2的摩尔质量是44 g·mol-1,表示1 mol CO2的质量为44 gB.H2SO4溶液的物质的量浓度为1 mol·L-1,表示1 L溶液中含有1 mol H2SO4C.气体摩尔体积V m≈22。
4 L·mol-1,表示1 mol任何气体的体积都约为22.4 LD.阿伏加德罗常数N A≈6。
02×1023 mol-1,表示1 mol任何粒子集体所含的粒子数约为6.02×1023解析:在标准状况下,1 mol任何气体的体积都约为22。
4 L,故C错误。
答案:C4.(2017·洛阳调研)工业上将氨气和空气的混合气体通过铂—铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(N A)可表示为()A.11.2n5V B.5V11。
2nC.错误!D。
错误!解析:根据反应4NH3+5O2错误!4NO+6H2O,当有标准状况下V L NH3完全反应时,NH3的物质的量为错误!mol,转移电子的物质的量为错误!mol,已知在此反应中转移电子数为n,则n=错误!×N A,所以,N A=错误!。
限时训练[选题细目表]一、选择题(本题包括7个小题,每小题6分,共42分,每小题仅有一个选项符合题意)1.下列有关元素的性质及其递变规律正确的是()A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物B.第二周期元素从左到右,最高正价从+1递增到+7C.同主族元素的简单阴离子还原性越强,水解程度越大D.同周期金属元素的化合价越高,其原子失电子能力越强解析:A项,ⅠA族的氢元素可以与ⅦA族的元素形成共价化合物,钠等金属元素可以与ⅦA族的元素形成离子化合物,正确。
B项,第二周期,O无最高正价,F无正价,错误。
C项,同主族元素的简单阴离子还原性与其水解能力无直接联系,错误。
D项,同周期金属元素的化合价越高,其原子失电子能力越弱,如失电子能力Na>Mg>Al,错误。
答案:A2.下列有关性质的比较,不能用元素周期律解释的是()A.酸性:H2SO4>H3PO4B.非金属性:Cl>BrC.碱性:NaOH>Mg(OH)2D.热稳定性:Na2CO3>NaHCO3解析:A项,S、P位于同一周期,且S位于P的右侧。
同周期元素从左向右非金属性逐渐增强,故非金属性S>P,所以H2SO4的酸性大于H3PO4。
B项,Cl、Br位于同一主族,Cl位于Br的上方,同主族元素由上到下非金属性逐渐减弱,故非金属性Cl>Br。
C项,Na、Mg是同周期元素,Na位于Mg的左侧,故Na的金属性比Mg的强,则NaOH的碱性比Mg(OH)2的强。
D项,NaHCO3的热稳定性差,是由于HCO-3受热易分解。
答案:D3.如表所示是元素周期表的一部分,有关说法正确的是()B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,e元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:同主族元素从上到下元素氢化物的稳定性减弱,A错误;同周期元素的原子半径从左到右逐渐减小,B错误;a到f六种元素分别为Na、Mg、C、O、S、Cl,其中金属单质Na的化学性质最活泼,非金属单质中Cl2、O2化学性质均比S活泼,C错误。
答案:D4.(2016·全国Ⅱ卷)a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d和b同族。
下列叙述错误的是()A.a与其他三种元素形成的二元化合物中其化合价均为+1B.b与其他三种元素均可形成至少两种二元化合物C.c的原子半径是这些元素中最大的D.d与a形成的化合物的溶液呈弱酸性解析:由题中所给的信息可知,a为H,b为O,c 为Na,d为S。
A项,H与Na可以形成化合物NaH,H的化合价为-1;B项,O与其他三种元素可以形成H2O、H2O2、Na2O、Na2O2、SO2、SO3等二元化合物;C项,四种元素原子半径大小顺序为Na>S>O>H; D项,H 与S形成化合物H2S,其水溶液呈弱酸性。
答案:A5.电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1个,Y的最外层电子数比K层多1个,Z的单质常用于制造太阳能电池,W的原子半径是同周期主族元素中最小的。
下列推断中正确的是()A.Z的简单氢化物的热稳定性强于W的简单氢化物B.Z的氧化物与水反应可制得相应的含氧酸C.X、Y、W的原子半径依次减小,对应的简单离子半径依次增大D.X、Y、W的最高价氧化物对应的水化物之间互相都能发生反应解析:由题意推知Z是硅,故这些元素都在第三周期,从而推断出X是钠,Y是铝,W是氯。
热稳定性:SiH4<HCl,A错误;SiO2与水不反应,B错误;简单离子半径:Al3+<Na+<Cl-,C错误;NaOH、Al(OH)3、HClO4之间互相都能发生反应,D正确。
答案:D6.(2017·广州一模)短周期元素W、X、Y、Z的原子序数依次增加。
m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质。
r溶液是实验室中常见试剂,常温下0.1 mol·L-1r溶液的pH为13。
工业上制备r和q的反应如图所示。
下列说法正确的是()A.单质的沸点:W>XB.简单离子半径:Z>Y>XC.W与其他3种元素均能形成共价化合物D.X与其他3种元素均可形成至少两种二元化合物解析:r溶液是实验室中常见的试剂,且常温下0.1 mol/L r溶液的pH是13,说明这是一种强碱,则其可能为NaOH或KOH,而工业上可由m、n电解制备r,并生成单质p、q,则此反应为电解饱和食盐水制备NaOH,所以可以推出W、X、Y、Z元素分别为H、O、Na、Cl,m、n为NaCl和H2O,p、q、r为NaOH、H2、Cl2。
D项,O与其他元素可形成H2O、H2O2、Na2O、Na2O2、ClO2、Cl2O3等,故D项正确;A项,W与X单质为气体,H2与O2,则沸点W<X,故A项错误;B 项,Z为氯,Y为钠,X为氧,因此简单离子半径Cl->O2->Na+,则为Z>X>Y,故B项错误;C项,H与Na形成的NaH为离子化合物,故C项错误。
答案:D7.(2016·合肥模拟)根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是()B.离子半径大小A+<D2-C.最高价氧化物对应水化物的碱性A<CD.氢化物的稳定性D>E解析:由表中数据可知,A为钠,B为铝,C为铍,D为硫,E为氧。
E2-与B3+的核外电子数都为10,相等,A错误;离子半径大小Na +<S2-,正确;钠比铍活泼,故最高价氧化物对应水化物的碱性C<A,C错误;元素的非金属性越强其对应氢化物就越稳定,应该是H2O>H2S,D错误。
答案:B二、非选择题(本题包括4个小题,共58分)8.(14分)元素周期表中前七周期的元素种类数如下表所示:(1)____________________________。
(2)周期表中________族所含元素种类最多。
(3)请分析周期序数与元素种类数的关系,然后预言第八周期最多可能含有的元素种类数为______(填字母,下同)。
A.18B.32C.50D.64(4)据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb……的碳酸盐)中,查明有尚未命名的116、124、126号元素。
试推断其中116号元素应位于元素周期表中的________。
A.第六周期第ⅣA族B.第七周期第ⅥA族C.第七周期第Ⅷ族D.第八周期第ⅥA族解析:(3)根据题意可通过分析已知数据归纳出潜在的规律:数应为2×52=50种,答案为C。
(4)116-86-14=16,则为第七周期第ⅥA 族。
答案:(1)第六、七周期在第ⅢB族出现了镧系、锕系(2)ⅢB(3)C (4)B9.(14分)已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素。
请回答下列问题:(1)①B在元素周期表中的位置__________________________;②上述元素的最高价氧化物的水化物中酸性最强的是__________(写化学式)。
(2)C、D、E、F四种元素对应的简单离子的半径由小到大....的顺序是______________________(用离子符号表示)。
(3)工业上常用A、B组成的物质X来检验F的单质是否发生泄漏,有大量白烟生成,写出此反应的化学方程式_________________。
其中该反应中还原剂和氧化剂的物质的量之比为__________。
解析:根据题意可知:A是H;B是N;C是O;D是Na;E是S;F是Cl。
(1)①B在元素周期表中的位置是第二周期第ⅤA族;②上述元素的最高价氧化物的水化物中酸性最强的是HClO4;(2)C、D的离子核外有两个电子层;E、F四种元素对应的简单离子核外有三个电子层,对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,对于电子层结构不同的离子来说,离子核外电子层数越多,离子半径就越大,因此这四种元素的简单的半径由小到大的顺序是:Na+< O2-< Cl-< S2-;(3)工业上常用A、B组成的物质X(NH3)来检验F的单质Cl2是否发生泄漏,有大量白烟生成,此反应的化学方程式是3Cl2+8NH3===6NH4Cl+N2。
其中该反应中还原剂是NH3,氧化剂是Cl2,还原剂与氧化剂的物质的量之比为2∶3。
答案:(1)①第二周期第ⅤA族②HClO4(2)Na+<O2-<Cl-<S2-(3)3Cl2+8NH3===6NH4Cl+N22∶310.(15分)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A 中看到白色沉淀时,……,关闭活塞a。
请回答:(1)B中反应的离子方程式是____________________________。
(2)通过步骤Ⅰ、Ⅱ得知盐酸具有的性质是________(填字母)。
A.挥发性B.还原性C.氧化性D.酸性(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________________________________________________________ ______________________________________________________,D中反应的化学方程式是____________________。
(5)碳、硅的非金属性逐渐减弱的原因是__________________________________________________________________________(从原子结构角度加以解释)。
解析:B中CaCO3与盐酸反应的离子方程式为CaCO3+2H+===Ca2++CO↑+H2O,此反应表明盐酸具有酸性,A中看到的白色沉淀是2AgCl沉淀,此现象表明盐酸具有挥发性。
C装置是用NaHCO3溶液除去CO2中混有的HCl气体,以保证与Na2SiO3溶液反应生成白色胶状沉淀的是CO2,此反应的化学方程式为CO2+Na2SiO3+H2O===H2SiO3↓+Na2CO3,从而说明碳酸的酸性强于硅酸,进而证明碳的非金属性强于硅。
答案:(1)CaCO3+2H+===Ca2++CO2↑+H2O(2)A、D(3)除HCl气体NaHCO3(4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3(5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱11.(2016·安徽师大附中模拟)(15分)X~W是元素周期表中的短周期元素,其性质或结构信息如下表:(1)X在元素周期表中的位置是______________________,V2-的离子结构示意图为________________________。