2019年高中化学-★第一节元素周期表1-1
- 格式:doc
- 大小:92.50 KB
- 文档页数:8
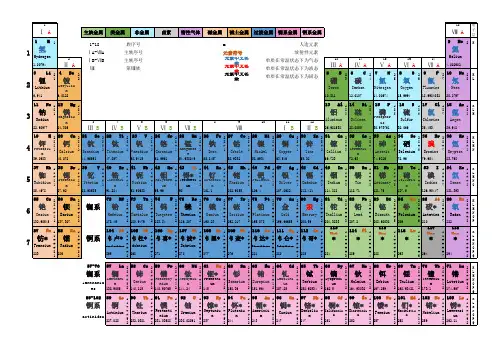


化学元素周期表个速记注音谐音口诀法高中必备WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】中文谐音第一周期:氢H 氦He ---- 侵害第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne ---- 鲤皮捧碳 蛋养福奶 第三周期:钠Na 镁Mg 铝Al 硅Si 磷S 硫P 氯Cl 氩Ar ---- 那美女桂林留绿牙(那美女鬼 流露绿牙)第四周期:钾K 钙Ca 钪 钛 钒 铬 锰 ---- 嫁改康太反革命铁 钴 镍 铜 锌 镓 锗 ---- 铁姑捏痛新嫁者砷 硒 溴 氪 ---- 生气 休克第五周期:铷 锶 钇 锆 铌 ---- 如此一告你(本图可放大)化学元素周期表速读速记钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!汉语拼音第一周期元素:1 氢(qīng) 2 氦(hài) 正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳tàn(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(n ǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè)第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78铂(bó) 79 金(jīn) 80 汞(g ǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná)94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鑪(lú) 105 ??(dù) 106 ??(xǐ) 107 ??(bō) 108 ??(hēi) 109 ?(mài) 110 钽(dá) 111 錀(lún) 112 (仍未有中文名)元素周期表表格说明周期表的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。





最新版本高中化学目录(2019年人教版) 最新版本高中化学目录(2019年人教版)
必修一
第一章物质及其变化
第一节物质的分类及转化
第二节离子反应
第三节氧化还原反应
单元小结
第二章海水中的重要元素——钠和氯
第一节钠及其化合物
第二节氯及其化合物
第三节物质的量
实验活动1 配制一定物质量浓度的溶液单元小结
第三章铁金属材料
第一节铁及其化合物
第二节金属材料
实验活动2 铁及其化合物的性质
单元小结
第四章物质结构元素周期律
第一节原子结构与元素周期表
第二节元素周期律
第三节化学键
实验活动3 同周期、同主族元素性质的递变单元小结
必修二
第五章化工生产中的重要非金属元素
第一节硫及其化合物
第二节氮及其化合物
第三节无机非金属材料
实验活动4 用化学沉淀法去除粗盐中的杂质离子实验活动5 不同价态含硫物质的转化
单元小结
第六章化学反应与能量
第一节化学反应与能量变化
第二节化学反应的速率与限度
实验活动6 化学能转化成电能
实验活动7 化学反应速率的影响因素
单元小结
第七章有机化合物
第一节认识有机化合物
第二节乙烯与有机高分子材料第三节乙醇与乙酸。

第一章 物质结构 元素周期表第一节 元素周期表一、周期表原子序数 = 核电荷数 = 质子数 = 核外电子数1、依据横行:电子层数相同元素按原子序数递增从左到右排列纵行:最外层电子数相同的元素按电子层数递增从上向下排列2、结构周期序数=核外电子层数 主族序数=最外层电子数短周期(第1、2、3周期) 周期:7个(共七个横行)周期表 长周期(第4、5、6、7周期) 主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素二.元素的性质和原子结构(一)碱金属元素:1、原子结构 相似性:最外层电子数相同,都为1个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2、物理性质的相似性和递变性:(1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K 反常) ②熔点、沸点逐渐降低 结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质(1)相似性:(金属锂只有一种氧化物)4Li + O 2 Li 2O 2Na + O 2 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑ 2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。
点燃 点燃 过渡元素结论:碱金属元素原子的最外层上都只有1个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。
(二)卤族元素:1、原子结构相似性:最外层电子数相同,都为7个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2.物理性质的递变性:(从F2到I2)(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(B r2反常)(3)单质的熔、沸点升高3、化学性质(1)卤素单质与氢气的反应:X2 +H2=2 HXF2Cl2Br2I2卤素单质与H2的剧烈程度:依次增强;生成的氢化物的稳定性:依次增强(HF 最稳定)(2)卤素单质间的置换反应2NaBr +Cl2=2NaCl + Br2氧化性:Cl2________Br2;还原性:Cl-_____Br-2NaI +Cl2=2NaCl + I2氧化性:Cl2_______I2;还原性:Cl-_____I-2NaI +Br2=2NaBr + I2氧化性:Br2_______I2;还原性:Br-______I-结论:F2 F-Cl2 Cl-Br2 Br-I2 I-单质的氧化性:从下到上依次增强(F2氧化性最强),对于阴离子的还原性:从上到下依次增强(I-还原性最强)结论:①非金属性逐渐减弱②原子结构的递变性导致化学性质的递变性。
第一章物质结构元素周期律第一节元素周期表学案门捷列夫简介门捷列夫(1834-1907)俄国化学家。
1834年2月7日生于西伯利亚托博尔斯克,1907年2月2日卒于彼得堡(今列宁格勒)。
1850年入彼得堡师范学院学习化学,1855年毕业后任敖德萨中学教师。
1857年任彼得堡大学副教授。
1859年他到德国海德堡大学深造。
1860年参加了在卡尔斯鲁厄召开的国际化学家代表大会。
1861年回彼得堡从事科学著述工作。
1863年任工艺学院教授,1865年获化学博士学位。
1866年任彼得堡大学普通化学教授,1867年任化学教研室主任。
1893年起,任度量衡局局长。
1890年当选为英国皇家学会外国会员。
门捷列夫的最大贡献是发现了化学元素周期律。
他在前人的基础上,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(相对原子质量)的递增而呈周期性的变化,这就是元素周期律。
他根据元素周期律于1869年编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。
元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。
1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。
一、元素周期表原子序数:按元素核电荷数由小到大的顺序给元素的编号。
如:氢元素的原子序数为1,镁元素的原子序数为12。
则:对任意元素的原子:原子序数核电荷数质子数核外电子数对任意元素的阳离子:原子序数核电荷数质子数核外电子数对任意元素的阴离子:原子序数核电荷数质子数核外电子数思考:1.画出1——2、3——10、11——18各元素的原子结构示意图,分别有什么相同之处?领会它们在元素周期表中的位置与它们原子结构的关系。
2.元素周期性表中第一列元素的原子结构示意图(见教材P5)有什么异同,领会它们在元素周期表中的位置与它们原子结构的关系。
一)、元素周期表编排原则:1、把相同的元素按原子序数递增的顺序由左到右排成一个横行。
2、把相同的元素按电子层数递增的顺序由上到下排成纵行。
二)、元素周期表的结构:1、周期:具有而又按照由左往右2、族:不同横行中的元素按顺序某些主族元素的别称:第Ⅰ族(除氢):碱金属元素:第Ⅱ族:碱土金属;第Ⅳ族:碳族元素;第Ⅴ族:氮族元素;第Ⅵ族:氧族元素;第Ⅶ族:卤族元素。
0族:稀有气体元素。
【课堂练习】1.主族元素在周期表中所处的位置,取决于该元素的(A)最外层电子数和原子量(B)原子量和核外电子数(C)次外层电子数和电子层数(D)电子层数和最外层电子数2.下列叙述错误的是(A)把最外层电子数相同的元素按电子层数递增排成8行(B)主族元素在周期表中的位置决定于该元素原子的电子层数和最外层电子数(C)元素周期表能体现元素间的某些联系(D)把电子层数相同的各元素按原子序数递增排成七个横行3.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。
如碱金属元素为第1列,稀有气体元素为第18列。
下列说法错误的是()A、第9列元素中没有非金属元素B、只有第2列元素原子最外层有2个电子C、第15列元素的最高价氧化物的化学式为R2O5D、在整个18列元素中,第3列的元素种类最多4.推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素:第13号元素:第34号元素:第53号元素:第88号元素:第82号元素:小结:①基本组成(行、列、周期、族);②上下,左右相邻元素序数的关系;③记1~36号元素;④主族元素的位置与原子结构的关系(周期序数=电子层数、主族序数=最外层电子数);⑤牢记短周期元素;⑥熟记主族元素和0族元素。
思考:元素在元素周期表中的位置与其原子的结构有密切的关系,即:同周期元素具有相同的电子层数,同主族元素具有相同的最外层电子数。
那么元素的性质与它在元素周期表中的位置有什么关系呢?同周期或同主族元素的性质具有哪些相似点?又有什么样的不同呢?二、元素的性质与原子结构1、碱金属元素思考:碱金属元素在元素周期表中的位置是: ;碱金属元素包括 ;它们在元素周期表是的位置与它们结构的关系是:(1)碱金属元素的原子结构思考:完成教材第5页“科学探究”,填写第5页表格①相同点:碱金属元素原子结构的 相同, 都为 。
②递变性:从Li 到Cs ,碱金属元素的原子结构中, 依次增多。
思考:元素性质主要取决于原子的最外层电子数,从碱金属原子的构可推知其化学性质如何?是否完全相同?最外层上都只有 电子,化学反应中易 而表现 ,形成 ,并能与氧气等非金属元素及水发生化学反应。
与我们已学过的 相似。
(2)碱金属元素的化学性质实验:取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。
同钠与氧气的反应比较。
钠、钾化学性质比较思考:根据实验讨论钠与钾的性质有什么相似性和不同性。
你认为元素的性质与他们的原子结构有什么关系?其余碱金属的性质又如何?碱金属元素原子的最外层都 电子,它们的化学性质 ,都能与氧气、水等反应 ①与O 2的反应: Li+ O 2= Li+ O 2==Na+O 2= Na+O 2==K 、Rb 、Cs 也能与氧气反应生成更为复杂的产物。
如钾与氧气在不同条件下反应可生成:K 2O 、K 2O 2、KO 2/。
△ △②与水的反应:Na + H2O K + H2ORb、Cs也能与水反应,但更。
碱金属与水反应的通式:R + H2O思考:某碱金属3.9g与足量水反应,生成氢气0.1g,则该金属是什么?小结:由于碱金属元素原子的最外层都电子,所以它们的化学性质,如都能与氧气、水等反应。
但从Li→Cs它们的化学性质,表现在与氧气、水等反应。
思考:请仔细思考,怎样解释碱金属元素在性质上的这种相似性和递变性?碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的,碱金属元素原子的电子层数逐渐,原子核对最外层电子的引力逐渐,原子失电子的能力逐渐。
元素的金属性逐渐,与水和氧气的反应越来越,生成的氧化物越来越。
最高价氧化物对应水化物的碱性越来越。
元素金属性强弱判断依据:①、根据金属单质与水或者与酸反应置换出氢的难易程度。
置换出氢越容易,则金属性越强。
如已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?②、根据金属元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。
如已知NaOH为强碱、Mg(OH)2为中强碱、Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?③、可以根据对应阳离子的氧化性强弱判断。
金属阳离子氧化性越弱,则元素金属性越强。
氧化性Al3+﹥Mg2+﹥Na+,则元素金属性顺序为或者:可以根据金属单质的还原性强弱判断。
金属单质还原性越强,则元素的金属性越强。
如A+B+=A++B,则A、B元素的金属性强弱为:(3)碱金属的物理性质思考:请认真阅读教材P7表1—1并比较碱金属元素单质的物理性质有何相似性和递变性?相似点:色,质地,密度,熔沸点递变性:从Li→Cs:碱金属元素单质的密度():熔沸点。
(4)碱金属元素的用途①.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机)。
②.液态钠可以做核反应堆的传热介质。
③.钾的化合物最大用途是做钾肥。
硝酸钾还用于做火药。
④.铷铯主要用于制备光电管、真空管。
铯原子钟是目前最准确的计时仪器。
2.卤族元素思考:卤族元素在元素周期表中的位置是:;卤族元素包括;它们在元素周期表是的位置与它们结构的关系是:(1)卤族元素的原子结构思考:根据卤族元素的原子结构,请你试着推测一下卤素音质在化学性质上的相似性的递变性。
你的依据是什么?①相似性:卤族元素原子结构的相同,都为。
因此它们在化学反应中易而表现。
与我们已学过的相似。
②递变性:卤族元素从上到下(F、Cl、Br、I),随着核电荷数的,卤族元素原子的电子层数逐渐,原子核对最外层电子的引力逐渐,原子得电子的能力逐渐,即性逐渐。
(2)卤族单质的物理性质思考:请认真阅读教材P8资料卡片并比较卤素单质的物理性质有何相似性和递变性?相似点:色,均为分子。
递变性:从F2→I2:卤族单质的物态;密度:熔沸点。
思考:卤素单质的物理性质与碱金属的物理性质相比有什么异同?特性一、常温下唯一呈液态的金属单质为,常温下唯一呈液态的非金属单质为。
特性二、碘受热易升华。
特性三、单质溴和单质碘较难溶于水而易溶于有机溶剂如四氯化碳(CCl4)溴水通常呈橙黄色,溴的有机溶液通常呈橙红色。
碘水通常呈褐色,碘的有机溶液通常呈紫红色。
(3)卤素单质的化学性质思考:①对比Cl2,写出Br2与Na 、Fe 反应的化学方程式。
②对比Cl2,写出F2、Br2、I2与H2 反应的化学方程式。
并预测它们与氢气反应的难易程度及反应的剧烈程度有何不同。
③对比Cl2,写出Br2、I2与H2O 反应的化学方程式。
小结:(1)卤素单质与H2化合的难易关系:(2)卤化氢的稳定性关系:根据卤素单质与氢气反应的难易程度说明从F2到I2它们的性逐渐增强,正是因为如此,它们的产物即氢化物的稳定性逐渐。
2)、与水反应Cl2+H2O = HCl+HClO Br2+H2O = HBr+HBrO I2+H2O = HI+HIO但2F2+2H2O=4HF+O2(特例)通式:X2+H2O = HX+HXO(X:Cl、Br、I)思考:把氯水滴加到碘化钾溶液中可能出现什么现象?为什么?加入CCl4充分振荡后又可出现什么现象?为什么?在此基础上完成教材P9实验表格3)卤素间的相互置换思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序结论:氧化性:还原性:小结1.卤素原子结构的相似性,决定了单质化学性质的相似性:与金属反应,生成卤化物;与氢气反应,生成卤化氢;与水反应,生成卤化氢和次卤酸。
2.卤素原子结构的差异性,决定了单质化学性质的差异性和递变性:与氢反应的能力渐弱;氢化物的稳定性渐弱3.特性碘遇淀粉显蓝色;2Fe3++2I-=2Fe2++I2氟气和水的反应:2F2 +2H2O=4HF+ O2元素非金属性强弱判断依据:①、根据非金属单质与氢气化合的难易程度或氢化物的稳定性。
与氢气化合越容易或氢化物越稳定,则非金属性越强。
②、根据非金属元素最高价氧化物对应水化物酸性强弱。
酸性越强,则非金属元素的非金属性越强。
③、可以根据对应阴离子的还原性性强弱判断。