辽宁省鞍山市第一中学高中化学 第二章 分子结构与性质 第二节 分子的立体构型配合物学案(无答案)新人
- 格式:doc
- 大小:58.00 KB
- 文档页数:3





辽宁省鞍山市第一中学高三化学复习分子的立体构型专项练习题
辽宁省鞍山市第一中学高三化学复习分子的立
体构型专项练习题
分子结构在很大程度上影响了化学物质的反应性、极性、相态、颜色、磁性和生物活性,以下是分子的立体构型专项练习题,查字典化学网希望对考生有帮助。
1、10毫升某种气态烃,在50毫升氧气里充分燃烧,得到液态水和体积为35毫升的混和气体(所有气体体积都是在同温同压下测定的),则该气态烃可能是
A、甲烷
B、乙烷
C、丙烷
D、丙烯
某混合烃由两种气态烃组成,取2.24L混合气燃烧后,得3.36LCO2和3.6g水,则关于混合烃的组成判断正确的是(气体体积均在标准状况下测定) ( )
A.一定含甲烷
B.一定有乙烷
C.一定是甲烷和乙烯的混合
气体 D.可能是甲烷和丙炔的混合气体
1.25g / L一定体积的该烃完燃烧生成4.48LCO2和3.6g水,求该烃的分子式。
8、若A是相对分子质量为128的烃,则其分子式只可能是______或______.
9、某含碳、氢、氧三种元素的有机物,其C、H、O的质量比为6︰1︰8,该有机物蒸气的密度是相同条件下氢气密度的30倍,求该有机物的分子式。
3、。

第二章分子结构与性质第二节分子的立体构型第2课时分子的立体构型(2)知识归纳一、杂化轨道理论简介1.杂化轨道理论杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体构型提出的。
(1)轨道的杂化在形成多原子分子时,中心原子价电子层上的某些_____________________发生混杂,重新组合成一组新的轨道的过程。
注意:双原子分子中不存在杂化过程。
(2)杂化轨道杂化后形成的新的能量相同的一组原子轨道,叫做杂化原子轨道,简称杂化轨道。
2.杂化轨道的类型(1)sp3杂化sp3杂化轨道是由1个s轨道和3个p轨道杂化而得。
sp3杂化轨道间的夹角是________,立体构型为正四面体形。
如图1所示。
图1CH4分子的形成过程:碳原子2s轨道中1个电子吸收能量跃迁到2p空轨道上,这个过程称为激发,但此时各个轨道的能量并不完全相同。
于是1个2s轨道和3个2p轨道混杂起来,形成能量相等、成分相同的4个sp 3杂化轨道(其中每个杂化轨道中s 成分占1/4,p 成分占3/4),如图2所示。
图2 CH 4分子中碳原子的杂化4个sp 3杂化轨道上的电子间相互排斥,使4个杂化轨道指向空间距离最远的正四面体的4个顶点,碳原子以4个sp 3杂化轨道分别与4个氢原子的1s 轨道形成4个C —H σ键,从而形成CH 4分子。
由于4个C —H 键完全相同,所以形成的CH 4分子为正四面体形,键角是109°28',如图3所示。
图3(2)sp 2杂化sp 2杂化轨道是由1个s 轨道和两个p 轨道混杂而成的。
sp 2杂化轨道间的夹角是_______,呈平面三角形(如图4所示)。
图4 sp 2杂化BF 3分子的形成过程:硼原子的电子排布式为1s 22s 221p x ,硼原子的1个2s 电子激发到1个空的2p 轨道中,使硼原子的电子排布式为1s 22s 121p x 21p y 。
硼原子的2s 轨道和两个2p 轨道混杂成3个sp 2杂化轨道,硼原子的3个sp 2杂化轨道分别与3个氟原子的各1个2p 轨道重叠形成3个sp 2−p σ键,由于3个sp 2杂化轨道在同一平面上,而且夹角为120°,所以BF 3分子具有平面三角形结构(如图5所示)。




高中化学第二章分子结构与性质第二节分子的立体构型(第2课时)第2课时杂化轨道理论配合物理论【目标导航】1了解杂化轨道理论的基本内容,能够根据杂化轨道理论确定简单分子的三维构型。
2.能够正确描述配位键的概念及其形成条件;能够分析配合物的形成和应用。
3.熟悉几种常见配位离子的颜色和性质:[Cu(H2O)4],[Cu(NH3)4],[Fe(SCN)2],[Ag(NH3)2]等。
拼十年寒窗挑灯苦读不畏难;携双亲期盼背水勇战定夺魁。
如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。
2+2+++一、混合轨道理论1.用杂化轨道理论解释甲烷分子的形成当CH4分子形成时,碳原子的一个2S轨道和三个2p轨道混合形成四个能量相等的SP 杂化轨道。
四个SP杂化轨道与四个H原子的1s轨道重叠形成CH4分子,因此四个C-H键是相同的。
可以表示为3三2.杂化轨道的类型与分子构型的关系(1)sp杂化SP型杂化轨道由s轨道和p轨道组成。
轨道之间的夹角为180°,这是线性的,例如becl 2分子。
(2) SP杂种sp杂化轨道是由一个s轨道和两个p轨道组合而成的,杂化轨道间的夹角为120°,呈平面三角形,如:bf3分子。
(3)sp杂化SP杂化轨道由一个s轨道和三个p轨道组成。
SP杂化轨道之间的夹角为109°28'。
空间构型为四面体,如CH4分子。
[讨论]1.用杂化轨道理论分析nh3呈三角锥形的原因。
三3322给出了NH3分子中N原子的价电子排列图3、1条2S轨道和3条2p轨道化后,形成4个sp杂化轨道,其中3个杂化轨道中是单电子,分别与3个h原子形成σ一键,一个杂化轨道中是成对电子,不形成共价键。
sp杂化轨道应为正四面体构型,但由于孤电子对不形成化学键,故nh3分子为三角锥形。
2.原子轨道杂化后,数量和能量有什么变化?答:杂化轨道的数量与杂化原子轨道的数量相同,但能量不同。
2018-2019学年高中化学第二章分子结构与性质第2节分子的立体构型第1课时分子空间结构与价层电子对互斥理论课堂达标验收新人教版选修3编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018-2019学年高中化学第二章分子结构与性质第2节分子的立体构型第1课时分子空间结构与价层电子对互斥理论课堂达标验收新人教版选修3)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018-2019学年高中化学第二章分子结构与性质第2节分子的立体构型第1课时分子空间结构与价层电子对互斥理论课堂达标验收新人教版选修3的全部内容。
第二章第二节第1课时分子空间结构与价层电子对互斥理论1.下列分子的空间构型是直线形的是( B )A.CH4B.C2H2C.BF3D.H2O解析:CH4分子的空间构型是正四面体;BF3分子的空间构型是平面三角形;H2O分子的空间构型是V形。
2.下列分子或离子的中心原子,带有一对孤电子对的是( D )A.H2O B.BeCl2C.CH4D.PCl3解析:H2O有2对孤电子对,BeCl2和CH4没有孤电子对。
3.用价层电子对互斥模型预测H2S、BF3的空间构型,两个结论都正确的是( D )A.直线形、三角锥形B.V形、三角锥形C.直线形、平面三角形D.V形、平面三角形解析:硫原子最外层有孤电子对,故H2S为V形结构;BF3分子中硼原子最外层电子全部参与成键,三个B-F键等效排斥,故分子的空间构型为平面三角形.4.据报道,大气中存在一些潜在的温室气体SF5-CF3,虽然其数量有限,但它是已知气体中吸热最高的气体.关于SP5-CF3的说法正确的是( C )A.分子中有σ键也有π键B.所有原子在同一平面内C.CF4与CH4都是正四面体结构D.0。
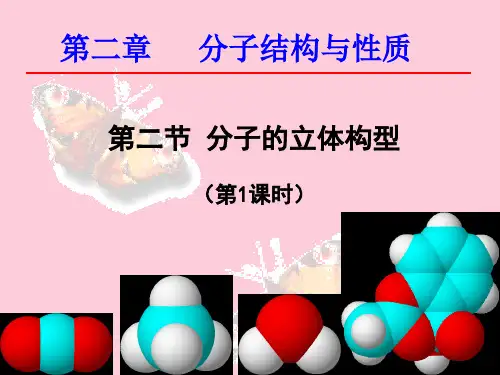
分子的立体构型
写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
一、形形色色的分子
展示CO2、 H2O、 NH3、CH2O 、 CH4分子的球棍模型(或比例模型);
二、价层电子对互斥理论()( Valence Shell Electron Pair Repulsion )
1、理论内容
(1)共价分子或离子的立体构型主要取决于。
(2)价层电子对包括
(3)价层电子对各自占据的位置倾向于彼此分离得尽可能的,此时电子对之间的斥力,整个分子最。
2、VSEPR的应用——预测分子或离子的立体构型
⑴确定中心原子价层电子对数目
价层电子对数=+
σ键电子对数=
孤电子对数=
a:
x:
b:
注意(1) 离子孤电子对数 =
(2) 孤电子对数出现分数时,
⑵确定价层电子对的空间构型
空间构型中价层电子对的排列遵循;
(3)确定分子的空间构型:
略去VSEPR模型中的即可得分子的空间构型
适用范围:主族元素单中心分子或离子。