2005年全国高中学生化学竞赛级赛区备用试题
- 格式:doc
- 大小:209.00 KB
- 文档页数:8

・56・化学教育2005年第4期2005年全国高中学生化学竞赛决赛理论试题参考答案与评分标准上海市化学化工学会华东理工大学命题组第1题0lIl一1x的结构式:Ho一卜NH20Ox的化学名称氨基磺酸。
(答磺酸酰胺也可。
)1—2化学方程式:2H2S04+CO(NH2)2==一H3N03S+NH4HS04+C02l一3化学方程式:H3N03S+HCl+NaN02一N2+H2S04+NaCl+H201—4化学方程式:H5106+2I一+H+—==12+103一+3H20103一+5I一+6H+===-312+3H201—5注入甲醇的作用:注入甲醇与水形成氢键后破坏了油气分子与水分子形成的包合物。
第2题2—1http://wlww.ccs.ac.cn/uploadjs/38st.doc2—2有旋光性的异构体是编号为D、E的异构体。
2—3取代速率最慢的是编号为D的异构体。
你对这种性质的理解是:对于D,当负一价阴离子取代氯时,无论从上方,还是从下方进攻中心co”时,均受到甲基空间的位阻,因此,取代的速率最慢。
第3题3—1http://www.ccs.ac.cn/uploadjs/38st.doc3—2化学式:LiCoO,。
3—3晶胞里有三个锂原子,三个钴原子和』个氧原子。
3—4电极反应方程式:Ij。
一;c。
o:+菇“++算e一堂皇“c。
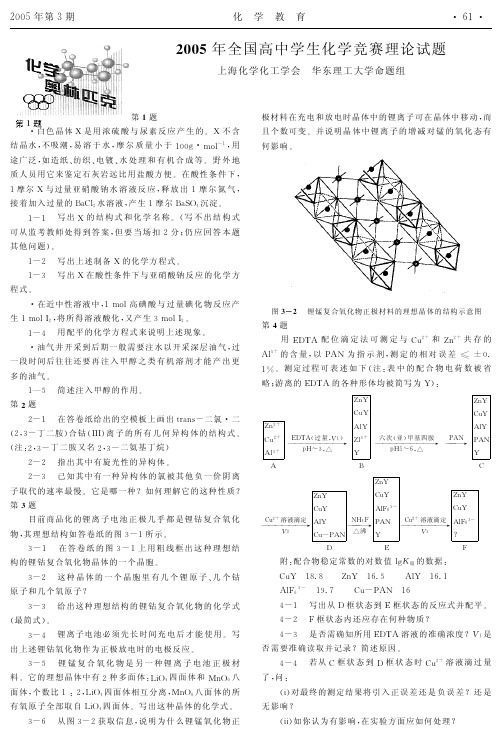
o:(理想)3—5化学式:“Mn2043—6相邻“+离子之间有多个未填“+离子的八面体及四面体空隙,在电场的作用下,形成“离子通道”。
充电时,锂锰氧化物中部分Li+离子沿着“离子通道”移出晶体,晶体中锂离子的个数减少,Mn的氧化态升高。
当放电时,“+离子沿着““+离子通道”从电解质流回锂锰氧化物晶体,晶体中锂离子的个数增加,Mn的氧化态降低。
.‘.充电时,放出并“+,b+离子沿着如图3—2的箭头方向从Li+离子通道流向电解质。
第4题4一lAlY一+6F一=AlF63一+Y4一Cu—PAN+Y4一=CuY+PAN4—2还应存在Cu—PAN。

年全国高中化学竞赛(安徽赛区)初赛试题(考试时间3小时,满分150分)H 1.008 元素周期表He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-La注意:答案必须写在答题卷上,写在试题卷上无效......................。
一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意。
若该题只有1个选项合题意,多选或错选均不得分。
若该题有2个选项合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
⒈我国有些煤矿的坑道中具有丰富的可燃性气体。
目前已建成利用坑道气的发电厂,这样既充分利用了能源,又保证了煤矿的安全生产,坑道中的可燃性气体是A.H2B.COC.CH4D. CH4和CO的混合气体⒉A是烷烃,B是单烯烃,B分子中的碳原子数比A分子中多。


磋砣莫遗韶光老,人生惟有读书好中国化学会2005年全国高中学生化学竞赛(省级赛区)备用试题(2005年10月9日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第一题(12分)将H2O2慢慢加入到SbF5的HF溶液中得一白色固体A,A是一种盐类,其阴离子呈八面体结构。
1.A的结构简式,生成A的化学方程式。
2.A不稳定,能定量分解,B是产物之一,其中亦含有八面体结构,B的结构简式为。
3.若将H2S气体通入SbF5的HF溶液中,则得晶体C,C中仍含有八面体结构,写出C的结构简式。
生成C的化学反应方程式是。
4.将H2O2滴入液氨中得白色固体D,D是一种盐,含有正四面体结构,写出D的结构式和生成反应方程式。
5.比较H2O2和H2S的性质异同。
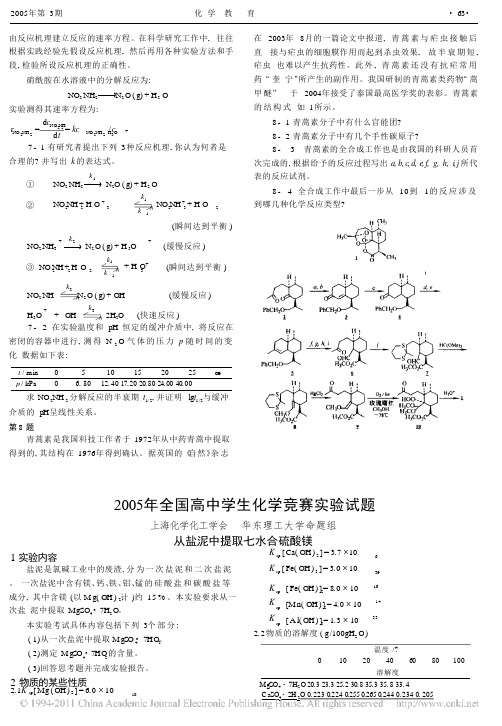
第二题(12分)锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。
下图为锂电池工作原理图,阴极材料由LiMO2(M=Co,Ni,V,Mn)构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:(-)C n/LiClO4/LiMO2(+)1.写出锂电池充放电时的可逆电极反应。
2.根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
3.锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
4.早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?第三题(10分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。
“南化·福达杯”2005年全国高中学生化学竞赛(江苏赛区)预赛试题相对原子质量:H :1.01 C :12.01 N :14.01 O :16.00 Na :22.99 S :32.06 K :39.10Ca :40.08 Cu :63.55 Br :79.90 Y :88.91 Ag :107.9 I :126.9 Ba :137.31.本试卷共26题,用2小时完成,全卷共150分; 2.可使用计算器。
一、选择题(每小题有1~2个选项符合题意;每题4分,共15题,共60分)1.2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节的蛋白质降解机理。
蛋白质降解时发生了( )A .氨基酸的酯化反应B .肽键的水解反应C .碳氧键的断裂D .碳氮键的断裂2.过氧苯甲酸(C O O H O)与H 2O 2的分子结构中都有“O O ”。
过氧苯甲酸可作为食品漂白剂,但它能破坏食品中的维生素C(俗名抗坏血酸)、维生素E(俗名生育酚)等从而降低食品的营养价值,这个过程主要应是维生素C 、维生素E 等 ( )A .酸性被中和B .碱性被中和C .被氧化D .被还原3.痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO 3显现法就是其中的一种:人的手上有汗渍,接触过白纸后,手指纹线就留在纸上。
如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。
则①②③的化学式是 ( )A .①AgNO 3 ②NaBr ③AgBrB .①AgNO 3 ②NaCl ③AgClC .①AgCl ②AgNO 3 ③NaClD .①AgNO 3 ②NaI ③AgI4.下列操作或实验数据记录正确的是 ( )A .1mol/L 的AgNO 3溶液和1mol/L 的KI 溶液混合制碘化银胶体B.用标准NaOH溶液滴定未知浓度的盐酸用去NaOH溶液23.10mLC.用pH试纸测得氯水的pH为2D.在试管中制备Fe(OH)2时,将吸有NaOH溶液的滴管插入试管里FeSO4溶液的底部5.下列说法正确的是( )A.Na2O2、Na2O均能吸收CO2并放出氧气B.Mg、A1、Fe均能在冷的浓硝酸中钝化C.SO2和C12的漂白原理相同D.SiO2既能与NaOH又能与Na2CO3反应生成Na2SiO36.下列哪种物质的中心原子的最外层不是8电子结构( )A.CO2B.NF3C.PF5D.OF27.Al(OH)3是一种难溶于水的物质,只要溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10mol/L AlCl3不产生沉淀的最大OH-物质的量浓度(mol/L)为( )A.1.9×10-33B.2.7×10-11C.8.7×10-8D.1.2× 10-118.某溶液可能含有Na+、Ag+、A13+、AlO2-、S2-、CO32-、SO32-、NO3-等离子中的数种。
2005年北京市高中学生化学竞赛试题(高中二年级)·竞赛时间2小时。
迟到超过30分钟者不得进场。
1小时内不得离场。
时间到,把答题纸及试题纸(背面向上)放在桌面上,立即离场。
·竞赛答案全部写在答题纸上,使用黑色或蓝色圆珠笔、签字笔或钢笔答题,使用红色或铅笔答题者,试卷作废无效。
·姓名、准考证号和所属区、县、学校必须填写在答题纸上方指定位置,写在他处者按废卷处理。
·允许使用非编程计算器及直尺等文具。
·答题纸按密封线封装。
第一题单选或多选题(共24分)(选对一个答案得2分,多选一个错误答案扣1分)1.体积、物质的量的浓度均相等的NaCl和NaF两份溶液中阴离子总数关系正确的是。
A) 前者多B) 后者多C) 相等D) 无法判断2.大量生产次氯酸钠(漂白液)的主要方法是。
A)电解NaCl水溶液制取Cl2气后通入NaOH水溶液B)电解NaCl水溶液直接得到NaClO水溶液C)浓盐酸和MnO2反应制取氯气后通入NaOH水溶液D)浓盐酸和KMnO4反应制取氯气后通入NaOH水溶液3.导电仪测得液态BrF 3具有微弱的导电性,表示BrF 3液体中有阴、阳离子X 和Y 。
X 和Y 也存在于BrF 2SbF 6、KBrF 4、(BrF 2)2SnF 6等化合物中,则下列的电离式正确的是 。
A) BrF 3Br 3+ + 3F - B) BrF 3BrF 2+ + FC) 2BrF 3BrF 2+ + BrF 4- D) 2BrF 3BrF 4- + Br 3+ + 2F -4.美国Gokel 教授研制了氧化还原型电控分子开关——蒽醌套索醚电控开关。
它是使冠醚“胳膊”阴离子化,从而加强对流动阳离子的束缚力,达到“关”的作用。
下列说法正确的是 。
A )[a]过程是氧化反应B )通过[b]过程达到“开启”状态C )A 为“关闭”状态D )A 的分子式为C 25H 30O 85.a mol 铁粉和硫粉b mol 混合均匀(a ≠ b),隔绝空气加热充分反应。
湖南省2005年高中学生化学竞赛试卷(2005.9.3)(时量:150分钟满分150分)特别提醒:完成本卷不得使用计算器。
可能用到的相对原子质量: H(1) C(12) N(14) O(16) S(32)C1(35.5) K(39) Na(23) Cu(64) Fe(56)一、选择题(本题共16分,每小题2分。
每小题只有1个选项符合题意)1.2005年6月5日是第34个世界环境日,联合国环境署确定今年的活动主题是“营造绿色城市,呵护地球家园”,我国环保总局确定的主题是“人人参与,创建绿色家园”。
下列措施不符合...这一主题的是 ( ) A.推广垃圾分类存放,分类回收,分类处理B.改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排人空气的做法,采用先开采和综合利用煤层气,然后再采煤的方法C. 推广使用液化石油气(LPG)替代汽油和柴油作公交车和出租车的燃料D.将工厂的烟囱造高,以减少工厂周围的大气污染2.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种粒子是由3个氢原子核(只有质子)和2个电子构成。
对于这种粒子,下列说法中正确的是 ( ) A.是氢的一种新的同分异构体 B.是氢的一种新的同位素C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核3.香皂一般呈碱性,长期用香皂洗脸容易造成面部油脂层破坏,皮肤老化;而洗面奶一般呈弱酸性,和皮肤酸碱性相似,有利于皮肤健康。
“蔓秀雷登”推出了新型化妆品——活性炭男士洗面奶,针对男士面部毛孔粗大容易吸纳污垢而开发,此产品主要利用了活性炭 ( ) A.具有还原性 B.具有漂白性 C.具有吸附性 D.具有弱酸性4.下列关于胶体的认识错误的...是 ( ) A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,此白色沉淀可溶于清水B.将一束强光通过淀粉溶液,也能产生丁达尔现象C.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带有电荷D.纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体5.生活中的问题常涉及到化学知识,下列叙述中正确的是 ( ) A. 铁制品在干燥的空气中易生锈B.使用明矾可以对水进行消毒、杀菌C.硫酸钡难溶于水和酸,可作X光透视肠胃的药剂D.棉花、蚕丝和人造丝的主要成分是纤维素6.食品安全是近期的焦点问题。
2005年全国高中学生化学竞赛(省级赛区)备用试题第一题(12分)将H2O2慢慢加入到SbF5的HF溶液中得一白色固体A,A是一种盐类,其阴离子呈八面体结构。
1.A的结构简式,生成A的化学方程式。
2.A不稳定,能定量分解,B是产物之一,其中亦含有八面体结构,B的结构简式为。
3.若将H2S气体通入SbF5的HF溶液中,则得晶体C,C中仍含有八面体结构,写出C的结构简式。
生成C的化学反应方程式是。
4.将H2O2滴入液氨中得白色固体D,D是一种盐,含有正四面体结构,写出D的结构式和生成反应方程式。
5.比较H2O2和H2S的性质异同。
第二题(12分)锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。
下图为锂电池工作原理图,阴极材料由LiMO2(M=Co,Ni,V,Mn)构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:(-)C n/LiClO4/LiMO2(+)1.写出锂电池充放电时的可逆电极反应。
2.根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
3.锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
4.早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?第三题(10分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。
在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。
如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。
1.推测Al2O3基质中掺入Cr3+的发光原理。
2.Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。
第四题(8分)本题涉及4种组成不同的配合物,它们都是平面正方形结构。
1.PtCl2·2KCl的水溶液与二乙硫醚(Et2S)反应(摩尔比1︰2)得到两种结构不同的黄色配合物,该反应的化学方程式和配合物的立体结构是:2.PtCl2·2KCl的水溶液与足量Et2S反应获得的配合物为淡红色晶体,它与AgNO3反应(摩尔比1︰2)得到两种组成不同的配合物,写出上述两个反应的化学方程式。
第五题(10分)氯化钯是一种重要的催化剂,在石油化工和汽车尾气转化中应用广泛,从工业废料中提取钯通常得到的物料是二氯二氨合钯,然后再用复杂的工艺得到氯化钯,并且环境污染严重,转化率低。
2005年有人报道制取的新工艺,过程较简单,无污染,直收率99%,产品纯度>99.95%。
1.在二氯二氨合钯中加入一定量的水和盐酸,加热至100℃得澄清溶液A。
写出该反应的化学方程式:2.于上述A的热溶液中加入一定量的氯酸钠溶液,继续加热溶液有气体逸出,得溶液B,写出该反应的化学方程式,此时钯以何形式存在?3.在溶液B中加入10% NaOH溶液调节pH=10,保持溶液温度在100℃左右得沉淀C。
如溶液PH>10,上清液中钯含量升高。
分别写出溶液B中生成沉淀C及上清液中钯量又升高的化学反应方程式。
4.在C中加入浓盐酸加热至100℃浓缩直至蒸干,再在120℃下烘5小时。
写出发生的化学反应方程式。
第六题(10分)1.给出下列四种化合物的化学名称A:COOH B:CH3CCH2CCH3O=O=A的名称:B的名称:C:NHOCH3D:CH3-C-CH3OOC的名称:D的名称:2.写出下列每步反应的主要产物(A、B、C)的结构式第七题(10分)20世纪60年代,化学家发现了一类酸性比100%的硫酸还要强的酸,称之为魔酸,其酸性强至可以将质子给予δ受体,CF3SO3H就是其中常见的魔酸之一。
1.试写出CH3CH3与CF3SO3H可能的反应式。
2.以上反应所得产物活性均很高,立即发生分解,试写出分解以后所得到的全部可能产物。
第八题(8分)熵是由德国物理学家克劳休斯于1865年首次提出的一个重要热力学概念。
统计物理学研究表明,熵是系统混乱度的量度。
熵增加原理的数学表达式是:(ds)U,V≥0。
其物理意义是:一个孤立系统的自发过程总是朝着熵增加的方向进行,即从有序走向无序。
而生命的发生、演化及成长过程都是从低级到高级、从无序到有序的变化。
这样看来把熵增加原理应用到生命科学中似乎是不可能的。
1.熵增加原理与达尔文进化论是否矛盾?说明理由。
2.初期的肿瘤患者可以治愈,而晚期癌症患者的肿瘤想要治愈是根本不可能的,用熵增加原理解释其原因。
第九题(12分)维生素C又称抗坏血酸,广泛存在于水果、蔬菜中,属于外源性维生素,人体不能自身合成,必须从食物中摄取。
其化学式为C6H8O6,相对分子量为176.1,由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,半反应为:C6H8O6=C6H6O6+2H++2e =0.18V因此,可以采用碘量法测定维生素C药片中抗坏血酸的含量。
具体实验步骤及结果如下:(1)准确移取0.01667mol/L的K2Cr2O7标准溶液10.00mL于碘量瓶中,加3mol/L H2SO4溶液10mL,10% KI溶液10mL,塞上瓶塞,暗处放置反应5min,加入100mL水稀释,用Na2S2O3标准溶液滴定至淡黄色时,加入2mL淀粉溶液,继续滴定至溶液由蓝色变为亮绿色。
平行三次实验,消耗Na2S2O3标准溶液平均体积为19.76mL。
(2)准确移取上述Na2S2O3标准溶液10.00mL于锥瓶中,加水50mL,淀粉溶液2mL,用I2标准溶液滴定至蓝色且30s不褪。
平行三次实验,消耗I2标准溶液平均体积为10.15mL。
(3)准确称取0.2205g的维生素C粉末(维生素C药片研细所得)于锥瓶中,加新煮沸过并冷却的蒸馏水100mL,2 mol/L HAc溶液10mL,淀粉溶液2mL,立即用I2标准溶液滴定至蓝色且30s不褪,消耗12.50mL。
(4)重复操作步骤(3),称取维生素C粉末0.2176g,消耗I2标准溶液为12.36mL;称取维生素C粉末0.2332g,消耗I2标准溶液为13.21mL。
根据以上实验结果计算出该维生素C药片中所含抗坏血酸的质量分数。
第十题(8分)有一固体化合物A(C14H12NOCl),与6mol/L盐酸回流可得到两个物质B(C7H5O2Cl)和C(C7H10NCl)。
B与NaHCO3溶液反应放出CO2。
C与NaOH反应后,再和HNO2作用得黄色油状物,与苯磺酰氯反应生成不溶于碱的沉淀。
当C与过量CH3Cl加热反应时,得一带有芳环的季铵盐。
推出A、B、C的可能结构式。
参考答案第一题(12分)1.[H3O2]+[SbF6]-(2分)H2O2+HF+SbF5=[H3O2]+[SbF6]-(1分)2.[H3O]+[SbF6]-(2分)3.[SH3]+[SbF6]-(2分)H2S+HF+SbF5=[SH3]+[SbF6]-(1分)4.[NH4]+[HOO]-(2分)H2O2+NH3=[NH4]+[HOO]-(1分)5.H2O2既是酸又是碱,H2S是一种碱(1分)第二题(12分)1.Cathode:LiMO2=Li1-x MO2+x Li++x eAnode:nC+x Li++x e=Li x C n正反应为充电、逆反应为放电反应。
(4分)2.O:立方面心密堆积;Li和M占据八面体空隙;(1分)以氧为顶点的一个晶胞表示如下:(2分)3.(3分)4.锂活泼,易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。
(1分)还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3)用有机溶剂不能含水),以及固体电解质等。
(1分)第三题(10分)1.Al3+和O2-是满壳层电子结构,能隙大,电子不易激发,故无色;(2分)掺入的Cr3+是过渡金属,具有3d电子,在晶体中置换部分Al3+形成较低的激发态能级,两个强吸收带分别吸收黄绿色及蓝色的光,只有红光透过,因而掺Cr3+的刚玉呈绚丽的红色,称为红宝石。
(3分)2.(4分)Y 的O 的配位数为6,O 的Y 配位数为4。
(1分)第四题(8分)1.PtCl 2·2KCl +2Et 2S =[Pt(Et 2S)2 Cl 2]+2KCl (2分) Cl SEt 2 ClPt Cl PtCl SEt 2 SEt 2 SEt 2顺式 反式 (各0.5分)2.2PtCl 2·2KCl +4Et 2S =[Pt(Et 2S)4][PtCl 4]+4KCl (3分)[Pt(Et 2S)4][PtCl 4]+2AgNO 3=Ag 2[PtCl 4]+[Pt(Et 2S)4](NO 3)2(2分)第五题(10分)1.Pd(NH 3)2Cl 2+2HCl =(NH 4)2[PdCl 4](2分)2.6ClO 3-+10NH 4+=3Cl 2+5N 2+18H 2O +4H +(2分)钯以H 2PdCl 4形式存在(1分)3.H 2PdCl 4+4NaOH =Pd(OH)2↓+4NaCl +2H 2O (2分)过量NaOH 与部分Pd(OH)2发生反应:Pd(OH)2+2NaOH =Na 2[Pd(OH)4](2分)4.Pd(OH)2+2HCl =PtCl 2+2H 2O (1分)第六题(10分)1.A :2-(对-异丁基苯基)丙酸 或:布洛芬 B :2,4-戊二酮 或:乙酰丙酮 C :α-甲基丁二酰亚胺 D :丙酮缩乙二醇(各1分)2.A : B :CO 2C 2H 5COCH 3 C :O =O =(各2分)第七题(10分)1.CH 3+CF 3SO 3_CH 3CH 3+CF 3SO 3H (2.5分)CH 3CH 3+CF 3SO 3H CH 3CH 2H H +CF 3SO 3_(2.5分)(生成二电子三中心键)2.CH 3+CF 3SO 3_CH 4+CF 3SO 3CH 3(1分) (1分)CH 3CH 2H H+CF 3SO 3_2+CF 3SO 3CH 2CH 3+CH 2=CH 2(1分) (1分) (1分)第八题(8分)1.熵增加原理适用于孤立系统,而生命系统是一个开放系统,生物进化是一个熵变过程,生物的复杂性(种群系)与熵有关,生物进化的谱系越复杂,熵值就越大。
生物的组织化(个体结构)与信息有关。
谱系复杂化的分支衍生带来更大的进化突变空间,但是由于生物遗传的制约作用,使实际产生的状态数(种类数)比更大可能产生的状态数少,即实际熵比更大可能熵小。