上海高二化学8 金属及其化合物3(铝)讲义--教师版
- 格式:doc
- 大小:2.79 MB
- 文档页数:18

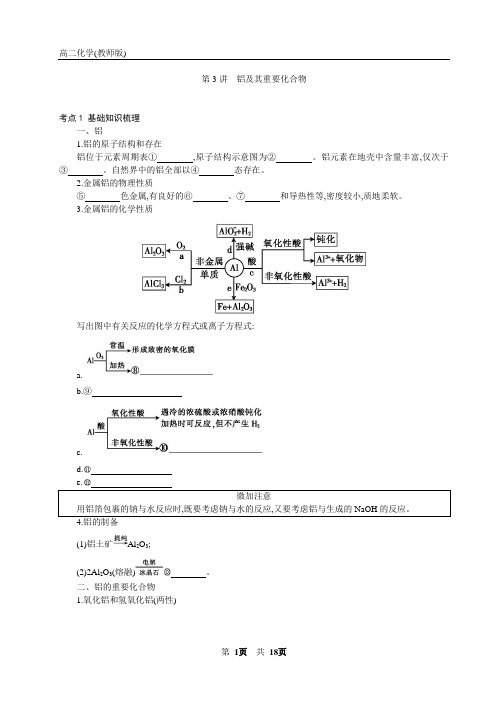
第3讲铝及其重要化合物考点1 基础知识梳理一、铝1.铝的原子结构和存在铝位于元素周期表①,原子结构示意图为②。
铝元素在地壳中含量丰富,仅次于③。
自然界中的铝全部以④态存在。
2.金属铝的物理性质⑤色金属,有良好的⑥、⑦和导热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式:a.b.⑨c.d.(1)铝土矿Al2O3;(2)2Al2O3(熔融)。
二、铝的重要化合物1.氧化铝和氢氧化铝(两性)氢氧化铝的电离:Al(OH)32.常见的铝盐——明矾(1)明矾的化学式为 ,属于复盐。
(2)明矾净水的原理明矾溶于水时发生电离,电离方程式为 ,其中Al 3+发生水解反应,产生 ,NN 反应:Al +HCO ↓+C 。
答案:①第三周期ⅢA族②③氧和硅④化合⑤银白⑥延展性⑦导电性⑧4Al+3O22Al2O3⑨2Al+3Cl22AlCl3⑩2Al+6H+2Al3++3H2↑2Al+2OH-+2H2O2Al+3H2↑2Al+Fe2O32Fe+Al2O34Al+3O2↑Al(OH)3+3H+Al3++3H2O Al2O3+2OH-2Al+H2O Al(OH)3+OH-Al+2H2OH++Al+H2O Al3++3OH-KAl(SO4)2·12H2OKAl(SO4)2K++Al3++2S Al(OH)3(胶体)【跟踪练习】1.下列说法不正确...的是()。
A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低B.铝与Fe2O3发生铝热反应后固体的质量不变C. Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O→2Al+3H2↑D. Al、HCl、NaOH中任意两种物质在一定条件下均能发生反应【解析】打磨后的铝箔在酒精灯上灼烧,表面生成Al2O3薄膜,高熔点的Al2O3薄膜兜住了熔融的液态铝,故液态铝不会滴落,A项错误;Al与Fe2O3发生铝热反应生成Fe和Al2O3,反应前后均是固体,根据质量守恒定律可知,B项正确;Al与NaOH溶液反应生成NaAlO2和H2,C项正确;Al既能与HCl反应又能与NaOH溶液反应,且HCl和NaOH能发生中和反应,D项正确。

8.2铝和铝合金的崛起第一课时铝和铝合金【教学目标】1.知识与技能(1)掌握铝的物理性质和用途。
(2)掌握铝的部分化学性质及铝热反应。
2.过程与方法(1)应用“结构决定性质”的化学思想,通过对铝原子结构的分析推测铝的化学性质,再通过实验进行验证。
(2)通过铝与氧气的反应、铝热反应等化学实验,初步了解通过化学实验来研究物质性质的科学方法。
3.情感态度与价值观(1)通过对铝与氧气的反应、铝热反应等实验现象的观察,激发对化学学科的兴趣,对科学的热爱(2)通过对铝和铝合金的重要用途的学习,体验化学知识在社会生产和日常生活中的重要作用。
【教学重点】理解铝的部分化学性质:铝与氧气反应,铝热反应。
【教学难点】理解“毛刷”实验。
【教材分析】本课内容选自高中化学上科版(2007年版)第八章第二节。
从教材的体系看本章“走进精彩纷呈的金属世界”是在学生系统学习了非金属元素及其化合物识后,集中学习金属元素及其化合物的知识,本节的学习是建立在物质结构理的基础上,重点研究铝和铝合金的性质和用途。
本课教学从铝和铝合金的用途出发,通过铝的原子结构的分析,推测铝可能具的化学性质,从实验的角度进一步学习铝和铝和铝合金的性质,教学重点是理铝的部分化学性质:铝与非金属单质的反应,铝热反应。
教学难点是理解“毛刷实验、铝热反应的反应原理。
【学情分析】学习本课之前,学生已经初步掌握了金属的性质,在上学期的学习中也了解了结构决定性质,性质决定用途的元素化学学习的基本方法,为本课学习铝和铝合金奠定了一定的基础学生们对于铝和铝合金非常熟悉,而且他们对于与生活联系紧密的知识总是特别感兴趣,因此我在学生已有的知识经验基础上,合理设置学习情境,引导学生参与、合作和交流,在主动的活动中完善认知结构,实现知识、能力和情感的生长和发展。
【教学设计说明】高中新课程的教学理念提倡以学生为主体的多样化教学方式,化学教学中可将创设丰富的学习情境来体现实验探究的研究型学习模式,体现学生学习的主体性。
学必求其心得,业必贵于专精
- 1 - 铝和铝合金的崛起
一、教学目的
1、 知识目标:
① 巩固铝及其重要化合物的有关性质。
② 理解勒夏特列原理的应用。
2、 情感目标:
① 引导学生积极参与解决问题的过程,提高学生的化学科学素养. ② 培养学生的科学探究的学习方法。
3、 能力目标:
① 培养学生理解生活中的化学问题的能力。
② 提高学生运用基本理论解决实际问题的能力.
二、重点、难点
用勒夏特列原理认识铝的重要化合物之间的转化关系。
三、教学过程
1、汇总学生收集的有关铝及其化合物用途的资料。
2
四、作业
查阅有关“金属的冶炼”的相关资料,总结金属的冶炼方法。
金属的物理通性与铝的
特性(如反光的特点 从氧化铝的形成探究铝
与其它金属的化学性质(通性与铝的特性) 氧化铝的两性(使用铝
锅可能引起摄入铝的量过多) 从胃舒平
与胃酸反
应揭示氢
氧化铝的
性质 的两性有无必然联系 H ++ AlO 2―+H 2O Al(OH )3Al 3++3OH ― (科学探究的学习过程) 铝的主要化合物的化学性质
离子方程式。

《铝和铝合金的崛起》教案一.教学目标知识技能:(1)掌握铝的物理性质;了解铝及其铝合金的用途。
(2)掌握铝跟非金属、水、酸、碱、盐及其某些金属氧化物反应的化学性质。
能力培养:通过系列实验活动,培养学生的观察能力、思维能力和动手能力。
科学思想和方法:让学生通过观察、实验、归纳、类比等方法,体验到化学活动的探索性与创造性,启发学习兴趣,培养学生勇于创新与实践的科学精神。
科学品质:(1)通过对铝的用途的介绍,激发学生的学习兴趣,使学生进一步认识化学与生产生活的密切联系。
(2)通过介绍我国铝资源的使用情况,增强学生的环保意识及其能源意识。
(3)通过金属铝的制备历史的介绍,使学生体验了化学学科发展对人类生活的影响,激发它们热爱化学、热爱科学、崇尚科学。
重点难点:铝的化学性质二.教学手段演示实验多媒体三.教学过程[引入新课] 图片展示(图一)这是一种新型材料----- 泡沫铝,它是将发泡剂加入到熔融铝合金中制成,其优点是密度小,比木材还轻,可浮在水面,又有很大的刚性和隔音保温的效果,是一种良好的建筑材料和轻质材料。
(图二)这是一款新型轿车------ 尼桑颐达,他在广告中的卖点是“宽敞的空间”和“全铝合金引擎”。
(图三)飞机、火车、汽车、船舶、导弹制造业,使用了各种铝合金,如一架超音速飞机70% 由铝合金构成,每枚导弹用铝量约占总量的10%--15% ,国外已有铝制火车轨道,而一艘大型船舶用铝量达2000 吨。
[教师] 通过这些图片,大家了解到了铝在高科技领域的广泛应用,除此之外,在我们身边,铝还有哪些应用呢?[学生讨论] 铝制炊具、铝合金门窗、铝制导线、铝用于药品、食品包装,反射镜等。
[教师] 展示铝的各种不同用途[设问] 的确,铝在我们身边无处不在,具有广泛的应用。
接下来再请大家思考一下图中的一些应用主要利用了铝的哪些性质?[学生讨论] 略[归纳] 铝的物理性质及其用途(略)[教师] 铝不仅可以促进科技发展日新月异,又和我们的生活息息相关,它是大自然赐予人类的宝物。

第03讲 铝及其化合物(1)一、知识梳理:1、铝的物理性质及用途:2、铝的化学性质:(1)铝是比较活泼的金属,在化学反应中较容易失去3个电子变成带3个单位正电荷的阳离子。
(2)铝原子结构示意图:(3)铝的氧化反应▲A1与O 2反应,发出耀眼的白光,生成Al 2O 3:4Al+3O 2−−−→高温2Al 2O 3 ▲铝的钝化:铝在__________________中发生钝化现象。
(4)铝与其他非金属单质反应:2Al+3C12−−−→点燃2Al C13 (5)铝热反应:2Al+Fe 2O 3−−−→高温_________;Al+Cr 2O 3−−−→高温_________ 【归纳】(1)铝粉与氧化铁的混合物叫做铝热剂。
(2)V 2O 5、Cr 203、Mn02能发生与氧化铁相似的铝热反应。
(3)工业上常利用铝热反应冶炼某些_________的金属。
(6)铝与热水反应:2Al+6H 2O ∆−−→2Al(OH)3+3H 2↑_________沉淀 (7)铝与盐酸、稀硫酸反应: 2Al+6HCl →2AlCl 3+3H 2↑ 2Al+3H 2SO 4(稀) →__________________ (8)铝与碱反应:2Al+6H 2O →2Al(OH)3+3H 2↑ ① AI(OH)3+NaOH →NaAlO 2+2H 2O ②反应①不易进行的原因是:a .Al 的金属性相对较弱.b .产生的AI(OH)3不溶于水覆盖在金属表面而阻止反应的进行。
由反应②可知AI(OH)3能溶于NaOH 溶液中,能促使反应①向右进行,所以Al 能与NaOH 溶液反应,将①与②相加可得总反应:可简写为:2Al+2NaOH+2H 2O →2NaAlO 2+3H 2↑【归纳】(1)铝与NaOH溶液反应时,H2O作为反应物参加反应。
(2)铝与碱反应过程中,AI(OH)3起_________作用;(3)铝制品不能用来存放_________的物质。
沪科版化学高二上8铝和铝合金一、铝1、铝的物理性质含量、自然存在、物理性质---(P13)2、铝的化学性质(1)Al的原子结构—化学性质爽朗(P14)(2)Al的化学性质·与Cl2(P15)·与O2及毛刷现象(P15)、·铝热反应、铝热剂、铝热反应原理及应用(P15)·与H2O(P16)·铝的两性:与HCl(P16)NaOH·与浓H2SO4HNO3的钝化·二、工业制法:2Al2O3 2Al + 3O2(电解)1、用途(P14)三、Al2O31、自然存在--矿铝土(混合物) 、刚玉(较纯洁)2、物理性质(P17)3、两性:与HCl: Al2O3 + 6H+ 2Al3+ +3H2ONaOH: Al2O3 + 2OH- 2AlO2- +H2O用矿铝土制纯洁A2O34用途四、Al(OH)31物理性质:白色,难溶于水,有吸附色素的作用2化学性质—两性·与HCl(P16) Al(OH)3 + 3H+ Al3+ +3H2O ·与NaOH(P16)Al(OH)3 +2OH- AlO2- +2H2O ·缘故:电离方程式H+ + AlO2- +H2O Al(OH)3Al3+ + 3OH-酸式电离碱式电离3实验室制法(可溶性盐和过量氨水)Al3+ + 3NH3·H2O Al(OH)3 + 3NH4+ 4用途五、铝盐·明矾:KAl(SO4)4·12H2O(复盐)AlCl3 Al2(SO4)3·明矾净水原理:KAl(SO4)2·12H2O +K+ +Al3+ +2SO42- +12H2O Al3+ +3H2O Al(OH)3(胶体)+3H+。
“铝的重要化合物”教学设计一.教学分析本节课是高二第一学期第8章第2节内容,“高中化学学科教学基本要求”中氢氧化铝的学习水平要求是B,是元素及其化合物知识的重要组成部分。
氧化铝、氢氧化铝的两性是高中元素化学的重点知识,是元素周期型递变规律的一大体现,本课的学习内容为元素周期律的学习进行了重要的铺垫。
本节课的重点是探究氢氧化铝的两性,而氧化铝的学习则是作为课后作业,让学生查阅资料完成归纳总结。
课堂上从实验观察、实验设计出发,理解氢氧化铝的化学性质,指导学生学会用实验解决问题的方法,通过分析对比、归纳总结来加深对氢氧化铝两性的认识。
本节课的教学内容,是基于学生已学习了认识了铝的存在和用途,掌握了铝的化学性质,他们必要的知识储备,再在教师的引导下,设计实验,学习氢氧化铝的两性。
学生喜欢自己动手进行实验操作,有较高的学习热情。
但是他们的学习往往容易停留在感性认识上,不善于动脑筋深入分析事物的本质。
学生的基础比较薄弱,动手操作能力不强,分析推理能力有待提升,还需要在教师指导下完成本节课的学习。
二.教学目标1.知识与技能(1)知道氢氧化铝的物理性质(2)理解氢氧化铝的化学性质(3)学会利用平衡移动知识来理解氢氧化钠化铝的两性2.过程与方法(1)通过设计简单的实验、观察实验现象来认识氢氧化铝的两性,体验科学探究的一般过程。
(2)理解氢氧化铝两性的实验探究过程,初步学会分析、比较、归纳。
3.情感态度与价值观(1)实验分组实验和实验设计,感触化学实验在化学研究中的重要性,体验实事求是的科学精神。
(2)用“定量”的观点看待硫酸铝溶液与氢氧化钠溶液反应,体验“量”对描述物质性质和变化的意义,感悟量变导致质变的辩证唯物主义观点。
三.教学重点和难点1.教学重点氢氧化铝的化学性质2.教学难点氢氧化铝两性的探究四.教学用品多媒体0.5mol/L 硫酸铝溶液、2mol/L 氢氧化钠溶液、2mol/L 盐酸、2mol/L 氨水、一次性吸管、试管五.教学流程1.流程图2.流程说明1引入:用红宝石和蓝宝石首饰图片引入课题,从学生日常生活中的所见激发他们的学习兴趣,另外最后可以引出作业内容—查阅资料归纳氧化铝的性质和用途,为第三课时做准备。
第3讲铝及其重要化合物考点1 基础知识梳理一、铝1.铝的原子结构和存在铝位于元素周期表①,原子结构示意图为②。
铝元素在地壳中含量丰富,仅次于③。
自然界中的铝全部以④态存在。
2.金属铝的物理性质⑤色金属,有良好的⑥、⑦和导热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式:a.b.⑨c.d.(1)铝土矿Al2O3;(2)2Al2O3(熔融)。
二、铝的重要化合物1.氧化铝和氢氧化铝(两性)氢氧化铝的电离:Al(OH)32.常见的铝盐——明矾(1)明矾的化学式为 ,属于复盐。
(2)明矾净水的原理明矾溶于水时发生电离,电离方程式为 ,其中Al 3+发生水解反应,产生 ,NN 反应:Al +HCO ↓+C 。
答案:①第三周期ⅢA族②③氧和硅④化合⑤银白⑥延展性⑦导电性⑧4Al+3O22Al2O3⑨2Al+3Cl22AlCl3⑩2Al+6H+2Al3++3H2↑2Al+2OH-+2H2O2Al+3H2↑2Al+Fe2O32Fe+Al2O34Al+3O2↑Al(OH)3+3H+Al3++3H2O Al2O3+2OH-2Al+H2O Al(OH)3+OH-Al+2H2OH++Al+H2O Al3++3OH-KAl(SO4)2·12H2OKAl(SO4)2K++Al3++2S Al(OH)3(胶体)【跟踪练习】1.下列说法不正确...的是()。
A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低B.铝与Fe2O3发生铝热反应后固体的质量不变C. Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O→2Al+3H2↑D. Al、HCl、NaOH中任意两种物质在一定条件下均能发生反应【解析】打磨后的铝箔在酒精灯上灼烧,表面生成Al2O3薄膜,高熔点的Al2O3薄膜兜住了熔融的液态铝,故液态铝不会滴落,A项错误;Al与Fe2O3发生铝热反应生成Fe和Al2O3,反应前后均是固体,根据质量守恒定律可知,B项正确;Al与NaOH溶液反应生成NaAlO2和H2,C项正确;Al既能与HCl反应又能与NaOH溶液反应,且HCl和NaOH能发生中和反应,D项正确。
【答案】A2.下列说法正确的是()。
A.将氯化铝溶液滴入浓氢氧化钠溶液中,立刻产生大量白色沉淀B. Al2O3和MgO均可与NaOH溶液反应C. AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O→Al+4N+2H2OD.常温下,Al(OH)3既能与NaOH溶液反应又能与稀硫酸反应【解析】将AlCl3溶液滴入NaOH溶液中,开始时NaOH溶液过量,不会出现白色沉淀,随着反应不断进行将会有白色沉淀产生,A项错误;MgO是碱性氧化物,不能与NaOH溶液反应,B项错误;Al(OH)3不能与氨水反应,AlCl3中加入过量氨水,反应的离子方程式为Al3++3NH3·H2O→Al(OH)3↓+3N,C项错误;Al(OH)3是两性氢氧化物,常温下既能与NaOH溶液反应又能与稀硫酸反应,D项正确。
【答案】D3.科学家发明的透明坚硬的新型材料镁铝氧化物,可以用作显示器和手机屏幕。
下列有关镁和铝的说法正确的是()。
A.镁的金属性比铝弱B.镁和铝的氧化物都可以与盐酸反应C.镁和铝原子的最外层电子数都为3D.镁和铝的氧化物都可以与氢氧化钠溶液反应【解析】镁的金属性比铝强,A项错误;氧化镁、氧化铝都可以与盐酸反应,B项正确;镁和铝原子的最外层电子数分别为2和3,C项错误;镁和铝的氧化物中氧化镁是碱性氧化物,不能与氢氧化钠溶液反应,氧化铝是两性氧化物,可以与氢氧化钠溶液反应,D项错误。
【答案】B4.下列变化不可能...通过一步反应直接完成的是()。
A.Al(OH)3→Al2O3B.Al2O3→Al(OH)3C.Al→AlD.Al3+→Al(OH)3【解析】Al(OH)3加热分解可直接得Al2O3;Al与强碱溶液反应可得Al;Al3+与碱反应可生成Al(OH)3;Al2O3难溶于水,不能通过一步反应得到Al(OH)3,应将Al2O3与酸或碱反应得Al3+或Al,再与碱或酸反应,才能得到Al(OH)3。
【答案】B5.下列图像中,纵坐标为沉淀量,横坐标为某溶液中加入的反应物的物质的量,选择合适图像对应的序号填空。
(1)向AlCl3溶液中加入氨水至过量:。
(2)向AlCl3溶液中加入NaOH溶液至过量:。
(3)向AlCl3、MgCl2混合溶液中加入NaOH溶液至过量:。
(4)向澄清石灰水中通入过量CO2:。
(5)向含有少量盐酸的AlCl3溶液中加入过量NaOH溶液:。
(6)向含有少量HCl的AlCl3溶液中加入过量氨水:。
【答案】(1)③(2)⑥(3)①(4)②(5)⑤(6)④考点2 重难点探究一、铝与酸、碱反应的定量关系铝分别与盐酸、NaOH溶液反应的原理:2Al+6HCl→2AlCl3+3H2↑,2Al+2NaOH+2H2O→2NaAlO2+3H2↑。
(1)铝与酸或碱溶液反应的实质Al与酸、碱溶液反应,实质上都是Al3+,2H+,故铝与酸、碱溶液反应时,铝与氢气的关系可利用关系式:2Al~3H2进行计算,也可以直接利用得失电子守恒灵活计算。
(2)①等量的铝分别与足量盐酸和足量氢氧化钠溶液反应,产生H2的体积之比为1:1。
②足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生H2的体积之比为1:3。
例题1 甲、乙两烧杯中各盛有100 mL 3 mol·L-1盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积之比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为()。
A.5.4 gB.3.6 gC.2.7 gD.1.8 g【解析】2Al+6HCl→2AlCl3+3H2↑,2Al+2NaOH+2H2O→2NaAlO2+3H2↑,由化学方程式可知,若在等物质的量的盐酸和NaOH溶液中分别加入足量铝,反应时产生H2的体积之比为1∶3。
现产生H2的体积之比为1∶2,说明铝粉的量相对于盐酸来说是过量的,相对于NaOH来说是不足的,所以与盐酸反应的铝粉的质量为2.7 g,与NaOH反应的铝粉的质量为5.4 g。
故加入铝粉的质量为5.4 g。
【答案】A二、氢氧化铝两性的重要应用(1)检验与鉴别①用过量NaOH溶液检验Al3+的存在;②用过量NaOH溶液鉴别Al3+和Mg2+;③用互滴法鉴别Al3+与OH-、Al与H+。
(2)分离用过量的NaOH溶液和相应的酸溶液分离Al3+与Mg2+、Fe3+等离子或分离MgO、Al2O3。
(3)Al(OH)3的三种制备方法例题2 某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。
在一定条件下由甲可实现下图所示的物质之间的转化:请回答下列问题:(1)写出A、B、D的化学式:A,B,D。
(2)试剂a最好选用(填字母)。
A.NaOH溶液B.稀盐酸C.二氧化碳D.氨水(3)写出反应①的离子方程式:。
(4)固体E可以作为复合性的化学肥料,E中所含物质的化学式为。
【解析】由甲的成分可知B应为Al2O3,因此反应③是Al2O3通过电解而得到D(O2)和A(Al)。
甲加入水得到的溶液为明矾溶液,溶液中含有Al3+、K+和S,得到的沉淀为Al2O3、Fe2O3的混合物,再加入NaOH溶液,则Al2O3溶解,再通入CO2可以得到Al(OH)3沉淀。
试剂a应该为氨水,若加入的试剂a是NaOH 溶液,则加入的量不好控制,由此可推知E为K2SO4、(NH4)2SO4的混合物。
【答案】(1)Al;Al2O3;O2(2)D(3)Al2O3+2OH-→2Al+H2O(4)K2SO4、(NH4)2SO4三、有关氢氧化铝的图像分析1.四个基本图像(1)可溶性铝盐溶液与NaOH溶液反应的图像Al+3Al(2)偏铝酸盐溶液与盐酸反应的图像沉淀逐渐溶解时间后逐渐产生白色沉淀+Al2.拓展图像(1)向AlCl3溶液中逐滴加入氨水或NaAlO2溶液至过量,图像如图①所示。
(2)向NaAlO2溶液中逐滴加入AlCl3溶液或通入CO2至过量,图像如图②所示。
(3)向MgCl2、AlCl3和盐酸的混合溶液(即将Mg、Al溶于过量盐酸所得的溶液)中逐滴滴入NaOH 溶液至过量,图像如图③所示。
(4)向MgCl2、AlCl3混合溶液中先加入过量的NaOH溶液,后加入盐酸(NaOH与盐酸的物质的量浓度相等),图像如图④所示。
例题3C、Si AlN、现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示,下列说法正确的是()。
A.若Y是盐酸,则O a段转化为沉淀的离子只有AlB.若Y是盐酸,则溶液中可能含有的阳离子是Al3+C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-→Al+2H2OD.若Y是NaOH溶液,则X溶液中只存在四种离子:Al3+、Fe3+、N、Cl-【解析】因溶液是无色的,所以肯定不含Fe3+。
加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸而后者不能,由图像可知溶液中肯定含有Al、Si,O a段发生反应的离子为Al、Si,ab段发生反应的离子为C,bc段则是Al(OH)3的溶解,Al3+与这三种酸根离子是不共存的,A、B 两项均错误。
当向溶液中加入NaOH溶液时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是N与OH-发生反应,bc段是溶解生成的Al(OH)3沉淀,因Mg2+、Al3+不能与C、Si、Al共存,故此时溶液中的阴离子只有Cl-,则C项正确,D项错误。
【答案】C【跟踪练习】1.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是()。
A.AlCl3B.Na2OC.FeCl2D.SiO2【解析】由于Al3+与HC的水解相互促进,故两者不能大量共存,发生反应的化学方程式为Al3++3HC→Al(OH)3↓+3CO2↑,并且AlCl3可由Al和Cl2反应得到,A项正确;钠与氧气在常温下反应生成Na2O,Na2O与水反应生成NaOH,NaOH与Ba(HCO3)2反应只能生成沉淀,B项错误;尽管在Ba(HCO3)2溶液中加入FeCl2也有沉淀和气体生成,但Fe与Cl2反应生成的是FeCl3,不能生成FeCl2,C项错误;SiO2与Ba(HCO3)2不反应,D项错误。
【答案】A2.室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图所示,下列有关说法正确的是()。