04碘淀粉比色法测定唾液淀粉酶
- 格式:doc
- 大小:45.00 KB
- 文档页数:2


碘比色法测定淀粉含量
碘比色法是一种常用的测定淀粉含量的方法。
淀粉与碘形成复合物时,会呈现深蓝色的颜色,根据颜色的深浅可以推测淀粉的含量。
测定步骤如下:
1. 准备样品:将待测的样品(如食物、植物组织等)制成适当的浓度,使其能够被较为准确地测定。
2. 提取淀粉:采用热酸提取法或酶解法将样品中的淀粉提取出来。
其中热酸提取法是将样品加入盐酸或硫酸中,加热至淀粉糊状后进行提取。
酶解法则是使用淀粉酶将样品中的淀粉分解为葡萄糖后进行提取。
3. 碘溶液制备:制备适量的碘溶液,一般是用碘酸钾和碘化钾制备。
4. 反应:将提取的淀粉溶液与碘溶液混合,等反应一段时间后,观察溶液的颜色变化。
颜色越深,说明淀粉含量越高。
5. 分光光度计测定:使用分光光度计,将混合溶液置于光管中,通过比较混合溶液的吸光度与已知浓度淀粉溶液的吸光度,可以得出待测样品中淀粉的含量。
需要注意的是,测定淀粉含量时需保证操作准确,并根据测定
的样品选择适当的提取方法。
此外,测定时要排除其他物质对测定结果的干扰,如物质的颜色、光散射等。

唾液淀粉酶最适pH的测定【摘要】酶是具有高效催化能力的生物大分子物质,底物浓度相同时,酶的催化活性主要受温度、pH值等因素影响。
温度一定时,酶活力最高时的pH值为该酶在该温度的最适pH。
在不同pH值下,通过测定淀粉酶水解底物的程度,测定唾液淀粉酶的最适pH值。
在不同pH条件下,淀粉被唾液淀粉酶水解,与碘液反应呈现颜色反应,通过对颜色的观察和分光光度计测量产物吸光值的大小,可知底物的反应程度,从而可以判断出唾液淀粉酶的最适pH。
Enzymes are highly efficient catalytic ability of biological macromolecular material, phase at the same time, initial concentration of enzyme catalytic activity was mainly affected by factors such as temperature, pH value. At a certain temperature, the highest enzyme activity of enzyme in the pH value of the temperature of the optimum pH.Under different pH, by measuring the degree of hydrolysis enzyme substrates, determination of salivary amylase optimum pH value. Under the condition of different pH, starch is saliva amylase hydrolysis, and iodine liquid reaction to colors, through the observation of the color and the size of the spectrophotometer absorbance value measurement products, shows the reaction degree of substrates, which can determine the optimal pH of salivary amylase.【关键词】唾液淀粉酶、最适pH、碘-淀粉比色法【引言】新陈代谢是生命活动的基础。
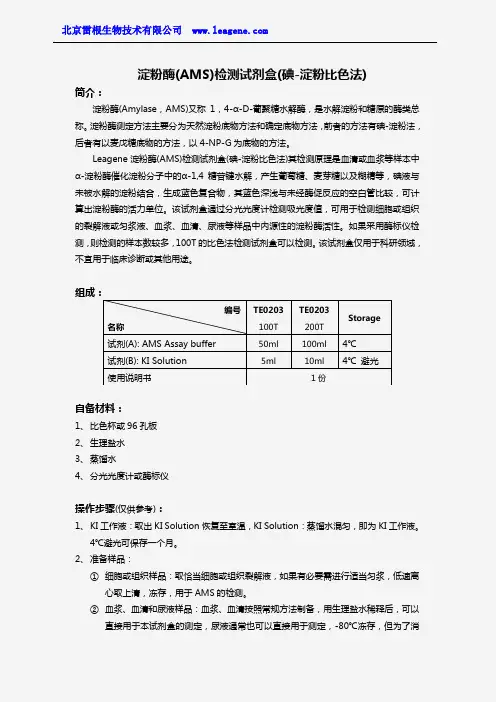
淀粉酶(AMS)检测试剂盒(碘-淀粉比色法)简介:淀粉酶(Amylase ,AMS)又称1,4-α-D-葡聚糖水解酶,是水解淀粉和糖原的酶类总称。
淀粉酶测定方法主要分为天然淀粉底物方法和确定底物方法,前者的方法有碘-淀粉法,后者有以麦戊糖底物的方法,以4-NP-G 为底物的方法。
Leagene 淀粉酶(AMS)检测试剂盒(碘-淀粉比色法)其检测原理是血清或血浆等样本中α-淀粉酶催化淀粉分子中的α-1,4糖苷键水解,产生葡萄糖、麦芽糖以及糊精等,碘液与未被水解的淀粉结合,生成蓝色复合物,其蓝色深浅与未经酶促反应的空白管比较,可计算出淀粉酶的活力单位。
该试剂盒通过分光光度计检测吸光度值,可用于检测细胞或组织的裂解液或匀浆液、血浆、血清、尿液等样品中内源性的淀粉酶活性。
如果采用酶标仪检测,则检测的样本数较多,100T 的比色法检测试剂盒可以检测。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 比色杯或96孔板2、 生理盐水3、 蒸馏水4、 分光光度计或酶标仪操作步骤(仅供参考):1、 KI 工作液:取出KI Solution 恢复至室温,KI Solution :蒸馏水混匀,即为KI 工作液。
4℃避光可保存一个月。
2、 准备样品:① 细胞或组织样品:取恰当细胞或组织裂解液,如果有必要需进行适当匀浆,低速离心取上清,冻存,用于AMS 的检测。
② 血浆、血清和尿液样品:血浆、血清按照常规方法制备,用生理盐水稀释后,可以直接用于本试剂盒的测定,尿液通常也可以直接用于测定,-80℃冻存,但为了消编号 名称TE0203 100T TE0203 200T Storage试剂(A): AMS Assay buffer 50ml 100ml 4℃ 试剂(B): KI Solution 5ml10ml 4℃ 避光使用说明书1份除样品本身颜色的干扰,需设置加了血浆或血清但不加底物的对照。
③高活性样品:如果样品中含有较高活性的AMS,可以使用生理盐水或PBS等进行稀释,也可以采用ALP Assay buffer稀释。

淀粉酶活力测定的方法
淀粉酶活力测定的方法主要有以下几种:
1. 碘液法:在含有淀粉的溶液中加入淀粉酶,然后加入碘液,根据溶液的颜色变化来判断淀粉酶的活力。
如果淀粉在溶液中完全降解,溶液的颜色将由深蓝色变为无色。
2. 比色法:淀粉酶活力的测定也可以采用比色法。
将含有淀粉的溶液加入淀粉酶,然后在一定时间内加入染色剂,比如碘液或酚酞溶液,根据溶液的吸光度或颜色的变化来测定淀粉的降解程度。
3. 尿液淀粉酶活力法:这种方法适用于测定淀粉酶在尿液中的活力。
将尿液样品加入含有淀粉的溶液中,然后通过碘液法或比色法测定淀粉的降解程度,从而计算出淀粉酶的活力。
以上方法为常见的淀粉酶活力测定方法,具体选择哪种方法应根据实验需求和设备条件进行决定。


唾液淀粉酶实验报告唾液淀粉酶实验报告引言:唾液淀粉酶是一种消化酶,能够将淀粉分解成较小的分子,为消化系统提供能量。
本实验旨在探究唾液淀粉酶的活性及其受到的影响因素。
实验材料与方法:实验材料:1. 淀粉溶液2. 唾液样本3. 碘液4. 试管5. 恒温水浴6. 酒精灯7. 显微镜8. 盖玻片实验方法:1. 取一定量的淀粉溶液倒入试管中。
2. 加入一滴碘液,观察试管中溶液颜色的变化,记录下颜色。
3. 将一定量的唾液样本加入另一个试管中。
4. 将两个试管放入恒温水浴中,保持温度恒定。
5. 同时开始计时,每隔一分钟,分别取出两个试管中的溶液滴在盖玻片上。
6. 用显微镜观察滴在盖玻片上的溶液,记录下观察结果。
7. 重复以上步骤,分别在不同温度和不同pH值条件下进行实验。
实验结果及讨论:在初始状态下,淀粉溶液的颜色为深蓝色,加入碘液后,颜色变为紫黑色。
这是因为碘液与淀粉反应生成了淀粉碘复合物,导致颜色变化。
在观察唾液淀粉酶活性的实验中,我们发现随着时间的推移,滴在盖玻片上的溶液逐渐变浅,最终变为无色。
这说明唾液淀粉酶能够将淀粉分解成较小的分子,从而使溶液中的淀粉含量减少。
在不同温度下的实验中,我们发现唾液淀粉酶的活性受到温度的影响。
当温度较低时,唾液淀粉酶的活性较低,反应速率较慢;而当温度较高时,唾液淀粉酶的活性较高,反应速率较快。
这是因为温度能够影响酶的构象和分子振动,从而影响酶的活性。
在不同pH值条件下的实验中,我们发现唾液淀粉酶的活性也受到pH值的影响。
在中性条件下,唾液淀粉酶的活性最高;而在酸性或碱性条件下,唾液淀粉酶的活性较低。
这是因为酶的活性受到pH值的影响,过高或过低的pH值会破坏酶的构象,从而降低酶的活性。
结论:通过本实验,我们得出了以下结论:1. 唾液淀粉酶能够将淀粉分解成较小的分子。
2. 唾液淀粉酶的活性受到温度的影响,温度越高,活性越高。
3. 唾液淀粉酶的活性受到pH值的影响,中性条件下活性最高。


碘-淀粉比色法测定唾液淀粉酶一 实验目的1、 掌握比色法测定a-淀粉酶的原理;2、 掌握分光光度计的正确使用方法;二 实验原理1、比色法作为一种定量分析的方法,是以生成有色化合物的显色反应为基础,通过比较或测量有色物质溶液颜色深度来确定待测组分含量的方法。
常用的比色法有两种:目视比色法和光电比色法,两种方法都是以朗伯-比尔定律 (A =εbc)为基础。
2、血清中α-淀粉酶催化淀粉分子中α-1,4糖苷键水解,产生葡萄糖、麦芽糖及含有α-1,6糖苷键支链的糊精。
a-淀粉酶淀粉 葡萄糖+麦芽糖+糊精+碘液 蓝色复合物在底物过量的条件下,反应后加入碘液与未被水解的淀粉结合成蓝色复合物,其蓝色的深浅与未经酶促反应的空白管比较,从而推算出淀粉酶的含量。
3、酶活力的大小、即酶量的多少用酶活力单位(U )(active unit )表示。
1961年国际生物化学学会酶学委员会提出采用统一的“国际单位”(IU )来表示酶的活力,规定为:在最适条件(25℃)下,每分钟内催化1微摩尔(μmol )底物转化为产物所需的酶量定为一个活力单位,即1IU = 1μmol /min 。
这样酶的含量就可用每克酶制剂或每毫升酶制剂含有多少酶活力单位来表示(U/g 或U/ml )。
4、 计算公式:A A 1.65100AMY A 55X-=⨯⨯⨯空白管吸光度测试管吸光度空白管吸光度 其中,A A A -空白管吸光度测试管吸光度空白管吸光度代表测定管淀粉的大致水解程度,大小范围为0~l 。
当测定管淀粉未被水解时,其蛋白酶活性为0;当测定管淀粉被完全水解时,其值为1。
1.61515151100X⨯⨯⨯⨯中,5151100⨯⨯”为碘一淀粉比色法中淀粉酶活性的单位定义-100ml 唾液中的淀粉酶,在37度5min 水解淀粉5mg 为1个单位,1.6151X ⨯⨯表示实验的测试条件:X 代表稀释后的唾液量,稀释倍数根据个人的情况而定,若50倍稀释唾液0.1ml ,则唾液量为0.002ml ,反应时间为5分钟,1.6g/L 淀粉溶液1.0ml ,即淀粉量为1.6mg 。

第1篇一、实验目的1. 了解唾液淀粉酶对淀粉的消化作用。
2. 掌握实验操作步骤,观察淀粉遇唾液后的变化。
3. 分析实验结果,探讨影响唾液淀粉酶活性的因素。
二、实验原理唾液淀粉酶是一种消化酶,主要存在于唾液中,具有催化淀粉水解为葡萄糖的作用。
淀粉遇碘后呈现蓝色,当淀粉被唾液淀粉酶水解后,碘与葡萄糖不发生反应,因此淀粉遇唾液后的溶液颜色会发生变化。
三、实验材料与仪器1. 实验材料:淀粉溶液、唾液、碘液、蒸馏水、试管、移液器、滴管、烧杯、酒精灯、温度计、pH试纸等。
2. 实验仪器:恒温水浴锅、显微镜、离心机、电子天平等。
四、实验步骤1. 将淀粉溶液、唾液、碘液、蒸馏水等实验材料准备好。
2. 分别取3支试管,分别编号为1、2、3号。
3. 向1号试管中加入2ml淀粉溶液,2号试管中加入2ml淀粉溶液和2ml唾液,3号试管中加入2ml淀粉溶液和2ml蒸馏水。
4. 将3支试管放入37℃恒温水浴锅中,保持恒温。
5. 5分钟后,向3支试管中分别加入2滴碘液。
6. 观察并记录3支试管中溶液的颜色变化。
7. 分别将3支试管取出,用pH试纸测定溶液的酸碱度。
五、实验结果与分析1. 1号试管(淀粉溶液)加入碘液后,溶液呈蓝色,表明淀粉未被唾液淀粉酶水解。
2. 2号试管(淀粉溶液+唾液)加入碘液后,溶液颜色逐渐变浅,最终呈无色,表明淀粉被唾液淀粉酶水解。
3. 3号试管(淀粉溶液+蒸馏水)加入碘液后,溶液仍呈蓝色,表明水对淀粉没有消化作用。
实验结果表明,唾液淀粉酶具有催化淀粉水解的作用,而蒸馏水对淀粉没有消化作用。
此外,pH值、温度等因素也会影响唾液淀粉酶的活性。
六、实验讨论1. 实验过程中,淀粉溶液与唾液的混合比例对实验结果有一定影响。
本实验中,淀粉溶液与唾液的比例为1:1,此比例较为适宜,能够较好地观察唾液淀粉酶对淀粉的消化作用。
2. 实验过程中,温度对唾液淀粉酶的活性有一定影响。
本实验中,实验温度为37℃,这是唾液淀粉酶的最适温度,有利于观察唾液淀粉酶对淀粉的消化作用。

探究人唾液淀粉酶的最适PH(碘-淀粉比色法)欧奇灿学号:201680075 临床医学“5+3”2班3组摘要:唾液淀粉酶是由唾液腺分泌的一种水解酶,可作用于可溶性淀粉、直链淀粉、糖原等α-1,4-葡聚糖等,属于α-淀粉酶的一种。
酶学与医学联系紧密,测定酶的最适pH,有利于我们把酶学知识运用于临床诊断与应用治疗。
本实验尝试用碘-淀粉比色法测定唾液淀粉酶最适pH,加深对酶学知识的理解。
关键词:缓冲液;唾液淀粉酶;分光光度计前言:人体内各种代谢反应,都离不开酶的催化作用,酶量的改变以及酶活性的改变都会引起人体化学反应的异常或紊乱,因此酶在人体内是否能发挥正常活性关系着人体内环境的稳定。
而pH是影响酶活性的一个重要因素,因此,通过探究实验探究人唾液淀粉酶的最适pH,不仅可以检测我们的生物化学实验操作能力和探究能力,也可以加深我们对酶学知识的理解。
正文:【实验原理】酶是具有高效催化能力的生物大分子物质,其化学结构上具有许多极性基团,在不同酸碱环境中,这些基团的解离状态不同,所带电荷也不同。
只有当酶处于一定的解离状态,才能和作用物结合。
因此,溶液的pH对酶活性影响很大。
若其他条件不变,酶只有在一定的pH范围内才能表现出催化活性。
在某pH时,酶催化活性最大,此pH称为酶作用的最适pH。
当溶液的pH偏离最适pH时,酶活性降低,甚至失活。
淀粉经唾液中淀粉酶的水解,生成糊精和麦芽糖。
在底物过量的条件下,反应后加入碘液与未被水解的淀粉结合成蓝色复合物,其颜色深浅与空白管颜色的差值和唾液淀粉酶的活力成正比。
在底物过量的条件下,相同时间内,在温度、酶浓度相同、pH不同的条件下,越接近最适 pH的反应体系中酶活性越高,消耗淀粉的量越大,剩余淀粉与过量碘液生成的颜色越浅,吸光度越小。
本实验利用分光光度计测出各管的吸光度后,取处于降低与升高趋势之间的较小吸光度范围对应的 pH 值即为唾液淀粉酶的最适pH。
【仪器与试剂】仪器材料:试管架,试管,烧杯,一次性纸杯,移液枪,刻度吸管,洗耳球,胶头滴管,pH试纸,恒温水浴箱,分光光度计试剂药品:2.5g/L淀粉溶液,碘液,0.2mol/L NaH2PO4、0.2mol/LNa2HPO4,唾液,纯净水【实验步骤】1、唾液的获取纯净水先漱口1~2次,然后含一大口水约2分钟,其间做咀嚼运动,然后将水和唾液一同收集至烧杯中。
碘淀粉比色法测定唾液淀粉酶实验报告误差分析引言:唾液淀粉酶是一种消化酶,它在人体的消化过程中发挥着重要的作用。
本实验以测定唾液淀粉酶活性为目标,采用碘淀粉比色法来测定淀粉酶对淀粉的降解能力。
实验中,我们以淀粉溶液作为底物,唾液作为酶,通过比色法来测定唾液淀粉酶的活性。
实验步骤:1.准备0.1%的淀粉溶液。
2.取适量的淀粉溶液分别放在4个试管中。
3.将每个试管中的淀粉溶液加热,使其变稀。
4.将加热后的淀粉溶液分别加入4个试管中。
5.取适量的唾液加入每个试管中,使试管内的淀粉溶液和唾液混合。
6.在每个试管中滴加一滴稀盐酸,停止淀粉的降解反应。
7.用滴管向淀粉溶液滴加少量的碘液,形成蓝色沉淀。
8.稀释各自制的超标和亚标溶液,并进行分别测定吸光度及活性。
误差分析:1.温度误差:实验中,加热淀粉溶液的温度可能会对唾液淀粉酶活性产生影响。
不同温度下,淀粉酶的活性可能不同,导致实验结果的误差。
为减小该误差,可以使用恒温水浴进行加热,保持相同的温度条件。
3.时间误差:实验中,淀粉酶对淀粉的降解速度可能受到时间的影响。
在不同的反应时间内,淀粉的降解程度可能不同,导致实验结果的误差。
为减小时间误差,可以设置相同的反应时间,并进行多次实验取平均结果。
4.容器误差:实验中,试管的直径和透明度可能会对光的透射率产生影响。
试管直径不同会导致吸光度的差异,透明度不同可能会影响碘液的进入情况。
为减小容器误差,可以使用相同类型和品牌的试管进行实验。
措施与建议:1.严格控制温度:使用恒温水浴控制实验过程中的温度,确保每个试管中的淀粉溶液温度相同。
2.多次实验取平均:进行多次实验,取各次实验的平均结果,以减小个体偶然误差的影响。
3.量取唾液:在加入唾液的过程中,尽量使用分量器等精确量取唾液,以尽量减小不同试管中唾液质量的差异。
4.控制反应时间:在实验过程中,控制相同的反应时间,确保淀粉酶对淀粉的降解在相同时间内完成。
5.使用相同类型的试管:使用相同类型和品牌的试管,以减小容器误差对实验结果的影响。
唾液淀粉酶最适pH值的测定实验参考唾液淀粉酶最适pH值的测定实验实验⽬的:1、掌握⽤碘-淀粉⽐⾊法的⽅法精测唾液淀粉酶最适pH值。
2、学会常⽤的缓冲溶液配制的⽅法。
3、进⼀步熟悉分光光度计的使⽤。
⼀、实验原理:1、酶催化活性最⾼时反应体系的pH值称为酶的最适pH值。
⼈体正常唾液pH值为6.6~7.1,吸光度值在6.0~8.0范围内并且随着pH的增⼤先减⼩后增⼤。
2、在不同pH条件下,淀粉经淀粉酶⽔解后不同程度的⽔解产物能与碘液反应呈现不同颜⾊,可⽤分光光度计测量出反应后各溶液在660nm 处的吸光度A,由朗伯-⽐尔定律可知,吸光度A值越⼤,其相应的酶活⼒越低,从⽽可间接得出唾液淀粉酶的最适pH值。
三、仪器材料和试剂:仪器材料:1. ⽩瓷板、中试管、试管架、⽑刷、吸⽿球、玻璃笔、烧杯、漱⼝⽔2. 37 C恒温⽔浴箱、分光光度计、沸⽔浴3.1ml吸量管、5ml吸量管,胶头滴管、100ul移液器实验试剂:0.02%淀粉溶液、 0.2mol/L磷酸⼆氢钠溶液、0.2mol/L磷酸氢⼆钠溶液、碘液、蒸馏⽔四、实验步骤:1、试剂的配制:0.02%淀粉溶液—取2.5g/L的淀粉溶液4ml,置于50ml容量瓶中,加蒸馏⽔稀释到50mL。
0.2mol/L磷酸⼆氢钠溶液—准确称取14.200g,加⼊20ml蒸馏⽔溶解在烧杯,然后置于500ml容量瓶中稀释⾄刻度备⽤。
0.2mol/L磷酸氢⼆钠溶液—准确称取12.000g,加⼊20ml蒸馏⽔溶解在烧杯,然后置于500ml容量瓶中稀释⾄刻度备⽤。
根据下表,混合溶液⾄50.00ml后⽤蒸馏⽔稀释到100.00ml.pH 值 0.2mol/LNa2HPO4(ml)(丁) 0.2mol/LNaH2PO4 (ml)(霞)5.8 4.00 46.006.0 6.15 43.856.2 9.25 40.756.4 13.25 36.756.6 18.75 31.256.8 24.50 25.507.0 30.50 19.507.2 36.00 14.507.4 40.50 9.507.6 43.50 6.507.8 45.75 4.258.0 47.35 2.652、唾液的获取:(1)蒸馏⽔漱⼝,然后⽤⾆尖抵住上额或下额齿根后,微低头.轻启双唇,将下嘴唇搁在烧杯边缘,让唾液⾃然流⼊试管中.(2)唾液的稀释:取10⽀试管,分别编上号铭1~10。
生化实验唾液淀粉酶的活性测定1实验目的和要求:观察淀粉在水解过程中遇碘后溶液颜色的变化。
观察温度,pH,激活剂与抑制剂对唾液淀粉酶活性的影响2实验用主要设备、实验用品:器材:试管、烧杯、量筒、试管夹、试管架、酒精灯、恒温水浴锅、玻璃棒、白瓷板、铁三角架试剂:1%淀粉溶液、碘液、0.4%HCI溶液、班氏试剂、0.1%的乳酸溶液、1%的NaCl溶液、1%的CuSO4溶液、0.1%淀粉溶液3实验原理(内容):人的唾液淀粉酶水解淀粉的过程及产物与酶所呈现的颜色反应如下:水解反应过程:淀粉—紫糊精—红糊精—无色糊精—麦芽糖、葡萄糖遇碘后显示:蓝色— 紫色— 红色— 无色— 无色淀粉与糊精无还原性或还原性很弱,对班氏试剂呈阴性反应。
麦芽糖、葡萄糖是还原糖与,班氏溶液共热后生成红棕色氧化亚铁沉淀。
唾液淀粉酶的最适温度为37~40℃,最适pH值为6.8,偏离此最适条件时酶的活性减弱。
低浓度的Cl-能增强淀粉酶的活性,是淀粉酶的激活剂。
Cu+等金属离子能降低淀粉酶的活性,是淀粉酶的抑制剂。
4操作方法与实验步骤:⑴.酶液的提取:采用每人的唾液淀粉酶。
用水漱口两次,每次含一口蒸馏水约一分钟左右,吐入小烧杯中,用二层棉布过滤,取滤液10ml,加入1-3倍水,备用。
℃.酶的专一型:取两支试管,在1号管中加入淀粉液2ml,酶液2ml,在2号管中加入蔗糖液2ml,酶液1ml。
将试管放入37~40℃水浴锅中,保温十分钟左右,取出后向各管中加入班氏试剂1ml放入沸水中煮2~3分钟观察现象。
℃.pH对酶活性的影响:取四支试管分别加入0.4%HCI溶液、0.1%乳酸溶液、蒸馏水与1%Na2CO3溶液各2ml,再向以上四支试管中各加入2ml1%淀粉溶液及2ml淀粉酶试剂,在沸水浴中加热,根据生成红棕色沉淀的多少,说明淀粉水解的强弱。
℃.温度对酶活性的影响:取3支试管,各加入3ml1%淀粉溶液,另取3支试管各加1ml淀粉酶液。
将此6支试管儿分为三组,每组中成淀粉溶液与淀粉酶液的试管各一支,三组试管分别置于0℃、37℃和70℃的水浴中。
碘-淀粉比色法测定唾液淀粉酶
一 实验目的
1、 掌握比色法测定a-淀粉酶的原理;
2、 掌握分光光度计的正确使用方法;
二 实验原理
1、比色法作为一种定量分析的方法,是以生成有色化合物的显色反应为基础,通过比较或测量有色物质溶液颜色深度来确定待测组分含量的方法。
常用的比色法有两种:目视比色法和光电比色法,两种方法都是以朗伯-比尔定律 (A =εbc)为基础。
2、血清中α-淀粉酶催化淀粉分子中α-1,4糖苷键水解,产生葡萄糖、麦芽糖及含有α-1,6糖苷键支链的糊精。
a-淀粉酶
淀粉 葡萄糖+麦芽糖+糊精
+
碘液 蓝色复合物
在底物过量的条件下,反应后加入碘液与未被水解的淀粉结合成蓝色复合物,其蓝色的深浅与未经酶促反应的空白管比较,从而推算出淀粉酶的含量。
3、酶活力的大小、即酶量的多少用酶活力单位(U )(active unit )表示。
1961年国际生物化学学会酶学委员会提出采用统一的“国际单位”(IU )来表示酶的活力,规定为:在最适条件(25℃)下,每分钟内催化1微摩尔(μmol )底物转化为产物所需的酶量定为一个活力单位,即1IU = 1μmol /min 。
这样酶的含量就可用每克酶制剂或每毫升酶制剂含有多少酶活力单位来表示(U/g 或U/ml )。
4、 计算公式:
A A 1.65100AMY A 55X
-=⨯⨯⨯空白管吸光度测试管吸光度空白管吸光度 其中,A A A -空白管吸光度测试管吸光度
空白管吸光度
代表测定管淀粉的大致水解程度,大小范围为0~l 。
当测定管淀粉未被水解时,其蛋白酶活性为0;当测定管淀粉被完全水解时,其值为1。
1.61515151100
X
⨯⨯⨯⨯中,5151100⨯⨯”为碘一淀粉比色法中淀粉酶活性的单位定义-100ml 唾液中的淀粉酶,在37度5min 水解淀粉5mg 为1个单位,1.6151X ⨯⨯表示实验的测试条件:X 代表稀释后的唾液量,稀释倍数根据个人的情况而定,若50倍稀释唾液0.1ml ,则唾液量为0.002ml ,反应时间为5分钟,1.6g/L 淀粉溶液1.0ml ,即淀粉量为1.6mg 。
1.61515151100
X ⨯⨯⨯⨯含义即为在实验条件下,
Xml 唾液中的淀粉酶在5分钟内水解1.6mg 淀粉,则其活性为32/X 个单位,再将其乘以水解程度,则整个公式代表了测定管淀粉酶的活性。
三 仪器与试剂
仪器:分光光度计及1cm 比色皿;吸量管;水浴锅;量筒;移液器等
试剂:1.6g/L淀粉溶液;蒸馏水;碘化钾-碘溶液
四实验步骤
1、溶液的配制:
(1)淀粉溶液的配制:称取80mg的可溶性淀粉,溶于50ml蒸馏水中,配成1.6g/L 的淀粉溶液;
(2)碘-碘化钾储备液:称取4g碘化钾及2g碘溶于100ml蒸馏水中,作为储备液;
2、取新鲜唾液,取0.1ml唾液进行稀释,稀释倍数根据个人情况而定;
3、唾液淀粉酶的测定:按下表所列在两支干净的比色管中分别加入1ml淀粉,37℃水浴5min后,在测试管中加入稀释的唾液0.1ml,充分混匀,37℃水浴5min后,分别加入0.5ml 的碘化钾—碘溶液,然后再分别在空白管和测试管中加入蒸馏水至刻度线25mL,混匀。
以波长660nm,蒸馏水调零,读取各管吸光度。
加入物(ml)空白管测定管淀粉溶液(37℃水浴5min) 1.0 1.0
稀释唾液0.1
混匀,置37℃水浴水浴5m i n 碘化钾—碘溶液0.5 0.5
蒸馏水加至25mL 加至25mL
五数据处理
六注意事项
1、缓冲淀粉溶液若出现混浊或絮状物,表示缓冲淀粉溶液受污染或变质,不能再用,应重新配制。
2、如测定管吸光度小于空白管吸光度一半时,应加大唾液稀释倍数或减少稀释唾液加入量,测定结果乘以稀释倍数
3、本法亦适用于其他体液淀粉的测定,如尿液、血清等。