第五章 相平衡
- 格式:doc
- 大小:1.30 MB
- 文档页数:11

第五章相平衡§5.1 引言相平衡是热力学在化学领域中的重要应用之一。
化工中很多分离提纯过程,例如精馏、吸收、结晶、萃取等,都涉及到物质在不同相中的分配,它们主要利用物质的挥发性或溶解度等方面的差异,以达到分离提纯的目的,相平衡亦可为此提供理论依据。
因此研究相平衡有着重要现实意义。
一、相(phase)体系内部物理和化学性质完全均匀的部分称为相。
相与相之间在指定条件下有明显的界面。
(1)气体,不论有多少种气体混合,只有一个气相。
(2)液体,按其互溶程度可以组成一相、两相或三相共存。
(3)固体,一般有一种固体便有一个相。
两种固体粉末无论混合得多么均匀,仍是两个相(固体溶液除外,它是单相)。
体系中相的总数用Φ表示。
二、相变物质从一个相流动到另一个相的过程,称为相变化,简称相变。
相变包括气化(boil)、冷凝(condensation)、熔化(melt)、凝固(freeze)、升华(sublimation)、凝华以及晶型转化等。
三、相图(phase diagram)将多相体系的状态随组成、温度、压力等强度性质的改变而发生的过程用图形表示,称为相图。
根据组成相的物态不同分为气-液相图、液-液相图和液-固相图。
根据用途不同可将相图分为温度-蒸汽压图(T-p图,P314 图5.1)、蒸汽压-组成图(p-x图,P318 图5.3):恒定温度,研究P-x,y之间的关系。
称为压力组成图。
温度-组成图(T -x 图,P321 图5.5):在恒定压力下表示二组分系统气-液平衡时温度与组成关系的相图。
研究T-x ,y 之间的关系。
和温度-蒸汽压-组成图(T -p -x 图,P322 图5.6),T-x-y ,x-y ,p-x-y 相图等。
四、自由度(degrees of freedom )确定平衡体系的状态所必须的压力、温度和浓度等独立强度性质的数目称为自由度,用字母f 表示。
如果已指定某个强度性质,除该性质以外的其它强度性质数称为条件自由度,用*f 表示。





第五章相平衡(Phase equilibrium)相平衡、热平衡和化学平衡是热力学在化学领域中的重要应用,也是化学热力学的主要研究对象。
相平衡研究对生产和科学研究具有重大的实际意义。
例如在化学研究和化学生产过程的分离操作中,经常会遇到各种相变化过程,如蒸发、冷凝、升华、溶解、结晶和萃取等,这些过程及到不同相之间的物质传递。
相平衡研究是选择分离方法、设计分离装置以及实现最佳操作的理论基础。
除了分离以外,相平衡及其基本理论还广泛应用于冶金、材料科学、地质矿物学、晶体生长等学科中,对这些部门的科研和生产有着重要的指导意义。
相平衡研究多相体系相变化规律,是热力学基本原理在化学领域中的重要应用。
“相律”是根据热力学原理推导出来的,以统一观点处理各种类型多相平衡的理论方法十分严谨明确。
它表明一个多相平衡体系的组分数、相数以及自由度之间的关系,可以帮助我们确定体系的平衡性质以及达平衡的必要条件。
然而,相律也有其局限性,它只能对多相平衡作定性描述。
可指明特定条件下平衡体系至多的相数以及为保持这些相数所必具的独立变量数。
但究竟是哪些相共存?哪些性质可作为独立变量以及它们之间的定量关系如何等问题,相律均无能为力。
这方面知识仍有待从实验中确定。
本章着重讨论各种相平衡体系所遵守的一个普遍规律----相律,以及各种基本类型的相图,具体分析体系的相平衡情况与温度、压力和组成等因素的关系,并举例说明其实际应用§5.1相律一、基本术语1、相:体系中物理性质和化学性质完全均匀的一部分称为相物质从一个相转移到另一个相的过程称为相变化过程,而相平衡状态就是相变化过程的极限,此时宏观上投有任何物质在相间传递。
此处“完全均匀”,是指体系中的物质在分子水平上的均匀混合的状态,此时即便是由多种物质构成的体系,但其物理性质和化学性质都达到了完全均匀的程度,用一般的仪器已分不出其界面了,形成一个均相体系。
多相体系中,相与相之间存在明显的界面,称为相界面。


第五章 相平衡一、本章基本要求1.掌握相、组分数和自由度的意义。
2.了解相律的推导过程及其在相图中的应用。
3.了解克劳修斯-克拉珀龙方程式的推导,掌握其在单组分两相平衡系统中的应用。
4.掌握各种相图中点、线及面的意义。
5.根据相图能够画出步冷曲线,或由一系列步冷曲线绘制相图。
6.掌握杠杆规则在相图中的应用。
7.结合二组分气液平衡相图,了解蒸馏与精馏的原理。
8.对三组分系统,了解水盐系统的应用,相图在萃取过程中的应用及分配定律的应用。
二、 基本公式和内容提要(一)基本公式相律的普遍形式:f K n =-Φ+ 克拉珀龙方程:mm d ln d V T H T p ∆∆= 克劳修斯-克拉珀龙方程的各种形式:微分式: 2m vap d ln d RT H T p ∆= vap m H ∆与温度无关或温度变化范围较小vap m H ∆可视为常数, 定积分:vap m 211211ln ()H p p R T T ∆=- 不定积分式:vap mln H p C RT ∆=-+ 特鲁顿规则:K)J/(mol 88b mvap ⋅≈∆T H杠杆规则:以系统点为支点,与之对应的两个相点为作用点,有如下关系:1122()()n x x n x x -=-其中n 1 、n 2 分别表示平衡两相的摩尔数,x 、x 1、x 2分别表示系统的组成及其对应的平衡两相的组成。
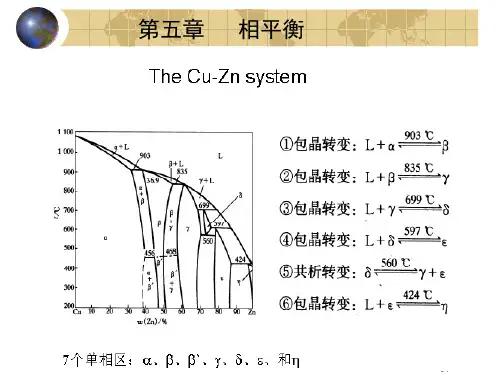
(二)内容提要1.单组分系统 单组分系统相律的一般表达式为:f =1-Φ+2=3-Φ图5-1 水的相图可见单组分系统最多只能有三相平衡共存,并且最多有两个独立变量,一般可选择温度和压力。
水的相图为单组分系统中的最简单相图之一。
图5-1中三条曲线将平面划分成固、液及气相三个区。
单相区内f =2。
AB 、AD 和AE 分别表示气液、气固和固液两相平衡线。
两相共存时f =1。
虚线AC表示应该结冰而未结冰的过冷水与水蒸气平衡共存。
A 点为三相点,这时f =0,水以气、液、固三相共存。
第五章相平衡一、选择题1.NH4HS (s) 和任意量的NH3 (g) 及H2S (g) 达平衡时有(Ф代表相数):( )(A) C = 2,Ф = 2,f = 2 (B) C = 1,Ф = 2,f = 1(C) C = 2,Ф = 3,f = 2 (D) C = 3,Ф = 2,f = 32. FeCl3和H2O 能形成FeCl3·6H2O,2FeCl3·7H2O,2FeCl3·5H2O,FeCl3·2H2O四种水合物,则该体系的独立组分数C和在恒压下最多可能的平衡共存的相数Ф分别为: ( )(A) C = 3,Ф = 4 (B) C = 2,Ф = 4 (C) C = 2,Ф = 3 (D) C = 3,Ф = 53. 硫酸与水可形成H2SO4·H2 O (s)、H2SO4·2H2O (s)、H2SO4·4H2O (s)三种水合物,问在101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3 种(B) 2 种(C) 1 种(D)不可能有硫酸水合物与之平衡共存4. 某体系存在C (s)、H2O (g)、CO (g)、CO2 (g)、H2 (g) 五种物质,相互建立了下述三个平衡:H2O (g) +C (s) = H2 (g) + CO (g); CO2 (g) + H2 (g) = H2O (g) + CO (g); CO2 (g) + C (s) = 2CO (g)。
则该体系的独立组分数C 为: ( )(A) C = 3 (B) C = 2 (C) C = 1 (D) C = 45. 298K 时,蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度数为( )(A) C = 2,Ф = 2,f = 1 (B) C = 2,Ф = 2,f = 2(C) C = 2,Ф = 1,f = 2 (D) C = 2,Ф = 1,f = 36.对恒沸混合物的描述,下列各种叙述中哪一种是不正确的?( )(A) 与化合物一样,具有确定的组成(B) 不具有确定的组成(C) 平衡时,气相和液相的组成相同(D) 其沸点随外压的改变而改变7. 二元恒沸混合物的组成( )(A) 固定(B) 随温度改变(C) 随压力改变(D) 无法判断8. 在pΘ下,用水蒸汽蒸镏法提纯某不溶于水的有机物时,体系的沸点: ( )(A) 必低于373.2K (B) 必高于373.2K(C) 取决于水与有机物的相对数量(D) 取决于有机物的分子量大小9. 水的三相点是:( )(A) 某一温度,超过此温度,液相就不能存在(B) 通常发现在很靠近正常沸点的某一温度(C) 液体的蒸气压等于25 °C时的蒸气压三倍数值时的温度(D) 固体、液体和气体可以平衡共存时的温度和压力10. 当Clausius-Clapeyron方程应用于凝聚相转变为蒸气时,则:( )(A) p 必随T 之升高而降低(B) p必不随T而变(C) p必随T 之升高而变大(D) p随T之升高可变大或减少11. 在0 °C到100 °C的温度范围内,液态水的蒸气压p与T 的关系为:lg(p/Pa)=-2265/T+11.101,某高原地区的气压只有59995 Pa,则该地区水的沸点为( )(A) 358.2 K (B) 85.2 K (C) 358.2 °C(D) 373 K12. 在373.15 K时,某有机液体A和B的蒸气压分别为p和3p,A和B的某混合物为理想液体混合物,并在373.15 K、2p时沸腾,那么A在平衡蒸气相中的摩尔分数是多少?( )(A) 1/3 (B) 1/4 (C) 1/2 (D) 3/413. 当用三角形坐标来表示三组分物系时,若某物系其组成在平行于底边BC的直线上变动时,则该物系的特点是:( )(A) B的百分含量不变(B) A的百分含量不变(C) C的百分含量不变(D) B和C的百分含量之比不变14. 在通常情况下,对于二组分物系能平衡共存的最多相为:( )(A) 1 (B) 2 (C) 3 (D) 415. 哪一种相变过程可以利用来提纯化学药品?( )(A) 凝固(B) 沸腾(C) 升华(D) A、B、C任一种16. 在相图上,当系统处于下列哪一点时只存在一个相?( )(A) 恒沸点(B) 熔点(C) 临界点(D) 低共熔点17. 水的三相点附近,其气化焓和熔化焓分别为44.82 kJ·mol-1和5.99 4kJ·mol-1。
则在三相点附近,冰的升华焓约为:( )(A) 38.83 kJ·mol-1(B) 50.81 kJ·mol-1(C) -38.83 kJ·mol-1(D) -50.81 kJ·mol-118. 已知苯-乙醇双液系统中,苯的沸点是353.3K,乙醇的沸点是351.6K,两者的共沸组成为:含乙醇47.5%(摩尔分数),沸点为341.2 K。
今有含乙醇77.5%的苯溶液,在达到气液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。
问下列结论何者正确?( )(A) y2 > x2(B) y2=x2(C) y2 < x2(D) 不确定19. 已知A和B可构成固溶体,在A中,若加入B可使A的熔点提高,则B在此固溶体中的含量与B在液相中的含量的关系是:( )(A) 大于(B) 小于(C) 等于(D) 不确定20. 区别单相系统和多相系统的主要根据是( )(A) 化学性质是否相同(B) 物理性质是否相同(C) 物质组成是否相同(D) 物理性质和化学性质是否都相同二、填空题1. 纯物质在临界点的自由度数等于。
2. 一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于。
3. 化工生产中经常用食盐水溶液作为冷冻循环液,从食盐在水中溶解度曲线可知,盐水体系有一定的低共熔点,因此在实际应用中,为了得到低温和不堵塞管道的效果,盐水浓度应采用为宜。
4.完全互溶的二组分溶液,在x = 0.6处,平衡蒸气压有最高值,那么组成x = 0.4的溶液在气—液平衡时,x (g)、x (l)、x (总)的大小顺序为。
5.一般有机物可以用水蒸气蒸镏法提纯,当有机物的和越大时,提纯一定质量有机物需用的水蒸气量越少,燃料越省。
6. 下列化学反应,同时共存并到达平衡(温度在900~1200 K范围内): CaCO3 (s) = CaO (s) + CO2 (g); CO2 (g) + H2 (g) = CO (g) + H2O (g); H2O(g) + CO (g) + CaO (s) = CaCO3 (s) + H2 (g)。
问该体系的自由度为。
7. 在80 °C下,将过量的NH4HCO3 (s)放入真空密闭容器中,发生下列分解反应:NH4HCO3 (s) = NH3(g) + CO2 (g) + H2O (g)。
达平衡后,系统的C = ; Ф = ; F = 。
8. 由A(l)与B(l)形成的二组分液态完全互溶的气-液平衡系统中,在外压一定的条件下,向系统中加入B(l)后系统的沸点下降,则该组分在平衡气相中的组成其在液相中的组成。
9. 某物质液态蒸气压与温度的关系为ln(p l/Pa) = -3063/(T/K) + 24.38,固态的蒸气压与温度的关系为ln(p s/Pa) = -3754/(T/K) + 27.92,则该物质的三相点对应的温度T = ,压力p = ,该物质液态的摩尔蒸发焓Δvap H m = 。
10. 水蒸气通过灼热的C(石墨)发生下列反应:H2O (g) + C(石墨) = CO (g) + H2 (g)。
次平衡系统的组分数C = ,相数Ф = ,自由度数F = 。
这说明生成的CO (g),H2 (g)在气相中的摩尔分数与有关。
三、简答题1. 相点与物系点有什么区别?2. 单组分系统的三相点与低共熔点有何异同点?3. 恒沸混合物是不是化合物?4. 在汞面上加了一层水能减少汞的蒸气压吗?5. 沸点和恒沸点有何不同?四、计算题1. 已知两组分A和B 体系的相图如下:(1) 在图右部画出a,b,c 表示的三个体系由t1温度冷却到t2的步冷曲线;(2) 标出各相区的相态,水平线EF,GH上体系的自由度;(3) 使体系P降温,说明达到M,N,Q,R 点时体系的相态和相数。
2. Au 和Sb 分别在1333 K 和903 K 时熔化,并形成一种化合物AuSb2,在1073 K熔化时固液组成不一致。
试画出符合上述数据的简单相图,并标出所有的相区名称。
画出含50% Au之熔融物的步冷曲线。
3. 苯(A)和二苯基甲醇(B)的熔点分别为6 °C和65 °C。
A和B可形成不稳定化合物AB2,它在30 °C 时分解为B和x B = 0.5的熔液。
低共熔点为1 °C, 低共点熔液组成x B = 0.2。
(1) 根据以上数据画出苯—二苯基甲醇的T-x示意图。
(2) 标出各区域的相态。
4.定压下Tl、Hg 及其仅有的一个化合物 (Tl2Hg5) 的熔点分别为303 °C、-39 °C、15 °C。
另外还已知组成为含8%Tl 的溶液和含41%Tl 的溶液的步冷曲线分别为下图:Hg、Tl 的固相互不相溶。
(1) 画出上面体系的相图。
(Tl、Hg 的相对原子质量分别为204.4、200.6)(2) 若体系总量为500 g,总组成为10% Tl,温度为20 °C,使之降温至-70 °C 时,求达到平衡后各相的量。
5. A-B二组分液态部分互溶系统的液-固平衡相图如下图所示,指出各个相区的相平衡关系、各条线所代表的意义以及三相线所代表的相平衡关系。
6. 某A-B二组分凝聚系统相图如下图所示。
(1) 指出各相区的稳定相,三相线上的相平衡关系;(2) 绘出图中状态点为a, b, c的样品的步冷曲线,并注明各阶段的相变化。
7. 根据下图回答问题:(1) 曲线OA, OB, OC分别代表什么意思?(2) 指出O点的含义。
(3) 碳在常温、常压下的稳定状态是什么?(4) 在2000 K时,增加压力,使石墨转变为金刚石是一个放热反应,试从相图判断两者的摩尔体积哪个大?(5) 试从相图上估计,在2000 K时,将石墨转变为金刚石至少要加多大压力?8. 在273 K和293 K时,固体苯的蒸气压分别为3.27 kPa 和12.30 kPa, 液体苯在293 K时的蒸气压为10.02 kPa,液体苯的摩尔蒸发焓为34.17 kJ/mol。