2019_2020学年高中化学第二章微型专题(三)分子(离子)立体构型与杂化轨道类型的判断课件新人教版选修3
- 格式:pptx
- 大小:1.38 MB
- 文档页数:25

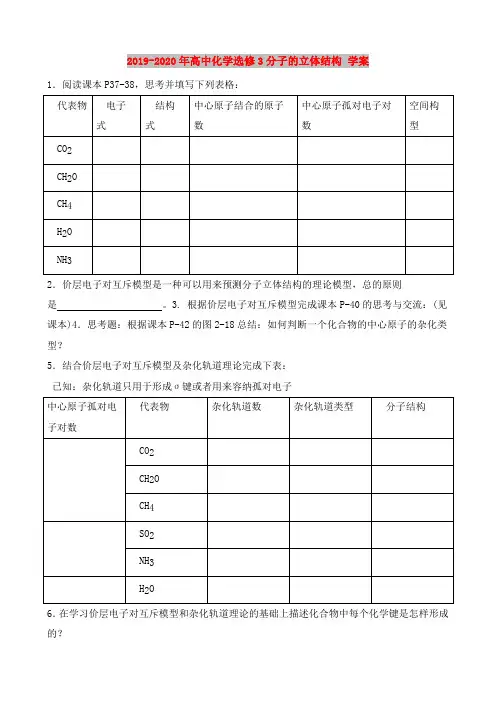
2019-2020年高中化学选修3分子的立体结构 学案1.阅读课本P37-38,思考并填写下列表格:2.价层电子对互斥模型是一种可以用来预测分子立体结构的理论模型,总的原则是 。
3. 根据价层电子对互斥模型完成课本P-40的思考与交流:(见课本)4.思考题:根据课本P-42的图2-18总结:如何判断一个化合物的中心原子的杂化类型?5.结合价层电子对互斥模型及杂化轨道理论完成下表: 已知:杂化轨道只用于形成σ键或者用来容纳孤对电子 6.在学习价层电子对互斥模型和杂化轨道理论的基础上描述化合物中每个化学键是怎样形成的?(1).CO2(2).H2O(3).CH2O(4).NH3(5).HCN6.(1).实验2-1:思考:前三种溶液呈天蓝色大概与什么物质有关?根据是什么?四水合铜离子的结构简式:(2).实验2-2:试写出实验中发生的两个反应的离子方程式?(3).实验2-3中发生的反应的离子方程式?及其用途?例题一:下列分子中的中心原子杂化轨道的类型相同的是 ( ) A.CO2与SO2 B.CH4与NH3C.BeCl2与BF3 D.C2H2与C2H4例题二:下列分子或离子中都存在着配位键的是( )A.NH3、H2O B.NH4 +、H3O+C.N2、HClO D.[Cu(NH3) 4]2+、PCI3例题三: CO2、BF3、CH4都是非极性分子,NH3、H2S都是极性分子,由此可判断AB n形分子是否非极性分子的经验规律,下列叙述中正确的是( )A.所有原子在同一平面内 B.分子中不含有氢原子C.A的化合价等于主族序数(n>1)D.A的相对原子质量小于B例题四:对SO2与CO2说法正确的是( )A.都是直线形结构B.中心原子都采取sp杂化轨道C. S原子和C原子上都没有孤对电子D. SO2为V形结构, CO2为直线形结构例题五:指出下列分子中,中心原子可能采用的杂化轨道类型,并预测分子的几何构型。
(1)PCI3⑵BCl3⑶CS2 ⑷C12O(2)(3)(4)2019-2020年高中化学选修5酸酯学案人教版一.基础知识一、乙酸的组成与结构1、用结构式写出工业用乙醛制乙酸的方程式:2、写出乙酸的分子式、结构式、结构简式、电子式:二、乙酸的物理性质三、乙酸的化学性质1、酸性:(1)酸性强弱:(与碳酸比较)(2)电离方程式:(3)写出有关反应的离子方程式:A:与大理石反应:B:与小苏打溶液反应:C:试比较乙酸、乙醇、苯酚、碳酸、水中羟基的活泼性?2、酯化反应:(1)反应进行的条件:(2)酯化反应的概念:(3)浓硫酸的作用:四、有关练习:1、写出用普通乙醇(CH3CH2OH)与标记乙酸(CH3C18O18OH)在浓硫酸存在下反应的方程式,并求出生成的酯的分子量。




微型专题(三)分子(离子)立体构型与杂化轨道类型的判断题组一价层电子对互斥理论及应用1.下列物质的中心原子,带有一对孤电子对的是()A.H2O B.BeCl2C.CH4D.PCl3【考点】价层电子对互斥理论及应用【题点】价层电子对数目的计算与判断答案 D解析方法1:选项中四种物质的电子式依次为。
H2O有2对孤电子对,BeCl2和CH4没有孤电子对,PCl3有1对孤电子对。
方法2:将选项中各物质的未知数据代入公式:中心原子上的孤电子对数=12×(a-xb),经计算知,选项中原子上的孤电子对数依次为2、0、0、1。
2.下列有关价层电子对互斥理论的描述正确的是()A.价层电子对就是σ键电子对B.孤电子对数由分子式来确定C.分子的立体构型是价层电子对互斥的结果D.孤电子对数等于π键数【考点】价层电子对互斥理论及应用【题点】价层电子对互斥理论的应用答案 C解析价层电子对数是σ键电子对数与孤电子对数之和,孤电子对数是指没有成键的价电子对数,其与中心原子价层电子总数、与中心原子结合的原子最多能接受的电子数及与中心原子结合的原子数有关,A、B、D项错误。
3.下列有关描述正确的是()A.NO-3为V形分子B.ClO-3的立体构型为平面三角形C.NO-3的VSEPR模型、立体构型均为平面三角形D.ClO-3的VSEPR模型、立体构型相同【考点】 价层电子对互斥理论及应用 【题点】 价层电子对互斥理论的应用 答案 C解析 NO -3中N 原子的价层电子对数=3+12×(5-2×3+1)=3,没有孤电子对,故A 项错误,C 项正确;ClO -3中氯原子的价层电子对数=3+12×(7-3×2+1)=4,有1对孤电子对,VSEPR 模型为四面体形而立体构型为三角锥形,B 、D 项错误。
4.根据VSEPR 模型判断下列各组分子或离子结构相同的是( ) A .SO 2和CO 2 B .BF 3和NH 3 C .PH 3和H 2SD .CCl 4和NH +4【考点】 价层电子对互斥理论及应用 【题点】 价层电子对互斥理论的应用 答案 D解析 A 项中,SO 2分子中S 有一对孤电子对,而CO 2分子中没有孤电子对,因此SO 2为V 形而CO 2为直线形;B 项中,BF 3中B 无孤电子对,而NH 3中有一对孤电子对,因此其立体构型分别为平面三角形和三角锥形;C 项中,其立体构型分别为三角锥形和V 形;D 项中,中心原子的成键情况相同,故分子结构也相同,均为正四面体形。




