过敏原特异性IgE抗体检测试剂
- 格式:doc
- 大小:57.50 KB
- 文档页数:18

过敏原特异性抗体IgE ELISA 检测试剂盒说明书【用途】定性和定量检测过敏原特异性人IgE。
过敏反应是一种特殊的病理性免疫反应,是人体对一种或多种原本无害的物质产生不正常的反应。
其主要原因是患者吸入或食入含有过敏性物体刺激机体,触发细胞大量分泌药理活性物质,引起一系列过敏症状,例如过敏性哮喘,过敏性鼻炎,湿疹、发痒、流泪、皮炎以及肠胃道过敏症等。
同时产生相当量的E型免疫球蛋白(Immunoglobulin E 即Ig E),引起人类过敏反应的过敏原种类繁多,如能从中查到引起机体过敏的物质,就能很好地预防和治疗过敏反应。
本检测盒是一种用酶联免疫法(ELISA)快速、精确测定体内引起过敏反应的特异E型免疫球蛋白的体外诊断工具。
它可定性和定量地测定人体抗特种过敏原的E型免疫球蛋白在血清中的水平,从而帮助医生正确地诊断引起病人过敏反应的过敏原。
本过敏原检测盒适合于广泛的过敏原检测,特别适用于少儿患者,同时也非常适用于湿疹以及其他皮肤病患者和对皮试过敏的患者。
【检测原理】本试剂盒采用酶免ELISA法。
当具有过敏抗原固化于表面的载体与病人血清培养在一起后,血清中特异性IgE(一抗)就会特异地结合到抗原上,此特异结合的抗体可被酶联的二抗所识别,加入显色剂后,二抗所联的酶使显色剂呈蓝色,加终止液后呈黄色。
显色的深度与血清中特异性IgE成正比;能定性/半定量地检测血清中特异性IgE的浓度。
【检测盒组成】过敏原包被微孔酶标板(Coated Wells) 96wells HRP酶联二抗12 ml浓缩洗涤液(15X)(Washing Conc.) 40ml×1 TMB单组分显色液12 ml硫酸终止液(Stop Solution) 12ml 样本稀释液(Sample Diluent) 12 ml【检测动态范围】0.35 ~100 IU/ml (0.84ng ~ 240 ng/ml)。
【重现性】CV 10%~15%【重现性】0.30IU/ml (0.72ng/ml)【注意事项】1.严格按照规定的时间和温度进行温育以保证准确结果。


过敏原IgE检测试剂技术审查指导原则(征求意见稿)一、前言本指导原则旨在指导注册申请人对过敏原特异性抗体IgE和总IgE(Allergen-specific IgE and total IgE)检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对过敏原特异性抗体IgE和总IgE (Allergen-specific IgE and total IgE)检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
如申请人认为有必要增加本指导原则不包含的研究内容,可自行补充。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
二、适用范围IgE抗体介导的I型过敏反应性疾病相当普遍,世界各国变态反应疾病的总发病率约为15%-30%,我国大约有5-10%的人受过敏原的袭扰,是当前世界性的重大卫生学问题,被世界卫生组织(WHO)列为二十一世纪重点防治的三大疾病之一。
过敏性疾病是患者吸入、摄食入或者注入含有致敏成分的物质(称为过敏原或变应原,Allergen)后触发机体的B 细胞产生特异性免疫球蛋白E(Immunoglobulin E, IgE),IgE 以其Fc 段与肥大细胞或嗜碱性粒细胞的表面相应的FcεRI 结合,使机体处于对该过敏原的致敏状态。
当相同过敏原再次或多次进入致敏机体时,可与肥大细胞或嗜碱性粒细胞表面的IgE发生特异性结合,当过敏原与致敏细胞表面的两个或两个以上相邻的IgE结合时,发生FcεRI 交联,使肥大细胞和嗜碱性粒细胞活化,导致细胞脱颗粒并释放储存在细胞浆颗粒里的炎性介质——组胺,并通过花生四烯酸途径合成新介质——白三烯、免疫反应性前列腺素和IL4、IL5等细胞因子及趋化因子,从而引发过敏反应(或称变态反应,Allergy )的疾病及相关症状,如过敏性哮喘、枯草热、荨麻疹、过敏性鼻炎、湿疹、结膜炎及胃肠道I型过敏性疾病及严重过敏反应等。
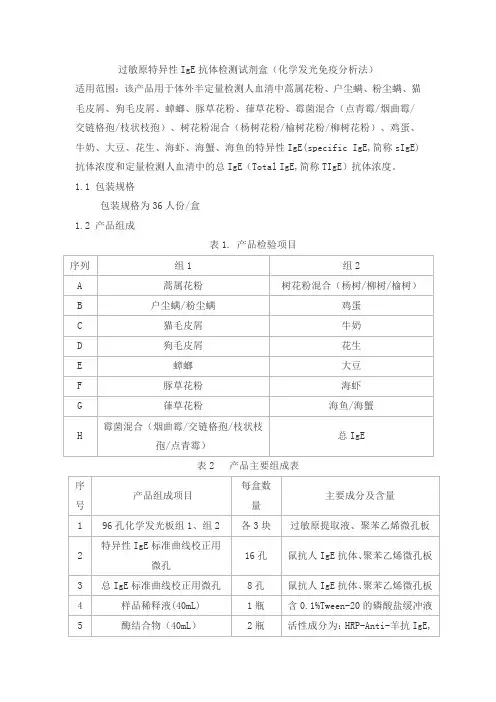
过敏原特异性IgE抗体检测试剂盒(化学发光免疫分析法)适用范围:该产品用于体外半定量检测人血清中蒿属花粉、户尘螨、粉尘螨、猫毛皮屑、狗毛皮屑、蟑螂、豚草花粉、葎草花粉、霉菌混合(点青霉/烟曲霉/交链格孢/枝状枝孢)、树花粉混合(杨树花粉/榆树花粉/柳树花粉)、鸡蛋、牛奶、大豆、花生、海虾、海蟹、海鱼的特异性IgE(specific IgE,简称sIgE)抗体浓度和定量检测人血清中的总IgE(Total IgE,简称TIgE)抗体浓度。
1.1 包装规格包装规格为36人份/盒1.2 产品组成表1. 产品检验项目表2 产品主要组成表2.1 外观外观应符合如下要求:2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无破损。
2.2 校准品溯源性按照GB/T 21415-2008标准,特异性IgE试剂盒校准品溯源到WHO人血清IgE国际标准品(WHO International Standard Immunoglobulin E(IgE),human serum)。
2.3 准确度2.3.1 特异性IgE2.3.1.1 偏差Ⅰ表3中过敏原偏差试验按以下方法操作:用WHO人血清IgE国际标准品(WHO International Standard Immunoglobulin E(IgE),human serum)标定的过敏原血清作为参考物质进行检测,其测量结果的相对偏差应在±25%范围内;表3:特异性IgE偏差试验Ⅰ中的过敏原Ⅱ表4中过敏原偏差试验按以下方法操作:用Phadia ImmunoCAP试剂标定分级级别的过敏原血清作为参考物质进行检测,其测量结果应该符合对应参考品的分级级别。
表4. 特异性IgE偏差试验Ⅱ中的过敏原2.3.1.2 符合率Ⅰ阳性符合率每种过敏原用5份过敏原阳性内部参考品检测,相应检测结果≥0.35IU/mL,不得出现阴性。
Ⅱ阴性符合率每个检测项目用5份相应过敏原阴性内部参考品检测,相应检测结果<0.35IU/mL,不得出现阳性。

DOI:10.13602/j.cnki.jcls.2020.11.03·过敏原检测·过敏原特异性IgE抗体定量检测试剂的性能验证 作者简介:杜文胜,1979年生,男,副主任技师,硕士,主要从事临床免疫检验工作。
通信作者:黄俊琼,主任技师,博士,教授,E mail:543369692@qq.com。
杜文胜1,朱杰华1,潘丽2,黎兵1,何应中1,陈莉1,黄俊琼1(1.遵义医科大学附属医院医学检验科,贵州遵义563003;2.玉溪市人民医院检验科,云南玉溪653100)摘要:目的 对某品牌过敏原IgE抗体定量检测试剂进行性能验证。
方法 参考美国临床和实验室标准协会(clinicalandla boratorystandardsinstitute,CLSI)及中华人民共和国医药行业标准YY/T1581 2018的相关文件,对符博克TM过敏原IgE抗体定量检测试剂进行准确度、检出限、线性、重复性、批间差、特异性验证,并与ImmunoCAP系统检测结果进行一致性评价。
结果 该试剂批内变异系数(CV)<10%,批间CV<20%,与WHO11/234标准品的相对偏差<15%,回收率为85%~115%,检出限≤0.35IU/mL,稀释线性相关系数>0.99,对总IgE浓度>60IU/mL的样本、IgA浓度>700μg/mL的样本、IgM浓度>500μg/mL的样本、IgG浓度>7000μg/mL的样本的测定浓度均不高于检出限(0.35IU/mL)。
与ImmunoCAP系统进行方法学比对,屋尘螨、粉尘螨、屋尘、艾蒿、鸡蛋、牛奶6个项目Kappa值均>0.75。
结论 该过敏原特异性IgE抗体的定量检测试剂具有良好的准确度、检出限、线性、重复性、批间差、特异性,与ImmunoCAP系统具有较高的一致性,具备临床推广价值。
关键词:过敏原;IgE抗体;定量检测;性能验证中图分类号:R446.6;R56 文献标志码:APerformanceverificationforallergenspecificIgEantibodyquantitativedetectionreagentsDUWensheng1,ZHUJiehua1,PANLi2,LIBing1,HEYingzhong1,CHENLi1,HUANGJunqiong1(1.DepartmentofMedicalLaboratory,AffiliatedHospitalofZunyiMedicalUniversity,Zunyi563003,Guizhou;2.DepartmentofClinicalLaboratory,YuxiPeople′sHos pital,Yuxi653100,Yunnan,China)Abstract:Objective ToverifytheperformanceofabrandofallergenIgEantibodyquantitativedetectionreagents.Methods AccordingtotherelevantdocumentsofClinicalandLaboratoryStandardsInstitute(CLSI)andpharmaceuticalindustrystandardsofthePeople′sRepublicofChinaYY/T1581 2018,theaccuracy,detectionlimit,linearity,repeatability,inter assayvariationandspecific ityofHOBTMallergenIgEantibodyquantitativedetectionreagentswereverified,andtheconsistencywasevaluatedbycomparingwiththeresultsoftheImmunoCAPsystem.Results Theintra assaycoefficientsofvariation(CV),inter assayCV,recovery,detectionlimitandlinearcorrelationcoefficientofthereagentswere<10%,<20%,85%-115%,≤0.35IU/mLand>0.99,respectively.TherelativedeviationbetweenthereagentsandWHO11/234standardmateiralswasbelow15%.WhenthesampleswithtotalIgE>60IU/mL,IgA>700μg/mL,IgM>500μg/mLorIgG>7000μg/mLweredetectedbythereagents,theconcentrationsofallergenspecificIgEantibodywerenothigherthanthedetectionlimit(0.35IU/mL).ComparedwiththeImmunoCAPsystem,theKappavaluesof6items,includingdermatophagoidespteronyssinus,dermatophagoidesfarinae,housedust,mugwort,eggandmilk,werehigherthan0.75.Conclusion HOBTMallergenspecificIgEantibodyquantitativedetectionreagentshavegoodaccuracy,detectionlimit,linearity,repeatability,inter assayvariationandspecificity,andhavehighconsistencywiththeImmunoCAPsystem,indicatingthattheyhaveclinicalapplicationvalue.Keywords:allergen;IgEantibody;quantitativedetection;performanceverification临床常见的过敏性疾病以Ⅰ型变态反应为主,即由IgE抗体所介导,多表现为过敏性鼻炎、特异性皮炎、过敏性哮喘等症状,发病率逐年上升[1 2]。

吸入性/食物性过敏原特异性IgE抗体检测试剂盒(免疫印迹法)适用范围:用于定性检测人血清中的柳树/杨树/榆树、普通豚草、艾蒿、屋尘螨/粉尘螨、屋尘、猫毛、狗上皮、蟑螂、点青霉/分枝孢霉/烟曲霉/交链孢霉、葎草、鸡蛋白、牛奶、花生、黄豆、鳕鱼/龙虾/扇贝、虾、蟹过敏原特异性IgE 抗体。
1.1 试剂盒规格20人份/盒(7项、10项、17项)1.2 试剂盒型号吸入性/食物性过敏原特异性IgE抗体检测试剂盒(7项):鸡蛋白、牛奶、花生、黄豆、鳕鱼/龙虾/扇贝、虾、蟹;吸入性/食物性过敏原特异性IgE抗体检测试剂盒(10项):柳树/杨树/榆树、普通豚草、艾蒿、屋尘螨/粉尘螨、屋尘、猫毛、狗上皮、蟑螂、点青霉/分枝孢霉/烟曲霉/交链孢霉、葎草;吸入性/食物性过敏原特异性IgE抗体检测试剂盒(17项):柳树/杨树/榆树、普通豚草、艾蒿、屋尘螨/粉尘螨、屋尘、猫毛、狗上皮、蟑螂、点青霉/分枝孢霉/烟曲霉/交链孢霉、葎草、鸡蛋白、牛奶、花生、黄豆、鳕鱼/龙虾/扇贝、虾、蟹;1.3 试剂盒组成及规格见表1表1 试剂盒的组成及规格2.1 外观2.1.1 产品包装完整、标签清晰。
液体试剂中,样品稀释液、底物液和酶标二抗为淡黄色,其它试剂为无色,均无混浊,无未溶物。
2.1.2 检测膜条干净、无污渍、无破损。
2.2 膜条尺寸宽度: 2±0.5mm2.3 装量及组件数量检查见1.3,其中装量应不少于标示值。
2.4 阴性符合率用N1-N10总计10份阴性参考品进行检测,各项检测指标检测结果均为阴性。
2.5阳性符合率用P26-P45总计20份企业阳性参考品进行检测,各项检测指标检测结果应符合企业阳性参考品结果。
2.6最低检出限应小于或等于0.35IU/mL。
2.7分析特异性用N11-N15总计5份分析特异性企业参考品进行检测,各项检测指标检测结果均为阴性。
其中,N11为花生特异性IgG抗体阳性,N12为黄豆特异性IgG抗体阳性,N13为虾特异性IgG抗体阳性,N14葎草特异性IgG抗体阳性,N15为屋尘螨/粉尘螨特异性IgG抗体阳性。
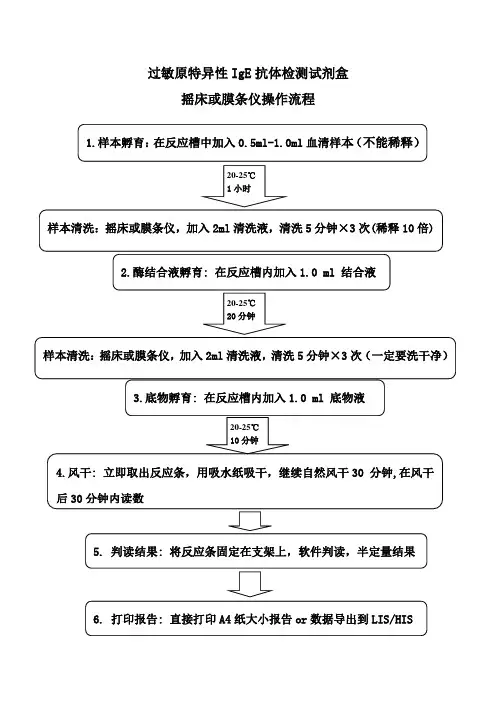
过敏原特异性IgE抗体检测试剂盒
摇床或膜条仪操作流程
1.样本孵育:在反应槽中加入0.5ml-1.0ml血清样本(不能稀释)
2.酶结合液孵育: 在反应槽内加入1.0 ml 结合液
5.判读结果: 将反应条固定在支架上,软件判读,半定量结果
6. 打印报告: 直接打印A4纸大小报告or数据导出到LIS/HIS
欧博克(包括总IgE)操作注意事项
一、手工操作注意事项
1、取膜条的时候,不要触碰过敏原反应区,避免污染抗原包被区域;
2、4项,7项,14项欧博克试剂盒说明书要求血清样本用样本稀释液稀
释后加入,但实际操作中样本不能稀释,且血清的量必须是能够覆
盖过敏原反应区,一般要0.5ml;后面的反应步骤请按照流程图的
指引来完成。
3、10项欧博克试剂盒说明书中是浸泡式孵育和自来水冲洗,为了保证
实验的标准化,请按照流程图来完成,血清的量也是以能够覆盖过
敏原反应区为准,一般要0.5ml。
4、在实验过程中,注意是否有膜条翻转并及时调整过来;
5、结合液反应完后的清洗步骤一定要清洗干净,否则会出现花条或整
个背景偏深,影响结果的判读。
必要时可以将清洗时间延长到
8min。
6、反应结束时应立即取出膜条,在晾干后30min内读数。
一、上机操作注意事项
1、因为我们目前结合液和底物的瓶子还没有刻度,所以在每次试验之
前,一定要确保结合液与底物液量足够该次试验用量,管理占液量
约为3.2-3.5ml,试剂瓶中的最低液量为反应条数N*1+3.5ml。
2、试验前后一定要将管路清洗干净,同时发现背景偏深时要观察吸液
后的废液残留量是否过多,如超过30ul就需要调整吸液系统。

附件2之老阳三干创作过敏原特异性IgE抗体检测试剂技术审查指导原则本指导原则旨在指导注册申请人对过敏原特异性IgE抗体(Allergenspecific IgE)检测试剂注册申报资料的准备及撰写, 同时也为技术审评部份审评注册申报资料提供参考.本指导原则是对过敏原特异性IgE抗体(Allergenspecific IgE)检测试剂的一般要求, 申请人应依据产物的具体特性确定其中内容是否适用, 若不适用, 需具体论述理由及相应的科学依据, 并依据产物的具体特性对注册申报资料的内容进行充分和细化.如申请人认为有需要增加本指导原则不包括的研究内容, 可自行弥补.本指导原则是供申请人和审查人员的指导文件, 不涉及注册审批等行政事项, 亦不作为法规强制执行, 如有能够满足法规要求的其他方法, 也可以采纳, 但应提供详细的研究资料和验证资料.应在遵循相关法规的前提下使用本指导原则.本指导原则是在现行法规、标准体系及以后认知水平下制定的, 随着法规、标准的不竭完善和科学技术的不竭发展, 本指导原则相关内容也将适时进行调整.一、范围I型过敏反应性疾病相当普遍, 人群总发病率高达10%~30%,是以后世界性的重年夜卫生学问题, 被世界卫生组织(WHO)列为二十一世纪重点防治的三年夜疾病之一.过敏性疾病是患者吸入、食入或者注入含有致敏成份的物质(称为过敏原或变应原, Allergen)后触发机体的B细胞发生特异性免疫球卵白E(Immunoglobulin E, IgE), IgE以其Fc 段与肥年夜细胞或嗜碱性粒细胞的概况相应的FcεRI结合, 使机体处于对该过敏原的致敏状态.当相同过敏原再次或屡次进入致敏机体时, 可与肥年夜细胞或嗜碱性粒细胞概况的IgE发生特异性结合, 当过敏原与致敏细胞概况的两个或两个以上相邻的IgE结合时, 发生FcεRI 交联, 使肥年夜细胞和嗜碱性粒细胞活化, 招致细胞脱颗粒并释放贮存在细胞浆颗粒里的炎性介质——组胺, 并通过花生四烯酸途径合成新介质——白三烯、免疫反应性前列腺素和IL4、IL5等细胞因子及趋化因子, 从而引发过敏反应(或称反常反应, Allergy)的疾病及相关症状, 如过敏性哮喘、枯草热、荨麻疹、过敏性鼻炎、湿疹、结膜炎及胃肠道I型过敏性疾病及严重过敏反应等.上述过敏性疾病的发生, IgE抗体起关键作用.I型过敏反应性疾病的特征是患者体内循环血液中的过敏原特异性IgE抗体浓度较正常状况下高, 且特异性IgE抗体浓度越高, 诊断过敏性疾病的概率越高.本指导原则适用于过敏原特异性IgE抗体检测试剂, 包括总IgE和特异性IgE, 同时适用于分歧的检测方法(原理).本指导原则适用于申请产物注册和相关许可事项变更的产物.二、基本要求(一)综述资料综述资料主要包括产物预期用途、产物描述、有关生物平安性的说明、有关产物主要研究结果的总结和评价以及同类产物在国内外批准上市的情况介绍等外容, 其中同类产物上市情况介绍部份应着重从主要原资料、检出限、阳性判断值或者参考区间等方面写明拟申报产物与目前市场上已获批准的同类产物之间的主要区别, 同时应对申报的每一个过敏原具体项目进行详尽的论述, 分别论述每个过敏原的具体特点及相关信息.综述资料的撰写应当符合《体外诊断试剂注册管理法子》(国家食品药品监督管理总局令第5号)(以下简称《法子》)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告第44号)(以下简称44号公告)的相关要求.(二)主要原资料的研究资料若主要原资料为申请人自己生产, 其生产工艺必需稳定;如主要原资料源于外购, 应提供的资料包括:供货方提供的质量标准、出厂检定陈说以及申请人对到货后主要原资料的质量检验资料.除上述内容外, 建议申请人依照以下要求提交研究资料:1.企业内部参考品的制备、定值过程.详细论述参考品中过敏原特异性IgE抗体的鉴定方法和浓度确认方法, 鉴定方法应科学合理并采纳国际公认的方法、金标准方法或临床诊断等方法综合进行确认.浓度确认应采纳国家或国际标准品进行溯源.应分别对每一个过敏原项目进行研究.2.质控品的制备、定值过程应参照企业内部参考品的制备方法进行.3.过敏原主要原资料的研究资料.(1)无论是天然提取抗原, 还是基因工程重组抗原, 均应对原料进行详细分析研究, 至少包括主要过敏原(致敏)卵白的特异性、分子量、纯度、致敏卵白含量、反应性:生物活性, 效价(抑制试验)等外容.(2)对以上要求的指标应给出具体的研究方案、研究方法、实验过程、试验数据、相关图谱等外容.(3)如为自制抗原, 还需提供详细的抗原鉴定、提取、制备、生产等的研究资料.(4)如为外购原资料, 还需提供过敏原等主要原资料的出厂陈说及进货检验陈说.(5)对其他主要原资料, 如二抗、工具酶、包被板等原资料, 应提供主要原资料的选择、制备及质量标准等外容的详细研究资料及试验数据.(三)主要生产工艺及反应体系的研究资料1.主要生产工艺介绍, 可用流程图方式暗示, 并简要说明主要生产工艺简直定依据.2.产物基本反应原理介绍.3.主要生产工艺过程的研究资料、每一步生产工艺简直认资料及试验数据.4.主要反应体系的研究资料、每一步反应体系简直认资料及试验数据.(四)分析性能评估资料申请人应提交在产物研制或制品验证阶段对试剂盒所有的分析性能进行研究的资料, 对每项分析性能的研究都应包括具体研究目的、实验设计、研究方法、可接受标准、实验数据、统计方法等详细资料.有关分析性能研究的布景信息也应在注册申报资料中有所体现, 包括研究地址(实验室)、适用仪器、试剂规格、批号、临床样原根源等.分析性能研究的实验方法, 可以参考国内或国际有关体外诊断产物性能评估的指导原则.对总IgE抗体的检测, 不建议进行定性检测, 应采纳定量及半定量检测, 所有分析性能也应根据定量或半定量检测试剂的要求进行评估.对过敏原IgE抗体检测试剂, 建议着重对以下分析性能进行研究.1.提供参考品(国家参考品、企业参考品)的验证资料.最低检出限简直定及验证应采纳适当的参考品进行, 最低检出限参考品应进行精确的浓度确认.对定性检测产物, 可采纳每一浓度样本至少20次的检测情况对最低检出限进行研究, 选取90%~95%检出率的浓度水平作为最低检出限;对定量检测产物, 可采纳每一浓度样本至少10次的检测情况对最低检出限进行研究, 选取CV值≤20%的浓度水平作为最低检出限.过敏原特异性IgE抗体的检测限建议不高于0.35IU/ml, 总IgE 抗体的检测限建议不高于3~5 IU/ml, 可采纳稀释或系列参考品的方式进行研究, 但应保证分歧浓度的样本同时包括上述两个浓度及其邻近的浓度, 明确写明最低检出限邻近浓度的检测情况,如过敏原特异性IgE抗体浓度在0.30IU/ml水平的检测情况、总IgE 抗体在阳性判断值附近浓度的检测情况.对包被过敏原为混合过敏原(非组合)的产物, 应对可检测项目中的每一个过敏原项目进行最低检出限的评价及验证.对定量或半定量检测的试剂, 均应当进行线性范围的研究.线性范围确定的研究应使用高值临床样本(由可溯源至国家参考品/国际参考品的方法定量)进行梯度稀释, 稀释液应使用经确认为相应过敏原项目检测结果为阴性的混合人血清或血浆, 建议应包括很多于9个浓度(应包括接近最低检测限的临界值浓度, 同时满足国家或国际分级标准的要求), 通过评价一定范围内的线性关系及各水平的准确度确定该产物的线性范围.瞄准确度的评价, 可采纳与国家/国际参考品的偏差、回收试验或者方法学比对等方法进行, 申请人可根据实际情况选择合理方法进行研究.详细描述评价方法中样本的制备过程、评价方案、试验过程、试验数据、统计方法、研究结论等外容.除上述资料之外, 对过敏原特异性IgE抗体检测试剂, 建议提供至少50例与临床诊断结果比对的研究资料, 对极为罕见的过敏原特异性IgE抗体检测项目, 可提供至少30例与临床诊断结果比对的研究资料.精密度的评价方法并没有统一的标准可依, 可根据分歧产物特征或申请人的研究习惯进行, 前提是必需保证研究的科学合理性, 具体实验方法可以参考相关的美国临床实验室标准化协会批准指南(CLSIEP)或国内有关体外诊断产物性能评估的文件进行.申请人应对每项精密度指标的评价标准做出合理要求, 如标准差或变异系数的范围等.针对本类产物的精密度评价主要包括以下要求:(1)至少应在产物检测阴性、最低检出限浓度、医学决定水平(Cutoff值)浓度进行精密度的评价.①阴性样本(质控品):应尽量采纳高值阴性样本(质控品)进行(n≥20), 如最低检出限浓度为0.35IU/ml, 可选择0.30IU/ml浓度作为评价样本浓度.②最低检出限浓度样本(质控品):待测物浓度应接近产物的最低检出限(n≥20).③医学决定水平(Cutoff值)浓度样本(质控品):根据产物设计的Cutoff值确定样本(质控品)的浓度(n≥20).(2)合理的精密度评价周期, 例如:为期至少20天的连续检测, 每天至少由2人完成很多于2次的完整检测, 从而对批内/批间、日内/日间以及分歧把持者之间的精密度进行综合评价.如有条件, 申请人应选择分歧的实验室进行重复实验以对室间精密度进行评价.(1)交叉反应在进行交叉反应的研究过程中, 对过敏原的选择建议考虑以下内容:生物学分类的相近性、基因组或结构的守旧性和同源性、过敏原卵白AA序列以及立体结构的类同性、IgE抗体结合表位在构象/拓扑学的兼容性.①应采纳与被检过敏原卵白在组成或结构上部份相同或者具有相近性的过敏原特异性IgE抗体阳性样本进行交叉反应研究.②建议采纳高浓度的过敏原特异性IgE抗体阳性样本进行交叉反应研究, 应明确抗体浓度.③申请人应对进行交叉反应研究的过敏原特异性IgE抗体阳性样本简直认方法进行详细论述, 并提供详细简直认资料和数据, 如:是否经过其他方法检测、经过金标准简直认或经过临床诊断简直认等.④亦可采纳抗原电泳分析致敏卵白的方法进行研究.至少应对公认的可能具有交叉反应的过敏原项目进行验证, 建议对每种过敏原至少选取2~3个可能发生交叉反应的过敏原进行研究.(2)干扰物质①对样本中罕见的内源性干扰物质进行研究, 如血红卵白、甘油三酯或胆固醇、胆红素、类风湿因子(RF)、抗核抗体(ANA)、抗线粒体抗体(AMA)等, 确定可接受的干扰物质极限浓度.建议采纳被测物阴性及最低检出限浓度对每种干扰物质的干扰影响进行评价.②对高浓度的非特异性人IgA、IgG、IgM、IgD抗体阳性样本进行评价, 建议采纳被测物阴性及最低检出限浓度进行研究.③对含有高浓度总IgE抗体的特异性IgE抗体阴性或弱阳性样本进行评价.干扰物质研究的样本可采纳临床或模拟添加样本进行验证, 样本量选择应体现一定的统计学意义.7.钩状(HOOK)效应须采纳高浓渡过敏原特异性IgE抗体阳性血清进行梯度稀释后由低浓度至高浓度开始检测, 每个梯度的稀释液重复3~5份, 对钩状效应进行合理的验证.应给出不会发生钩状效应的抗体最高浓度, 并在产物说明书上明示对钩状效应的研究结果.应提交详细的溯源性研究资料, 该类产物有国际标准品, 产物检测结果的量值必需溯源至国际标准品.对企业内部参考品、标准品、质控品均应提供详细的溯源资料, 包括溯源方案、溯源方法、溯源过程、溯源步伐, 溯源过程中每一步的不确定度的计算等外容.(五)阳性判断值或参考区间确定资料对过敏原特异性IgE抗体检测试剂, 分歧过敏原检测项目的阳性判断值可能纷歧致, 因此应根据分歧项目分别给出适于中国人群的阳性判断值, 提供详细的研究资料.如将阳性判断值确定为0.35IU/ml或者依照国际或国家分级标准的分歧级别对阳性判断值进行设定, 则应当说明确定或者设定的具体依据, 并提供详细的验证资料.对总IgE抗体检测试剂, 应给出参考区间, 应依照分歧的年龄段分别进行参考区间的研究, 并提供详细的研究资料.(六)稳定性研究资料稳定性研究资料主要涉及两部份内容, 申报试剂的稳定性和适用样本的稳定性研究.前者主要包括实时稳定性(有效期)、运输稳定性、开瓶稳定性等研究, 申请人可根据实际需要选择合理的稳定性研究方案.稳定性研究资料应包括研究方法简直定依据、具体的实施方案、详细的研究数据以及结论.对实时稳定性研究, 应提供至少三批样品在实际贮存条件下保管至制品有效期后的研究资料.应对样本稳定性进行研究, 主要包括室温保管、冷藏和冷冻条件下的有效期验证, 可以在合理的温度范围内选择温度点(温度范围), 每间隔一定的时间段即对贮存样本进行全性能的分析验证, 从而确认分歧类型样本的效期稳定性.适于冷冻保管的样本还应对冻融次数进行评价.试剂稳定性和样本稳定性两部份内容的研究结果均应在说明书【贮存条件及有效期】和【样本要求】两项中进行详细说明.(七)临床评价资料临床试验总体要求及资料内容应符合《体外诊断试剂临床试验技术指导原则》、《法子》和44号公告的规定, 以下仅根据过敏原检测试剂的特点对其临床试验中应重点关注的内容进行论述.对该类试剂已有同类产物上市的, 依照法规要求应选择境内已批准上市、临床普遍认为质量较好的同类产物作为比较试剂, 采纳试验用体外诊断试剂(以下称考核试剂)与之进行比较试验研究, 证明考核试剂与已上市产物等效.如无已上市同类产物的, 应根据产物设计的具体用途进行临床试验.综合临床检测结果、病例临床资料、其他检测检查结果(病史、皮肤试验、激发试验)、患者治疗情况等多方面因素进行综合判断以评价产物检测结果是否准确.应充沛考虑地区性不同, 由于过敏原检测项目很多, 包括各种食物、吸入性、注入性等过敏原, 而且过敏症状的发生存在季节性, 所以应充沛考虑各种过敏原的地区性不同、发病时间的分歧、流行病学的不同选择有代表性的单位进行临床试验, 应尽量选择分歧省分的临床单位.对组合过敏原检测项目(套组, 非混合), 每一个检测项目应分别进行统计, 且应满足至少1000例的要求, 对每一个检测项目病例选择中应包括一定命量的交叉反应样本, 以评价产物检测的特异性.对每一过敏原检测(陈说)项目均应提供年夜于30~50例检测结果与临床诊断结果比对的临床资料, 应随机选择病例, 先选择高度怀疑的临床病例, 再通过样本检测进行比对, 比对病例应保证一定的阳性率, 并提供详细的病例情况(包括病史、临床诊断方法、各种检测结果等), 建议在反常反应科、呼吸科、消化科等临床专业科室进行临床试验.对适用于对多个样本类型进行检测的产物, 如分歧样本类型之间具有可比性, 应至少完成一个样本类型很多于1000例的临床研究, 同时再进行很多于 200例同一患者分歧样本类型之间的比力研究.如样本类型中包括指尖全血或静脉全血等全血样本, 应至少进行300例同一患者全血样本与血清或者血浆样本的比对临床资料.对定性检测试剂至少应计算阳性符合率、阴性符合率、总符合率, 并以四格表的形式进行列表, 并对定性结果进行Kappa检验以验证检测结果的一致性.对定量和半定量检测试剂除计算阳性符合率、阴性符合率、总符合率外, 还应进行相关性分析, 给出相关系数, 进行回归分析给出回归方程和试验数据的散点图, 并对相关系数和回归方程的斜率进行显著性分析.对半定量检测产物还应对检测的分级结果进行统计, 明确分级存在差此外样本数量和分级不同情况, 同时提供样本检测结果的频率分布图.对两种试剂的检测结果有纷歧致(检测结果不同较年夜)的样本, 应采纳临床上公认较好的第三种同类试剂进行复核, 同时结合患者的临床病情、临床资料对不同原因及可能结果进行分析.对半定量检测产物, 在检测结果阴阳性判定一致的情况下, 如分级不同即是或年夜于2个级别, 应采纳第三种方法进行复核.对选择的交叉反应样本应独自列出并独自进行统计, 并对检测结果进行详细描述, 并对可能发生交叉反应的原因进行详尽描述.7.临床试验结果应提供原始临床试验数据.8.对在同一膜条上同时包括总IgE抗体和特异性IgE抗体检测项目的产物, 应分别提供每个检测项目与定量检测试剂检测结果的比对研究资料, 每个项目应包括分歧阳性强度的样本.(八)产物风险分析资料基本要求应符合44号公告的要求, 同时考虑到过敏原特异性IgE抗体检测可能存在一定的交叉反应, 而且过敏原特异性IgE 抗体的浓度与患者的临床症状并没有绝对相关性, 因此申请人应根据这些不确定的因素分析产物应用可能存在的风险.(九)产物技术要求产物技术要求应符合《法子》和44号公告的要求.申请人应当在原资料质量和生产工艺稳定的前提下, 根据产物研制、分析性能评估等结果, 依据国家标准、行业标准及有关文献, 依照《医疗器械产物技术要求编写指导原则》的有关要求, 编写产物技术要求.如果拟申报产物已有适用的国家/行业标准发布, 则产物技术要求的内容应不低于适用标准.定性产物应进行参考品的检测, 定量产物除进行参考品的检测外还应进行线性的评价.每个项目均须进行最低检出限和阳性参考品符合率的检测.性能指标及检验方法中应明确写明阳性参考品所包括的检测项目.(十)产物注册检验陈说根据《法子》及44号公告的要求, 申请注册的第三类产物应在具有相应医疗器械检验资质的医疗器械检验机构进行连续3个生产批次样品的注册检验.目前, 过敏原IgE抗体检测试剂尚无适用的国家参考品, 可采纳企业参考品进行注册检验, 但企业参考品的具体信息应明确,如IgE抗体浓度、过敏原检测项目简直定方法等.如有适用的国家参考品/标准品发布, 则申请人应采纳国家参考品/标准品进行注册检验, 并在产物技术要求中写明相应内容.(十一)产物说明书产物说明书承载了产物预期用途、检验原理、检验方法、检验结果的解释以及注意事项等重要信息, 是指导实验室工作人员正确把持、临床医生针对检验结果给出合理医学解释的重要依据, 因此, 产物说明书是体外诊断试剂注册申报最重要的文件之一.产物说明书格式应符合《体外诊断试剂说明书编写指导原则》的要求, 境外产物的中文说明书除格式要求外, 其内容应尽量坚持与原文说明书的一致性, 翻译力求准确且符合中文表达习惯.产物说明书的所有内容均应与申请人提交的注册申报资料中的相关研究结果坚持一致, 如某些内容引用自参考文献, 则应以规范格式对此内容进行标注, 并独自列明参考文献的相关信息.结合《体外诊断试剂说明书编写指导原则》的要求, 下面对过敏原特异性IgE抗体(Allergenspecific IgE)检测试剂说明书的重点内容进行详细说明, 以指导注册申请人更合理地编写产物说明书.1.【产物名称】可以根据拟申报产物的具体特点增加描述性语言, (吸入组1或2)、(食物组1或2)、(综合组1或2)等, 如组合过敏原检测项目命名为“过敏原特异性IgE抗体检测试剂盒(吸入组1/化学发光法)”, 以更好的区分分歧的产物.2.【预期用途】应至少包括以下几部份内容:(1)试剂盒用于××检测人×××样本中的过敏原特异性IgE抗体和/或总IgE抗体.其中, ××应依照产物类型写明具体为定性、半定量还是定量检测, ×××应写明适用的样本类型为血清、血浆还是全血, 上述内容均应有相应的分析性能评估资料和临床试验资料支持.对总IgE抗体检测试剂, 不建议声称定性检测用途, 对过敏原特异性IgE抗体检测试剂, 还应当逐项列明能够检测的具体过敏原项目.(2)应当说明该试剂不建议用于健康人群体检, 检测结果阳性或者阴性仅代表相应的IgE抗体检测结果阳性或阴性, 与患者是否患病的相关性不确定, 不得作为患者病情评价的唯一指标, 必需结合患者临床暗示和其他实验室检测对病情进行综合分析.(3)待测人群特征介绍:应分分歧的年龄段、性别进行简单介绍, 并对检测结果及患者临床症状之间的关系进行描述.(4)对过敏反应的机理进行简单的介绍.(5)临床用途:说明与预期用途相关的临床适应症布景情况, 说明相关的临床或实验室诊断方法, 应对每个过敏原分别进行编写.3.【贮存条件及有效期】说明试剂盒的效期稳定性、开封稳定性、运输稳定性等, 应标明具体的贮存条件及有效期.4.【阳性判断值或者参考区间】(1)明确产物的溯源情况, 无论定量或是定性产物, 其检测结果量值均须溯源至国际或国家标准品, 应以IU/ml作为单位或提供与国际单位的换算单位.(2)分别列出总IgE抗体(建议进行定量检测)和每个过敏。

特应性过敏原(中国组合)检测试剂盒标准操作流程1方法欧蒙印迹法2原理用于体外半定量检测人血清或血浆中吸入性和食物性过敏原特异性IgE抗体。
试剂盒中的检测膜条上平行包被了21种不同的吸入性和食物性过敏原。
经缓冲液预处理的检测膜条与患者样本进行第一步温育。
如果样本阳性,IgE类特异性抗体与相应的过敏原结合。
为检测结合的抗体,加入酶标单克隆的抗人IgE抗体(酶结合物)进行第二步温育,然后加入酶底物,发生颜色反应。
3试剂品牌、编号、代号、包装、规格(表1)表1 德国欧蒙医学实验诊断有限公司试剂1601(16)4试剂成分4.1包被过敏原的检测膜条:ts20, w1, w6, ds1, h1, e1, e2, i6, ms1, u80, f1, f2, f13, f14,f27,f88, fs33, fs34, f23,f234,CCD 。
4.2酶结合物: 碱性磷酸酶标记的抗人IgE(小鼠),直接使用。
4.34. 色原/底物液:四唑硝基苯胺兰/5-溴-4-氯啶-3-吲哚-磷酸盐(NBT/BCIP),直接使用。
4.4通用缓冲液: 10倍浓缩。
5仪器品牌、型号摇床、扫描仪6检测时间根据样本稀释度与加样量不同检测时间略有不同。
7标本要求待测样本在2-8℃可以稳定14天,已稀释的样本应在同一个工作日内检测。
8试剂准备同一批号试剂盒中各个组分互相匹配,不能与其它批号试剂盒中的组份混用。
所有试剂均应在室温(18-25℃)平衡30分钟后方可使用;液体试剂使用前应充分混匀。
从第一次使用起,试剂盒如保存在2-8℃,并且在没有污染的情况下,可稳定至所标示的有效期。
9操作步骤9.1预处理:当膜条平衡到室温后打开包装,取出所需的膜后应立即密封好原包装并将其保存于2-8℃。
先将10倍浓缩的通用缓冲液充分混匀,如需温育一条检测膜条,可取5ml浓缩缓冲液加入到45ml蒸馏水或去离子水中进行稀释。
稀释后的缓冲液应在同一个工作日用完。
将模条上有编码的一面朝上放入温育槽中,用移液枪吸取1ml的稀释好的通用缓冲液加入到温育槽中,于室温条件下在摇摆摇床上温育5分钟。

过敏原特异性IgE抗体检测试剂盒(胶体金免疫层析法)产品技术要求xhl过敏原特异性IgE抗体检测试剂盒(胶体金免疫层析法)适用范围:该产品用于体外定性检测人血清中针对蒿属花粉/豚草花粉、户尘螨/粉尘螨、猫毛皮屑、狗毛皮屑、大豆、鸡蛋、牛奶、杨树/柳树/榆树花粉变应原的特异性IgE抗体。
1.1 包装规格:25人份/盒。
1.2 主要组成成分:2.1 外观检查外观应符合如下要求:2.1.1试剂盒各组分应齐全、完整,密封包装无漏气、破损;2.1.2包装、标签无破损,文字清晰。
2.1.3铝箔袋内检测卡外观平整,物料贴附牢固,内容齐全。
2.2 物理检查试纸条的宽度应不低于4mm;液体移行速度应不低于5mm/min。
2.3 阴性符合率应为(-/-)20/20。
2.4 阳性符合率每个过敏原检测项阳性符合率均应为(+/+)5/5。
2.5 最低检测限每个过敏原检测项对应最低检测限质控品L1和L2的检测结果均应为阳性,L3应为阴性。
2.6 精密度每个过敏原检测项10个测试之间反应结果一致,显色度均一。
2.7 稳定性2.7.1热稳定性试验:试剂盒于37±1℃放置6天,检测2.1~2.6各项,结果应符合2.1~2.6各项目要求。
2.7.2效期稳定性试验:试剂盒在2℃~30℃保存,取到效期后的试剂盒,检测2.1~2.6各项,结果应符合2.1~2.6各项目要求。
2.8 批间差三批每个过敏原检测项各10个精密度质控品测试之间反应结果应一致,显色度均一。
2.9 特异性测10份特异性质控品血清(S1~S10),其结果为阴性。

过敏原IgE检测试剂技术审查指导原则(征求意见稿)一、前言本指导原则旨在指导注册申请人对过敏原特异性抗体IgE和总IgE(Allergen-specific IgE and total IgE)检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对过敏原特异性抗体IgE和总IgE (Allergen-specific IgE and total IgE)检测试剂的一般要求,申请人应依据产品的具体特性确定其中容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的容进行充实和细化。
如申请人认为有必要增加本指导原则不包含的研究容,可自行补充。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关容也将适时进行调整。
二、适用围IgE抗体介导的I型过敏反应性疾病相当普遍,世界各国变态反应疾病的总发病率约为15%-30%,我国大约有5-10%的人受过敏原的袭扰,是当前世界性的重大卫生学问题,被世界卫生组织(WHO)列为二十一世纪重点防治的三大疾病之一。
过敏性疾病是患者吸入、摄食入或者注入含有致敏成分的物质(称为过敏原或变应原,Allergen)后触发机体的B 细胞产生特异性免疫球蛋白E(Immunoglobulin E, IgE),IgE 以其Fc 段与肥大细胞或嗜碱性粒细胞的表面相应的FcεRI 结合,使机体处于对该过敏原的致敏状态。
当相同过敏原再次或多次进入致敏机体时,可与肥大细胞或嗜碱性粒细胞表面的IgE发生特异性结合,当过敏原与致敏细胞表面的两个或两个以上相邻的IgE结合时,发生FcεRI 交联,使肥大细胞和嗜碱性粒细胞活化,导致细胞脱颗粒并释放储存在细胞浆颗粒里的炎性介质——组胺,并通过花生四烯酸途径合成新介质——白三烯、免疫反应性前列腺素和IL4、IL5等细胞因子及趋化因子,从而引发过敏反应(或称变态反应,Allergy )的疾病及相关症状,如过敏性哮喘、枯草热、荨麻疹、过敏性鼻炎、湿疹、结膜炎及胃肠道I型过敏性疾病及严重过敏反应等。
附件2过敏原特异性IgE抗体检测试剂技术审查指导原则本指导原则旨在指导注册申请人对过敏原特异性IgE抗体(Allergenspecific IgE)检测试剂注册申报资料得准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则就是对过敏原特异性IgE抗体(Allergenspecific IgE)检测试剂得一般要求,申请人应依据产品得具体特性确定其中内容就是否适用,若不适用,需具体阐述理由及相应得科学依据,并依据产品得具体特性对注册申报资料得内容进行充实与细化。
如申请人认为有必要增加本指导原则不包含得研究内容,可自行补充。
本指导原则就是供申请人与审查人员得指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求得其她方法,也可以采用,但应提供详细得研究资料与验证资料。
应在遵循相关法规得前提下使用本指导原则。
本指导原则就是在现行法规、标准体系及当前认知水平下制定得,随着法规、标准得不断完善与科学技术得不断发展,本指导原则相关内容也将适时进行调整。
一、范围I型过敏反应性疾病相当普遍,人群总发病率高达10%~30%,就是当前世界性得重大卫生学问题,被世界卫生组织(WHO)列为二十一世纪重点防治得三大疾病之一。
过敏性疾病就是患者吸入、食入或者注入含有致敏成分得物质(称为过敏原或变应原,Allergen)后触发机体得B细胞产生特异性免疫球蛋白E(Immunoglobulin E, IgE),IgE以其Fc 段与肥大细胞或嗜碱性粒细胞得表面相应得FcεRI结合,使机体处于对该过敏原得致敏状态。
当相同过敏原再次或多次进入致敏机体时,可与肥大细胞或嗜碱性粒细胞表面得IgE发生特异性结合,当过敏原与致敏细胞表面得两个或两个以上相邻得IgE结合时,发生Fc εRI 交联,使肥大细胞与嗜碱性粒细胞活化,导致细胞脱颗粒并释放储存在细胞浆颗粒里得炎性介质——组胺,并通过花生四烯酸途径合成新介质——白三烯、免疫反应性前列腺素与IL4、IL5等细胞因子及趋化因子,从而引发过敏反应(或称变态反应,Allergy)得疾病及相关症状,如过敏性哮喘、枯草热、荨麻疹、过敏性鼻炎、湿疹、结膜炎及胃肠道I型过敏性疾病及严重过敏反应等。
试剂(1)技术参数产品名称:吸入性食物性过敏原特异性抗体IgE检测试剂盒(免疫印迹法)规格:20人份/盒产品用途:该产品用于定性检测人血清中过敏原特异性IgE水平,检测项目:共21位点,30项目:、屋尘螨/户尘螨、屋尘、蟑螂、狗毛皮屑、猫毛皮屑、矮豚草、艾蒿、葎草、霉菌组合(点青霉/交链孢霉/烟曲霉/分枝孢霉)、树花粉组合(栎树/榆树/梧桐/柳树/杨树)、鸡蛋白、牛奶、牛肉、羊肉、蟹、虾、鳕鱼、鲑鱼、龙虾/扇贝、花生、黄豆主要技术参数和要求:1.检测方法:免疫印迹法,血清检测。
2.检测位点:21个位点。
3.检测区间:≥0.35IU/ml4.适用仪器:手工或全自动免疫印迹仪5.主要性能指标:最低检出量:用最低检出量质控品进行检测,不高于0.35IU/ml。
阴性质控品符合率:阴性质控品结果判读为阴性结果,阴性质控品符合率为100%。
阳性质控品符合率:阳性质控品结果判读符合阳性质控品性质,阳性质控品符合率为100%。
精密度:以某一浓度的人IgE校准品重复测定(n=10),反应结果一致,显色度均一。
交叉反应:与5.0IU/ml人IgA、IgG、IgM无交叉反应;由于两种或两种以上过敏原蛋白在结构上的相似,使它们竞争IgE抗体的结合表位,引起交叉反应。
临床灵敏度:>95.0%临床特异性:>98.0%6.资质:国家食品药品监督管理局批准的三类体外诊断试剂证书。
试剂(2)技术参数产品名称:总IgE检测试剂盒(胶体金法)规格:规格:20人份/盒产品用途:该产品用于定性检测人血清中总IgE抗体含量。
主要技术参数和要求:1.检测方法:胶体金法,血清检测。
2.检测位点:总IgE3.检测区间:≥87IU/ml5.适用仪器:无需仪器6.主要性能指标:最低检出量:用最低检出量质控品进行检测,不高于87IU/ml。
阴性质控品符合率:阴性质控品结果判读为阴性结果,阴性质控品符合率为100%。
阳性质控品符合率:阳性质控品结果判读符合阳性质控品性质,阳性质控品符合率为100%。
附件2过敏原特异性IgE抗体检测试剂技术审查指导原则本指导原则旨在指导注册申请人对过敏原特异性IgE抗体(Allergen-specific IgE)检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对过敏原特异性IgE抗体(Allergen-specific IgE)检测试剂的一般要求,申请人应依据产品的具体特性确定其中容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的容进行充实和细化。
如申请人认为有必要增加本指导原则不包含的研究容,可自行补充。
本指导原则是供申请人和审查人员的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准的不断完善和科学技术的不断发展,本指导原则相关容也将适时进行调整。
一、围I型过敏反应性疾病相当普遍,人群总发病率高达10%~30%,是当前世界性的重大卫生学问题,被世界卫生组织(WHO)列为二十一世纪重点防治的三大疾病之一。
过敏性疾病是患者吸入、食入或者注入含有致敏成分的物质(称为过敏原或变应原,Allergen)后触发机体的B细胞产生特异性免疫球蛋白E(Immunoglobulin E, IgE),IgE以其Fc 段与肥大细胞或嗜碱性粒细胞的表面相应的FcεRI结合,使机体处于对该过敏原的致敏状态。
当相同过敏原再次或多次进入致敏机体时,可与肥大细胞或嗜碱性粒细胞表面的IgE发生特异性结合,当过敏原与致敏细胞表面的两个或两个以上相邻的IgE结合时,发生FcεRI 交联,使肥大细胞和嗜碱性粒细胞活化,导致细胞脱颗粒并释放储存在细胞浆颗粒里的炎性介质——组胺,并通过花生四烯酸途径合成新介质——白三烯、免疫反应性前列腺素和IL4、IL5等细胞因子及趋化因子,从而引发过敏反应(或称变态反应,Allergy)的疾病及相关症状,如过敏性哮喘、枯草热、荨麻疹、过敏性鼻炎、湿疹、结膜炎及胃肠道I型过敏性疾病及严重过敏反应等。
上述过敏性疾病的发生,IgE抗体起关键作用。
I型过敏反应性疾病的特征是患者体循环血液中的过敏原特异性IgE抗体浓度较正常状况下高,且特异性IgE抗体浓度越高,诊断过敏性疾病的概率越高。
本指导原则适用于过敏原特异性IgE抗体检测试剂,包括总IgE和特异性IgE,同时适用于不同的检测方法(原理)。
本指导原则适用于申请产品注册和相关许可事项变更的产品。
二、基本要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、有关产品主要研究结果的总结和评价以及同类产品在国外批准上市的情况介绍等容,其中同类产品上市情况介绍部分应着重从主要原材料、检出限、阳性判断值或者参考区间等方面写明拟申报产品与目前市场上已获批准的同类产品之间的主要区别,同时应对申报的每一个过敏原具体项目进行详尽的阐述,分别阐述每个过敏原的具体特点及相关信息。
综述资料的撰写应当符合《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)(以下简称《办法》)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)(以下简称44号公告)的相关要求。
(二)主要原材料的研究资料若主要原材料为申请人自己生产,其生产工艺必须稳定;如主要原材料源于外购,应提供的资料包括:供货方提供的质量标准、出厂检定报告以及申请人对到货后主要原材料的质量检验资料。
除上述容外,建议申请人按照以下要求提交研究资料:1.企业部参考品的制备、定值过程。
详细阐述参考品中过敏原特异性IgE抗体的鉴定方法和浓度确认方法,鉴定方法应科学合理并采用国际公认的方法、金标准方法或临床诊断等方法综合进行确认。
浓度确认应采用国家或国际标准品进行溯源。
应分别对每一个过敏原项目进行研究。
2.质控品的制备、定值过程应参照企业部参考品的制备方法进行。
3.过敏原主要原材料的研究资料。
(1)无论是天然提取抗原,还是基因工程重组抗原,均应对原料进行详细分析研究,至少包括主要过敏原(致敏)蛋白的特异性、分子量、纯度、致敏蛋白含量、反应性:生物活性,效价(抑制试验)等容。
(2)对于以上要求的指标应给出具体的研究方案、研究方法、实验过程、试验数据、相关图谱等容。
(3)如为自制抗原,还需提供详细的抗原鉴定、提取、制备、生产等的研究资料。
(4)如为外购原材料,还需提供过敏原等主要原材料的出厂报告及进货检验报告。
(5)对于其他主要原材料,如二抗、工具酶、包被板等原材料,应提供主要原材料的选择、制备及质量标准等容的详细研究资料及试验数据。
(三)主要生产工艺及反应体系的研究资料1.主要生产工艺介绍,可用流程图方式表示,并简要说明主要生产工艺的确定依据。
2.产品基本反应原理介绍。
3.主要生产工艺过程的研究资料、每一步生产工艺的确认资料及试验数据。
4.主要反应体系的研究资料、每一步反应体系的确认资料及试验数据。
(四)分析性能评估资料申请人应提交在产品研制或成品验证阶段对试剂盒所有的分析性能进行研究的资料,对于每项分析性能的研究都应包括具体研究目的、实验设计、研究方法、可接受标准、实验数据、统计方法等详细资料。
有关分析性能研究的背景信息也应在注册申报资料中有所体现,包括研究地点(实验室)、适用仪器、试剂规格、批号、临床样本来源等。
分析性能研究的实验方法,可以参考国或国际有关体外诊断产品性能评估的指导原则。
对于总IgE抗体的检测,不建议进行定性检测,应采用定量及半定量检测,所有分析性能也应根据定量或半定量检测试剂的要求进行评估。
对于过敏原IgE抗体检测试剂,建议着重对以下分析性能进行研究。
1.提供参考品(国家参考品、企业参考品)的验证资料。
2.最低检出限最低检出限的确定及验证应采用适当的参考品进行,最低检出限参考品应进行精确的浓度确认。
对于定性检测产品,可采用每一浓度样本至少20次的检测情况对最低检出限进行研究,选取90%~95%检出率的浓度水平作为最低检出限;对于定量检测产品,可采用每一浓度样本至少10次的检测情况对最低检出限进行研究,选取CV值≤20%的浓度水平作为最低检出限。
过敏原特异性IgE抗体的检测限建议不高于0.35IU/ml,总IgE抗体的检测限建议不高于3~5 IU/ml,可采用稀释或系列参考品的方式进行研究,但应保证不同浓度的样本同时包括上述两个浓度及其邻近的浓度,明确写明最低检出限邻近浓度的检测情况,如过敏原特异性IgE抗体浓度在0.30IU/ml水平的检测情况、总IgE抗体在阳性判断值附近浓度的检测情况。
对于包被过敏原为混合过敏原(非组合)的产品,应对可检测项目中的每一个过敏原项目进行最低检出限的评价及验证。
3.线性围对于定量或半定量检测的试剂,均应当进行线性围的研究。
线性围确定的研究应使用高值临床样本(由可溯源至国家参考品/国际参考品的方法定量)进行梯度稀释,稀释液应使用经确认为相应过敏原项目检测结果为阴性的混合人血清或血浆,建议应包含不少于9个浓度(应包含接近最低检测限的临界值浓度,同时满足国家或国际分级标准的要求),通过评价一定围的线性关系及各水平的准确度确定该产品的线性围。
4.准确度对准确度的评价,可采用与国家/国际参考品的偏差、回收试验或者方法学比对等方法进行,申请人可根据实际情况选择合理方法进行研究。
详细描述评价方法中样本的制备过程、评价方案、试验过程、试验数据、统计方法、研究结论等容。
除上述资料之外,对于过敏原特异性IgE抗体检测试剂,建议提供至少50例与临床诊断结果比对的研究资料,对于极为罕见的过敏原特异性IgE抗体检测项目,可提供至少30例与临床诊断结果比对的研究资料。
5.精密度精密度的评价方法并无统一的标准可依,可根据不同产品特征或申请人的研究习惯进行,前提是必须保证研究的科学合理性,具体实验方法可以参考相关的美国临床实验室标准化协会批准指南(CLSI-EP)或国有关体外诊断产品性能评估的文件进行。
申请人应对每项精密度指标的评价标准做出合理要求,如标准差或变异系数的围等。
针对本类产品的精密度评价主要包括以下要求:(1)至少应在产品检测阴性、最低检出限浓度、医学决定水平(Cut-off值)浓度进行精密度的评价。
①阴性样本(质控品):应尽量采用高值阴性样本(质控品)进行(n≥20),如最低检出限浓度为0.35IU/ml,可选择0.30IU/ml浓度作为评价样本浓度。
②最低检出限浓度样本(质控品):待测物浓度应接近产品的最低检出限(n≥20)。
③医学决定水平(Cut-off值)浓度样本(质控品):根据产品设计的Cut-off值确定样本(质控品)的浓度(n≥20)。
(2)合理的精密度评价周期,例如:为期至少20天的连续检测,每天至少由2人完成不少于2次的完整检测,从而对批/批间、日/日间以及不同操作者之间的精密度进行综合评价。
如有条件,申请人应选择不同的实验室进行重复实验以对室间精密度进行评价。
6.特异性(1)交叉反应在进行交叉反应的研究过程中,对于过敏原的选择建议考虑以下容:生物学分类的相近性、基因组或结构的保守性和同源性、过敏原蛋白AA序列以及立体结构的类同性、IgE抗体结合表位在构象/拓扑学的兼容性。
①应采用与被检过敏原蛋白在组成或结构上部分相同或者具有相近性的过敏原特异性IgE抗体阳性样本进行交叉反应研究。
②建议采用高浓度的过敏原特异性IgE抗体阳性样本进行交叉反应研究,应明确抗体浓度。
③申请人应对进行交叉反应研究的过敏原特异性IgE抗体阳性样本的确认方法进行详细阐述,并提供详细的确认资料和数据,如:是否经过其他方法检测、经过金标准的确认或经过临床诊断的确认等。
④亦可采用抗原电泳分析致敏蛋白的方法进行研究。
至少应对公认的可能具有交叉反应的过敏原项目进行验证,建议对于每种过敏原至少选取2~3个可能产生交叉反应的过敏原进行研究。
(2)干扰物质①对样本中常见的源性干扰物质进行研究,如血红蛋白、甘油三酯或胆固醇、胆红素、类风湿因子(RF)、抗核抗体(ANA)、抗线粒体抗体(AMA)等,确定可接受的干扰物质极限浓度。
建议采用被测物阴性及最低检出限浓度对每种干扰物质的干扰影响进行评价。
②对高浓度的非特异性人IgA、IgG、IgM、IgD抗体阳性样本进行评价,建议采用被测物阴性及最低检出限浓度进行研究。
③对含有高浓度总IgE抗体的特异性IgE抗体阴性或弱阳性样本进行评价。
干扰物质研究的样本可采用临床或模拟添加样本进行验证,样本量选择应体现一定的统计学意义。
7.钩状(HOOK)效应须采用高浓度过敏原特异性IgE抗体阳性血清进行梯度稀释后由低浓度至高浓度开始检测,每个梯度的稀释液重复3~5份,对钩状效应进行合理的验证。